孜然乙醇提取物的工艺优化 及对酪氨酸酶活性的抑制作用
2018-05-30杜国英邹红梅马敏倩
王 雅,杜国英,邹红梅,马敏倩
(兰州理工大学生命科学与工程学院,甘肃兰州 730050)
酪氨酸酶(EC 1.14.18.1),是一种含铜的氧化还原酶,广泛分布于生物体内。酪氨酸酶在黑色素生物合成的过程中起第一限速酶和第三功能酶的作用,是黑色素合成的关键酶。它主要参与反应过程:催化L-酪氨酸转变为L-多巴和将L-多巴氧化为多巴醌,再通过一系列的反应形成黑色素[1-2]。酪氨酸酶活性的大小与生成黑色素的量成正比[3]。因此,酪氨酸酶在皮肤增白方面具有很大的研究价值。孜然(CuminumcyminumL.),又名孜然芹、安息孜然、枯茗等。属于一年或两年生的伞形科孜然芹属植物,是亚洲、非洲和欧洲传统的中草药和调味料之一,具有较高的药用和食用价值,在我国主要分布于新疆[4]。目前,国内外研究发现孜然具有降血糖、抑菌、抗氧化[5-7]等生物活性。但关于孜然抑制酪氨酸酶活性方面的研究鲜有报道。
本文在单因素实验的基础上,以响应面法优化孜然乙醇提取物抑制酪氨酸酶的提取工艺,并研究了各极性部位对酪氨酸酶的抑制效果及主要活性成分的含量,以期为孜然抑制酪氨酸酶活性的作用机理和将孜然开发为皮肤美白剂提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
孜然 兰州黄河药材市场;L-酪氨酸、蘑菇酪氨酸酶(≥1000 U/mg)、Folin-Ciocalteu试剂、芦丁、薯蓣皂苷元、葡萄糖 Sigma-Aldrich公司;磷酸氢二钠、磷酸二氢钠 天津天新精细化工开发中心;其他试剂 均为国产分析纯。
DNM-9602酶标分析仪 北京普朗新技术有限公司;Scientz-N 真空冷冻干燥机 宁波新芝生物科技股份有限公司;L-550/L550台式低速离心机 长沙湘仪离心机有限公司;DHP-9082电热恒温培养箱 上海一恒科学仪器有限公司;752N紫外-可见分光光度计 北京瑞利分析仪器公司。
1.2 实验方法
1.2.1 孜然乙醇提取物的制备 孜然经粉碎后过60目筛,称取5.00 g的孜然粉末,按设定的液料比、乙醇体积分数、提取时间和提取温度回流提取后,离心,收集上清液,减压浓缩,冷冻干燥,备用。
1.2.2 酪氨酸酶抑制活性的测定 参考文献[8]的方法,并稍作修改。吸取80 μL的样品溶液(0.8 mg/mL)加到96孔酶标板中,再加入预先在37 ℃保温的100 μL的L-酪氨酸溶液(2 mmol/L),振荡混匀,在37 ℃恒温箱中放置10 min后,加入40 μL的酪氨酸酶溶液(40 μg/mL),混匀继续在37 ℃反应10 min,然后迅速用酶标仪测定492 nm处的吸光度AC1,AC2,AT1,AT2,按下式计算样品对酪氨酸酶活性的抑制率:

式中,AC1为未加样品的加酶混合液在492 nm处的吸光度值;AC2为未加样品和酶的混合液在492 nm处的吸光度值;AT1为加样品和酶的混合液在492 nm处的吸光度值;AT2为加样品而未加酶的混合液在492 nm处的吸光度值。
1.2.3 孜然乙醇提取物抑制酪氨酸酶活性的单因素实验
1.2.3.1 乙醇体积分数的选择 液料比为20∶1 (mL/g),提取时间为1.5 h,提取温度为80 ℃,考察不同乙醇体积分数(50%、60%、70%、80%、90%)对孜然乙醇提取物抑制酪氨酸酶活性的影响。
1.2.3.2 液料比的选择 乙醇体积分数由1.2.3.1确定,提取时间为1.5 h,提取温度为80 ℃,考察不同液料比(5∶1、10∶1、15∶1、20∶1、25∶1 mL/g)对孜然乙醇提取物抑制酪氨酸酶活性的影响。
1.2.3.3 提取时间的选择 乙醇体积分数由1.2.3.1确定,液料比由1.2.3.2确定,提取温度为80 ℃,考察不同提取时间(1、1.5、2、2.5、3 h)对孜然乙醇提取物抑制酪氨酸酶活性的影响。
1.2.3.4 提取温度的选择 乙醇体积分数由1.2.3.1确定,液料比由1.2.3.2确定,提取时间由1.2.3.3确定,考察不同提取温度(50、60、70、80、90 ℃)对孜然乙醇提取物抑制酪氨酸酶活性的影响。
1.2.4 响应面实验设计 在单因素实验结果的基础上,根据Box-Behnken设计原理,以酪氨酸酶抑制率为响应值,以乙醇体积分数、液料比、提取温度、提取时间等因素为自变量,进行四因素三水平的响应面实验,得到孜然乙醇提取物抑制酪氨酸酶活性的最佳工艺条件。因素与水平设计见表1。
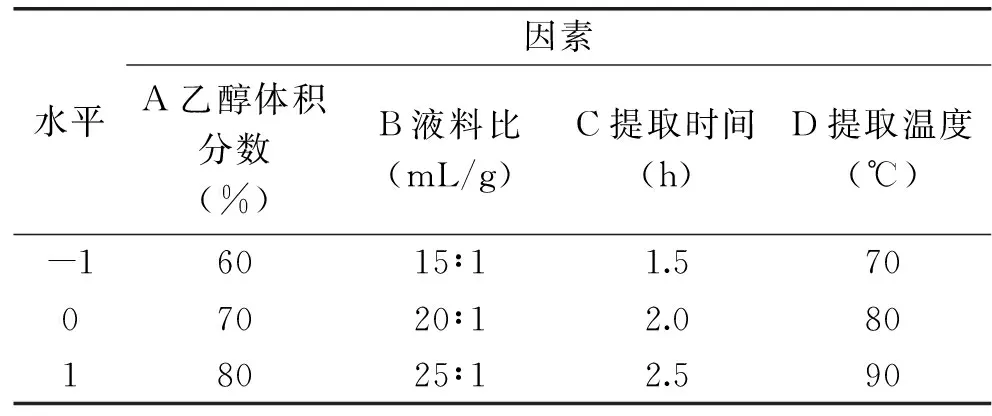
表1 响应面因素及水平设计Table 1 Factors and levels for response surface analysis
1.2.5 孜然乙醇提取物中主要活性成分的含量测定 多酚含量的测定采用Folin-Ciocalteu比色法[9],以没食子酸为标准品。黄酮含量的测定采用NaNO2-Al(NO3)3-NaOH比色法[10],以芦丁为标准品。多糖含量的测定采用苯酚-硫酸比色法[11],以葡萄糖为标准品。皂苷含量的测定采用香草醛比色法[12],以薯蓣皂苷元为标准品。各活性成分的含量计算公式分别如下:




1.2.6 孜然乙醇提取物不同极性部位对酪氨酸酶活性的影响 按1.2.4得到的最佳提取条件获得孜然乙醇提取物后,依次用石油醚、乙酸乙酯、正丁醇分别萃取3次,旋转蒸发除去溶剂,冷冻干燥后,按1.2.2的方法测定各极性部位对酪氨酸酶活性的抑制率,计算IC50(酪氨酸酶抑制率达到50%时的样品浓度),曲酸做阳性对照。
1.3 统计分析
所有实验均做三次重复,实验结果以均值±标准差的形式表示,响应面设计及分析由Design-Expert 8.0.6.1完成,数据处理及绘图由Origin 9.0完成。
2 结果与分析
2.1 单因素实验结果
2.1.1 乙醇体积分数对孜然乙醇提取物抑制酪氨酸酶活性的影响 由图1可知,随着乙醇体积分数的增大,孜然乙醇提取物对酪氨酸酶的抑制率呈先增大后减小的趋势,乙醇体积分数为70%时,抑制率达最大,之后又开始下降。可能是乙醇体积分数过高时提取溶剂的极性小,使孜然中抑制酪氨酸酶活性的成分不易溶出所导致的[13],因此70%乙醇为最佳提取溶剂。

图1 乙醇体积分数对孜然乙醇提取物抑制酪氨酸酶活性的影响Fig.1 Effect of ethanol concentration on tyrosinase inhibition of ethanol extract from cumin
2.1.2 液料比对孜然乙醇提取物抑制酪氨酸酶活性的影响 由图2可知,随着液料比的增大,孜然乙醇提取物对酪氨酸酶的抑制率呈增大趋势,当液料比达到15∶1 (mL/g)时抑制率最大,之后基本保持不变。可能是随着液料比的增大,会加快提取过程中液相和固相浓度差减小的速度,从而加快有效成分的溶出,从节约成本、提高效率的角度考虑,液料比不宜过大,故确定最佳液料比为15∶1 (mL/g)。
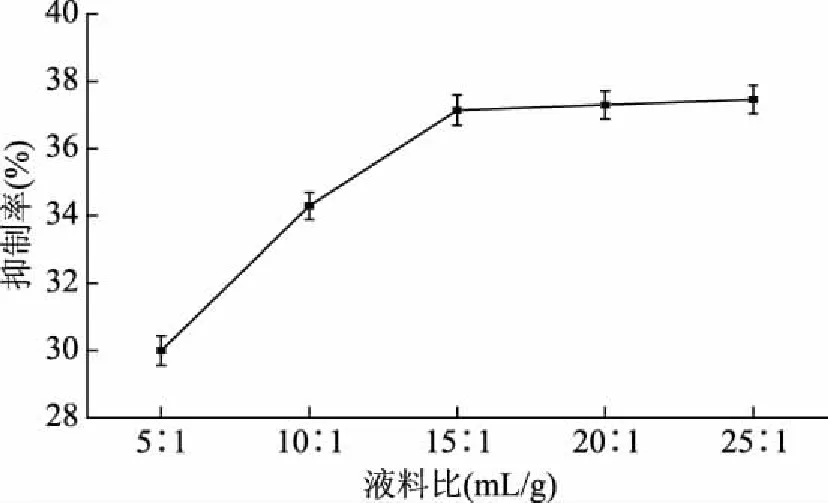
图2 液料比对孜然乙醇提取物抑制酪氨酸酶活性的影响Fig.2 Effect of liquid-solid ratio on tyrosinase inhibition of ethanol extract from cumin
2.1.3 提取时间对孜然乙醇提取物抑制酪氨酸酶活性的影响 由图3可知,随着提取时间的延长,孜然乙醇提取物对酪氨酸酶的抑制率呈现先增大后减小的趋势,当提取时间为2 h时,抑制率达最大,之后略有下降。可能是随着提取时间的延长,孜然中抑制酪氨酸酶的成分逐渐溶到乙醇中,但提取时间过长,有些活性成分会在长时间的有氧及高温条件下受到破坏,导致抑制率下降,所以最佳提取时间确定为2 h。
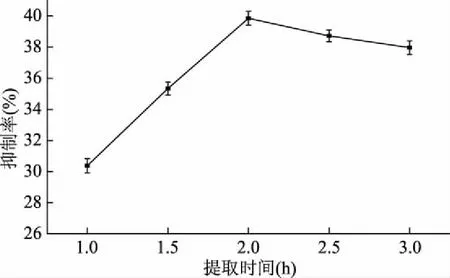
图3 提取时间对孜然乙醇提取物抑制酪氨酸酶活性的影响Fig.3 Effect of extraction time on tyrosinase inhibition of ethanol extract from cumin
2.1.4 提取温度对孜然乙醇提取物抑制酪氨酸酶活性的影响 由图4可知,随着温度的升高,孜然乙醇提取物对酪氨酸酶的抑制率呈先增加后减小的趋势,在80 ℃时抑制率达最大值,之后又有所下降。可能是在一定的温度范围内,随着温度升高,具有活性的物质溶解度会加大,但是超过一定温度后,部分活性物质会被破坏[14],导致抑制能力减弱,故确定最佳提取温度为80 ℃。
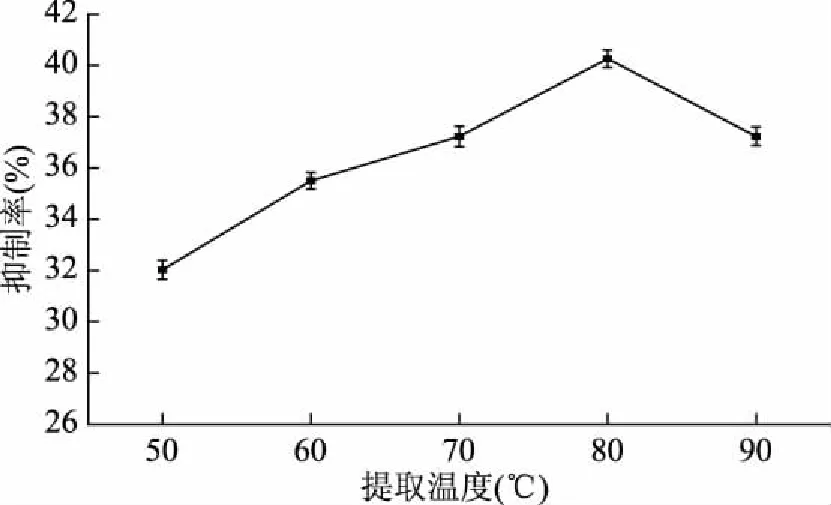
图4 提取温度对孜然乙醇提取物抑制酪氨酸酶活性的影响Fig.4 Effect of extraction temperature on tyrosinase inhibition of ethanol extract from cumin
2.2 响应面实验结果与分析
2.2.1 响应面实验设计方案及结果 根据Box-Behnken中心组合设计原理,结合单因素实验结果,设计四因素三水平的响应面优化实验,以获得孜然乙醇提取物抑制酪氨酸酶活性的最佳提取条件。响应面实验设计及结果见表2。
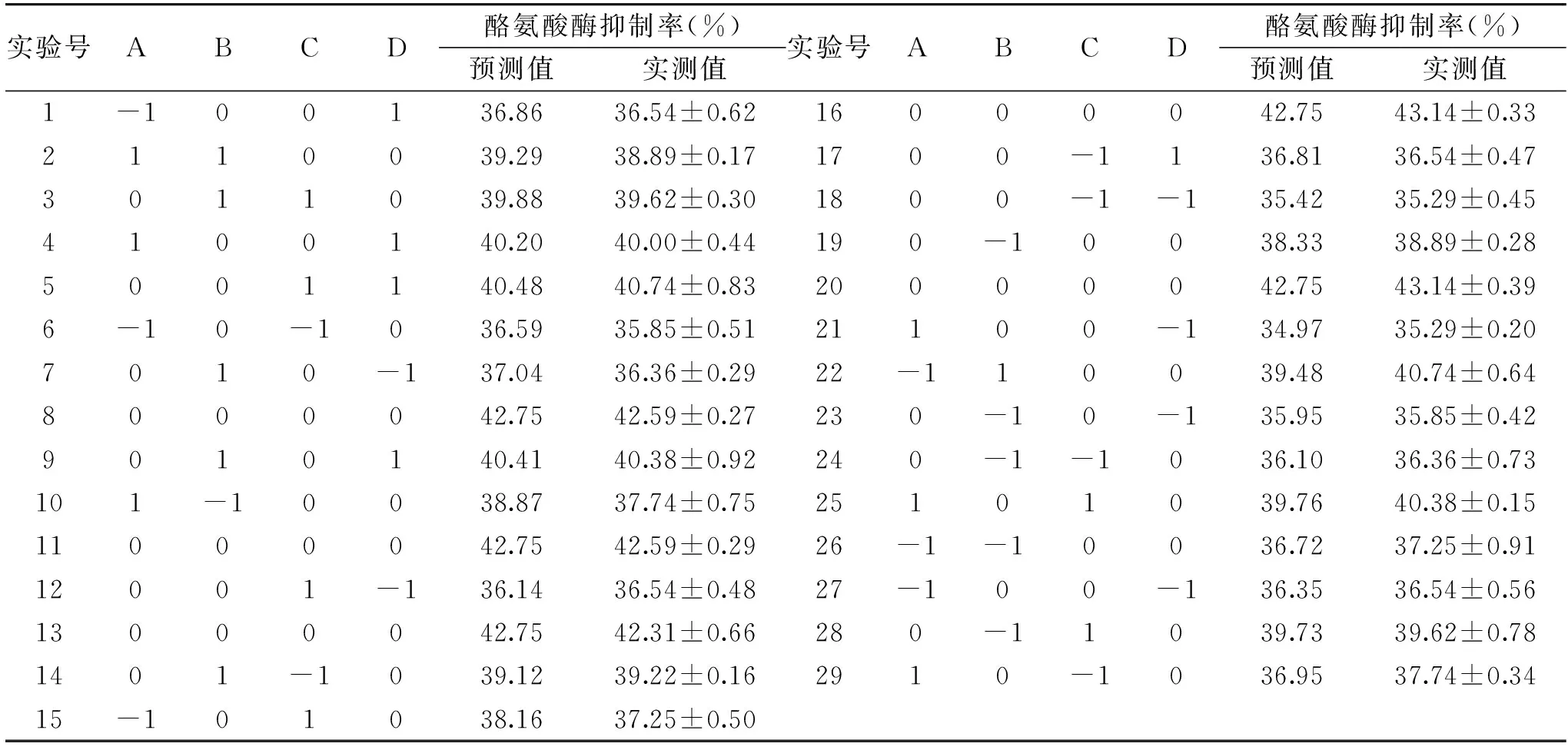
表2 响应面实验设计及结果Table 2 Design and test results of response surface
2.2.2 回归方程拟合及方差分析 用Design-Expert 6.0软件对表2数据进行二次多元回归拟合,得到四个因素的二次多元回归方程:
Y=42.75+0.49A+0.79B+1.10C+1.44D-0.59AB+0.31AC+1.18AD-0.71BC+0.25BD+0.74CD-2.50A2-1.66B2-2.38C2-3.16D2
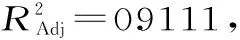

表3 回归模型方差分析表Table 3 Analysis of varlance of the regression model
一次项中液料比、提取时间和提取温度对酪氨酸酶抑制率的影响极显著(p<0.01),乙醇体积分数对酪氨酸酶抑制率的影响显著(p<0.05)。二次项中四因素对酪氨酸酶抑制率的影响均极显著(p<0.01)。交互项中乙醇体积分数和提取温度的交互作用对酪氨酸酶抑制率的影响极显著(p<0.01),其他各因素两两之间的交互作用对酪氨酸酶抑制率的影响均不显著(p>0.05)。
由F值可知,各个因素对酪氨酸酶抑制率的影响程度的次序为:D(提取温度)>C(提取时间)>B(液料比)>A(乙醇体积分数)
2.2.3 响应面图分析 利用 Design-Expert 8.0.6.1软件作出各因素之间交互作用的响应面图。等高线的形状越接近椭圆,表示两因素交互作用越显著,接近圆形则与之相反。响应面曲面越陡,中心投影点越靠近椭圆中心,表示两因素交互作用越显著[15]。图5所示为固定液料比和提取时间为零水平时,乙醇体积分数和提取温度的交互作用对酪氨酸酶抑制率的影响极显著。
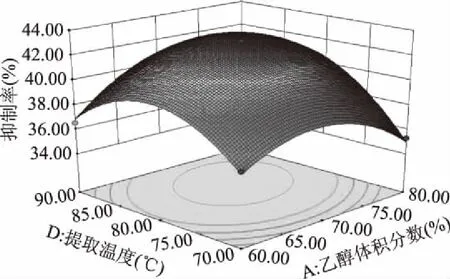
图5 乙醇体积分数和提取温度的交互作用对酪氨酸酶抑制率的响应面图Fig.5 The interactive effects of ethanol concentration and extraction temperature on tyrosinase inhibition rate
随着乙醇体积分数和提取温度的增加,酪氨酸酶抑制率也在不断的增大,当增加到中心区域时,抑制率达到最大,随着乙醇体积分数和提取温度的继续增加,提取率又随之减小,且提取温度的上升幅度大于乙醇体积分数的上升幅度,说明提取温度对酪氨酸酶抑制率的影响较乙醇体积分数显著。而其余各因素间的交互作用对酪氨酸酶抑制率的影响均不显著,因此没有在此提供交互作用影响不显著的响应面图。
2.3 验证实验
由Design-Expert 8.0.6.1软件从回归模型中得出最佳提取条件:乙醇体积分数71.41%,液料比15.68∶1 (mL/g),提取时间2.16 h,提取温度为83.37 ℃,该条件下酪氨酸酶抑制率达到理论最大值43.20%。为验证响应面实验结果的可靠性并考虑到实际操作的可行性,将提取条件修正为:乙醇体积分数 71%,液料比16∶1 (mL/g),提取时间2.2 h,提取温度为83 ℃。用修正后的条件进行三次平行验证实验,测得实际酪氨酸酶抑制率为(42.61%±0.56%),基本接近于预测值(43.20%)。说明该模型与实际情况拟合较好,证明了实验的可靠性。
2.4 孜然乙醇提取物中主要活性成分的含量
分别以没食子酸、芦丁、薯蓣皂苷元、葡糖糖作为标准品,绘制标准曲线,得到关于标准溶液取样量(mL)与吸光值的4个回归方程:Y=0.3521X+0.0020,R2=0.9983;Y=0.2120X+0.0040,R2=0.9991;Y=0.4752X+0.0054,R2=0.9992;Y=0.1820X+0.0014,R2=0.9984。经计算,由表4可知,孜然乙醇提取物中黄酮和多糖的含量较高,皂苷含量较低。

表4 孜然乙醇提取物中主要成分的含量Table 4 The content of main components of cumin ethanol extract
已研究发现植物提取物中的多种活性成分,如酚类、黄酮类、有机酸、多糖类等具有美白潜力,其中多酚类和黄酮类物质具有较大的美白潜力,因为它们与酪氨酸酶的底物(酪氨酸或多巴)有着相似的结构,可以作为底物类似物结合酪氨酸酶,从而减弱底物与酪氨酸酶的结合能力,达到减少黑色素生成的目的[16-17]。
2.5 孜然乙醇提取物不同极性部位对酪氨酸酶活性的影响
由表5和表6可知,孜然乙醇提取物不同极性部位对酪氨酸酶活性的抑制能力均比曲酸(阳性对照)弱,但也有较好的抑制作用。可能是孜然乙醇提取物相对来说是粗提取,其中含有一些杂质或具有拮抗作用的成分,从而造成孜然乙醇提取物不同极性部位对酪氨酸酶活性的抑制效果不是很突出[18]。各相对酪氨酸酶活性的抑制率随着浓度的增大而增大,IC50从大到小依次为:水相、石油醚相、正丁醇相和乙酸乙酯相,表明乙酸乙酯相和正丁醇相对酪氨酸酶活性的抑制能力最好,可能是孜然乙醇提取物抑制酪氨酸酶活性的成分主要集中在中等极性和极性较大的部位。多酚、黄酮、皂苷、多糖等都为极性较大的物质,因此它们都可能是孜然乙醇提取物抑制酪氨酸酶活性的功效成分。
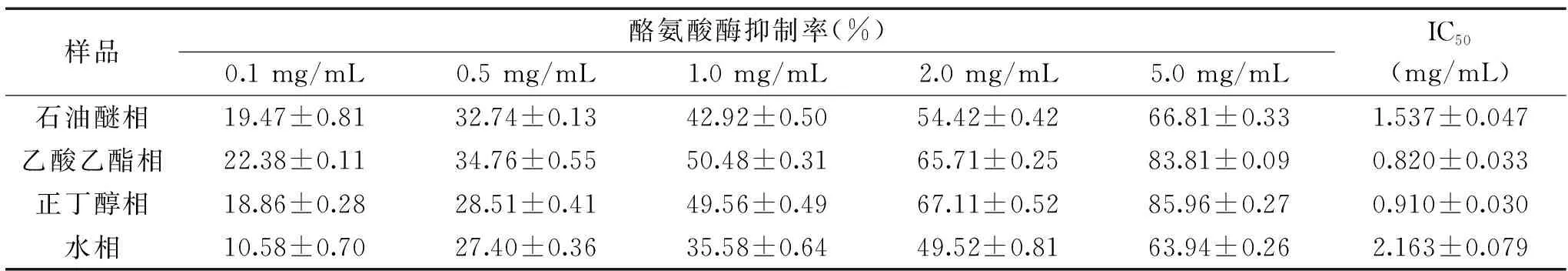
表5 不同极性部位对酪氨酸酶活性的影响Table 5 Effects of different polar fractions on tyrosinase activity

表6 曲酸对酪氨酸酶活性的影响Table 6 Effect of kojic acid on tyrosinase activity
3 结论
在单因素实验结果的基础上结合响应面设计,优化得到了孜然乙醇提取物抑制酪氨酸酶活性的最佳工艺参数:乙醇体积分数71%,液料比16∶1 (mL/g),提取时间2.2 h,提取温度83 ℃,在此优化条件下酪氨酸酶抑制率达(42.61%±0.56%),与预测值43.20%接近。表明由响应面法得到的孜然乙醇提取物抑制酪氨酸酶的提取工艺是有效可行的;孜然乙醇提取物中多酚、黄酮、皂苷、多糖四种活性成分的含量分别为(1.35%±0.03%)、(4.40%±0.29%)、(0.76%±0.04%)、(4.89%±0.28%);孜然乙醇提取物不同极性部位对酪氨酸酶活性均有抑制作用,且与浓度有依赖关系,其IC50从大到小依次为:水相>石油醚相>正丁醇相>乙酸乙酯相,表明乙酸乙酯和正丁醇部位富集了孜然乙醇提取物抑制酪氨酸酶活性的主要活性成分,其抑制机理有待进一步研究,为深入研究孜然的美白功效提供依据。
[1]Chen M J,Hung C C,Chen Y R,et al. Novel synthetic kojic acid-methimazole derivatives inhibit mushroom tyrosinase and melanogenesis[J]. Journal of Bioscience and Bioengineering,2016,122(6):666-672.
[2]Ding H Y,Chou T H,Lin R J,et al. Antioxidant and antimelanogenic behaviors ofPaeoniasuffruticosa[J]. Plant Foods for Human Nutrition,2011,66(3):275.
[3]楼彩霞,田燕泽,朴香兰. 连翘不同极性部位对酪氨酸酶活性抑制作用研究[J]. 时珍国医国药,2011,22(10):2415-2416.
[4]Siow H L,Gan C Y. Functional protein from cumin seed(Cuminumcyminum):Optimization and characterization studies[J]. Food Hydrocolloids,2014,41(20):178-187.
[5]马梦梅. 孜然膳食纤维改性及降血糖活性研究[D]. 北京:中国农业科学院,2016.
[6]王卓. 维药孜然不同提取物抗氧化及对α-葡萄糖苷酶抑制的研究[D]. 乌鲁木齐:新疆大学,2016.
[7]罗静莺,索菲娅,卢帅,等. 孜然果实发育过程中抗氧化活性的研究[J]. 时珍国医国药,2015(10):2505-2507.
[8]Wang G H,Chen C Y,Lin C P,et al. Tyrosinase inhibitory and antioxidant activities of threeBifidobacteriumbifidum-fermented herb extracts[J]. Industrial Crops and Products,2016,89:376-382.
[9]Dewanto V,Wu X,Adom K K,et al. Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity[J]. Journal of Agricultural and Food Chemistry,2002,50(10):3010-3014.
[10]王雅. 沙枣果实可食部分活性物质提取及抗氧化、抗肿瘤作用研究[D]. 杨凌:西北农林科技大学,2012.
[11]孔凡利,张名位,于淑娟,等. 荔枝多糖活性炭脱色方法研究[J]. 食品科技,2008,33(6):115-117.
[12]傅春燕,刘永辉,李明娟,等. 紫外可见分光光度法测定不同产地龙牙百合中皂苷含量[J]. 广东微量元素科学,2011,18(5):55-58.
[13]董妙音,李万武,孔维宝,等. 响应面法优化超声波辅助提取文冠果种皮总皂苷的工艺[J]. 中国油脂,2014,39(11):74-78.
[14]吴祥庭,朱涛,郑巧敏,等. 响应面法优化山药皮中皂苷提取的研究[J]. 中国粮油学报,2011,26(6):91-96.
[15]蒲立柠,陈光静,阚建全. 响应面实验优化青稞麸皮薏仁红曲霉发酵工艺[J]. 食品科学,2017,38(2):264-270.
[16]龚坚,刘朝圣. 美白中药实验研究进展[J]. 中医药导报,2015(16):100-103.
[17]Roh H J,Noh H J,Na C S,et al. Phenolic compounds from the leaves ofStewartiapseudocamelliamaxim and their whitening activities[J]. Biomolecules and Therapeutics,2015,23(3):283-289.
[18]王姝. 鹅毛竹叶提取物抗氧化及酪氨酸酶抑制活性的研究[D]. 杭州:浙江农林大学,2014.
