大蒜汁对耐甲氧西林金黄色葡萄球菌食品 分离菌株的生长和生物被膜形成的影响
2018-05-30贺苏皖王洪志田万帆唐俊妮
贺苏皖,龙 虎,王洪志,杜 玄,田万帆,唐俊妮
(西南民族大学生命科学与技术学院,四川成都 610041)
金黄色葡萄球菌是引起人类感染和食物中毒的常见病原菌,特别是耐甲氧西林金黄色葡萄球菌(Methicillin resistantStaphylococcusaureus,简称MRSA)。MRSA菌株于20世纪60年代开始被报道,当时是作为重要的医院病原菌出现,但是在20世纪80年代末和90年代初,MRSA开始作为社区相关感染的重要病原菌出现在大洋洲区域,随后遍布全世界。近年来,MRSA的流行在不断改变,MRSA在食品动物中的紧急出现已经引起了人们对食品中MRSA存在的巨大关注[1-2]。由此可以看出,MRSA菌株对人类健康构成严重威胁,特别是β-内酰胺类抗生素的广泛应用,MRSA菌株的多重耐药是目前存在的严重问题[3]。另一方面,生物被膜的形成给细菌提供了一个稳定的生存环境,MRSA菌株具有形成生物被膜的能力,从而使得细菌具有更强的抵抗能力,非常难以消除[4]。
大蒜为多年生草本植物,具有多种药理作用[5]。大蒜提取物中的活性成分能够进入致病菌的细胞质,干扰细菌的正常代谢,对致病菌有抑制和杀灭作用[6]。针对大蒜抑菌的相关研究主要集中在常见致病菌以及大蒜素的提取工艺上[7]。现有的研究认为大蒜汁对大肠埃希菌、沙门氏菌、金黄色葡萄球菌、蜡样芽胞杆菌、枯草芽孢杆菌、变形杆菌等均有良好抑制作用[8-9]。还有少量研究表明紫皮蒜的抑制效果优于白皮蒜,但未见大蒜汁针对食品源耐甲氧西林金黄色葡萄球菌的抑菌研究。
为了寻求对抗MRSA的有效方法,本研究试图探讨两种不同种类的大蒜汁对MRSA菌株的抑制活性以及对其生物被膜形成能力的影响,以期为MRSA的防控提供一定参考。
1 材料与方法
1.1 材料与仪器
7株耐甲氧西林金黄色葡萄球菌食品分离菌株(MRSA-1、MRSA-2、MRSA-3、MRSA-4、MRSA-5、MRSA-6、MRSA-7) 由本实验室保存和鉴定(备注:采用mecA基因引物扩增从食品中分离的金黄色葡萄球菌出现阳性条带并测序比对正确认定为MRSA菌株);普通白皮蒜和紫皮独头蒜 均产自成都本地(无芽新鲜)成都市某菜市场;大豆酪蛋白琼脂肉汤(TSB)和大豆酪蛋白琼脂培养基(TSA) 青岛海博生物技术有限公司;结晶紫 上海优选生物科技有限公司。
5804R型冷冻离心机 德国Eppendorf公司;UV-6100分光光度计 上海美普达公司;隔水式恒温培养箱GHP-9270 上海齐欣科学仪器有限公司;96孔板 中国Costar公司;榨汁机JS30-230 浙江绍兴苏泊尔电器有限公司;pHS-4C+酸度计 成都世纪方舟科技有限公司;Elx808酶标仪 美国BIO-TEK公司。
1.2 实验方法
1.2.1 大蒜汁制备 取一定量的新鲜白皮蒜和紫皮蒜分别剥皮,无菌水冲洗干净,分别榨汁处理后,3000 r/min离心3 min,取大蒜原汁上清,分装于不同的无菌EP管中并做好标记,置于-20 ℃条件下保存、备用。
1.2.2 菌悬液制备 将保存的7株MRSA菌株的原始培养液各取50 μL分别接种于5 mL的TSB培养基中,将过夜培养的菌液分别划线接种于TSA平板,(36±1) ℃过夜培养。分别挑取7株MRSA菌株的单菌落于不同管分装的无菌生理盐水中,调整菌悬液的浊度至0.5麦氏浊度,备用。
1.2.3 平板抑菌实验 使用无菌棉签将调整好浊度的菌悬液均匀涂布于TSA平板上,每种大蒜汁样品针对每株菌做三组平行。无菌条件下打孔,每个平板打三个孔,每孔加入20 μL大蒜汁,(36±1) ℃过夜培养16 h,取出测量抑菌圈直径,结果取三次重复实验的平均值±SD表示。判定标准[10]:极敏:抑菌圈直径>19 mm;高敏:抑菌圈直径15~18 mm;中敏:抑菌圈直径11~14 mm;低敏:抑菌圈直径<11 mm。
1.2.4 最小抑菌浓度(MIC)的测定 根据临床和实验室标准协会(CLSI 2012)所推荐的微量肉汤稀释法测定标准[11],进行两种蒜汁对7株耐甲氧西林金黄色葡萄球菌食品分离菌株的最小抑菌浓度实验。将培养过夜的菌液按1∶100接种到96孔板中,使得细菌的接种浓度约为1.5×105CFU/mL。采用二倍稀释法,白皮蒜汁的添加终浓度分别为100、50、25、12.5、6.25 μL/mL以及对照组;参考预实验结果,预实验中得知6.25 μL/mL的紫皮蒜汁已经能够有效抑制MRSA细菌的生长,所以,紫皮蒜汁的添加浓度分别设置为50、25、12.5、6.25、3.125 μL/mL以及对照组。每个浓度梯度做3个平行,同时设置空白组。实验组中加入160 μL的TSB、20 μL菌液及各稀释浓度的大蒜汁(总体积为200 μL),对照中用20 μL的无菌水代替大蒜汁,空白组中加200 μL的TSB。(36±1) ℃培养16 h,观察能够抑制耐甲氧西林金黄色葡萄球菌生长的最低浓度作为各自的最小抑菌浓度MIC,用酶标仪在630 nm处测定吸光度,并记录数据。
1.2.5 对生物被膜的影响实验 96板定量测定法[12]:两种大蒜汁分别设置空白组、对照组和实验组,各3个平行。对照组每孔分别加入180 μL的TSB和20 μL菌液,空白组中加入200 μL的TSB,实验组中加入及160 μL的TSB和20 μL菌液及不同浓度的大蒜汁(总体积为200 μL),大蒜汁的终浓度分别为MIC、1/2 MIC、1/4 MIC。37 ℃培养48 h。移除浮游菌体,加入200 μL磷酸缓冲液洗涤3次,加入100 μL甲醇固定15 min,并弃去残液,晾干。加入2%结晶紫100 μL室温染色5 min,弃多余染液,自来水洗涤至无色水滴,(36±1) ℃放置30 min,彻底干燥。加入33%的冰乙酸溶液100 μL,溶解吸附的细胞和结晶紫,用酶标仪在630 nm处测定其吸光度值。
1.3 数据处理
数据采用Microsoft Excel及SPSS 19.0统计软件处理,运用单因素方差分析法比较各组及组间差别,p<0.05为差异显著,有统计学意义。
2 结果与分析
2.1 平板抑菌实验结果
两种大蒜汁抑菌圈直径大小见表1,由表1可以看出,白皮蒜汁对7株耐甲氧西林金黄色葡萄球菌具有明显的抑菌活性,抑菌圈大于19 mm。从表1也可以看出,紫皮蒜汁对7株MRSA的抑菌能力更强,抑菌圈均大于19 mm,属于极敏。实验结果说明两种不同蒜汁都能很好地抑制7株耐甲氧西林金黄色葡萄球菌的生长,分析原因可能是生蒜中的大蒜素抑制了微生物生长繁殖所依赖的巯基酶活性,从而使细菌生长达不到对数生长期,起到有效抑制细菌的作用[13]。同时紫皮蒜汁与白皮蒜汁对7株耐甲氧西林金黄色葡萄球菌的抑菌能力上存在显著差异,具有统计学意义(p<0.05)。
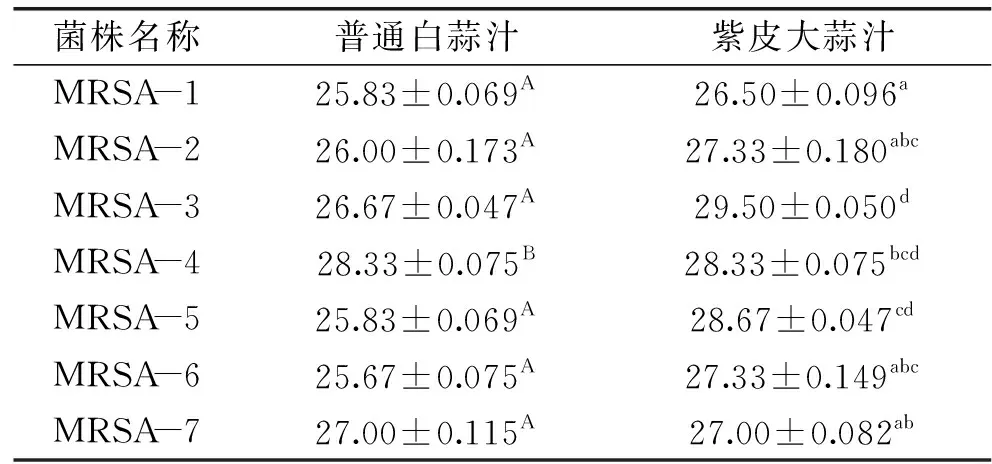
表1 两种大蒜汁对7株MASR抑菌圈直径大小(mm)Table 1 The bacteriostatic circle diameters of two types of garlic juices on the growth of MRSA isolates(mm)
2.2 最小抑菌浓度(MIC)的测定结果
采用96孔板法测定两种大蒜汁对7株耐甲氧西林金黄色葡萄球菌的最低抑菌浓度,结果见图1和图2。图1表明:随着大蒜汁浓度的增加,培养液在630 nm处的吸光度值下降,在12.5 mL/L浓度处,96孔板培养液的吸光度值是一个转折点,因此,本实验中,把白皮蒜汁对7株MRSA菌株的最小抑菌浓度定为12.5 mL/L;同样,从图2可以看出紫皮蒜汁对7株MRSA菌株的最小抑菌浓度为6.25 mL/L。通过比较可以看出,紫皮蒜汁的抑菌活性强于白皮蒜汁,紫皮蒜的抑菌效果更好。
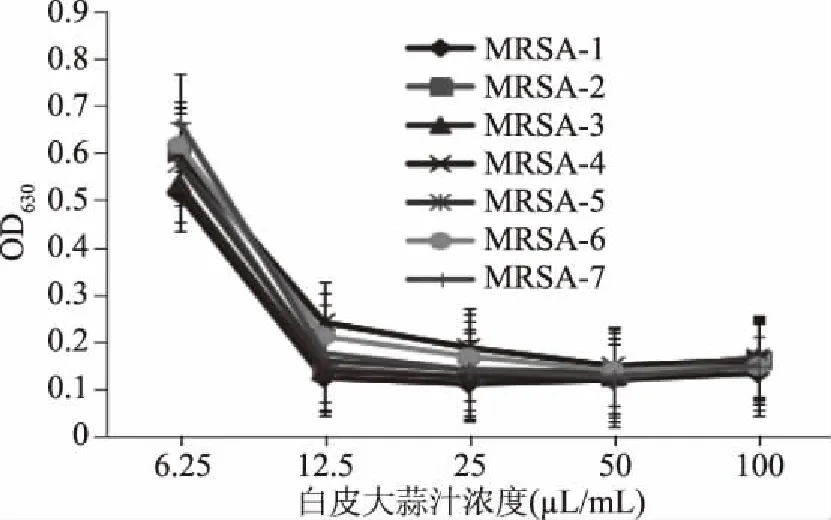
图1 不同浓度白皮蒜汁对MRSA抑菌活性的测定结果Fig.1 Antibacterial test against MRSA isolates by using different concentration of white garlic juices
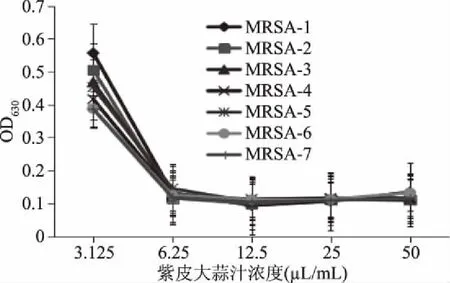
图2 不同浓度紫皮蒜汁对MRSA抑菌活性的测定结果Fig.2 Antibacterial test against MRSA isolates by using different concentration of purple garlic juices
2.3 两种大蒜汁对7株MRSA被膜形成影响测定结果
采用96孔板法定量观察两种大蒜汁对7株耐甲氧西林金黄色葡萄球菌被膜形成的影响结果见图3和图4。由图3可以看出,与对照相比,添加不同亚抑菌浓度的大蒜汁,7株MRSA菌株的生物被膜含量明显较低,曲线呈下降趋势。随着大蒜汁浓度的增加,生物膜的含量逐渐减少,说明白皮蒜汁对7株MRSA的生物被膜形成具有明显抑制作用;图4是加入紫皮蒜汁所得7株MRSA菌株的生物被膜含量变化图,由图4也可以看出,随着紫皮蒜汁浓度的增加,7株MRSA菌株的生物被膜含量也明显减少,并且细菌生物被膜的形成能力与大蒜汁的添加浓度呈负相关,可见,适当添加一定浓度的大蒜汁可以很好抑制MRSA细菌的生物被膜形成。
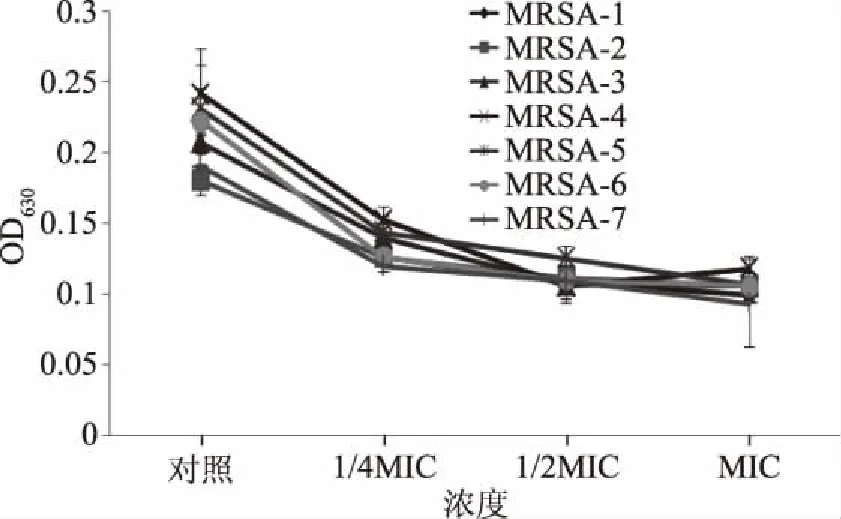
图3 白皮蒜汁在不同抑菌浓度下对7株MRSA生物被膜形成的影响结果Fig.3 The effect of white garlic juice on MRSA biofilm formation at different sub inhibitory concentration
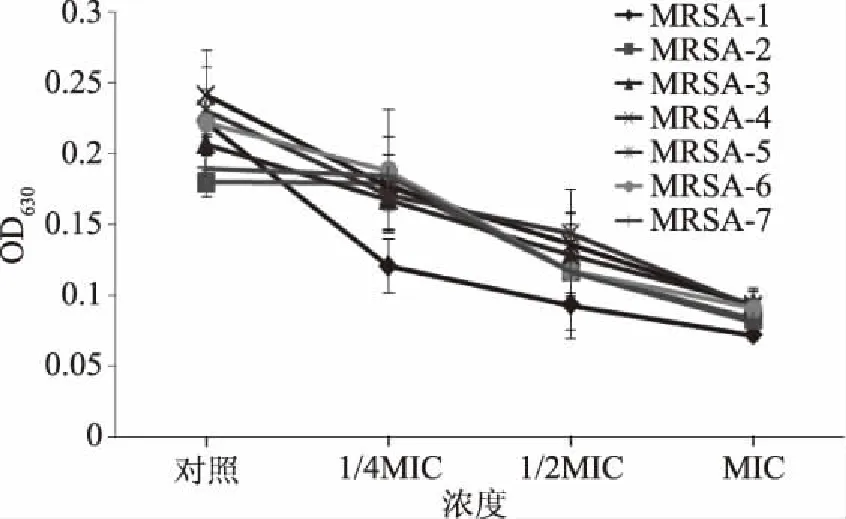
图4 紫皮蒜汁在不同抑菌浓度下对7株MRSA生物被膜形成的影响结果Fig.4 The effect of purple garlic juice on MRSA biofilm formation at different sub inhibitory concentration
3 结论
本实验中,两种不同大蒜汁对7株MRSA食品分离菌株均有明显的抑菌活性,抑菌圈的直径范围高于19 mm,属于极敏,抑制率达到了100%。
紫皮蒜汁的MIC值为6.25 mL/L,白皮蒜汁的MIC为12.5 mL/L,紫皮蒜汁和白皮蒜汁对7株MRSA的抑菌效果存在显著差异(p<0.05),具有统计学意义,相同浓度的紫皮蒜抑菌效果更好。
在不同亚抑菌浓度大蒜汁的干预下,7株MRSA产生的生物被膜含量均显著减少,适当的添加生大蒜汁能够很好抑制MRSA菌株生物被膜的形成。
4 讨论
金黄色葡萄球菌是一个大家都知晓的病原菌,在环境中广泛存在,是造成皮肤和软组织感染,心内膜炎和菌血症以及食物中毒的主要原因[14]。目前出现了耐药性金黄色葡萄球菌的广泛传播和流行,甚至是暴发流行。其中最为严重的是耐甲氧西林金黄色葡萄球菌(MRSA),其引发的感染难以控制,且近年来检出率呈增高趋势[15]。MRSA菌株不仅对β-内酰胺类抗菌药物耐药,还对喹诺酮类、氨基糖苷类和大环内酯类等抗菌药物耐药。因此,预防和控制MRSA菌株是目前面临的重要难题[16-17]。另一方面,细菌生物被膜的存在,大大增加了细菌的耐药性。生物被膜是细菌为适应外界环境而分泌的多糖基质、纤维蛋白等构成胞外基质,将其自身包裹其中而形成的一种细菌聚集物。生物被膜的形成为细菌提供了一个保护性的生活环境,并屏蔽了寄主的免疫功能,使得细菌能够大量增殖、扩散,也是细菌反复感染的重要原因[18]。正是基于目前采用抗生素对付MRSA菌株存在一定的难度,本研究试图探索其它途径控制MRSA菌株。我们采用两种不同品种的生大蒜汁对7株MRSA食品分离MRSA菌株进行研究,通过观察大蒜汁的抑菌效果及对MRSA细菌生物被膜的形成影响来评价大蒜汁在控制MRSA上的应用,旨在为食品中MRSA菌株的控制策略提供一定参考。
大蒜杀菌和抑菌主要活性成分是大蒜素及一些挥发性硫醚化合物,大蒜汁对其他病原菌的杀菌效果已有探讨,但针对MRSA菌株的研究目前还比较少。本实验通过研究两种不同种类的大蒜汁对MRSA菌株生长及其生物被膜形成影响,发现紫皮蒜汁的抑菌效果更好,推测紫皮蒜中所含的大蒜素等抑菌成分比白皮蒜更丰富。我们的结果与倪萍等[19]的结果一致,他们的研究也认为紫皮蒜针对蜡状芽孢杆菌、大肠杆菌和金黄色葡萄球菌的抑菌活性比白皮蒜更强。
在细菌生物被膜的检测实验中,我们的结果表明在不同亚抑菌浓度大蒜汁的干预下,7株MRSA产生的生物被膜量均显著减少。分析其原因,一方面可能是大蒜汁抑制了细菌本身的生长,另一方面大蒜汁中的大蒜素也可抑制细菌胞外多糖的分泌,减少细菌粘附性,干扰细菌生物被膜的成熟和分化,大蒜素浓度越高,抑制效果越明显[20]。因此,在日常生活中,凉拌食品中添加一定浓度的大蒜汁可以起到有效抑制MRSA菌株的生长和生物被膜的形成。
综上,本研究结果表明两种不同大蒜汁对MRSA菌株的生长和细菌生物被膜的形成均具有明显抑制效果。本研究结果为探索抑制超级细菌MRSA的研究提供参考,也对人们日常生活具有很好的指导意义。
[1]Wang W,Liu F,Baloch Z,et al. Genotypic characterization of methicillin-resistant Staphylococcus aureusisolated from pigs and retail foods in China[J]. Biomed Environ Sci,2017,30(8):570-580.
[2]Iqbal Z,Seleem MN,Hussain HI,et al. Comparative virulence studies and transcriptome analysis ofStaphylococcusaureusstrains
isolated from animals[J]. Sci Rep,2016,6:35442.
[3]黄德斌,胡泽华,余昭芬,等. 马桑水提取物抗耐甲氧西林金黄色葡萄球菌的作用机制研究[J].中草药,2017,48(9):1802-1811.
[4]邢茜,江荣林,雷澍,等.耐甲氧西林金黄色葡萄球菌的研究进展[C].全国中西医结合重症医学学术会议,2013:3638-3640.
[5]李建涛,刘书深,刘姝玮,等.大蒜浸提液的抑菌效应[J]. 黑龙江农业科学,2017(1):65-66.
[6]李岩,吕昌龙,桑力轩,等.黑大蒜提取物联合抗生素对金黄色葡萄球菌和大肠埃希菌的体外抗菌作用研究[J].微生物学杂志,2014,34(2):59-62.
[7]王晨旭,来平煜,李悦,等.大蒜素的提取工艺[J].甘肃科技,2017,33(1):44-47.
[8]尚丛珊,于乾,冯霞霞.大蒜提取液抑菌效果的研究[J].科技展望,2017,27(9):1672-8289.
[9]Saha SK,Saha S,Akhter SM,et al.InVitrodetermination of minimum inhibitory concentration of aqueous garlic extract and imipenem againstStaphylococcusaureusandEscherichiacoli[J].Mymensingh Med J,2016,25(3):477-84.
[10]姜成,申晓慧,李春丰,等.大蒜对常见食品污染细菌的抑制作用研究[J].黑龙江农业科学,2013(7):113-116.
[11]唐俊妮,王琼,韦吉敏,等. 洋葱汁对五种常见食源性病原细菌抑菌效果研究[J]. 西南民族大学学报:自然科学版,2015,41(3):277-284.
[12]朱安妮,袁宁,唐俊妮,等. 鲜榨柠檬原汁对7种常见食源性致病菌抑菌效果及被膜形成的影响[J]. 中国食品卫生杂志,2016,28(1):16-22.
[13]苏凤贤,张宝善.大蒜素的杀菌及其在食品中的防腐保鲜应用研究进展[J].中国调味品,2006(6):13-17.
[14]Ma YSL,Zhao YY,Tang JN,et al. Antimicrobial susceptibility and presence of resistance & enterotoxins/enterotoxin-likes genes inStaphylococcusaureusfrom food[J]. CyTA-Journal of Food,2018,16(1):76-84.
[15]Sato T,Usui M,Konishi N,et al. Closely related methicillin-resistantStaphylococcusaureusisolates from retail meat,cows with mastitis,and humans in Japan[J].PLoS One,2017,12(10):e0187319.
[16]朱吉超,魏莲花,杨永清,等. 耐甲氧西林金黄色葡萄球菌临床分布及耐药性分析[J]. 中华医院感染学杂志,2017,27(7):1462-1465.
[17]陈斌泽,李泽慧,冯强生,等.耐甲氧西林金黄色葡萄球菌耐药机制与分子分型研究进展[J].检验医学与临床,2016,13(19):2824-2827.
[18]王琼,唐俊妮,陈娟,等.金黄色葡萄球菌生物被膜检测及控制方法研究进展[J].食品工业科技,2014,35(22):71-375.
[19]倪萍,刘素辉,牛婷婷,等.紫皮蒜和白皮蒜抑菌活性的比较研究[J].医学信息,2013(16):126-126.
[20]林丽华.大蒜素对铜绿假单胞菌生物被膜的干预作用及机制初步研究[D].重庆:重庆医科大学,2009.
