磷脂复合物改善阿司匹林对大鼠胃肠道刺激性作用的研究
2018-05-30刘勃缨姜双瑜李新悦吴玉梅徐松林
刘勃缨 ,姜双瑜 ,李新悦 ,吴玉梅 ,张 瀛 ,徐松林
(1.天津中医药大学,现代中药发现与制剂技术教育部工程中心,天津300193;2.天津中医药大学,天津市现代中药重点实验室-省部共建国家重点实验室培育基地,天津300193;3.浙江海昶生物医药技术有限公司,杭州310000)
阿司匹林(asprin,ASP)又名乙酰水杨酸,具有解热、镇痛、抗癌、抗风湿作用[1],另外,阿司匹林能够降低血小板黏附力,可以防止血栓形成和降低心脑血管疾病发病率,已常规用于冠心病及脑血栓的防治[2]。阿司匹林是传统的非类固醇抗炎药,它最大的问题是消化道的毒副作用[3-6],由于其酸性成分可透过胃黏膜上皮脂蛋白膜层,破坏脂蛋白膜的保护作用,使胃酸可逆地弥散到组织中损伤细胞,导致毛细血管破损而出血,这种严重的胃肠道不良反应限制了其在临床的应用[7-10]。磷脂(phospholipid,PC)复合物是指药物与PC以一定的配比关系结合而成的复合物[11]。磷脂是生命的基础物质,它存在于人体的每一个细胞中,是细胞膜主要成分,在生物体内降解,无毒性、无免疫原性,可以降低阿司匹林对胃肠道的刺激[12-13]。本文通过大鼠胃肠道刺激性实验来探究磷脂复合物对阿司匹林造成的胃肠道损伤的改善作用,从而为传统的非类固醇抗炎药的剂型研究提供新的方向。
1 材料与方法
1.1 药物与试剂 阿司匹林普通肠溶片剂(浙江海昶生物医药技术有限公司,批号16112103-02,规格:81 mg);阿司匹林磷脂复合物(浙江海昶生物医药技术有限公司,批号:16122801,阿司匹林含量:42.7%);阿司匹林磷脂复合物胶囊(浙江海昶生物医药技术有限公司,批号16122802,规格:81 mg);生理盐水(山东康宁药业有限公司);多聚甲醛、甲醛溶液(天津市康科德科技有限公司)。
1.2 主要仪器 ASP200S自动真空组织脱水机,Leica EG1150H自动生物组织包埋机,Leica RM2255切片机,NikonCi-L显微镜。
1.3 实验动物 清洁级雄性SD大鼠,体质量(220±20)g[天津中医药大学实验动物中心,动物合格证号:SCXK(军)2014-0001]。动物室温度:(25±2)℃,相对湿度:(50±2)℃。健康雄性SD大鼠分为4组,每组10只,分别给予生理盐水(2 mL)、阿司匹林片剂、阿司匹林磷脂复合物胶囊和阿司匹林磷脂复合物胶囊内容物,每次按300 mg/kg阿司匹林灌胃给药。
1.4 实验方法
1.4.1 动物处理 实验前大鼠禁食12 h,每日灌胃1次,连续给药14 d,后颈椎脱臼法处死动物并解剖取胃,向胃内注射多聚甲醛溶液2 mL。将胃浸入10%甲醛固定液中浸泡10 min,沿胃大弯开胃,生理盐水洗净胃内容物,所有胃组织均以10%甲醛固定液固定24 h,制作病理组织切片,照相,观察胃部溃疡的发生情况。
1.4.2 组织制片与观察 解剖取材固定于10%甲醛固定液固定,组织经ASP200S自动真空组织脱水机脱水浸蜡,Leica EG1150H自动生物组织包埋机包埋,Leica RM2255切片机制片,HE染色,NikonCi-L显微镜观察,HMIAS-2000高清晰度数码显微图像分析系统采图。
1.4.3 参考评价依据 根据胃黏膜的完整性及炎症细胞的浸润情况分为以下4种情况:正常(0分)胃黏膜结构完整,上皮细胞无缺损或脱落,排列整齐,胃底腺形状规则,黏膜层偶见少量散在的炎症细胞;轻度(1分)胃黏膜结构相对完整,上皮细胞无缺损或脱落,黏膜上皮及胃底腺整体排列较规则或局部欠规则,黏膜层上1/3可见较多炎症细胞浸润;中度(2分)胃黏膜结构不完整,黏膜上皮及胃底腺排列不规则,部分上皮细胞缺损或脱落坏死,黏膜层上2/3伴较多炎症细胞浸润;重度(3分)上皮细胞成片缺损或脱落坏死,黏膜层大于2/3甚至全层伴大量炎症细胞浸润,胃底腺结构紊乱。
1.5 统计学分析 采用SPSS17.0统计学软件对数据进行相应的处理及分析,计量数据以分级评分表示,无损伤为0分,轻度1分,中度2分,重度3分。各组间的数据采用秩和检验分析方法进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 观察结果 将病理切片分别置于低倍镜和高倍镜观察胃的损伤情况,结果见图1、2。

图1 显微镜下观察到的胃损伤图像(×4)Fig 1 Images of the gastric injury observed with microscope(×4)

图2 显微镜下观察到的胃损伤图像(×10)Fig 2 Images of the gastric injury observed with microscope(×10)
由图1、2可知,对照组见胃黏膜结构完整,上皮细胞排列整齐,上皮细胞未见明显缺损或脱落,胃底腺形状规则,黏膜层偶见少量散在的炎症细胞,黏膜肌层无增厚及向黏膜层扩张现象;4/10只动物黏膜下层至肌层间见轻度充血和水肿。
阿司匹林片剂组镜下胃黏膜结构较完整,黏膜上皮排列规则,7/10胃底腺局部排列欠规则,黏膜层4/10轻度至重度以嗜中性粒细胞为主的炎症细胞浸润,7/10轻度至中度充血;9/10只动物黏膜下层至肌层间见轻度至中度充血和轻度水肿,8/10只动物轻度炎症细胞浸润。
阿司匹林磷脂复合物组镜下胃黏膜结构较完整,黏膜上皮排列规则,4/10胃底腺形状规则,黏膜层偶见少量散在的炎症细胞,6/10轻度充血;4/10只动物黏膜下层至肌层间见轻度充血,8/10轻度水肿,2/10只动物轻度炎症细胞浸润。
阿司匹林复合物胶囊组镜下胃黏膜结构较完整,黏膜上皮排列规则,4/10胃底腺局部排列欠规则,黏膜层3/10少量炎症细胞浸润,5/10轻度充血;9/10只动物黏膜下层至肌层间见轻度至中度充血,8/10轻度水肿,4/10只动物轻度炎症细胞浸润。
2.2 损伤情况 口服给药14 d后胃溃疡发生率见表1,由表可知,生理盐水对照组胃溃疡情况最低,阿司匹林普通片剂组胃溃疡发生率最高,4组实验对象具体胃损伤情况见表2。

表1 口服给药14 d后各组胃损伤发生率Tab 1 Incidence of gastric injury after oral administration of 14 d in each group
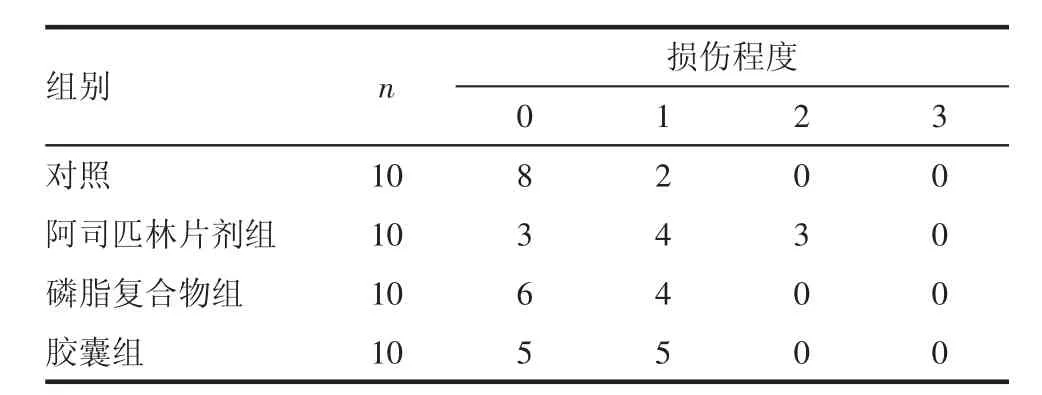
表2 各组胃损伤情况评分Tab 2 Gastric damage score in each group
由表1可知,对照组胃溃疡发生率最低,阿司匹林磷脂复合物组和胶囊组相对较高,阿司匹林普通片剂组胃溃疡发生率最高;采用秩和检验对表2所示的每组各级别损伤的样本数进行统计分析,比较各组间差异,结果为阿司匹林普通片剂组与对照组生理盐水相比,P<0.05,有统计学差异;阿司匹林磷脂复合物组和阿司匹林磷脂复合物胶囊组与对照组相比,结果均为P>0.05,没有显著性差异;阿司匹林片剂组与阿司匹林磷脂复合物组、阿司匹林磷脂复合物胶囊组相比,结果均为P<0.05,有统计学差异。说明阿司匹林磷脂复合物能有效降低阿司匹林对胃肠道的损伤。
3 讨论
近年来,国内外相关文献报道了多种类型的药物与磷脂在一定条件下形成磷脂复合物后,使药物的理化性质发生改变[14-16]。许建文等[17]对水飞蓟宾-磷脂酞胆碱复合物的急性毒性的研究表明复合物的安全范围很大,安全性好,其机制还有待进一步研究。目前,药物磷脂复合物已应用于普通药用剂型中,如已经用于糖浆剂、片剂、膜剂、胶囊剂、颗粒剂、口服液和适合局部用药的乳剂、凝胶、水分散体等[18-20]。
本文通过两周灌胃给药后对大鼠胃部取材并制作病理切片,观察阿司匹林药物对胃肠道的损伤情况,通过与普通阿司匹林肠溶片比较可以发现,加工成阿司匹林磷脂复合物后对胃肠道的损伤明显改善,这应该与磷脂本身的性质有关。活性成分通过与磷脂的极性基团相互作用而被固定,而磷脂的两个长脂肪酸链不参与复合反应可自由移动,形成一个亲脂性的表面[21],多个磷脂复合物分子有序排列形成一个球状体将药物中具有不良反应和刺激性的基团包裹起来,从而使得药物的不良反应及刺激性明显下降[17],确切的机制还有待研究。从实验结果来看,阿司匹林磷脂复合物组胃组织无明显病变,胃损伤情况与普通片剂组相比有显著性差异(P<0.05),但将磷脂复合物制成胶囊对胃肠道保护作用没有明显提高,这可能是由于在给药环节无法将整粒胶囊让动物吞服,只能将胶囊内容物取出溶解再灌胃,从而失去胶囊这一剂型本身的优势,进而影响实验结果,但胶囊的剂型从生物利用度到患者顺应性都有重要意义和研究空间。
[1]贺智勇,吴朝花,严俊丽,等.阿司匹林磷脂复合物的制备及其表征[J].中国药房,2017,28(25):3562
[2]李成军,马丹丹,祝友朋,等.阿司匹林对大鼠胃溃疡愈合的影响和机制[J].中国老年学杂志,2011,31(15):2898
[3]丁顺,王昕.生姜对阿司匹林诱发胃溃疡大鼠的胃粘膜保护作用研究[J].中国民族民间医药,2012,21(21):22
[4]顾同进,曹忆嵘.低剂量阿司匹林对黏膜损伤的防治[J].老年医学与保健,2007,13(1):58
[5]练新飞,向定成.服药时间对肠溶阿司匹林胃肠道副作用的影响[J].中国煤炭工业医学杂志,2005,8(5):457
[6]Li J P,Guo J M,Hua Y Q,et al.The mixture of Salvia miltiorrhiza-Carthamus tinctorius (Danhong injection)alleviates low-dose aspirin induced gastric mucosal damage in rats[J].Phytomedicine,2016,23(6):662
[7]辛文妤,张雷明,王天,等.娑罗子提取物对阿司匹林致胃溃疡作用的研究[J].中国药物警戒,2010,7(6):321
[8]Mccarthy D M.Efficacy and gastrointestinal risk of aspirin used for the treatment of pain and cold[J].Best Pract Res Clin Gastroenterol,2012,26(2):101
[9]Saha L,Bhatia A,Chakrabarti A.Gastroprotective effect of bezafibrate,a peroxisome proliferator activated receptor agonist and its mechanism in a rat model of aspirin-induced gastric ulcer[J].Advanc Digest Med,2016,3(3):101
[10]Elshinnawy N A,Abdelmageid S A,Alshailabi E M.Evaluation of antiulcer activity of indole-3-carbinol and/or omeprazole on aspirin-induced gastric ulcer in rats[J].Toxicol Ind Health,2014,30(4):357375
[11]顾海滨.药物磷脂复合物的研究进展[J].中国医药指南,2015,13(33):33
[12]翟光喜,娄红祥,邹立家,等.药物磷脂复合物的研究进展[J].中国药学杂志,2001,36(12):10
[13]郝海军,张红芹,贾幼智,等.采用制剂新技术提高中药磷脂复合物的溶出度和生物利用度研究进展 [J].中草药,2013,44(17):2474
[14]Semalty A,Semalty M,Singh D,et al.Development and characterizationofaspirin-phospholipidcomplexforimproveddrugdelivery[J].EpigenetPsychiatr,2010,35(2):79
[15]Tarnawski A S.Cellular and molecular mechanisms of gastrointestinal ulcer healing[J].Digest Dis Sci,2005,50(1):S24
[16]Giraud M N,Sanduja S K,Felder T B,et al.Effect of omeprazole on the bioavailability of unmodified and phospholipid-complexed aspirin in rats[J].Aliment Pharm Therap,2015,11(5):899
[17]许建文,张光军,陈正跃.水飞蓟宾-卵磷脂复合物制备工艺比较[J].中国生化药物杂志,2002,23(5):245
[18]凌沛学,汤漩,王凤山,等.药物与磷脂复合物研究近况[J].中国药学杂志,2005,40(6):401
[19]丁冬梅,张振海,蒋艳荣,等.中药磷脂复合物的研究进展[J].中国中药杂志,2013,38(13):2046
[20]李瑾,朱美娟,周凯,等.丹酚酸B磷脂复合物的制备和质量评价[J].广州化工,2016,44(21):26
[21]廉洁,王伯初.药物磷脂复合物工艺评价标准及应用研究进展[J].生物技术通讯,2006,17(5):830
