DNA为模板的纳米银簇探针检测肿瘤细胞高表达microRNA-21
2018-05-30侯肖肖孙丽范樊明玥孙艳华
侯肖肖,孙丽范,樊明玥,孙艳华
(天津医科大学1.药学院;2.公共卫生学院,天津300070)
肿瘤发生早期的标志物检测技术是目前临床工作者渴望的诊断技术之一。micro RNA(miRNA)是近年来发现的长度约22 nt的内源性短链RNA,在肿瘤发生、发展等病理过程中起重要调控作用[1]。miRNA-21在结肠癌、肺癌、胰腺癌、胃癌和乳腺癌等多种肿瘤中均表现为上调[2-4],因此成为早期检测癌症的潜在靶标。目前,特征miRNA的体外定量检测手段主要包括反转录聚合酶链反应(RT-PCR)、微阵列、电化学和荧光法等。但是它们在灵敏度、抗干扰性、生物相容性、操作流程复杂性等方面有待改进。所以,针对肿瘤细胞特异性表达的miRNA开发新型检测探针成为研究热点。纳米银簇由于具有较强的荧光发光性、容易制备以及好的生物相容性等优点,成为检测核酸、蛋白、细胞以及金属离子等多种目标物的理想传感材料。纳米银簇由几个到几十个银原子组成[5],它们的量子效应使其具有类似分子的光学性质[6]。DNA可以作为模板引导调控纳米银簇的形成[7]。同时,检测目标miRNA时,DNA与miRNA碱基互补配对的高度专一性,导致受DNA调控的纳米银簇内部发生能量转移,表现在荧光光谱上的改变,成为miRNA的检测信号。本文使用DNA单链引导合成纳米银簇,成功制备了检测miRNA-21的荧光探针,同时优化了检测时溶液的pH值和金属镁离子的影响条件,为将这一技术实际应用于血清、组织以及细胞中靶标miRNA的检测提供了依据。
1 材料与方法
1.1 试剂及仪器 硼氢化钠(NaBH4)、硝酸银(AgNO3)、磷酸二氢钠(NaH2PO4)、磷酸氢二钠(Na2HPO4)、硝酸镁[Mg(NO3)2]均购买于天津市江天化工技术有限公司,为分析纯;DNA序列和miRNA序列均订购于大连宝生物有限公司,为HPLC纯化。miRNA-21 序列:5′-UAG CUU AUC AGA CUG AUG UUGA-3′,模板 DNA 序列:5′-GGG TCA ACA TCA GTC TGA TAA GCT ACC CCC CCCC-3′。胎牛血清购买于AusGeneX公司;实验用水为超纯水(电阻率18.25 MΩ)。RF-5301pe荧光分光光度计(岛津),U-3310紫TCA ACA TCA GTC TGA TAA GCT ACC CCC CCCC-3′。胎牛血清购买于AusGeneX公司;实验用水为超纯水(电阻率18.25 MΩ)。RF-5301pe荧光分光光度计(岛津),U-3310紫外-可见分光光度计 (日立),Tecnai G2 F20高分辨透射电镜(荷兰FEI),Jasco-810 圆二色谱仪(日本 Jasco),K-30 干式恒温器(杭州奥盛仪器有限公司)。
1.2 方法
1.2.1 DNA引导纳米银簇的合成 90 μL的DNA溶液(100 μmol/L)加入到 494.5 μL 的磷酸缓冲溶液(4 mmol/L,pH7.4)中,加入 4 μL 的 Mg(NO3)2溶液(900 mmol/L),配制成 600 μL 溶液,干式恒温器中退火处理,95℃,3 min,缓慢降至室温。取出加入7.5 μL的 AgNO3溶液(7.25 mmol/L),震荡 2 min,室温下避光放置 1 h,加入 4 μL新鲜制备的NaBH4(13.5 mmol/L)溶液,立即震荡3 min,4℃过夜储存,备用。
1.2.2 miRNA-21的检测 把合成的DNA/AgNCs探针溶液(15 μmol/L)稀释10倍,分别加入浓度0、0.01、0.05、0.10、0.30、0.50、0.65、0.75、1.00 和1.20 μmol/L的miRNA-21,室温下避光放置1 h,进行荧光检测。
1.2.3 miRNA-21回收率实验 将胎牛血清于4℃下离心10 min(8 000 r/min)。取上清液,用4 mmol/L的磷酸缓冲溶液(pH7.4)稀释100倍备用。采取标准加样法进行miRNA-21回收实验。
1.2.4 溶液环境优化 pH值优化:配制pH值为3.0、5.0、7.4、9.0 和 11.0 的磷酸缓冲溶液作为反应体系进行DNA/AgNCs的合成,合成步骤同1.2.1。镁离子浓度优化:配制成镁离子浓度为 0、2、4、6、8、10和12 mmol/L的反应体系,进行DNA/AgNCs的合成,合成步骤同1.2.1。
2 结果
2.1 荧光探针DNA/AgNCs的性质及对miRNA-21的定性检测 荧光探针是基于材料的荧光变化进行检测的,因此纳米银簇的成功合成是后续检测的关键。图1A是高倍电子显微镜下的银簇形貌,可以看到纳米银簇粒径均一,平均粒径为(3±0.8)nm左右,说明已经形成了形态良好的纳米银簇。图1B(a)表明DNA/AgNCs在430 nm和600 nm处有吸收峰,430 nm代表大的银颗粒吸收峰,600 nm代表银簇的最大吸收峰位,1C(a)表明其对应的最大荧光发射峰位于650 nm处。当加入miRNA-21后,发现DNA/AgNCs的最大吸收峰位蓝移至550 nm[1B(b)],相应地,其最大发射峰位也蓝移至600 nm[1C(b)]。也就是加入 miRNA-21 后,探针 DNA/AgNCs在650 nm(Ex=600 nm)处的荧光强度降低,而其在600 nm(Ex=550 nm)处的荧光强度显著上升。圆二色谱结果显示,加入 miRNA-21 之前[1D(a)],探针DNA/AgNCs在245nm处有一负的吸收峰,在275nm处有一正的吸收峰;当加入目标miRNA-21后,其负峰位移至240 nm处,正峰移至265nm处[1D(b)]。
2.2 miRNA的定量检测 如图2A所示,随着miRNA-21的浓度逐渐增加,DNA/AgNCs在600 nm处的荧光强度逐渐增加。图2A中的插图是DNA/AgNCs的荧光强度与miRNA-21浓度在0~1 000 nmol/L的浓度范围的线性关系图,其拟合方程为 y=0.23x+158.0(R2=0.992 8),其最低检测限19.30 nmol/L(3σ/S,σ是10次空白溶液的标准差,S是标准曲线的斜率)。如图2B所示,对目标miRNA-21特异性检测实验证明,DNA/AgNCs探针除了对miRNA-182有一定程度的非特异性应答外,miRNA-195,miRNA-155,miRNA-31 对 DNA/AgNCs检测miRNA-21几乎不产生影响。
2.3 血清回收实验 采取标准加入法进行miRNA-21的血清检测回收率计算。向不含有miRNA-21胎牛血清中加入不同浓度的miRNA-21配成标准溶液,其加标回收结果见表1,miRNA-21在胎牛血清中的平均回收率在93.0%~110.0%范围内。
2.4 检测miRNA-21目标时的环境优化 为了满足实际生化检测的灵敏度要求,我们探索了检测环境pH值和对核酸结构有敏感调控的Mg2+对目标检测效果的影响。
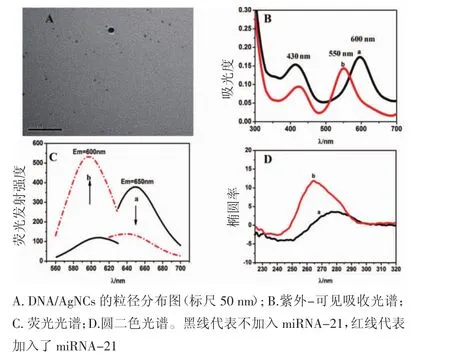
图1 DNA/AgNCs的合成以及可行性验证Fig 1 DNA/AgNCs synthesis and feasibility verification
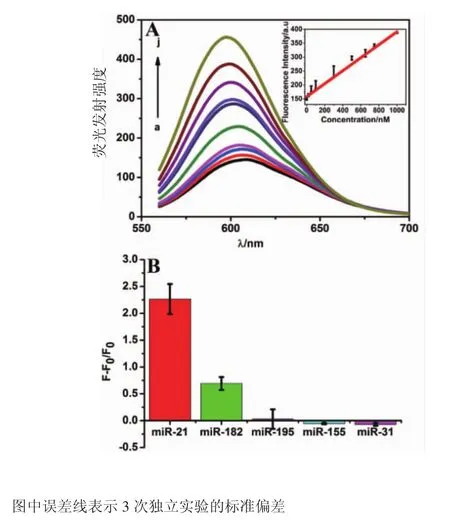
图2 不同浓度miRNA-21的DNA/AgNCs荧光图谱和miRNA-21的特异性检测Fig 2 Fluorescence emission spectra of DNA/AgNCs with various concentrations oftargetmiRNA-21 and selectivity experimentoftheDNA/AgNCsprobeformiRNA-21detection

表1 在胎牛血清中的miRNA-21的回收率Tab 1 Recoveries of miRNA-21 in fetal bovine serum samples
2.4.1 环境pH值对DNA/AgNCs探针荧光性质的影响 研究中设置了pH值分别为3.0(a),5.0(b),7.4(c),9.0(d)和 11.0(e)的溶液环境体系。如图 3 A所示,使用600 nm激发波长时,不同pH值溶液体系中探针材料的发射强度存在明显差别。当溶液pH值为7.4时,其荧光强度最大。如图3B所示,不同pH环境下的各组样品在紫外-可见吸收光谱中存在相似规律,均在600 nm波长处存在吸收峰,pH值为7.4时吸收强度最大。这说明溶液的pH值影响探针荧光性质,因此在应用于检测前需要对体系环境的酸碱度进行优化。
2.4.2 Mg2+对DNA/AgNCs探针荧光性质的影响 本研究体系中设置了 Mg2+浓度为 0,2,4,6,8,10 和12 mmol/L的溶液环境,研究Mg2+对探针DNA/AgNCs的荧光发射的影响。如图4A所示,Mg2+浓度在2~6 mmol/L的范围内比较理想,其浓度为4 mmol/L时荧光强度达到最大。对比加入和不加入Mg2+的探针DNA/AgNCs溶液的紫外光谱(图4B),不含Mg2+的样品只在400 nm有一处吸收峰[图4B(a)],而加入Mg2+的样品,在430 nm和600 nm处出现吸收峰[图4B(b)]。400 nm和430 nm处的吸收峰为大的银颗粒吸收峰,600 nm处吸收峰为银簇的吸收峰。
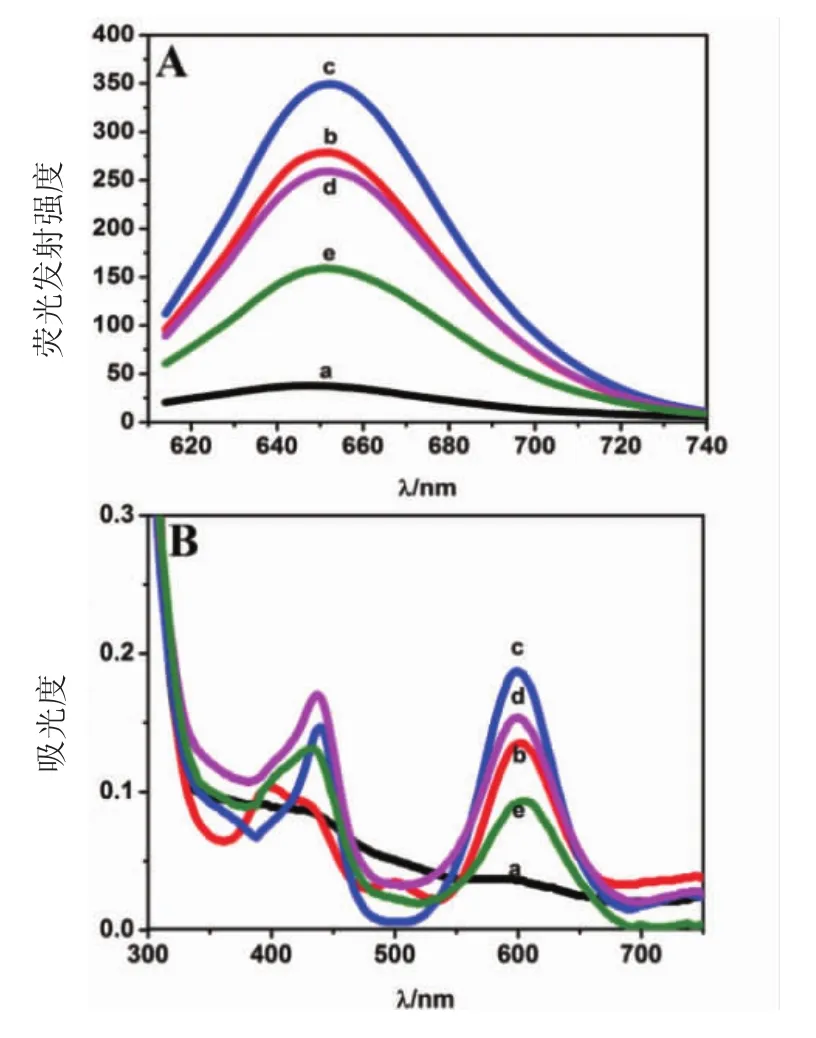
图3 荧光发射光谱图和紫外吸收光谱图Fig 3 Fluorescence emission spectroscopy and UV absorption spectroscopy
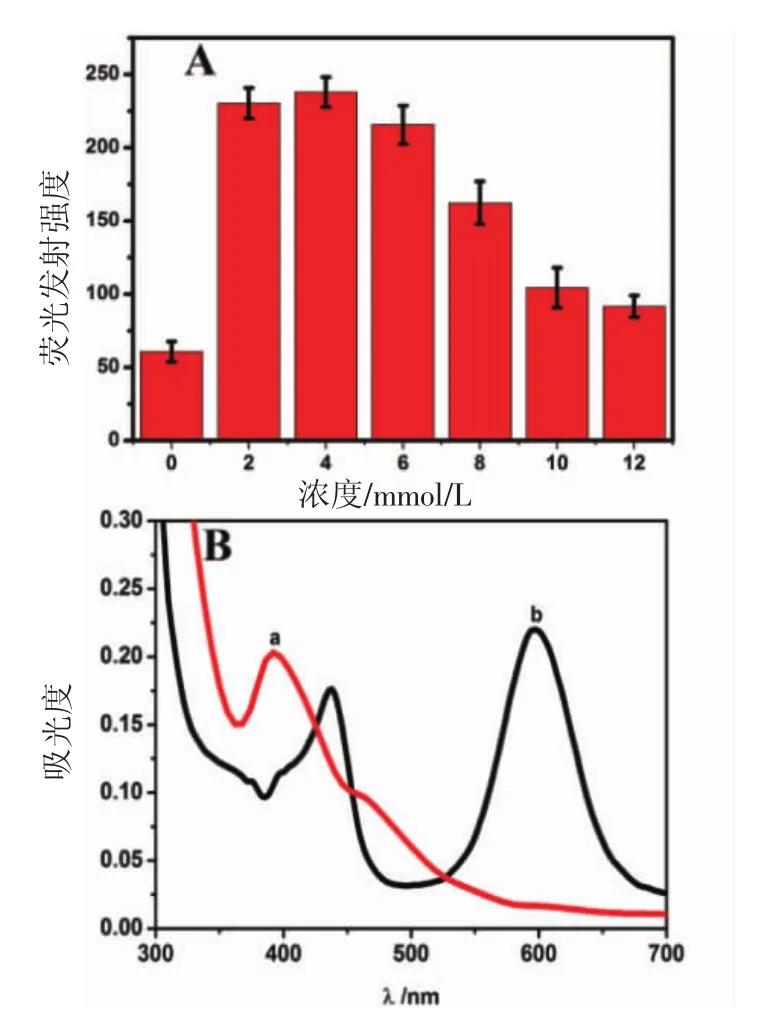
图4 荧光发射强度柱状图和紫外吸收光谱图Fig 4 Fluorescence emission intensity histogram and UV absorption spectroscopy
3 讨论
本研究通过构建以DNA作为模板合成的纳米银簇探针,借助探针与目标miRNA之间碱基互补配对引起的荧光信号变化,实现对miRNA-21的定性和定量检测。根据表征结果,实验合成的DNA/AgNCs在电镜视野中以小尺寸、均一的纳米粒子形态出现,在紫外光谱中600 nm处有最大吸收,并且以此波长激发有强的荧光发射。用于目标miRNA-21的检测时,探针DNA/AgNCs的最佳荧光发射峰位和紫外-可见吸收峰位均发生改变,且核酸的二级结构也发生改变,这些结果表明探针DNA/AgNCs能够用于目标物的定性分析。探针DNA/AgNCs荧光强度的变化与目标的浓度呈线性相关,说明此方法可以实现对目标的定量分析。探针DNA/AgNCs对miRNA-21的最低检测限达到19.30 nmol/L,与其他文献报道的检测miRNAs的方法[8-9]相比,本文所设计的方法更灵敏且操作简单。此外,实验验证这一方法对目标miRNA-21检测有良好的特异性。在miRNA-21的血清回收实验中,其平均回收率为93.0%~110.0%。综上这些结果,此方法可以用于miRNA-21的定性和定量检测分析。
为了实现检测过程中稳定的光学性能,探针材料合成环境的优化是必要的。对溶液体系酸碱度的优化结果表明,pH值影响DNA/AgNCs的荧光性质。在酸性环境下,胞嘧啶会发生质子化,导致其与银离子及银簇之间的相互作用减弱,不利于荧光银纳米簇的生成和稳定;碱性环境下,Ag+与DNA上的磷酸基团形成Ag3PO4化合物[10],导致与胞嘧啶相互作用的Ag+减少,不利于荧光银纳米簇的生成和稳定。所以,pH为7.4时是DNA/AgNCs材料发光的最佳环境。
Mg2+是人体必需的元素之一,其具有极其重要的生理生化功能。本文研究了Mg2+对探针DNA/AgNCs荧光性质的影响。结果显示,加入Mg2+后DNA/AgNCs的吸收峰从400 nm单一吸收峰,变为430 nm和600 nm两处吸收峰。由于400 nm附近的吸收通常认为来自于大的银颗粒间共振能量转移,600 nm处为银簇吸收峰[11-12],可以推断Mg2+发挥的作用为减少体系中大粒径银颗粒的形成。
本课题应用新型材料探针DNA/AgNCs,实现了对miRNA-21的定性、定量检测。同时对合成过程中的酸碱度和Mg2+环境进行了优化,为高效、敏感地检测早期肿瘤潜在靶标miRNA提供思路。
[1]Petri A,Lindow M,Kauppinen S.MicroRNA silencing in primates:towards development of novel therapeutics[J].Cancer Res,2009,69(2):393
[2]Volinia S,Calin G A,Liu C G,et al.A microRNA expression signature of human solid tumors defines cancer gene targets[J].Proc Natl Acad Sci U S A,2006,103(7):2257
[3]Wang Q,Liu S,Tang Y,et al.MPT64 protein from Mycobacterium tuberculosis inhibits apoptosis of macrophages through NF-kB-miRNA21-Bcl-2 pathway[J].PLoS One,2014,9(7):e100949
[4]Mcclure C,Brudecki L,Ferguson D A,et al.MicroRNA 21 (miR-21)and miR-181b couple with NFI-A to generate myeloid-derived suppressor cells and promote immunosuppression in late sepsis[J].Infect Immun,2014,82(9):3816
[5]Yeh H C,Sharma J,Shih I M,et al.A fluorescence light-up Ag nanocluster probe that discriminates single-nucleotide variants by emission color[J].J Am Chem Soc,2012,134(28):11550
[6]Zheng J,Nicovich P R,Dickson R M.Highly fluorescent noblemetal quantum dots[J].Annu Rev Phys Chem,2007,58:409
[7]Tyagi S,Kramer F R.Molecular beacons:probes that fluoresce upon hybridization[J].Nat Biotechnol,1996,14(3):303
[8]Lee S Y,Hairul Bahara N H,Choong Y S,et al.DNA fluorescence shift sensor:a rapid method for the detection of DNA hybridization using silver nanoclusters[J].J Colloid Interface Sci,2014,433:183.
[9]He K,Liao R,Cai C,et al.Y-shaped probe for convenient and label-free detection of microRNA-21 in vitro[J].Anal Biochem,2016,499:8
[10]Lee J D,Cang J,Chen Y C,et al.Detection of adenosine 5'-triphosphate by fluorescence variation of oligonucleotide-templated Silver nanoclusters[J].Biosens Bioelectron,2014,58:266
[11]Li J,Jia X,Li D,et al.Stem-directed growth of highly fluorescent silver nanoclusters for versatile logic devices[J].Nanoscale,2013,5(13):6131
[12]Zhu Y,Hu X C,Shi S,et al.Ultrasensitive and universal fluorescent aptasensor for the detection of biomolecules(ATP,adenosine and thrombin)based on DNA/Ag nanoclusters fluorescence light-up system[J].Biosens Bioelectron,2016,79:205
