腹部放线菌病1例
2018-05-30张子敬高志清黄展明谢晓华
张子敬, 高志清, 谢 波, 黄展明, 谢晓华
放线菌(Actinomycetes) 是呈丝状分枝的单细胞原核微生物,为一种特殊类型的细菌,绝大多数厌氧生长或兼性厌氧,在体内聚集生长,形成肉眼可见颗粒。放线菌病是人兽共患病,其特点是病程较为缓慢,呈渐进性,易在局部形成化脓性、肉芽肿性病灶,并可能在局部扩散。本文通过报道1例少见的腹腔内放线菌感染累及肝脏的病例,并分析国内外文献资料,以提高临床医师对放线菌病诊断、临床表现及治疗的认识,开阔思路,避免误诊误治。
1 病例资料
患者男,45岁。因“右下腹疼痛半年,加重1 个月余”于2013年6月13日入院。半年前无明显诱因出现右下腹部隐痛,时呈剧烈绞痛,饮食后加重,夜间疼痛较甚,无腹泻,无恶心呕吐,无发热恶寒。1个月余前上述症状加重,当地医院肠镜示:①慢性阑尾炎,②慢性乙状结肠-直肠炎。检查后未予特殊处理。2013年6月6日转至某三甲医院行全腹CT示:下腹部偏右侧软组织肿物,浸润周围脂肪间隙,局部包绕小肠肠管,并与盲肠分界不清,考虑胃肠道来源的恶性肿瘤;周围及腹主动脉、腔静脉旁淋巴结转移。后转至我院治疗。查体:右下腹腹肌紧张,有压痛、反跳痛,右下腹部可触及一约10 cm×8 cm包块,质软,边界不清,活动度差,与周围组织粘连。肝脾肋下未触及,余未见异常。患者既往体健,近2个月来体重下降约8 kg;对青霉素过敏;无家族肿瘤病史。实验室检查:CA125 49.52 U/mL。6月18日全腹MR检查示下腹部占位性病变,考虑肠系膜来源肿瘤可能性大,不排除肠道来源肿瘤,建议穿刺活检,回盲部肠壁轻度增厚,肠腔扩张,考虑慢性炎症可能性大;肝内多发异常信号影,考虑血管瘤可能性大;少量腹水征。6月19日遂以腹部包块性质待查行剖腹探查术,术中见右下腹包块位于小肠系膜根部腹膜后,范围向下达盆腔骶前间隙,包块侵犯肠系膜及腹膜后大血管,部分与小肠粘连,约10 cm小肠狭窄;回盲部炎性粘连,阑尾位于腹膜后,与周围组织粘连严重,尾端呈暗红色炎性改变;回结肠系膜根部可触及多发肿大淋巴结。行腹腔脓肿清除+肠系膜肿物切除+小肠部分切除+小肠端端吻合+回盲部切除+回肠升结肠端侧吻合术。标本采用HE染色,镜下观察见阑尾壁急慢性炎细胞浸润,回盲部及回肠末端肠管黏膜面及网膜均见大量中性粒细胞浸润,网膜粘连,纤维结缔组织增生。诊断考虑:①慢性阑尾炎,急性发作;②“回盲部及回肠末端”肠系膜慢性化脓并粘连,纤维结缔组织广泛增生。术后患者腹痛症状好转后出院。
2013年9月1日患者因“乏力1个月余,伴双下肢水肿1周”再次入院。近1个月体重下降4.5 kg。入院后患者发热、盗汗,无咳嗽咯痰,查体:Murphy征(+),肝区叩击痛(+),余未见异常。9月1日血液分析示:RBC 2.94×1012/L、WBC 16.24×109/L、HGB 72 g/L、中性粒细胞计数13.93×109/L、占比0.858;我院再次取回盲部及回肠末段肠壁及系膜标本,采用HE染色,镜下观察见:回盲部及回肠末端肠系膜见慢性化脓性炎症,见嗜碱性不规则分叶体,即放线菌颗粒(见图1),亦称“硫磺颗粒”,周围有大量中性粒细胞、嗜酸粒细胞及浆细胞围绕,诊断为放线菌感染。患者既往有青霉素类药物过敏史,予阿奇霉素0.5 g/d联合奥硝唑1 g/d静脉滴注,7 d后改为莫西沙星0.4 g/d静脉滴注,12 d后改为莫西沙星片0.4 g/d口服14 d,配合护肝、补充白蛋白、输血、营养支持及中医药等对症治疗后,10月3日复查血液分析及生化未见明显异常。患者发热、乏力症状好转,下肢水肿、贫血、低蛋白血症纠正后出院。10月28日、11月18日门诊复诊诉无明显不适症状,查血分析及生化均未见明显异常,予莫西沙星片0.4 g/d口服30 d;2014年1月7日门诊复诊诉无明显不适症状,查血分析及生化未见明显异常,嘱患者可停用抗生素治疗,并嘱每半年复诊。2014年6月10日、2015年8月24日分别门诊复诊均未诉明显不适症状,查血分析及生化未见明显异常。后每年电话随访患者,患者反应良好未诉身体不适症状。
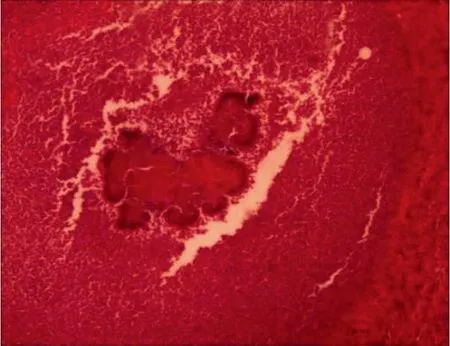
图1 回盲部病理切片所见Figure 1 Pathological section of ileocecal junction
2 讨论
放线菌在自然界分布广,是一种革兰阳性非抗酸厌氧丝状杆菌,可正常寄居在人体的口腔、上呼吸道、胃肠道及泌尿生殖道,是条件致病菌,当人体抵抗力降低或伴细菌感染时便可发病[1]。放线菌病是一种渐进性、化脓性、肉芽肿性炎症,以多发脓肿和窦道为特征,主要发生于面颈部、胸部、腹腔和盆腔,其中面颈部病变约占60%、胸部病变约占 15%、腹盆部病变约占20%、其他约占5%[2]。放线菌病可在任何年龄发病,成人发病率高,多见于15~35岁,以农民及野外作业者多见。
复习国内文献及本例病例,腹部放线菌多好发于回盲部,临床可表现为亚急性、慢性阑尾炎症状,在回盲部出现边界不清的不规则肿块,临床和影像学检查类似癌肿。病情继续发展时,腹部肿块增大与腹壁粘连,穿破腹壁后可形成多发性窦道,流出的脓液中可见“硫磺颗粒”[3]。腹部放线菌病主要临床表现有腹痛、腹部包块、恶心呕吐、发热恶寒、盗汗、消瘦,累及肝脏时可出现肝增大、疲倦乏力、食欲减退等。实验室检查可表现为白细胞升高,肿瘤标志物可阴性或稍高,累及肝脏时可出现肝酶异常。CT或MR多提示为恶性肿瘤征像。
放线菌不受解剖间隙限制,有侵袭特点,呈局部蔓延发展[4]。临床上,腹部放线菌容易被误诊的很大原因是腹部型放线菌病难以发现,所以相当部分的病例是在剖腹探查时才被确诊。放线菌病鉴别诊断比较困难,易与恶性肿瘤、化脓性感染、结核性感染相混淆。本例入院考虑腹部恶性肿瘤,行手术切除后初次病理结果未发现放线菌感染,后患者出现腹部绞痛、乏力、双下肢水肿、发热恶寒、盗汗、消瘦等症状,行PET/CT检查提示病变部位多,原因未明,我院复查病理结果提示放线菌感染。回顾分析本病例: ①腹部放线菌病临床少见,临床和辅助科室医师认识不足,没有提高警惕性。②本病临床表现无特异性,常不具备腹部肿块、腹壁瘘管、脓液中含“硫黄颗粒”典型表现,对放线菌病肿块与周围瘢痕性粘连常误认为是恶性肿瘤浸润。本例患者无明显放线菌感染的危险因素,术中未发现“硫磺颗粒脓汁”等。③影像学表现无特异性,本例CT、MRI、PET/CT检查均提示恶性肿瘤征象。④放线菌培养阳性率较低,仅在50%左右[5-6],故早期诊断较难。
放线菌病传统治疗方案: 青霉素成人300万~400万U/4 h静脉输注,或氨苄西林每日200 mg/ kg, 分3~4次静脉输注,4~6周后转为口服,即青霉素V 2~4 g/d,分4次口服,或阿莫西林500 mg/6 h口服,疗程6~12个月。替代选用治疗药物为多西环素或头孢曲松或克林霉素[7-8]。但也强调个体化治疗方案,取决于病变情况、感染部位、是否接受过手术以及治疗后的临床和影像学变化。研究报道16例肺部放线菌病中位治愈时间为静脉滴注青霉素2周,后序贯口服治疗3个月。近年来有多篇文献报道其疗程也可以<3个月,但强调对疗程<3个月的患者需加强随访,以防疾病复发及发生其他并发症[9-10]。但是在放线菌病治疗中仍然强调高剂量、长疗程以防复发。研究显示放线菌对多种抗生素敏感,当青霉素过敏或耐药时可选用磺胺类药物、四环素、多西环素、红霉素和克林霉素等药物,对播散性放线菌病及病情严重进展迅速的放线菌感染而言,通常为混合性感染,常伴有其他细菌的存在,所以应该与广谱抗生素联合应用[10-11]。2013年我国国家抗微生物治疗指南对于放线菌病的治疗首选方案:氨苄西林(2 g)或青霉素(1 000万~2 000万 U/ d)静脉滴注4~6周,后青霉素V钾(2~4 g/ d)口服3~6周,当青霉素过敏或耐药时可选用多西环素、头孢曲松、克林霉素、红霉素等药物治疗[12]。国外文献报道,放线菌对新型氟喹诺酮类药物盐酸莫西沙星敏感[13],在密切监测患者肝肾功能情况下,间歇使用莫西沙星疗程共约2个月,未发现患者出现肝肾功能损害情况,治疗效果明显。
通过本例放线菌病的回顾分析,旨在提高临床医师及辅助科室对放线菌病的认识,拓宽临床诊断思路,对于临床表现类似恶性肿瘤的病例应考虑放线菌病的可能。其次,对于任何不明原因的腹内包块在B超引导下的细针穿刺活检有助于明确诊断,并可避免不必要的探查或切除术[14]。再者,高度怀疑本病但不能明确诊断时,可用青霉素进行试验治疗,并密切观察治疗反应。希望通过对此病例的总结分析,能够引起临床各学科医师对该病的认识,避免误诊误治。
[1] 刘瑞华,冯艳. 腹部放线菌病1例[J]. 实用医学杂志,2002,18(11):1229.
[2] 杜冬,崔忠,孙建斌,等. 放线菌性肝脓肿误诊一例[J]. 临床误诊误治,2013,26(11):39-40.
[3] 温海. 放线菌的诊断与治疗新进展[R]. 杭州,2007:19-21.
[4] 刘丽燕,楼俪泓,姜海琼,等. 播散性放线菌病1例报道及文献复习[J]. 中国感染与化疗杂志,2012,12(6):419-423.
[5] 张曼林,汤兵祥. 肺放线菌病2例报道并文献复习[J]. 中华实用诊断与治疗杂志,2010,24(8):811-812.
[6] 杨惊,刘晓清,邓国华. 放线菌病的临床特点与治疗[J]. 中国全科医学,2009,12(7A):1206-1208.
[7] GIBERT DN, CHAMBERS DN,ELIOPOULOS GM, et al. The sanford guide to antimicrobial therapy[M]. 46th(ed).Antimicrobial Therapy Inc, Sperryville, 2016 :69.
[8] BENNETT JE, DOLIN R, BLASER MJ. Princioles and practice of infectious diseases[M]. 8th ed. Philadelphia: Churchill Livingstone, 2015 : 2864-2873.
[9] CHOI J,KOH WJ,KIM TS,et al. Optimal duration of Ⅳand oral antibiotics in the treatment of thoracic actinomycosis[J].Chest,2005,128(4):2211-2217.
[10] KOLDITZM,BICKHARDT J,MATTHIESSEN W,et al.Medical management of pulmonary actinomycosis:data from 49 consecutive cases[J]. J Antimicrob Chemother,2009,63(4):839-841.
[11] WONG VK,TURMEZEE TD,WESTON VC. Actionmycosis [J].BMJ,2011,343:6009.
[12] 何礼贤,肖永红,陆权,等. 国家抗微生物治疗指南[M]. 北京:人民卫生出版社,2013:98.
[13] LECOM DW,VERTUCCI FJ,ROJAS MF,et al.In vitroactivity of amoxicillin,clindamycin,doxycycline,metronidazole, and moxifloxacin against oralActinomyces[J]. J Endod,2007,33(5):557-560.
[14] 李世拥,于波,刘维伦,等. 放线菌感染致全身转移性多发脓肿一例[J] . 中华外科杂志,1998,36(4):252-252.
