大鼠新型隐球菌脑膜炎模型的建立
2018-05-30林文婷王一霖姚国泰陈江汉
林文婷, 高 睿, 滕 亮, 王一霖, 姚国泰, 陈江汉
隐球菌性脑膜炎是严重的深部真菌感染疾病,致死率高,治疗困难,复发率高,近年来发病率逐渐上升[1],其致病机制、免疫反应及治疗手段都是目前研究的热点。建立隐球菌脑膜炎动物模型是隐球菌基础研究的重要手段之一,目前隐球菌脑膜炎动物模型主要有小鼠、大鼠、豚鼠、蚕、斑马鱼及家兔等[2-3]。小鼠对隐球菌天然易感,是目前较为成熟的动物模型,可通过气管吸入、静脉注射或腹腔注射菌液等接种途径获得,但小鼠体型小,血、脑脊液含量少,无法进行一些精细操作。建立家兔隐球菌性脑膜炎模型需使用免疫抑制剂,大鼠是否需要使用免疫抑制剂说法不一。与小鼠相比,大鼠对隐球菌抵抗力更强,目前有气管接种、静脉注射、腹腔注射及脑池注射等途径,气管接种不能导致颅内感染,静脉注射和腹腔注射不能保证颅内感染的一致性,无法控制实验变量的统一[4]。目前尚无成熟的大鼠隐球菌脑膜炎模型及相关生存率的研究。在此,我们介绍一个避免使用免疫抑制剂,可行性强、感染率高的大鼠新型隐球菌性脑膜炎模型。
1 材料与方法
1.1 材料
Sprague-Dawley雄性大鼠购于第二军医大学实验动物中心,新型隐球菌标准株H99来源于上海长征医院皮肤真菌保藏实验室,酵母浸出粉胨葡萄糖培养基(YEPD)购于武汉谷歌生物,摇床、血球计数板、0.9% NaCl溶液、微量进样器(高鸽 /100 μL)、大鼠脑立体定位仪(美国Stoelting公司)、手术器械、75%乙醇、缝合线、1%戊巴比妥钠(美国Sigma公司)。
1.2 方法
1.2.1 菌悬液的配制 新型隐球菌标准株H99接种于YEPD液体培养基中(酵母粉10 g,蛋白胨20 g,葡萄糖20 g,水1 000 mL),置于摇床中以30 ℃、225 r/min的条件培养16~18 h,0.9% NaCl溶液洗涤2次(3 000 r/min离心5 min),用血球计数板将菌悬液浓度分别调至2×106cfu/mL、2×107cfu/mL、2×108cfu/mL。
1.2.2 脑池注射 24只体重250~300 g的雄性SD大鼠随机分成4组(A组、B组、C组、D组),1%戊巴比妥钠(40 mg/kg)麻醉,剃去大鼠两耳间颈背部的毛发,用耳杆将其头部固定在脑立体定位仪上,以两耳背侧下缘连线中点为中心,沿中线向切开约1.5 cm,分离皮下组织和肌肉,直至暴露出连接颅骨下缘和第一颈椎上缘的韧带,用微量进样器穿破此膜,进针约2 mm(约没过针头的斜面),保持微量进样器位置不动,缓慢抽出50 μL清亮脑脊液,再由相同位置注入50 μL配制好的菌悬液,待注入完毕后针头停留在原处约3~5 min再拔出,依次缝合肌肉及皮,全程无菌操作。
A组接种的菌负荷量为1×105cfu,B组为1×106cfu,C组为1×107cfu,D组为0.9% NaCl溶液对照组,观察接种后大鼠临床表现,在第14、21天取脑脊液做培养计数[5],记录28 d内大鼠死亡情 况。
1.3 统计学方法
采用Graphpad 7.0统计软件进行统计分析,实验数据以均数±标准差表示,采用Log-rank检验进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 临床表现
A组大鼠毛发生长正常,姿势体位正常,体重增加,反应灵敏;B组大鼠毛发正常,姿势正常,体重无明显减轻,反应力稍有下降;C组大鼠毛发干枯,失去光泽,体重进行性下降,呈明显弓背向上姿势,反应迟钝;D组大鼠正常生长,毛发正常,姿势无异常,体重正常生长,反应灵敏。
2.2 脑脊液培养
第14天和第21天脑脊液培养结果如图1所示。A组菌负荷减少,从(27 000±4 858)cfu/mL降至(13 667±2 944)cfu/mL;B组菌负荷增加,从(33 000±7 682)cfu/mL升至(45 000±12 712)cfu/mL;C组菌负荷增加,从(49 500±23 856)cfu/mL上升至(72 600±15 060)cfu/mL;D组无菌落生长。
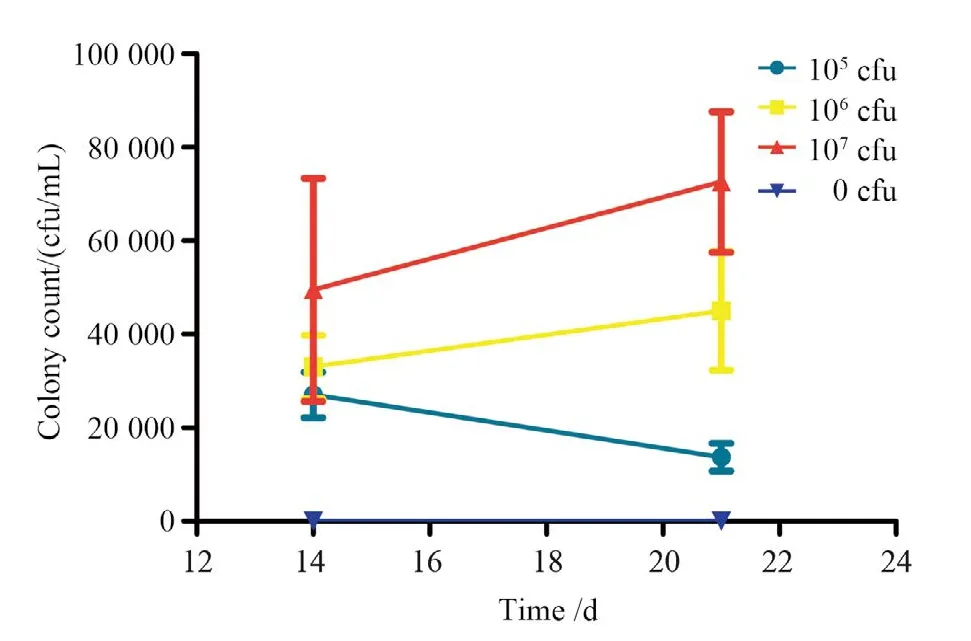
图1 第14天和第21天大鼠脑脊液培养结果Figure 1 The results on day 14 and day 21 culture for Cryptococcus neoformans with the cerebrospinal fluid of rats
2.3 生存曲线
大鼠生存率如图2所示,A组无大鼠死亡,生存率100%;B组在接种后第21天有1只大鼠死亡,28 d生存率83.33%;C组接种后第16天开始出现大鼠死亡,28 d生存率16.67%,中位生存时间23.5 d。统计学上,A组和B组生存曲线差异无统计学意义(P>0.05),A组与C组、B组与C组生存曲线差异有统计学意义(P<0.05)。D组为对照组,所有大鼠全部存活。

图2 大鼠28 d生存曲线Figure 2 The 28-day survival curve of rats after challenging with Cryptococcus neoformans by intracisternal injection
3 讨论
随着隐球菌的研究不断深入,其动物模型也在不断发展,根据不同的研究目的,选择不同的动物模型。隐球菌大鼠模型中,气管接种主要用于建立隐球菌肺炎模型[6];静脉注射和腹腔注射可以感染脑或肺,但感染的程度可能不同,无法控制实验变量的统一。鞘内注射可直接造成大鼠颅内感染,不需要使用免疫抑制剂,可以保证颅内感染的一致性。
大鼠枕大池脑脊液丰富,从颈背部沿中线切开,分离组织肌肉,直至暴露连接颅骨下缘和第一颈椎上缘的韧带,在可视的情况下保证进针的深度约1~2 mm,可避免触碰深处神经组织,此方法简单可行,平均10 min可接种一只大鼠。前期研究发现,新型隐球菌原代菌株毒性最强,转平皿后生长出来的菌落毒性减弱,因此要选取原代培养皿上的菌落,增菌培养后立即接种造模,保持菌体活性,以避免造模失败。
1×105cfu新型隐球菌鞘内注射后,大鼠无明显临床症状,未导致死亡,脑脊液菌负荷量下降,这可能与大鼠自身免疫作用有关。既往研究显示1×104cfu脑池注射后菌负荷进行性下降[7-8],由此可以推测当隐球菌菌负荷量不超过1×105cfu时,由于大鼠对新型隐球菌的免疫作用,脑脊液菌负荷逐渐下降。1×106cfu新型隐球菌鞘内注射后,大鼠出现反应略迟钝现象,无其他临床症状,菌负荷上升,28 d死亡率16.67%。该结果表明1×106cfu已经超出大鼠自身抵抗力,但病程进展相对较慢,短时间内不能导致大鼠死亡,延长观察时间可能会有更多大鼠死亡。1×107cfu新型隐球菌鞘内注射后大鼠临床症状明显,菌负荷明显上升,急性病程,感染率高,28 d死亡率达83.33%。统计学结果表明1×107cfu大鼠的生存曲线较1×105cfu和1×106cfu有显著差异,提示1×107cfu可作为大鼠新型隐球菌脑膜炎模型构建的鞘内注射菌量。
曾有报道在脑池接种新型隐球菌前使用环磷酰胺,使大鼠处于免疫抑制的状态[9],但是免疫抑制容易造成大鼠感染其他病原菌,导致造模失败。在非免疫抑制状态下,不同菌负荷造成大鼠感染程度不同,可根据实验目的选择不同的菌负荷,1×107cfu菌悬液鞘内注射可建立较为理想的大鼠新型隐球菌脑膜炎模型。该方法简单易行,感染率高,重复性好,为隐球菌的基础研究提供良好的方法。
[1] SLOAN DJ, PARRIS V. Cryptococcal meningitis: epidemiology and therapeutic options[J]. Clin Epidemiol, 2014, 6 :169-82.
[2] 周文江, 陶林琳. 新生隐球菌感染动物模型应用进展[J]. 实验动物与比较医学, 2010, 30(3):220-224.
[3] TENOR JL, OEHLERS SH, YANG JL, et al. Live imaging of host-parasite interactions in a zebrafish infection model reveals cryptococcal determinants of virulence and central nervous system invasion[J]. MBio, 2015, 6(5):e01425-15.
[4] 陈裕充. 隐球菌感染动物模型[J]. 中国真菌学杂志,2012,7(4):232-236.
[5] FRIES BC, LEE SC, KENNAN R, et al. Phenotypic switching ofCryptococcus neoformanscan produce variants that elicit increased intracranial pressure in a rat model of cryptococcal meningoencephalitis[J]. Infect Immu, 2005, 73(3):1779-1787.
[6] KROCKENBERGER MB, MALIK R, NGAMSKULRUNGROJ P, et al. Pathogenesis of pulmonaryCryptococcus gattiiinfection : a rat model[J]. Mycopathologia, 2010, 170(5):315-330.
[7] DZENDROWSKYJ TE, DOLENKO B, SORRELL TC, et al. Diagnosis of cerebral cryptococcoma using a computerized analysis of 1H NMR spectra in an animal model[J]. Diagn Microbiol Infect Dis, 2005, 52(2):101-105.
[8] KIRKPATRICK WR, NAJVAR LK, BOCANEGRA R, et al.New guinea pig model of cryptococcal meningitis[J]. Antimicrob Agents Chemother, 2007, 51(8):3011-3013.
[9] 冯峰, 施裕新, 夏淦林,等. 大鼠新型隐球菌脑感染的模型建立 [J]. 海南医学, 2010, 21(9):8-10.
