低氧环境对胶质瘤细胞增殖的影响
2018-05-30刘晨杨志军徐如祥戴宜武罗丹孙移坤王震
刘晨 杨志军 徐如祥 戴宜武 罗丹 孙移坤 王震
(1山西医科大学第二临床医学院,山西 太原 030000; 2北京陆军总医院神经外科,北京 100000; 3河北大学医学部临床医学院,河北 保定 071000)
肿瘤细胞所处的微环境由多种基本因素构成,对肿瘤的生存具有重要的作用。其中含氧量作用至关重要[1]。细胞微环境中含氧量变化会引起一系列细胞生物学、分子生物学变化,进而影响细胞的增殖、分化、调亡及损伤修复等。由于肿瘤细胞过度增殖和高代谢,肿瘤细胞微环境处于低氧状态[2]。
生物学功能的改变表现在以下方面:促进肿瘤新生血管生成、抑制肿瘤细胞凋亡、影响细胞周期、促进肿瘤的侵袭和远处转移、对放化疗产生抵抗等。多种细胞因子和信号转导通路参与调节。
高代谢产生的乳酸和碳酸造成微环境的低PH值。许多研究都证实,低氧诱导因子(hypoxia inducible factor, HIF)在各种实体肿瘤细胞中广泛表达。HIF在脑胶质瘤的病理标本和细胞培养中也存在的髙表达[3]。与之类似,Wnt通路相关蛋白的高表达也已在多种肿瘤中发现,与肿瘤增殖、侵袭等密切相关。在黑色素瘤中进一步证实低氧环境下Wnt通路被异常激活,并促使其下游靶点基因cyclin D1/C-myc激活, 刺激癌细胞增殖。可见,Wnt通路在细胞增殖过程中起到了重要的作用。
基于如上背景,本试验探究低氧环境对以U87细胞为代表的脑胶质瘤细胞增殖能力的影响,初步验证经典Wnt通路是否参与到细胞增殖调节中。
材料与方法
一、细胞培养
胶质瘤U87及U251系细胞以含有10%胎牛血清(fatal bovine serum, FBS)的Eagle (Dulbecco's modified Eagle medium)改良常规贴壁培养,添加血清替代物,含有10% B27神经细胞生长添加剂(B27 NeuroMix, B27)、20 ng/mL表皮细胞生长因子(cottony-stimulating factor, EGF)、20 ng/mL成纤维细胞生长因子(fibroblast growth factor, FGF)及10 ng/mL白血病抑制因子(leukemia inhibitory factor, LIF)的DMEM/F12(Dulbecco's modified Eagle medium: Nutrient Mixture F-12)培养悬浮细胞球。所有细胞均置于相应恒温培养箱中备用。
二、CCK-8实验
取对数生长期生长良好的细胞,调整细胞密度为2×104个/mL,即以2×103个/孔的接种于96孔板中,设置5个复孔,置于相应培养箱培养。分别于第 1天、第2天、第3天、第4天、第5天、第6天、第7天取出,弃上清液,每孔加入含10% CCK-8的新鲜培养液100 μL,置于相应培养箱避光培养2 h。2 h后取出,以酶标仪于检测各孔450 nm波长处的光密度(optical density, OD)值。以培养时间为横坐标,OD值为纵坐标,绘制细胞生长曲线。
三、成球实验
取对数生长期生长良好的细胞,传代方法制备单细胞悬液,计数后,以干细胞条件培养基调整细胞密度为5×103/mL。以5×103/mL密度细胞悬液接种200细胞/孔组(40 μL 5×103/mL细胞悬液与160 μL含血清培养基混合),将上述细胞悬液再稀释10倍,以制备5×102/mL细胞悬液,接种100细胞/孔组(200 μL 5×102/mL细胞悬液与0 μL含血清培养基混合)于96孔板的各排,接种50细胞/孔组(100 μL 5×102/mL细胞悬液与100 μL含血清培养基混合)。每3 d添加50 μL新鲜干细胞条件培养基,2 w后显微镜下计数直径大于75 μm的悬浮细胞球(表1)。
表1 有限稀释法 96孔板细胞梯度接种表
Tab 1 Cell inoculation table
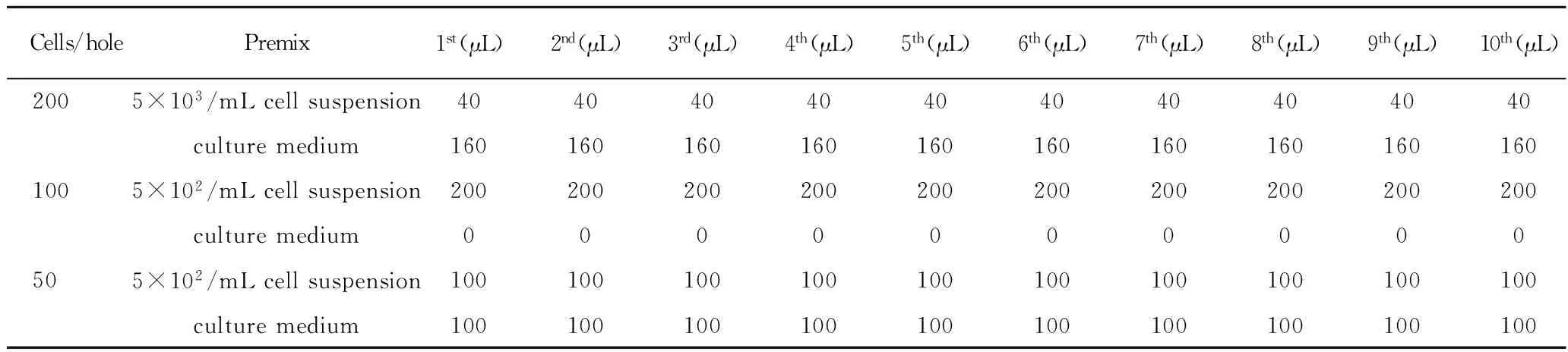
Cells/holePremix1st(μL)2nd(μL)3rd(μL)4th(μL)5th(μL)6th(μL)7th(μL)8th(μL)9th(μL)10th(μL) 2005×103/mLcellsuspension40404040404040404040 culturemedium160160160160160160160160160160 1005×102/mLcellsuspension200200200200200200200200200200 culturemedium0000000000 505×102/mLcellsuspension100100100100100100100100100100 culturemedium100100100100100100100100100100
四、单克隆实验
取对数生长期生长良好的细胞,干细胞条件培养基制备单细胞悬液,在稀释细胞至5×102,即每100 μL约含50个细胞。2 μL移液枪吸取细胞悬液打点种植于96孔板。然后在倒置显微镜下观察,如每孔1~2个细胞,则接种完96孔板。若细胞数过多或观察不到细胞,则调整浓度,重新种植直至每孔中1~2个细胞。在倒置显微镜下观察96孔板,排除无细胞孔和多细胞孔,标记单细胞孔,加培养液 200 μL。每3 d添加50 μL新鲜干细胞条件培养基,2 w后显微镜下计数直径大于75 μm的悬浮细胞球数目。
五、Western Blot
分别于常氧含量培养箱及低氧含量培养箱中培养U87细胞,48 h后终止。预冷PBS洗涤3次后,离心收集细胞,预冷细胞裂解液裂解细胞,冰上放置5 min,4 ℃离心收集上清液并测定蛋白浓度。每孔20 mg等量蛋白于10% SDS-聚丙烯酰胺凝胶(dodecyl sulfate sodium salt-polyacrylamide gel electrophoresis, SDS-PAGE)电泳,转膜至硝酸纤维素(nitrocellulose filter membrane, NC)膜,封闭杂交后于显影仪显影。图像处理软件Image J测算灰度值,绘制柱状图。
六、SYBR染料法定量定时反转录聚合酶连锁反应(quantificational real-time polymerase chain reaction, qRT-PCR)
分别于常氧含量培养箱及低氧含量培养箱中培养U87细胞,48 h后终止,预冷PBS洗涤3次后,离心收集细胞,提取总mRNA含量并测定纯度。用1 μg总RNA按试剂盒说明书操作生成cDNA,制备20 μL反应体系(2 μL引物,6 μL水,2 μL cDNA,10 μL primemix),置于7 500荧光定量PCR仪进行定量PCR检测,2-ΔΔCt法计算靶基因相对表达水平。
七、统计学分析
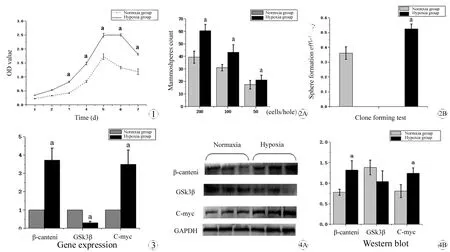
图1 低氧及常氧环境下细胞的增殖活性随培养时间的变化
Fig 1 The changes of proliferative activity of U87 cells when cultured under normoxia and hypoxia environment
Within a certain period of time (time≤5 d), the OD value of culture media of U87 cells that treated with CCK-8 rose steadily. When the incubation time overstepped a certain range (normoxia group>5 d, hypoxia group>5 d), the OD value declined sharply without a plateau in normoxia group, however, in hypoxia group it went into a platform (time: 5~6 d) firstly before decreased.
aP<0.05,vshypoxia group.
图2 低氧及常氧环境下细胞成球实验及单克隆实验检测细胞成球能力及单克隆形成效率检测
Fig 2 The assessment about capability of sphere-forming with sphere formation assay and sphere formation efficiency with colony formation assay of U87 cells that cultured in normoxia and hypoxia environment
A: The number of mammospheres in different cell density (200 cells/hole, 100 cells/hole, 50 cells/hole) in hypoxia group was more than that in normoxia group; B: The sphere formation efficiency of U87 cells in hypoxia group was higher than that in normoxia group.
aP<0.05,vshypoxia group.
图3 低氧环境对Wnt经典通路相关基因表达的影响
Fig 3 The effect of hypoxia environment on the expression of canonical Wnt/β-catenin pathway related genes The mRNA expression of β-cantenin and C-myc proto-oncogenes (C-myc) was up-regulated and the mRNA expression of GSK-3β was down-regulated.
aP<0.05,vshypoxia group.
图4 低氧环境对Wnt经典通路相关蛋白表达的影响
Fig 4 The effect of hypoxia environment on the expression of canonical Wnt/β-catenin pathway related proteins
A: With the pictures of bands, it could be observed directly that the protein expression of β-cantenin, C-myc increased and the protein expression of GSK-3β decreased; B: The gray value histogram provided more objective evidences to support the same results about that protein expression of β-cantenin and C-myc increased and the protein expression of GSK-3β decreased.
aP<0.05,vshypoxia group.
结 果
一、CCK-8细胞增殖活力实验
胶质瘤细胞于相应培养箱培养后,分别于第1天、第2天、第3天、第4天、第5天、第6天、第7天测定两组细胞450 nm波长处的OD值,并绘制增殖曲线。由增殖曲线可见:在一定时间范围内(培养时间小于5 d)细胞增殖,培养时间超出该范围后(培养时间大于5 d),常氧组细胞增殖活力迅速明显下降(无平台期),低氧组细胞增值活力经历平台期(第5~6天)后增殖活力下降。由增殖曲线可知,低氧组U87细胞的增殖活性明显高于常氧组,且常氧组较早出现细胞增殖活性下降(图1)。
二、细胞成球能力及单克隆形成能力检测
将胶质瘤细胞以不同梯度(200、100、50个/孔)接种于96孔板,相应培养箱培养2 w。显微镜下计数96孔板各细胞梯度(200、100、50个/孔)每孔中直径≥75 μm的细胞球数目。经统计低氧组各细胞梯度计数所得细胞球数目明显高于常氧组。将U87单细胞接种于96孔板后,每3 d添加50 μL新鲜干细胞条件培养基,2 w后显微镜下计数直径大于75 μm的悬浮细胞球,克隆形成率比=克隆形成数/接种细胞数,经计算统计低氧组细胞球形成效率明显高于常氧组。可知低氧组U87细胞成球能力和单克隆形成能力高于常氧组(图 2)。
三、PCR结果
PCR仪完成定量检测后,2-ΔΔCt法计算靶基因相对表达水平。以常氧组mRNA表达为1,可见Wnt通路关键基因β-cantenin、C-myc mRNA表达明显上调,介导β-cantenin磷酸化的GSk3βmRNA表达下调(图3)。
四、Western Blot结果
以图像处理image J测算得各蛋白条带灰度值,与内参蛋白进行校准。结果示Wnt通路关键蛋白β-cateninmi,C-myc表达明显增加,介导β-cantenin磷酸化的GSk3β蛋白表达表达量降低(图4)。
讨 论
在实体瘤中,低氧是一种很普遍的现象。肿瘤低氧微环境根据造成原因的不同,大体可以分为两类,分别为慢性低氧,又称为渗透限制型低氧和急性低氧,也称为灌注限制型低氧。在实体肿瘤中,接近供氧血管的肿瘤细胞氧和营养物质相对充足,细胞能迅速、正常生长;而远离血管的肿瘤组织由于迅速增殖与氧气、营养物质匮乏的矛盾,造成肿瘤细胞凋亡,瘤体内形成坏死区。在肿瘤的营养供应充足区与坏死去之间有一厚度为10~20 μm的细胞层,这一细胞层距距血管较远,氧弥散速率下降,供氧相对不足,成为慢性低氧区[4]。
在肿瘤微环境的研究中,缺氧一般指慢性缺氧。这一过程中肿瘤细胞的多种生物学特性发生变化,有多个信号转导通路参与,其中包括Wnt通路。Wnt蛋白家族在干细胞分化和组织胚胎学过程中发挥重要作用,同时参与人及哺乳动物的生理稳态调节[5]。Wnt信号通路大体分为两类:一是经典的Wnt信号通路,即Wnt蛋白与细胞表面的FZD(Frizzled, FZD)受体结合,抑制β-catenin降解,胞浆内β-catenin累积,后转移入细胞核后与核内的转录因作用,最终促进靶基因的表达[6]。另一种是非经典Wnt信号通路,其又称为非依赖β-catenin信号通路,主要以Wnt/Ca2+信号转导通路为代表[7]。
经典Wnt信号通路在生物进化史都极为稳定,其中β-catenin由胞质向胞核的转位被认为是Wnt/β-catenin经典通路激活的标志。既往实验证实,没有被磷酸化降解的β-catenin转移至细胞核内,并与TCF/LEF相结合启动下游基因。 β-catenin和Wnt-5A增高在子宫内膜型卵巢癌中已被证实[8]。此外,β-catenin的异常积累与卵巢癌分级增加和生存率的下降呈正相关。 正常条件下内源性的β-catenin大部分与胞膜上的E-cadherin等结合于粘连连接部位,介导细胞间的粘附。部分β-catenin与糖原合成酶激酶3β(GSK-3β)形成复合体,介导β-catenin磷酸化。Wnt通路激活时,GSK-3β的表达受到抑制。Wnt信号通路激活时,Wnt/卷曲蛋白FZD受体与调节因子相结合,导致其下游松散蛋白磷酸化,募集Axin蛋白,造成β-catenin在细胞内的降解减少,β-catenin蛋白逐渐积聚。积聚的β-catenin由胞质内转移至细胞核内,与细胞核内的转录因子淋巴样增强因子(the lymphoid enhancing factor, LEF)/T细胞因子(T-cell factor, TCF)家族结合,激活下游靶基因,如C-myc, cyclinD 1, matrix metalloproteinase-7等,进一步调控肿瘤细胞的增殖与侵袭的发展。其中C-myc和cyclinD1的启动子均有TCF的结合位点,并通过与TCF/β-catenin的复合体的结合,实现转录激活,调节细胞的周期与增殖。抑制TGF表达可以下调C-myc和cyclinD 1的表达。
在非经典的Wnt通路中则不通过β-catenin-TCF/LEF 结合体调节下游调节分子,一般认为非经典通路同时具有转录与非转录途径。非经典Wnt通路又称Wnt/Ca2+通路以FZD Wnt配体结合,通过G蛋白偶联受体(G-protein-couple receptor)的信号转导激活磷脂酶C,导致Ca2+内流,钙调蛋白依赖的蛋白激酶II(CaMKII)上调,进而调节下游靶蛋白。
本实验过程中,以CCK-8实验证明低氧环境下胶质瘤细胞增殖活力增强,细胞成球实验及单克隆实验证明胶质瘤细胞自我更新能力及单克隆能力较常氧组细胞增强,通过PCR实验及Western实验证实Wnt/β-catenin经典通路标志蛋白β-catenin表达上调,而介导β-catenin磷酸化并进一步降解的Wnt通路成员GSK-3β的表达受到抑制。作为是经典Wnt通路下游靶蛋白C-myc明显上调。C-myc是调节细胞周期从G1期到S期转变,促进肿瘤细胞的增殖的重要癌基因。通过本次实验初步推断低氧微环境可能通过激活Wnt经典通路促进胶质瘤细胞增殖。
但该实验仍存在明显不足,需进一步实验中补充完善。首先本实验只对Wnt通路促进胶质瘤细胞增殖的可能性进行了初步探讨,尚不能完全明确,其次需进一步研究上游调节因子及下游靶蛋白改变。目前研究已证实miRNA是短小的,高度保守的非编码RNA分子,参与多种生理调节,如增殖,分化,凋亡,发育和代谢等。在各种研究中小分子RNA既可能是肿瘤生成促进因子,也可能是肿瘤抑制分子[9]。本课题组拟于后续科研实验中,通过小分子RNA干扰Wnt通路抑制因子GSK3β,而后通过CCK-8实验,肿瘤成球实验等验证胶质瘤细胞增殖及自我更新能力的提高,并通过Western实验验证经小分子RNA-744处理后胶质瘤细胞中Wnt通路标志性蛋白β-catenin表达增加,以进一步验证Wnt通路参与胶质瘤增殖。其次,在进一步实验中,拟使用免疫荧光细胞化学技术处理胶质瘤细胞,采用荧光素标记β-catenin抗体作为探针,分别检测低氧组及常氧组细胞细胞标本,共聚焦显微镜管观察β-catenin于细胞中定位,进一步证实经低氧处理的胶质瘤细胞中上调的β-catenin向细胞核内转移,并利用荧光定量技术计算细胞各部分β-catenin的含量,为低氧组及常氧组胶质瘤细胞β-catenin定位、定量提供更明确依据,证实低氧微环境通过增加β-catenin表达增加并促进其细胞核内转移,从而调控下游蛋白,即低氧微环境通过经典Wnt通路参与脑胶质瘤细胞增殖调节。
总的来讲,本次实验可以初步推断低氧微环境可能通过激活Wnt通路促进胶质瘤细胞增殖。Wnt经典通路及非经典通路对胶质瘤细胞增殖的影响仍需要进一步实验的论证。通过对低氧环境对胶质瘤细胞增殖作用的影响研究,可以寻找微环境相关的以及微环境调节因子特异性的新的治疗手段,为胶质瘤的治疗创造可能。
参考文献
1ELKHATTOUTI A, HASSAN M, GOMEZ C R, et al. Stromal fibroblast in age-related cancer: role in tumorigenesis and potential as novel therapeutic target [J]. Front Oncol, 2015, 5: 158.
2DEYNOUX M, SUNTER N, HERAULT O, et al. Hypoxia and hypoxia-inducible factors in leukemias [J]. Front Oncol, 2016, 6: 41.
3PARK S K, DADAK A M, HAASE V H, et al. Hypoxia-induced gene expression occurs solely through the action of hypoxia-inducible fator 1alpha(HIF-1alpha): role of cytophasmic trapping of HIF-2alpha [J]. Mol Cell Biol, 2003, 23(14): 4959-4971.
4THOMLINSON R H, GRAY L H. The histological structure of some human lung cancers and the possible implications for radiotherapy [J]. Br J Cancer, 1955, 9(4): 539-549.
5QIN L, YIN Y T, ZHENG F J, et al. WNT5A promotes stemness characteristics in nasopharyngeal carcinoma cells leading to metastasis and tumorigenesis [J]. Oncotarget, 2015, 6(12): 10239-10252.
6KIM W, KIM M, JHO E H. Wnt/beta-catenin signalling: from plasma membrane to nucleus [J]. Biochem J, 2013, 450(1): 9-21.
7MARTINEZ S, SCERBO P, GIORDANO M, et al. The PTK7 and ROR2 receptors interact in the vertebrate WNT/PCP pathway [J]. J Biol Chem, 2015, 290(51): 30562-30572.
8BARGHOUT S H, ZEPEDA N, XU Z, et al. Elevated β-catenin activity contributes to carboplatin resistance in A2780cp ovarian cancer cells [J]. Biochem Biophys Res Commun, 2015, 468(1-2): 173-178.
9WINTER J, JUNG S, KELLER S, et al. Many roads to maturity: microRNA biogenesis pathways and their regulation [J]. Nat Cell Biol, 2009, 11(3): 228-234.
