右美托咪定对肺切除患者围术期免疫功能和应激反应的影响
2018-05-29谢娟华黄宏艳刘枧辉张亚军
谢娟华,黄宏艳,刘枧辉,张亚军,林 丽
(南方医科大学附属深圳龙华新区人民医院:1.麻醉科;2.妇科,广东深圳 518109)
自发性气胸行微创手术因创伤小已被临床接受,麻醉常在单肺通气(OLV)下进行,OLV技术不仅为术者创造良好的操作条件,还可减少术侧分泌物流向健侧,有效减轻肺部并发症,但OLV易导致肺内分流、通气/血流比例失调而诱发细胞炎性因子释放,降低动脉氧合、肺血管收缩及术侧肺复张对肺组织造成的损伤[1]。盐酸右美托咪定(DEX)是一种新型的高选择性α2肾上腺素能受体激动剂,具有镇静、镇痛、抗炎、抗氧化应激等作用[2]。现探讨右美托咪定对胸腔镜下部分肺切除术患者围术期炎性反应及氧化应激反应的影响,为临床应用提供一定的参考依据。
1 资料与方法
1.1一般资料 本研究经该院伦理委员会批准,与患者或其家属签署知情同意书。选取该院2014年1月至2015年12月自发性气胸行胸腔镜下部分肺切除术患者160例,男123例,女37例;年龄24~50岁。纳入标准:美国麻醉师协会(ASA)评分Ⅱ级,术前无循环系统疾病,无肝肾功能及凝血功能异常,近期无感冒上呼吸道感染,无长期服用镇静催眠或抗精神病药物史者。随机将患者分为2组,观察组(应用右美托咪定)和对照组各80例。
1.2方法 2组患者术前均禁食6~8 h,禁饮4~6 h,术前30 min肌注苯巴比妥钠2 mg/kg,阿托品0.01 mg/kg。进入手术室后常规监测心电图(ECG)、心率(HR)、血压(BP)、血氧饱和度(SPO2)、呼吸(R)、呼吸末二氧化碳分压(PETCO2),开放外周静脉通路,左侧桡动脉穿刺行持续有创动脉血压监测后取平均动脉压(MAP)。采用Aspect-2000 型脑电活动监测仪测定患者脑电双频指数(BIS)值。诱导麻醉用药:咪达唑仑2 mg,芬太尼2~4 μg/kg,异丙酚2 mg/kg,顺阿曲库铵0.15 mg/kg,待患者反射消失、下颌松弛后行双腔支气管插管,纤维支气管镜确定气管导管位置对位良好。连接麻醉呼吸机进行机械通气,呼吸比1∶2,潮气量6~8 mL/kg,通气频率12~16次/分,调节呼吸频率使PETCO2维持30~40 mm Hg,氧流量1 L/min,吸入氧浓度100%。观察组患者在上述麻醉基础上,加用右美托咪定(江苏恒瑞医药股份有限公司):麻醉诱导10 min后开始静脉输注右美托咪定1 μg/kg,输注时间10 min,容量20 mL。随后以0.5 μg/(kg·h)持续静脉输注至关胸。对照组输注等量的生理盐水。麻醉维持:2组均吸入1.0%~2.0%七氟醚,持续泵注芬太尼0.5~1.0 μg/(kg·h),丙泊酚3~4 mg/(kg·h),顺阿曲库铵0.07~0.01 mg/(kg·h),维持BIS 45~60,MAP、HR波动幅度不超过基础值20%。2组患者术中均行OLV至关胸,关胸清理后均恢复双肺通气,术毕适度膨肺,送恢复室等待患者清醒且通气指标满意后拔出双腔气管导管。
1.3观察指标 记录2组患者麻醉诱导前(T0)、OLV 60 min(T1)、手术结束时(T2)3个时间点的平均动脉压(MAP)、HR、BIS。取外周静脉血10 mL,其中5 mL加入装有促凝剂试管中分离血清,采用比色法检测超氧化物歧化酶(SOD)的水平,硫代巴比妥酸法检测血清丙二醛(MDA),另5 mL血标本使用酶联免疫法检测肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)。血清SOD、TNF-α、IL-6、IL-10、MDA应用ELISA试剂盒(美国CST公司)。
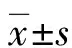
2 结 果
2.12组患者一般资料结果比较 2组患者的年龄、性别、体质量等一般资料比较,差异无统计学意义(P>0.05),具有可比性;2组手术时间等方面比较,差异有统计学意义(P<0.05)。见表1。
2.22组患者术中MAP、HR、BIS结果比较 2组患者T0时MAP比较,差异无统计学意义(P>0.05);HR和BIS比较,差异均有统计学意义(P<0.05)。2组T1、T2时MAP、HR、BIS比较,差异均有统计学意义(P<0.05)。见表2。
2.32组患者术中SOD、MDA、TNF-α、IL-6、IL-10水平结果比较 2组患者血清SOD活性随时间延长而活性降低,对照组降低得更快;而MDA、TNF-α、IL-6、IL-10随时间延长均有升高,T2时间段水平最高,但对照组升高更多。2组T0时SOD、TNF-α、IL-10比较,差异有统计学意义(P<0.05);MDA和IL-6比较,差异无统计学意义(P>0.05)。2组T1时SOD、TNF-α、IL-6、IL-10比较,差异有统计学意义(P<0.05);MDA比较差异无统计学意义(P>0.05)。2组T2时SOD、MDA、TNF-α、IL-6、IL-10比较,差异有统计学意义(P<0.05)。见表3。

表1 2组患者一般资料结果比较
注:与对照组比较,*P<0.05

表2 2组患者术中MAP、HR、BIS结果比较
注:与对照组比较,#▲*P<0.05

表3 2组患者不同时间点各指标结果比较

组别T1IL⁃10(pg/L)TNF⁃a(pg/mL)IL⁃6(pg/mL)SOD(μ/mL)MDA(μmol/mL)观察组36.93±4.32#22.03±4.04#21.94±2.81#428.96±14.55#5.41±0.55对照组56.98±3.2820.38±2.4420.41±1.76421.51±25.885.29±0.67

组别T2IL⁃10(pg/L)TNF⁃a(pg/mL)IL⁃6(pg/mL)SOD(μ/mL)MDA(μmol/mL)观察组44.63±4.04∗22.34±2.80∗22.89±3.05∗413.50±20.21∗6.09±0.17∗对照组66.30±3.2837.74±3.9433.65±3.23340.21±28.297.08±0.39
注:与对照组比较,*#▲P<0.05
3 讨 论
右美托咪定不仅是麻醉辅助用药,近年来还发现其对器官具有保护作用[3]。肺切除术是对肺脏造成巨大损伤的手术,术中造成炎性反应,引起肺部水肿、渗出等,致使肺部趋化因子、白细胞介素等水平的升高,从而影响患者的恢复及预后[4]。OLV过程中会导致肺内分流增加、低氧血症,通气结束恢复肺正常通气,造成氧自由基和炎性因子释放,诱发全身炎性反应和氧化应激反应,引起血管痉挛、毛细血管通透性增强,进而致使肺部损伤。围术期肺部损伤是肺部手术后的严重并发症,极大地影响患者恢复[5-6]。右美托咪定是α2肾上腺素能受体激动剂,具有良好的镇静止痛、抑制炎性反应的作用,手术期间可改善心血管系统的稳定性。
本研究结果表明,应用右美托咪定的观察组OLV 60 min和手术结束时患者的MAP、HR、BIS与手术前比较,差异无统计学意义(P>0.05),但对照组变化明显(P<0.05),可能是因为右美托咪定对患者的呼吸和血压均有抑制作用,可有效改善心血管的稳定性。与张干等[7]和胡宪文等[8]的研究结果相似,说明右美托咪定对呼吸系统的抑制作用较轻,使患者术中生命体征比较平稳。
氧化应激在肺部损伤的发生、发展起重要作用,氧化蛋白质释放蛋白酶使抗氧化剂和抗蛋白酶失活,损伤DNA导致断裂及点突变、脂质过氧化及前炎性基因表达增强,致使肺微血管壁和肺泡屏障破坏,损伤Ⅱ型肺泡上皮细胞,引起肺表面活性物质减少而功能下降,发生肺部损伤。SOD是重要的抗氧化酶,主要参与清除超氧阴离子、减少还原型亚硝酸盐的形成及所致的损伤,起保护肺的作用,可与氧自由基发生反应,减少细胞损伤,血清SOD的表达水平与肺损伤的程度呈明显的负相关,而氧化应激产物可降低该酶活性。MDA是自由基与细胞膜性结构发生脂质过氧化反应生成的产物,反映体内氧自由基量及活性,其水平可直接反映机体内脂质过氧化反应的强弱,间接反映细胞损伤程度。本研究结果显示,2组患者血清SOD活性随手术时间延长而活性均降低,观察组降低比对照组较慢;而MDA随手术时间延长而升高,对照组升高更显著,提示右美托咪定可增加体内抗氧化因子的产生,增强机体抗氧化能力。
OLV过程中,肺内中性粒细胞、肺泡巨噬细胞、合成释放促炎因子等均增加。中性粒细胞通过与内皮细胞、上皮细胞的作用,介导组织损伤[9]。IL-6作为前炎性因子,既可启动早期炎性反应,又可加重炎性反应,也可上调TNF-α表达[10]。本研究结果发现,2组患者TNF-α、IL-6、IL-10随时间延长均上升,但观察组低于对照组(P<0.05),尤以手术结束时显著,说明右美托咪定引起患者肺部炎性较轻,对肺具有较好的保护作用,与张伟等[11]研究相一致。右美托咪定对肺泡间隔的增厚反应起降低作用,对肺巨噬细胞活力起促进和维持作用,进而对肺部组织和功能起到保护作用[12]。
综上所述,右美托咪定在肺切除患者围术期对肺有较好的保护作用,减轻肺部炎性因子的产生,抑制氧化应激,调节免疫平衡,降低患者肺部损伤和肺部炎性发生的概率,术后恢复良好,改善预后,提高生活质量。
参考文献
[1]FULLER B M,MOHR N M,DETTMER M,et al.Mechanial Ventilation and acute lung injury in emergency department patients with severe sepsis and septic shock:an observation study[J].Acad Emerg Med,2013,20(7):659-669.
[2]陈亮,孟宪慧.右美托咪定对老年患者肺通气术后认知功能改变的影响[J].中国医药,2015,10(12):1760-1764.
[3]周家龙,梁启胜.右美托咪定肺保护的研究进展[J].中华全科医学,2016,14(8):1386-1388.
[4]吴先荣.右美托咪定肺保护作用的研究进展[J].中国实用医药,2014,9(6):246-248.
[5]YU S,SHI M,LIU C,et al.Time course changes of oxidative stress and inflammation in hyperoxia-induced acute lung injury in rats[J].Iran J Basic Med Sci,2015,18(1):93-103.
[6]MCDONALD C I,FUNG Y L,SHEKAR K,et al.The impact of acute lung injury ECMO and transfusion on oxidative stress and plasma selenium levels in an ovine model[J].J Trace Elem Med Biol,2015,30(12):4-10.
[7]张干,车邦民,梁大干,等.右美托咪定对双腔支气管插管单孔胸腔镜肺大泡切除术患者围术期应激反应的影响[J].牡丹江医学院学报,2015,36(4):25-27.
[8]胡宪文,张野,孔令锁,等.不同剂量右美托咪定抑制气管插管诱发患者心血管效应的比较[J].中华麻醉学杂志,2010,30(11):1304-1306.
[9]刘光杰,白庆林,李海燕,等.右美托咪定联合丙泊酚对单肺通气患者的肺保护作用[J].中国临床医生,2016,45(2):81-83.
[10]胡婧,都鹏飞,贝丹丹.外周血IL-6 对新生儿脓毒症诊断价值的Meta 分析[J].中国当代儿科杂志,2015,17(11):1176-1182.
[11]张伟,张加强,孟凡民.右美托咪定对单肺通气过程中炎性反应及氧化应激反应的影响[J].临床麻醉学杂志,2013,29(3):229-231.
[12]邓若熹,张晟,张锦枝,等.右美托咪定在全麻手术中对炎症及肺损伤保护作用的探讨[J].中华医院感染学杂志,2013,23(10):2343-2345.
