杂色鲍幼虫变态及TR干扰下内参基因的筛选
2018-05-29张丽莉徐建波王国栋王艺磊
张丽莉,徐建波,王国栋,王艺磊
(1.集美大学水产学院,福建 厦门 361021;2.农业部东海海水健康养殖重点实验室,福建 厦门 361021)
0 引言
实时定量PCR(real time quantitative PCR)是在PCR体系中加入荧光基团,通过观测荧光信号的强弱变化来实时监测PCR整个进程,可以获得PCR每一轮循环的扩增效果。因它能够充分利用PCR高灵敏性准确检测目标基因表达水平,被广泛用于基因表达研究中。用实时定量PCR进行基因的表达水平检测时,样品RNA的得率、质量及逆转录效率等对实时定量PCR结果影响巨大。为了获得目标基因真实的表达情况,必须选择内参基因进行校正和标准化[1]。因此,选择的内参基因是否合适是影响实时定量PCR分析基因表达水平的重要因素之一。理想的内参基因应当不受试验因素的影响,能在整个试验过程中恒定表达,即在不同处理、不同细胞、不同发育阶段均能恒定表达。一般认为管家基因能够在细胞中稳定表达,所以一些管家基因如肌动蛋白(ACT)、18S核糖体RNA(18SrRNA)、28S核糖体RNA(28SrRNA)和3-磷酸甘油醛脱氢酶(GAPDH)等常作为内参基因。然而近年来的研究表明,这些常用内参基因常常受到细胞类型、发育阶段和各种试验条件的影响,其表达量通常也会有所不同[2]。Chen等[3]筛选获得鲍早期发育阶段(受精卵到匍匐幼虫阶段)的4个表达稳定基因(YB1、OAZ1、EIF5A和RPL3)都不是常见的内参基因。因此,传统的内参基因很可能不适合作为变态过程的内参基因。
同大部分海洋无脊椎动物一样,鲍的生活史具有浮游和底栖两个阶段。其幼虫通过变态过程进行机体结构和生态习性两方面的改变,成为与成体类似的稚体。因为鲍幼虫营卵黄营养,在浮游生活阶段不摄食,变态过程中营养因素容易控制,成为研究浮游幼虫变态的模式之一[4]。此外,变态是鲍个体发育的重要过程,且死亡率高,所以变态过程是鲍苗种生产的一个关键环节,因而成为水产科技人员重点研究的内容之一。目前,鲍变态机制的研究已深入到分子层次,筛选与变态相关基因及关键基因在变态过程的功能注释成为研究的重点。变态相关基因的筛选主要通过比较变态前后其表达量来获得,而基因的功能验证则常采用RNAi。在这些研究中,实时定量PCR是重要的研究手段。而内参基因表达的稳定程度是影响定量PCR准确性的主要因素之一。
目前在鲍发育和变态过程中内参基因主要选择仍是β-actin、18SrRNA或28SrRNA等,也未见对内参基因的稳定性评估。本文拟对杂色鲍(Haliotisdiversicolor)变态前后及幼虫RNAi试验进行内参基因的稳定性评估。因鲍早期发育阶段和变态阶段具有类似的细胞学过程,所以本文依据Chen等[3]的筛选结果,选取了EIF5A、OAZ1、YB1和RPL3作为候选基因。此外,ACT和RPS9在鲍不同组织中具有较高的表达稳定性,表明其细胞类型和细胞分化对这两个基因影响不大,因此也选作候选基因。本文还对6个内参基因的稳定性进行了筛选,希望能为鲍幼虫变态研究提供技术支撑。
1 材料与方法
1.1 幼虫培育及变态前后样品收集
选取性腺发育饱满、机体无损伤的杂色鲍雌雄各30只(壳长4.5~5.0 cm)作为亲鲍。待阴干0.5~1 h后,分雌雄分别放入受紫外线照射(200~300 mW·h/L)的海水中,并进行±3 ℃的变温刺激。等卵子充分排放后,收集卵子并将其密度控制在20~100个/mL。同时收集精子,保证每个卵子周围有3~5个精子,并搅动水体,使之结合。受精后每隔30 min洗卵一次,并在显微镜下及时观察发育状况。胚胎发育和幼虫培育过程中水温23.7~28.5 ℃,盐度32.8~34.5。每天显微镜观察、拍照,收集变态前的感受态面盘幼虫(veliger ,VE)、变态时期的匍匐幼虫(creeping period ,CR)以及变态后的稚鲍(juvenile,JU)样品,液氮速冻后存于-80 ℃待用。
1.2 幼虫RNAi试验
当80%幼虫出现眼点时将之视作CR。用200目筛绢收集此时期幼虫,并用0.2 μm过滤海水冲洗幼虫3次,再用过滤海水将幼虫密度调整为100个/mL,然后取10 mL含幼虫过滤海水于15 mL试管中。将试管分为3组,每组5个。一组加入甲状腺激素受体(TR)dsRNA,将其终质量浓度调整为5 μg/mL,作为试验组;一组加入GFP dsRNA,同样将其终质量浓度调整为5 μg/mL,作为阴性对照组;还有一组不添加任何物质,作为空白对照组。处理2 h后,将幼虫转移至1 L底部铺有底栖硅藻的烧杯中。在烧杯中继续培养10 h,此时对照组大部分幼虫已完成变态,及时收集幼虫,液氮速冻后,存于-80 ℃待用。
1.3 杂色鲍幼虫变态过程总RNA的提取及cDNA第一链合成
取冻存于-80 ℃冰箱中的杂色鲍幼虫样品50 mg,快速置于已加有1 mL Trizol试剂并于冰上保存的2.0 mL离心管中,冰上匀浆至无颗粒状残留物,并按照Trizol试剂说明书提取总RNA。RNA沉淀用RNase free灭菌水溶解,对于已溶解的RNA溶液,分别采用紫外分光光度法和琼脂糖凝胶电泳法来检测RNA的浓度、纯度以及完整性。并用Dnase I处理后用于后续的cDNA第一条链的合成。
取2 μg经Dnase I处理的总RNA,由随机引物(2 μL,10 mmol/L)经M-MLV逆转录酶合成cDNA第一链,-20 ℃保存备用。
1.4 dsRNA制备
杂色鲍 TR的片段(521~1056 bp,KT023066)分别由引物dsTR-FT7和dsTR-R(或dsTR-F和dsTR-RT7)以cDNA第一条链作为模板,扩增后作为体转转录模板。同样绿色荧光蛋白657 bp的片段也分别由dsGFP-FT7和dsGFP-R(或dsGFP-F和dsGFP-RT7)以cDNA第一条链作为模板,扩增后作为转录模板。将上述模板割胶回收,测序确认后,用T7 RNA聚合酶(Promega)进行转录形成单链RNA(ssRNA)。用来自同一基因片段正负链ssRNA等量混合在含NaCl 400 mmol/L、Tris-Cl10 mmol/L的缓冲液(pH=7.4)中,经75 ℃、65 ℃和25 ℃各孵育15 min,形成dsRNA。
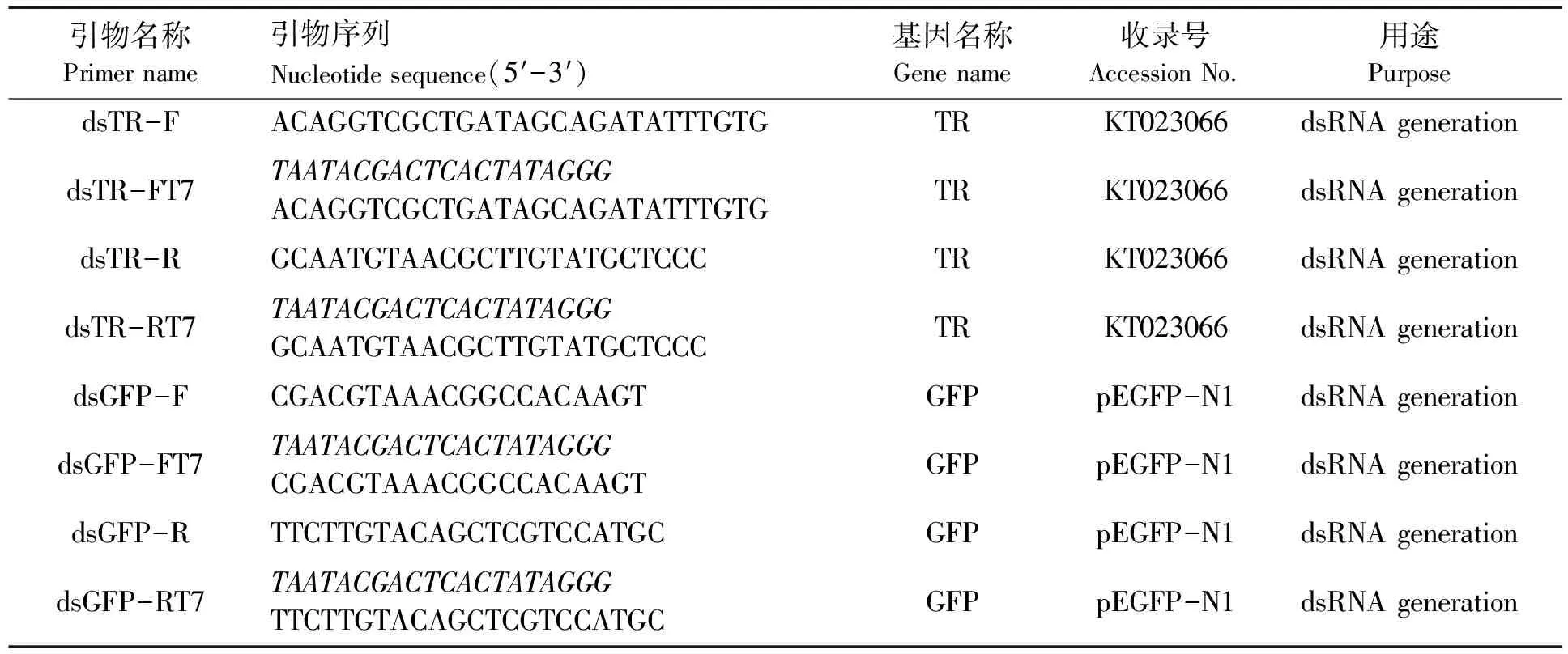
表1 dsRNA合成所用引物
1.5 实时荧光定量PCR反应体系及条件
采用20 μL反应体系:SYBR Green PCR Master Mix 10 μL,正反向引物各1 μL(10 μmol/L),cDNA模板(100倍稀释液)9 μL。采用LightCycler©480实时定量PCR仪,首先95 ℃变性5 min;然后以95 ℃变性 10 s,58 ℃退火 10 s,72 ℃延伸 10 s,为1个循环,进行45次。待扩增曲线完成后,进行溶解曲线分析,以确保每对定量引物扩增得到单一的产物。每个时期做5个平行样品,每个样品做3次重复。采用溶解曲线分析其是否为单峰,且检查阴性对照(不加模板)是否采集到荧光信号。用1.2%(质量分数)琼脂糖凝胶电泳检测其扩增长度是否符合预期。同时,注意是否存在引物二聚体和非特异性扩增条带等。
1.6 引物扩增效率和标准曲线的检验
引物扩增效率(E)的计算方程式为:E=10-(1/斜率)。绘制标准曲线时,将cDNA第一链模板逐次进行5倍稀释,获得5个模版浓度梯度,每个反应做3个重复,检验EIF5A、OAZ1、YB1、RPL3、RPS9、ACT6个候选内参基因定量PCR反应的扩增效率和标准曲线相关系数。
1.7 内参基因表达稳定性分析
定量PCR完成后,导出各样品的Ct值,采用GeNorm、normFinder和RefFinder等程序软件分析在杂色鲍幼虫变态三个时期和RNAi实验条件下6个候选内参基因的表达稳定性。GeNorm、normfinder中M值(average expression stability values)的计算公式为:M=2-ΔCt。
依据M值对各候选内参基因的表达稳定性进行评价和排序,M值越小越稳定,反之越不稳定。RefFinder整合GeNorm和Normfinder的分析方法,再由各自分析方法得到的内参基因表达的稳定性排名来计算几何平均值,最后得到一个综合排名指数,该指数越小表示对应的内参基因的表达越稳定。
2 结果
2.1 候选内参基因PCR扩增
通过对梯度稀释的模板进行qRT-PCR检验,获得候选内参基因的扩增效率E在95.32%~103.21%之间,相关系数R2变化范围为0.9893~0.9997(见表2),且溶解曲线分析结果为单峰。
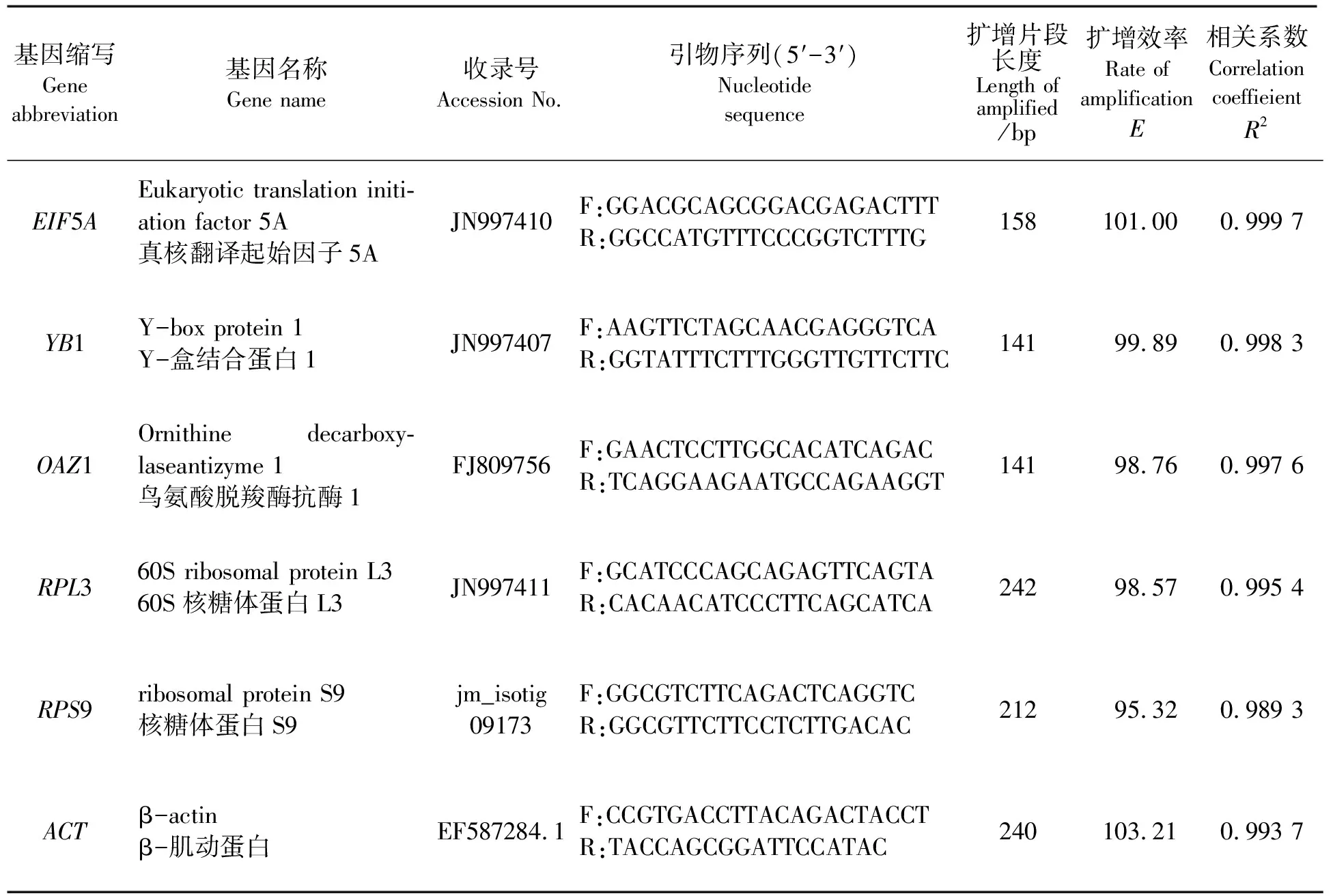
表2 所用候选内参基因、引物序列及PCR扩增效率
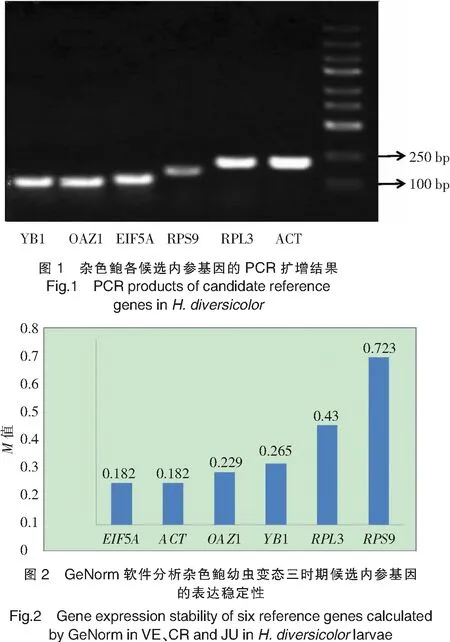
用琼脂糖凝胶电泳检测定量PCR扩增产物,结果(见图1)表明:6个候选内参基因的扩增长度与预期一致,没有出现引物二聚体和非特异性扩增。
2.2 幼虫附着变态过程内参基因筛选
借助GeNorm软件[5]根据ΔCt计算可获得M值。M值越小基因表达越稳定,反之越不稳定。图2显示,在杂色鲍幼虫变态发育的三个时期(VE、CR、JU),候选内参基因EIF5A和ACT的M值最小(M=0.182),具有较高的稳定性;而RPS9的M值(0.732)最大,稳定性较差。
normFinder软件[6]也是由ΔCt计算出M值。经该软件计算,在杂色鲍幼虫变态三个时期中,M值最小的是EIF5A(0.091),OAZ1次之(0.097),ACT、YB1和RPL3的M值在0.281至0.633之间,最大的是RPS9(1.268)。
RefFinder软件[7]获得的指数越小,则该内参基因的表达越稳定。在杂色鲍幼虫变态三个时期中,候选内参基因M值最小的是EIF5A(1.316),OAZ1、ACT和YB1的M值在2.213至2.828之间,RPL3和RPS9的M值较大(分别为5和6)。
根据3种软件给出的排名计算几何平均数,将这6个基因进行综合排名,结果见表3。3种软件对EIF5A、YB1、RPL3和RPS9的排名完全一致。只有GeNorm对OAZ1和ACT的排名与其他软件不一致。经计算排名几何平均数,得出这6个基因在变态过程中的稳定性由高到低为EIF5A>ACT>OAZ1>YB1>RPL3>RPS9。

表3 杂色鲍幼虫变态期的6个参考基因的表达稳定性分析
2.3 杂色鲍幼虫RNAi过程内参基因筛选结果
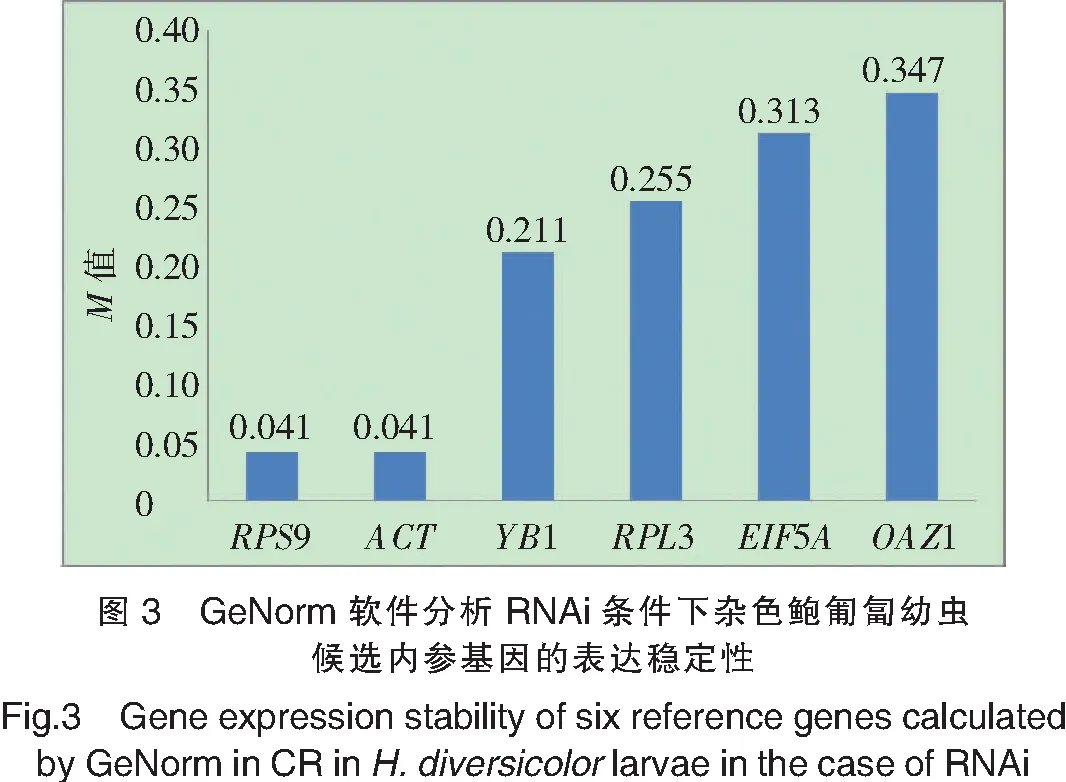
GeNorm对6个基因在RNAi干扰实验中稳定性评估见图3。RPS9和ACT的M值最小,都为0.041,稳定性最高;YB1、RPL3、EIF5A和OAZ1的M值分别为0.211、0.255、0.313和0.347。
NormFinder给出的稳定性前3位的基因与GeNorm一致,都是RPS9、ACT和YB1,其M值分别为0.021、0.021和0.272。EIF5A、OAZ1和RPL3的M值也较大,分别为0.344、0.347和0.353,但其大小顺序与GeNorm有所不同。
RefFinder同样判定RPS9为稳定性最好的基因,其M值最小(1.316);ACT的稳定性次之,其M值为1.682;EIF5A、YB1、RPL3和OAZ1的稳定性依次降低,其M值依次增大,分别为2.991、3.568、4.681和5.477。
计算3个软件对这6个基因在RNAi干扰实验中稳定性的排名几何平均数,结果见表4。3种软件对RPS9和ACT的排名一致,分别位于第1和第2位;而YB1、EIF5A、RPL3和OAZ1的排名平均数依次增大。

表4 RNAi条件下杂色鲍幼虫变态期候选内参基因的表达稳定性排名
3 讨论
正常组织中的细胞大部分完成分化,处于结构和功能稳定时期。参与细胞结构维持和能量代谢的相关基因表达水平比较稳定。所以多数情况下内参基因都选择参与这2个细胞学过程的基因。例如,在小鼠[1,9]、鸡[10]、牙鲆(Paralichthysolivaceus)[11]、家蚕(Bombyxmori)[12]、虾夷扇贝(Patinopectenyessoensis)[13]等进行内参基因稳定性分析的物种中,ACT、18SrRNA、28SrRNA、GADPH(甘油醛-3-磷酸脱氢酶)等参与细胞结构维持和基础代谢的基因,都具有较好的稳定性。
鲍幼虫变态是一个发育过程。幼虫特有结构组织,如面盘、幼虫收缩肌等,会退化崩解。而成体器官,如鳃、消化系统等,则会迅速形成。在变态阶段机体的大部分细胞要么增殖分化要么发生凋亡,细胞结构变化巨大,能量代谢波动大。完成分化的细胞比例较少。因此,参与细胞结构维持和能量代谢的基因稳定性通常较差,选取常规的内参基因往往不能满足定量PCR的要求。
通过比较6个候选基因在感受态面盘幼虫、匍匐幼虫和变态后稚鲍3个阶段的表达稳定性,发现EIF5A表达最稳定,这表明在鲍幼虫变态前后EIF5A适合作为定量PCR的内参基因。而在干扰TR的情况下,RPS9表达最稳定。不同软件的评价方法和目标分析的侧重点不同,所以对于同一数据的分析结果略有差异。因此,本文采用了多个软件来分析内参基因的稳定性,并采用排序的几何平均数比较其稳定性高低,这样能够更加全面地反映内参基因的稳定性。
EIF5A,即真核细胞翻译起始因子5A,是真核生物细胞内普遍存在的一种小分子蛋白,广泛存在于真核生物和古细菌中,其序列具有高度保守性。它参与了蛋白质合成[14-16 ]、核质转运[17]、细胞增殖、凋亡[16]及环境胁迫抵抗。目前,EIF5A的功能研究主要集中于癌症细胞发育和植物生长发育的作用分析。Chen等[3]通过转录组表达谱分析认为EIF5A从卵裂到匍匐幼虫阶段的表达相对稳定,适合作为内参基因,与本研究结果一致。尚未有EIF5A在贝类发育过程中作用的报道,但本研究发现其在杂色鲍中稳定的表达水平,表明其可以作为贝类变态过程的内参基因。又因其在植物生长发育过程中存在间歇和短暂的表达差异[17],表明EIF5A的表达水平稳定与否与物种和具体生物学过程相关。
核糖体蛋白S9(RPS9)同样广泛存在于各个物种中,具有高度保守性。它具有DNA修复、自体翻译调控、发育调控和正常细胞的恶性转化等功能。RPS9的表达水平研究相对较少。在细粒棘球绦虫的发育过程中该基因的表达水平没有显著差异[18]。本研究发现在杂色鲍变态过程中RPS9的稳定性是6个候选基因中最差的一个。而Chen等[3]在杂色鲍早期发育阶段的内参基因筛选中,没有提到该基因。但是本研究也发现,在RNAi TR试验中,该基因稳定性最高。这表明TR的干扰过程对RPS9的表达影响甚少。本文鲍幼虫的TR干扰是通过添加外源dsRNA来实现的。为了保证足够的dsRNA进入幼虫体内,本研究采用的处理浓度远远高于生理浓度,这会对幼虫的免疫和物质跨膜转运相关分子产生影响。而细胞内各个生物大分子是作为分子网络成员发挥其作用的,某个分子功能和数量的变化会通过分子网络影响其他成员,这可能是正常发育的变态过程和RNAi TR内参基因稳定性发生变化的主要原因。此外,在RNAi TR的试验处理中,为了节省dsRNA用量,极大提高了幼虫密度。高密度及提高密度时对幼虫的应激反应可能也是内参基因稳定性发生变化的原因。
每个具体的实验设计对分子网络的影响都会不同。具体处理过程对实验对象的应激反应也存在差异。同一内参基因在不同的试验条件下的稳定性会发生变化。因此,本文建议在运用实时定量PCR研究基因表达水平时,需要对内参基因进行评估,筛选出适用于具体试验条件的内参基因,以保证研究结果的可靠性。
ACT是一个常用的内参基因。在正常发育和干扰TR下,稳定性排名都位于第二位。本研究的前期研究表明ACT在弧菌感染杂色鲍前后是可以作为合适内参的[19]。Zhang等[11]也在牙鲆中得出类似的结果。此外,周瑞雪等[19]认为ACT在草鱼早期发育中可作为最适内参。虾夷扇贝在饥饿处理下ACT同样也是最适内参[13]。因此,ACT可能是一个适用范围较广的内参基因,可以作为一个通用的内参基因。
YB1是一种核酸结合蛋白,参与了转录、翻译、前mRNA剪接和DNA修复等多种细胞学过程[20]。Chen等[3]的研究结果表明从受精卵到稚贝大尺度的发育过程中,该基因表达稳定性高于其他基因,是最佳的定量PCR内参基因。但是鲍变态阶段细胞数目大体稳定,与鲍其他早期发育阶段细胞数目快速增加有着明显的不同[4],这可能是变态过程该基因稳定性较差的原因。OAZ1属于鸟氨酸脱羧酶抗酶家族,通过抑制鸟氨酸脱羧酶来降低细胞内多胺水平,从而调控细胞的生长和增殖[21]。OAZ1在受精卵到稚贝阶段,具有较好的稳定性,但是低于EIF5A和YB1[3]。而本文结果表明OAZ1基因的稳定性位于EIF5A和YB1两者之间。RPL3是核糖体蛋白60S亚基的组成元件,通常认为具有较好的表达稳定性[3]。但是在本研究的鲍变态阶段和RNA干扰TR试验中,稳定性较差与Chen等[3]的研究结果不同。OAZ1和RPL3稳定性的差异同样可能是变态过程造成的。本文RNA干扰TR处于变态阶段,所以YB1、OAZ1和RPL3稳定性也会受到影响,不如RPS9稳定。
[]
[1]董晓丽,王加启,卜登攀,等.内参基因在实时定量PCR 中应用的研究进展[J].中国畜牧兽医,2009(9):83-85.
[2]朱芷葳,董常生.持家基因作为相对定量内标物的稳定性比较[J].生物技术通讯,2006,17(5):807-809.
[3]CHEN J.Stable expression of Y-box protein 1 gene in early development of the abaloneHaliotisdiversicolor[J].International Journal of Developmental Biology,2012,56(5):369-375.
[4]王国栋,张丽莉,王艺磊.鲍幼虫变态分子机制的研究进展[J].集美大学学报(自然科学版),2012,17(2):101-108.
[5]VANDESOMPELE J,DE PRETER K,PATTYNF,et al.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].Genome Biology,2002,3(7):research0034.
[6]ANDERSEN C L,JENSEN J L,ØRNTOFT T F.Normalization of real-time quantitative reverse transcription-PCR data:a model-based variance estimation approach to identify genes suited for normalization,applied to bladder and colon cancer data sets[J].Cancer Research,2004,64(15):5245-5250.
[7]ZHU X,LI X,CHEN W,et al.Evaluation of new reference genes in papaya for accurate transcript normalization under different experimental conditions[J].PLoS ONE,2012,7(8):e44405.
[8]SILVER N,BEST S,JIANG J,et al.Selection of housekeeping genes for gene expression studies in human reticulocytes using real-time PCR[J].BMC Molecular Biology,2006,7(1):33.
[9]陈烨,李凯,周宇荀,等.小鼠基因转录表达分析中内参基因的优选[J].中国实验动物学报,2011,19(3):197-202.
[10]冯焱,李建芳,张芬鹊,等.LPS诱导的免疫应激对肉鸡组织内参基因稳定性的影响[J].中国家禽,2015,37(2):31-36.
[11]ZHENG W,SUN L.Evaluation of housekeeping genes as references for quantitative real time RT-PCR analysis of gene expression in Japanese flounder(Paralichthysolivaceus)[J].Fish & Shellfish Immunology,2011,30(2):638-645.
[12]吴玉,翟渊粉,黄明霞,等.家蚕常用内参基因稳定性分析及丝蛋白相关基因表达调控研究[J].中国细胞生物学学报,2013(4):423-431.
[13]鲍相渤,刘卫东,姜冰,等.内参基因在虾夷扇贝定量PCR中表达稳定性的比较[J].水产科学,2011,30(10):603-608.
[14]LI A L,LI H Y,JIN B F,et al.Anovel eIF5A complex functions as a regulator of p53 and p53-dependent apoptosis[J].J Biol Chem,2004,279(47):49251-49258.
[15]KANG H A,HERSHEY J W.Effect of initiation factor eIF-5A depletion on protein synthesis and proliferation ofSaccharomycescerevisiae[J].J Biol Chem,1994,269:3934-3940.
[16]ZUK D,JACOBSON A .A single amino acid substitution in yeast eIF-5A results in mRNA stabilization[J].EMBO J,1998,17:2914-2925.
[17]LIU Z,DUGUAY J,MA F,et al.Modulation of eIF5A1 expression alters xylem abundance inArabidopsisthaliana[J].J Exp Bot,2008,59:939-950.
[18]肖云峰,刘辉,吕国栋,等.细粒棘球绦虫核糖体蛋白S9基因克隆鉴定及其在不同发育阶段表达分析[J].中国病原生物学杂志,2014(2):150-154.
[19]LI N.Insulin-like growth factor binding protein 7,a member of insulin-like growth factor signal pathway,involved in immune response of small abaloneHaliotisdiversicolor[J].Fish & Shellfish Immunology,2012,33(2):229-242.
[20]KOHNO K,IZUMI H,UCHIUMI T,et al.The pleiotropic functions of the Y-box-binding protein,YB-1[J].Bioessays,2003,25(7):691-8.
[21]HAYASHI S,MURAKAMI Y,MATSUFUJI S.Ornithine decarboxylase antizyme:a novel type of regulatory protein[J].Trends in Biochemical Sciences,1996,21(1):27-30.
