海地瓜多糖和多肽提取纯化工艺及抗氧化活性
2018-05-29陈发河吴光斌
陈发河,李 真,吴光斌
(集美大学食品与生物工程学院,福建 厦门 361021)
0 引言
海地瓜(Acaudinamolpadioides),属于棘皮动物门(Echinodermata)海参纲(Holothuroidea)芋参目(Molpadioides)[1]。作为我国大宗低值海参品种,海地瓜广泛分布在我国山东、福建和广东沿海,食用品质较差。相关研究表明[2-6],海地瓜体内含有丰富的蛋白质、多糖、脂肪、皂苷、必需氨基酸、维生素和微量元素等活性组分,具有很高的营养价值和药用价值。由于海地瓜属低值海参,口感较差,食用价值较低,因此,研究其中的功效成分的分离提取工艺技术,是实现低值海参资源高值化利用的有效途径。
海参独特的自溶现象,给运输与贮藏带来极大不便。目前,海参加工产品主要有海参干品、海参冷冻制品、即食海参等传统海参产品以及海参口服液、胶囊制剂等深加工功能性海参制品[7-8]。海参多糖是海参体壁的重要组成物质,主要包括海参硫酸软骨素及海参岩藻聚糖硫酸酯2种组分[9-10],已证实海参多糖具有增强免疫力、抑制肿瘤、抗凝血、降血脂和预防组织老化等多种特殊功效[11-12]。海参体壁富含蛋白质,干品中蛋白质质量分数可达70%以上,是制备生物活性肽非常理想的原料[13-15]。海参活性肽的生物活性研究主要集中在降血压、抗疲劳、提高免疫力、抗菌抗氧化等方面[16-18]。运用海参自溶和外源酶酶解相结合的技术可有效制备海参多糖和活性多肽[13]。本文以海地瓜为原料,采用酶解和超滤相结合的方法,研究了联合制备不同分子质量段海地瓜多糖和多肽的工艺,并对不同分子质量段海地瓜多糖及多肽的体外抗氧化活性进行了比较分析。
1 材料与方法
1.1 材料与试剂
海地瓜干品购自厦门中埔水产品批发市场。实验前洗净体表与体内的泥沙,去除内脏,水发后剪成小块,于45 ℃烘箱中烘至恒重,粉碎,过60目筛,制成海地瓜干粉,装入自封袋,贮存于干燥器中备用。
木瓜蛋白酶(2×105U/g),中性蛋白酶(2×105U/g),南宁庞博生物工程有限公司;胰蛋白酶(2.5×105U/g),北京索莱宝科技有限公司;牛血清蛋白、D-氨基葡萄糖、D-葡萄糖醛酸、Tris-base,国药集团化学试剂有限公司;Q-Sepharose-Fast-Flow凝胶(分装进口),美国Pharmacia;其他试剂均为国产分析纯。
1.2 仪器与设备
Cary50紫外可见分光光度计,美国Varian公司;TH-300A梯度混合仪、BT-100恒流泵、DBS-100部分收集器,上海青浦沪西仪器厂;层析柱(1.5 cm×40 cm、1.5 cm×70 cm),上海方畦仪器有限公司;RE-52AA 旋转蒸发仪,上海亚荣生化仪器厂;SHB-Ⅲ 循环水多用真空泵,郑州长城科工贸有限公司;超滤膜(UP010、US100、UV200、UP010、UP005、NP010) ,迈纳德膜技术有限公司。
1.3 实验方法
1.3.1 工艺流程

1.3.2 总糖及蛋白质含量的测定
总糖含量的测定采用苯酚-硫酸法[19];蛋白质含量的测定采用Folin-酚法[20]。
1.3.3 酶法提取海地瓜多糖和多肽
1.3.3.1 蛋白酶的筛选
选用胰蛋白酶、中性蛋白酶和木瓜蛋白酶,根据酶制剂说明书提供的最佳酶解条件设计对比实验,以酶解液中总糖含量和蛋白质含量为指标确定后续实验中蛋白酶的使用量。实验中均取10 g海参粉,料液比(m/V)为1∶40,用1 mol/L的盐酸溶液和氢氧化钠溶液调节pH值,加酶量为2%,在电热恒温振荡水槽中酶解4 h后,置于100 ℃沸水浴灭酶5 min,冷却后离心(4000 r/min,15 min),取上清液定容于100 mL,分别用苯酚-硫酸法和Folin-酚法测A490和A640,计算酶解液中总糖和蛋白质含量。选用酶解液中蛋白质含量最高的蛋白酶A对原料液进行一次酶解,总糖含量最高的蛋白酶B对一次酶解沉淀及超滤截留液进行二次酶解。
1.3.3.2 酶解条件的优化
对实验用酶进行单因素实验,考察酶解时间、加酶量、酶解pH值和酶解温度这4个因素。每个因素选取不同的水平,均做3次平行试验,计算酶解液中的总糖含量或蛋白质含量。根据单因素实验结果,每个因素在最优范围内选取3个水平,利用L9(34)正交试验表进行正交试验,对每种实验用酶的酶解条件进行优化。
1.3.3.3 双酶体系复合酶解试验
提取海参多糖的关键在于破坏糖链与蛋白质之间的共价结合,即肽键。由于蛋白酶对肽链断裂作用具有专一性,一种酶只能水解固定的几种氨基酸残基,使其多糖提取率受到限制。因此,以单酶最佳酶解工艺为基础,选用双酶体系复合酶解,确定最佳酶解方案。
1.3.4 超滤条件的优化
超滤过程中以不同的操作压力、料液浓度和操作温度为考察因素,以膜通量和膜效能为衡量指标[21],确定最佳超滤条件。膜通量以单位时间通过单位膜面积透过液的体积来表示,具体公式为:膜通量(LMH)=V/(T×S);膜效能以单位时间通过单位膜面积透过液冷冻干燥后的质量来表示,具体公式为:膜效能(MMH)=M/(T′×S),其中,V为超滤透过液的体积(L);M为超滤透过液冷冻干燥后的质量(g);S为平板超滤膜的表面积(m2);T和T′为原料液通过膜表面所消耗的时间,单位分别为h和min。
1.3.5 超滤法分离分级海地瓜多肽和多糖
选用截留分子质量为5 ku和1 ku的超滤膜依次对海地瓜多肽混合液进行超滤分级,选用截留分子质量为10,100和200 ku的超滤膜依次对海地瓜多糖粗提液进行截留液超滤分级。采用截留液全循环超滤方式,当截留液体积为原始酶解液体积的1/5时,达到超滤终点。依次收集5,1 ku截留液和1 ku透过液,透析除盐并冷冻干燥得到3个海地瓜多肽组分。依次收集10,100,200 ku透过液和200 ku截留液,透析除盐并冷冻干燥得到4个海地瓜粗多糖组分。
1.3.6 海地瓜高分子质量粗多糖G4的离子交换柱层析法纯化
参照文献[22],采用Q-Sepharose-Fast-Flow强阴离子交换柱对G4进行分离纯化。取适量海参粗多糖溶解、离心去沉淀后上样,流速1 mL/min,每管收集5 mL,采用苯酚-硫酸法和波长280 nm处紫外吸收法分别测定各收集管的多糖含量和蛋白质含量,绘制洗脱峰,按多糖峰收集各含糖组分,透析法(3500 u)除盐、旋蒸浓缩、冷冻干燥后,低温干燥储藏备用。
1.3.7 羟基自由基(·OH)清除能力的测定
参照文献[23-24],反应体系依次加入1.0 mL磷酸盐缓冲液(pH =7.40,1 mol/L)、1.0 mL番红花红试剂(100 mg/L)、1.0 mL EDTA-Fe2+试剂(1 mmol/L)、0.5 mL各浓度样品溶液以及1 mL质量分数3% H2O2溶液,混合均匀,37 ℃下保温静置30 min,在波长520 nm处测吸光度值,记为AS(用1.0 mL磷酸盐缓冲液加3.5 mL蒸馏水调零)。按照相同的操作方法,以1.5 mL蒸馏水代替样品和H2O2溶液,吸光度值记为A;以0.5 mL蒸馏水代替样品,吸光度值记为A0,·OH清除率计算公式为:·OH清除率(%) =(AS-A0)/A×100。
1.3.8 1,1-二苯基-苦肼基自由基(DPPH·)清除能力的测定
参照文献[25-27],取各浓度的样品溶液2.0 mL和0.1 mmol/L的 DPPH·-乙醇溶液2.0 mL,充分混合均匀,在室温下避光静置30 min,在波长517 nm处测吸光度值,记为AS(用体积分数50%的乙醇调零)。按照相同的操作方法,以2.0 mL无水乙醇代替DPPH·-乙醇溶液,测吸光度值,记为A;以2.0 mL无水乙醇代替样品溶液,测吸光度值,记为A0,DPPH·清除率计算公式为:DPPH·清除率(%)=( 1-(AS-A)/A0)×100。

2 结果与分析
2.1 酶解方法对海地瓜多肽和多糖提取率的影响
2.1.1 蛋白酶的筛选
由表1可以看出,从提取多肽的角度出发,胰蛋白酶的酶解效果最佳,可溶性蛋白质含量明显高于中性蛋白酶和木瓜蛋白酶酶解所得,且总糖含量最低,这可能是由于胰蛋白酶作为动物性蛋白酶对肽键断裂作用专一性较高造成的。
从提取多糖的角度出发,作用谱广的微生物酶中性蛋白酶的酶解效果最佳,酶解液中总糖含量最高,木瓜蛋白酶酶解能力稍弱。故选用胰蛋白酶对原料液进行一次酶解,酶解条件参照文献[28]。然后通过截留分子质量10 ku的超滤膜分离得到分子质量相对较小海地瓜多肽,提取率达到海地瓜体壁干质量的(29.602±1.012)%,重复性好且纯度较高,残留糖含量控制在2%以下。
利用中性蛋白酶和木瓜蛋白酶对一次酶解沉淀及超滤截留液开展后续实验,提取海地瓜粗多糖。根据上述实验结果进行中性蛋白酶和木瓜蛋白酶的单因素试验和正交试验。中性蛋白酶酶解条件为:pH值7.0,加酶量4%,酶解温度50 ℃,酶解时间4 h。木瓜蛋白酶酶解条件为:酶解pH值7.0,加酶量4%,酶解温度50 ℃,酶解时间4 h。改变其中一个条件,保持其他条件不变,分别考察不同影响因素对多糖提取率的影响。各因素取值范围:酶解pH值为6.0,6.5,7.0,7.5,8.0;加酶量为1%,2%,4%,6%,8%;酶解温度为40,50,60,70 ℃;酶解时间为2,4,6,8,10 h。

表1 最佳蛋白酶筛选实验结果
2.1.2 酶解条件单因素试验
2.1.2.1 酶解时间对多糖提取率的影响
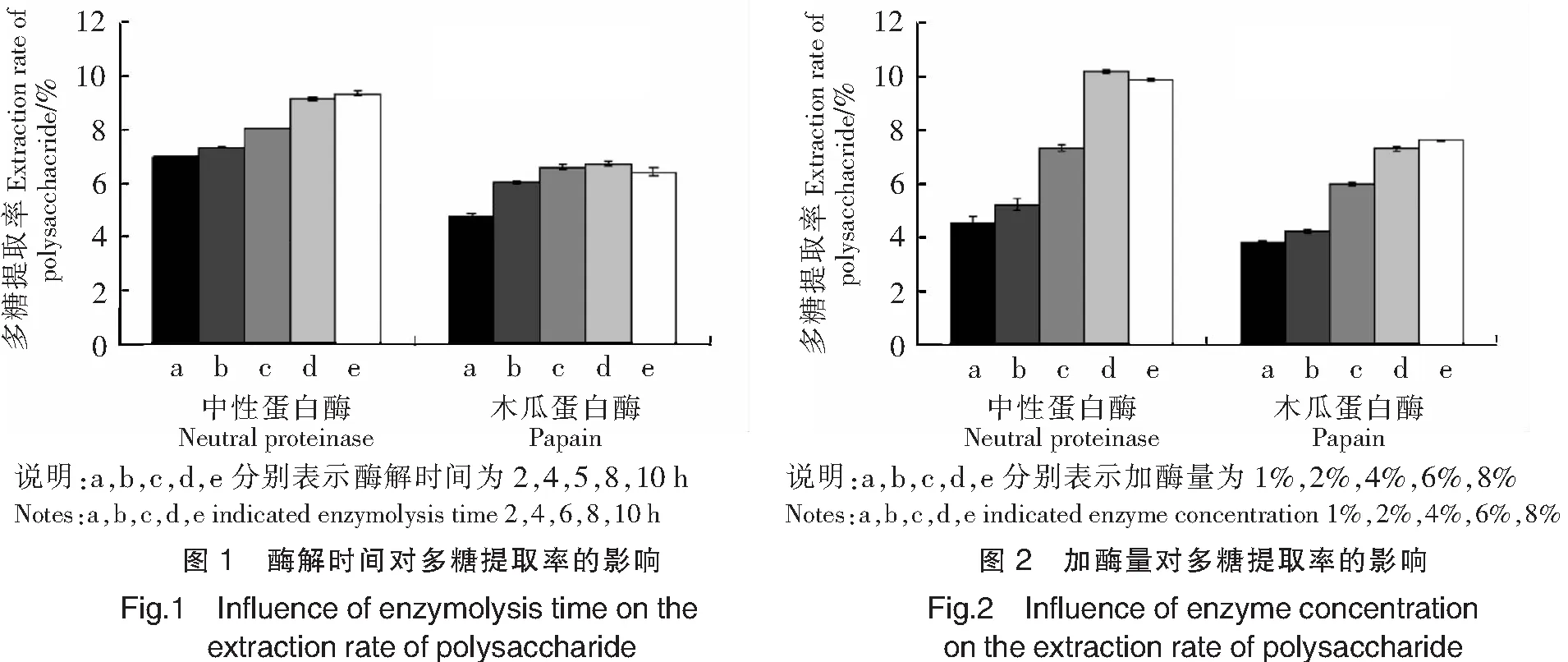
由图1可以看出,随着酶解时间延长,中性蛋白酶的多糖提取率逐渐增大,2~8 h之内增大趋势明显,8 h之后趋于平缓。这是因为溶液粘稠降低酶分子的移动性,不利于酶解反应进行,此时酶解产物达到饱和,阻碍多糖释放。在2~8 h之内,木瓜蛋白酶的多糖提取率同样逐渐升高,8 h时提取率最高,之后有所降低。
2.1.2.2 加酶量对多糖提取率的影响
由图2可以看出,随着加酶量的增大,中性蛋白酶多糖提取率迅速上升, 6%时达到最大值,而后出现下降。这可能是因为随着加酶量的增大,酶解程度加深,酶解液粘度有所升高,部分多糖被各种杂质吸附形成沉淀。木瓜蛋白酶多糖提取率随加酶量的增大而增大,6%之后继续增大加酶量,提取率增大幅度变小。因为此时酶解已达到饱和,底物浓度不变,即使增大加酶量,没有充足底物与酶结合,多糖提取率也不会有大幅度的增加。
2.1.2.3 酶解pH值对多糖提取率的影响
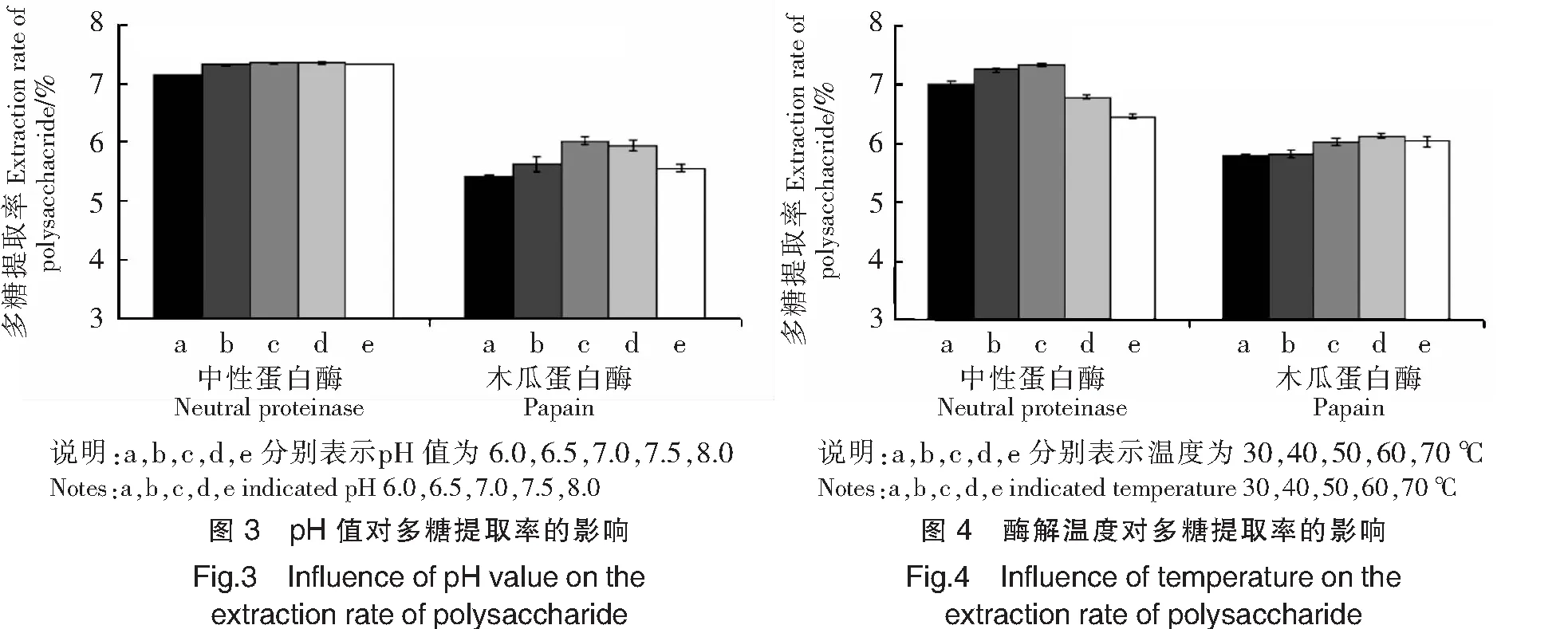
由图3可以看出,酶解pH值对中性蛋白酶多糖提取率的影响程度很小,pH值在6.0~7.0内,多糖提取率只有小幅度的升高,pH值在7.0以上时,多糖提取率几乎没有变化。酶解pH值对木瓜蛋白酶多糖提取率的影响则比较明显,pH值在6.0~7.0内,多糖提取率随着pH值的增大而增大,pH值在7.0时多糖提取率达到最大,之后逐渐减小。因此,中性蛋白酶和木瓜蛋白酶的最佳酶解pH值均控制在7.0左右,这与酶制剂说明书的描述一致。
2.1.2.4 酶解温度对多糖提取率的影响
由图4可以看出,中性蛋白酶和木瓜蛋白酶的多糖提取率随着温度的升高均呈现先增大后减小的趋势。酶解温度在50 ℃时,中性蛋白酶的多糖提取率最高;酶解温度在60 ℃时,木瓜蛋白酶的多糖提取率最高。另外,由图4还可以看出,酶解温度对中性蛋白酶的影响程度更明显。
2.1.3 酶解条件正交试验
2.1.3.1 中性蛋白酶正交试验
根据单因素实验结果,设计L9(34)正交试验来考察中性蛋白酶酶解时间、加酶量、酶解pH值、酶解温度4个因素对多糖提取率的影响,各因素水平见表2,正交试验结果见表3。由表3可知,在各因素水平范围内,对中性蛋白酶多糖提取率的影响主次顺序为:加酶量>酶解温度>pH值>酶解时间。得到中性蛋白酶的最优酶解条件A1B3C2D1:酶解时间为8 h,加酶量为7%,pH值为7.0,酶解温度为45 ℃。在该条件下经过3次验证实验,得到海地瓜体壁多糖提取率为体壁干重的(10.863±0.120)%。

表2 中性蛋白酶正交试验因素水平表
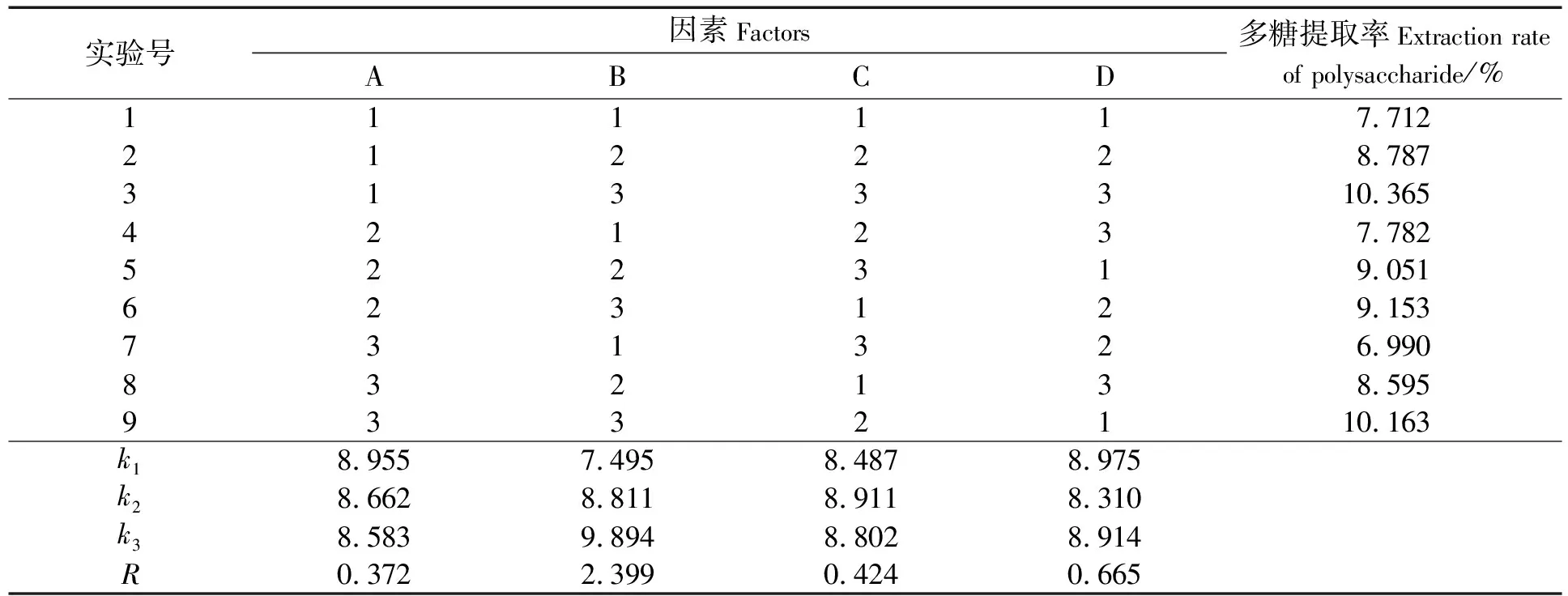
表3 中性蛋白酶正交试验结果
2.1.3.2 木瓜蛋白酶正交试验
根据单因素实验结果,设计L9(34)正交试验考察木瓜蛋白酶酶解时间、加酶量、pH值、酶解温度4个因素对多糖提取率的影响,各因素水平见表4,正交试验结果见表5。由表5可知,在各因素水平范围内,对木瓜蛋白酶多糖提取率的影响主次顺序为:加酶量>pH值>酶解温度>酶解时间,得到木瓜蛋白酶的最优酶解条件A2B3C2D2:酶解时间为8 h,加酶量为8%,pH值为7.0,酶解温度为60 ℃。在该条件下经过3次验证实验,得到海地瓜体壁多糖提取率为体壁干质量的(9.364±0.173)%。

表4 木瓜蛋白酶正交试验因素水平表
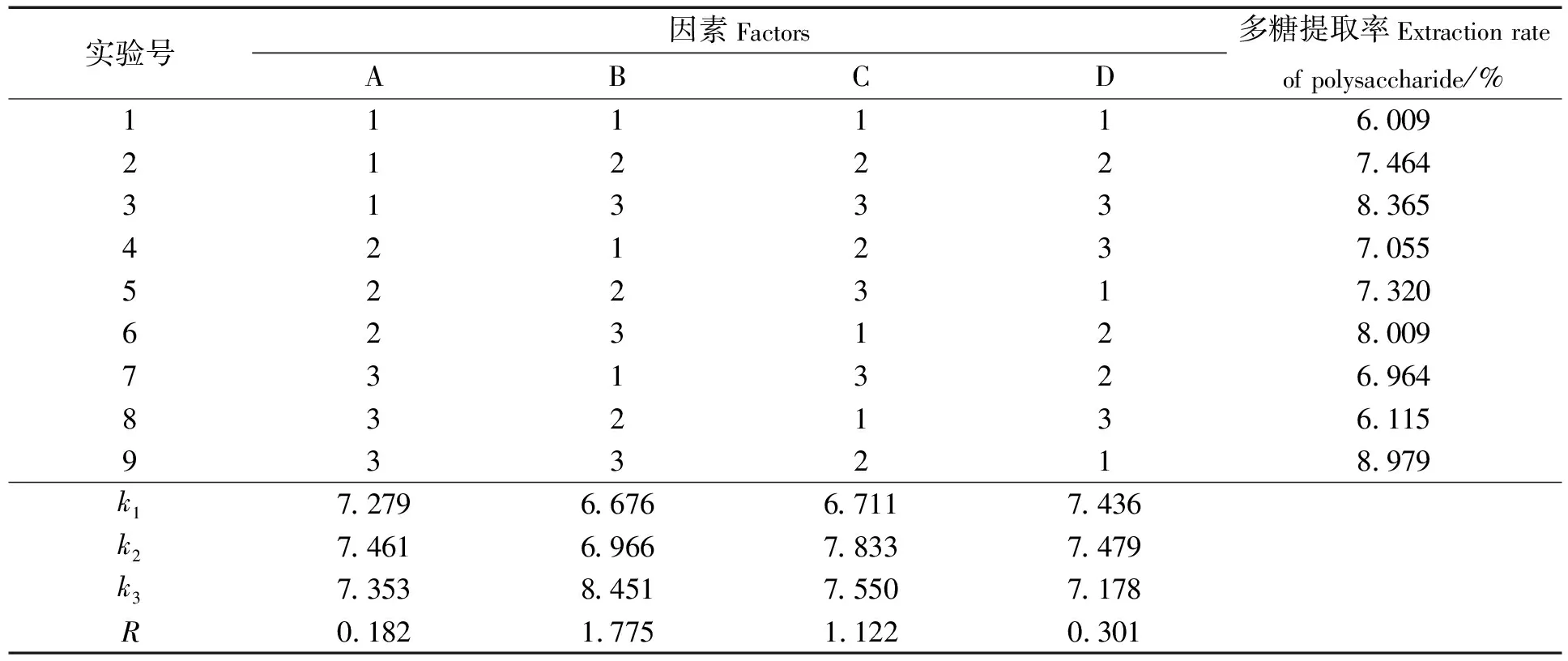
表5 木瓜蛋白酶正交试验结果
2.1.4 双酶体系复合酶解试验
通过酶的筛选试验结果,本试验选择多糖提取率较高的中性蛋白酶和木瓜蛋白酶,比较单酶酶解和双酶复配使用对海地瓜多糖提取率的影响。由正交试验结果可以看出,中性蛋白酶和木瓜蛋白酶的最佳酶解pH值均为7.0。因此结合正交试验所得两种单酶的最优条件,在不同的组合方式下,仅改变酶解温度和酶解时间,不同酶解的设计方案见表6。由表6可知,在酶解时间一定的情况下双酶复配使用,无论是混合酶解还是分步酶解,均比单酶酶解效果好。这与不同蛋白酶底物特异性及活性中心不同有关,酶复配使用大大增加了其可酶解的底物范围,多糖提取率明显升高。而分步后酶解方案5和方案6的多糖提取率均比复合酶解型的高,这可能是因为两种酶混合使用影响了各自的活性,而且无法同时兼顾两种酶的最优酶解条件。分步酶解两种方案又以中性蛋白酶在先的效果更好,所以方案5为最佳酶解方案,即:先加入中性蛋白酶,在加酶量7%、酶解温度45 ℃的条件下水解4 h,再加入木瓜蛋白酶,在加酶量8%、酶解温度60 ℃的条件下水解4 h,整个过程pH值均为7.0,多糖提取率最高,达到了(14.511±0.162)%,重复性良好。
目前使用双酶或多酶体系来提高多糖提取率的研究已有很多报道:展学孔等[29]采用胰蛋白酶和胃蛋白酶双酶体系先后水解的方式提取海参多糖,本文研究结果与其一致,效果良好;冀利等[30]以浓缩枣汁超滤截留液为原料,选用植物蛋白酶、木瓜蛋白酶和酸性蛋白酶3种酶分步水解金丝小枣蛋白,提取了多糖和多肽。
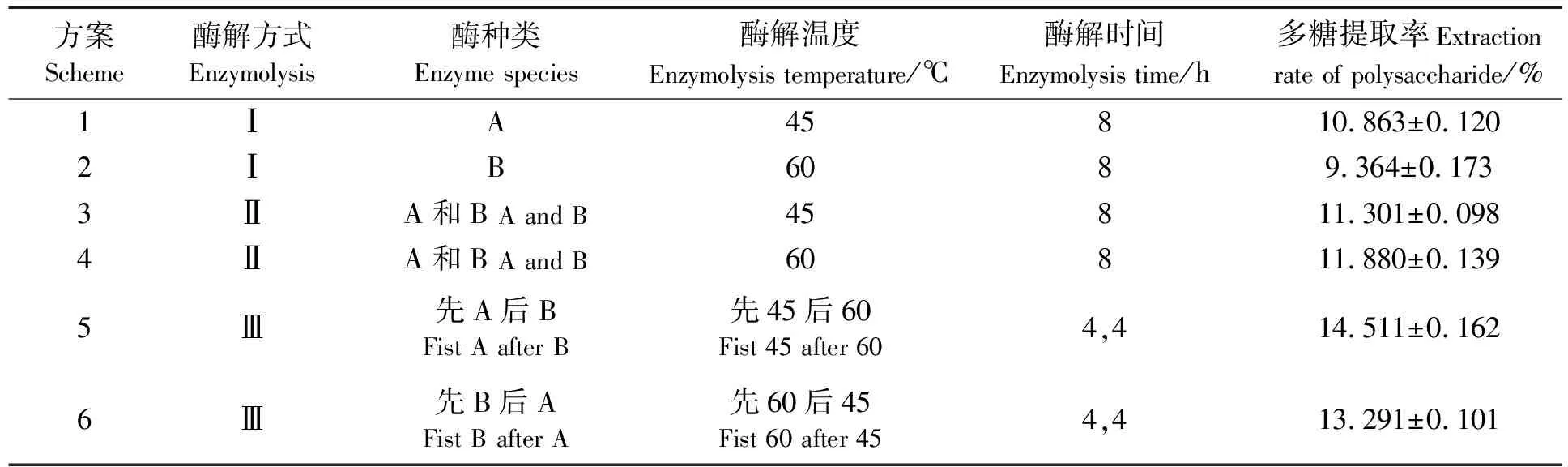
表6 单酶与双酶提取率比较
说明:A—中性蛋白酶,B—木瓜蛋白酶;Ⅰ型—单酶酶解,Ⅱ型—双酶混合酶解,Ⅲ型—双酶先后酶解
Notes:A—neutral proteinase;B—papain;I—single enzymolysis;Ⅱ—mixed enzymolysis;Ⅲ—mixed enzymes successively enzymolysis
2.2 海地瓜多肽和多糖的超滤法分离分级
2.2.1 超滤条件的优化
2.2.1.1 操作压力对超滤膜通量和膜效能的影响
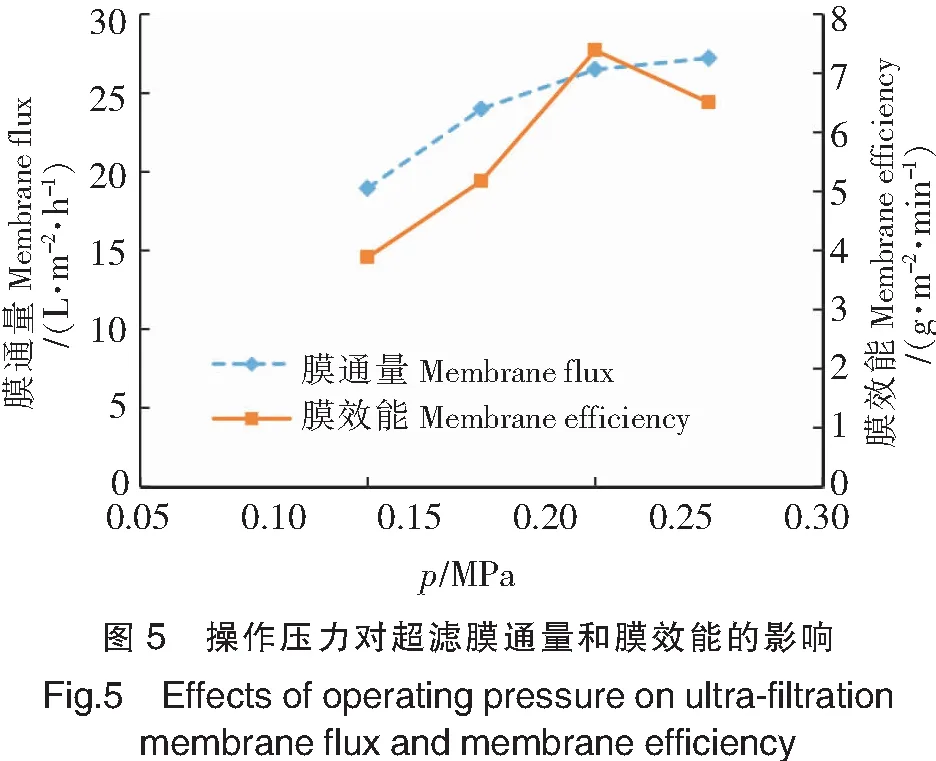
在料液质量分数为4%、操作温度为25 ℃的条件下,研究不同操作压力(0.10,0.15,0.20,0.25 MPa)对超滤膜通量和膜效能的影响,结果如图5所示。由图5可见,在0.10~0.25 MPa的压力范围内,膜通量随操作压力升高而增加,当其操作压力上升到 0.20 MPa 以后,增加幅度趋于平缓。随着压力的增加,被截留的大分子物质在膜表面不断累积吸附,最终达到饱和形成凝胶层。此时,继续增加压力,除了增加能耗外,只会增加凝胶层的厚度、致密度和传质阻力,加重膜污染。因此,当压力达到0.20 MPa 以后,膜通量减缓,膜效能由增大变为减小。结合膜通量和膜效能两项指标综合考虑,操作压力选择0.20 MPa为宜。
2.2.1.2 料液质量分数对超滤膜通量和膜效能的影响
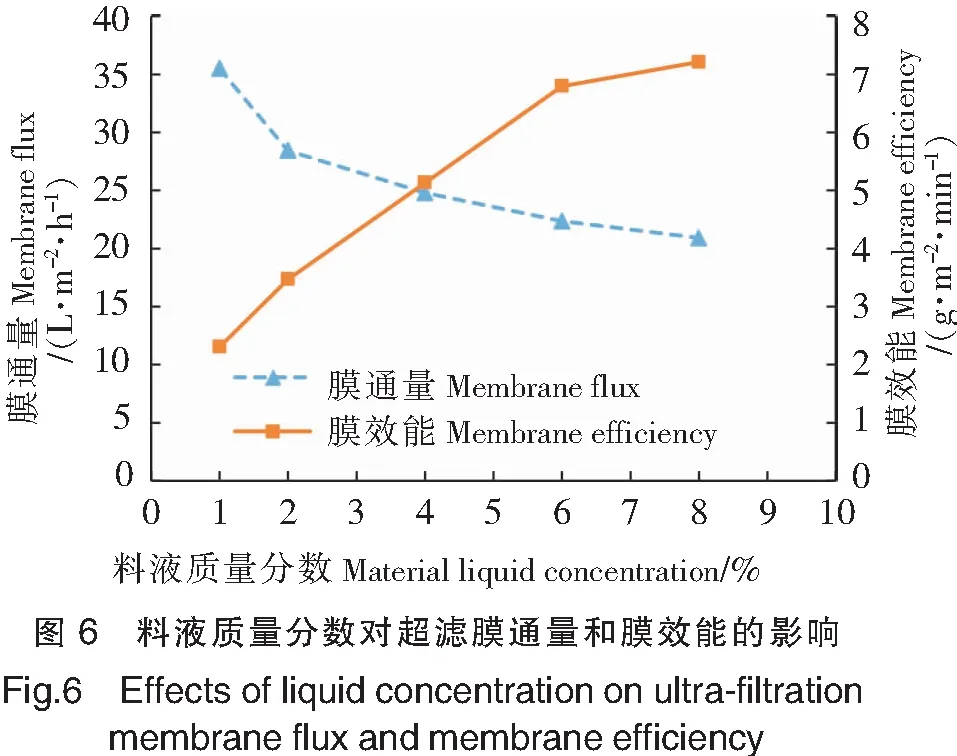
在操作压力为0.20 MPa、操作温度为25 ℃的情况下,研究不同料液质量分数(1%,2%,4%,6%,8%)对超滤膜通量和膜效能的影响,结果如图6所示。由图6可见,膜通量随着料液质量分数的升高而降低。这是因为料液黏度与溶质浓度成正比,而粘度越高,扩散系数越小,膜表面越易出现浓差极化现象,形成凝胶层,导致膜通量下降。但是低浓度料液中小分子溶质含量少,膜效能很低,随着料液质量分数的增加,膜效能显著增大,质量分数达到6%时膜效能增大幅度明显减小。综合考虑产品利用率、生产效率等,确定料液质量分数为6%。
2.2.1.3 操作温度对超滤膜通量和膜效能的影响
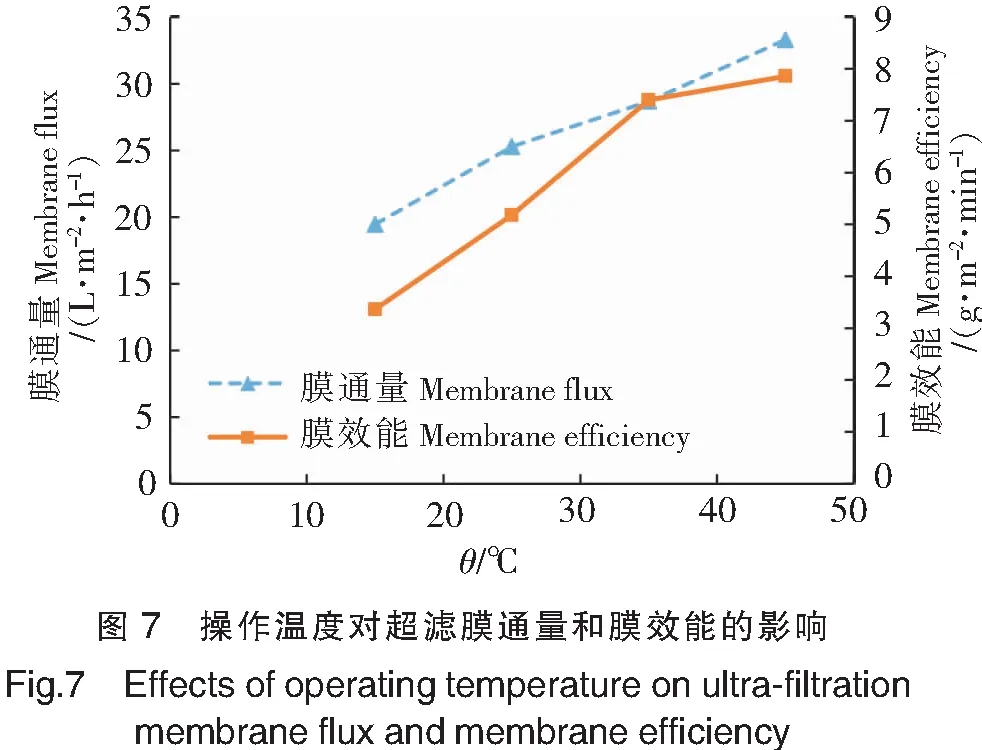
在操作压力为0.20 MPa、料液质量分数为4 %的条件下,研究不同操作温度(15,25,35,45 ℃)对超滤膜通量和膜效能的影响,结果如图7所示。由图7可见,温度升高,膜通量和膜效能都随之增大。这是因为料液黏度随温度上升而下降,因而扩散系数增加,浓差极化影响降低,有效延缓了膜表面凝胶层的形成。但是,温度升高使蛋白质等大分子物质体积膨胀而结构变得疏松不规则,易造成堵塞污染或吸附污染。当温度升高到35 ℃时,膜效能增加幅度明显降低。综合考虑膜通量和膜效能大小及经济效益,本实验采用35 ℃作为超滤温度。
2.2.2 海地瓜多肽和多糖的超滤分离分级
超滤分级得到3个不同分子质量段5~10 ku、1~5 ku和<1 ku的海地瓜多肽,分别命名为P1、P2和P3。经测定各组分中多肽含量,计算得到不同分子质量段海地瓜多肽在海地瓜多肽混合液中所占比例:P1(48.47%),P2(18.46%),P3(33.07%)。
超滤得到4个不同分子质量段(<10 ku,10~100 ku,100~200 ku,>200 ku)的海地瓜多糖,分别命名为G1、G2、G3和G4,测定4个组分中的化学组成如表7。由表7可见,随着分子质量的增大,海地瓜粗多糖中总糖含量逐渐增加,蛋白质含量逐渐减少,分子质量大于200 ku的粗多糖G4中总糖含量已升至55.99%,蛋白质含量已降至6.33%。故本研究只对所占比例较高且杂质最少的粗多糖G4进一步分级纯化。
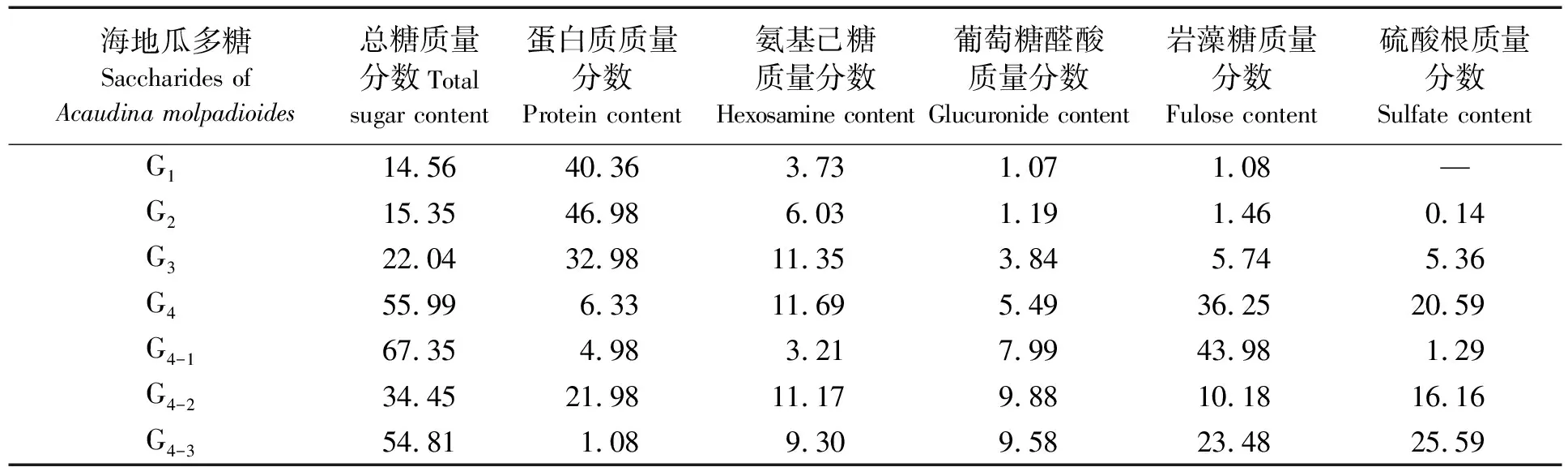
表7 海地瓜多糖的化学组成
2.2.3 粗多糖G4的离子交换柱层析法纯化
样品经初始Tris-HCl缓冲液(含0 mol/L NaCl)洗脱和0~4 mol/L NaCl线性洗脱后,选择了NaCl浓度为0,0.5,1.0,1.5,2.0 mol/L的洗脱盐对海地瓜多糖G4进行等梯度洗脱,洗脱峰如图8所示。由图8分析确定NaCl洗脱盐浓度为0,0.5,1.5 mol/L,洗脱出现3个主要的多糖峰,洗脱浓度的增大说明多糖组分中与凝胶发生离子交换作用的物质逐渐增多,可以推测最后一种多糖中含有最多的酸根离子。另外,由图8还可以看出,多糖峰二与蛋白质检测峰重合,推测其成分可能为糖-蛋白质复合物。多糖峰三无蛋白质检出,推测可能是一种组分单一的多糖。合并收集粗多糖洗脱曲线三个峰值处的多糖组分,经除盐、浓缩、冷冻干燥处理后,低温干燥环境中储藏,得到海地瓜多糖呈乳白色棉絮状,分别命名为G4-1、 G4-2和 G4-3。G4经过离子交换柱分离纯化得到的3种纯多糖的化学组成差异很大,说明相同分子质量范围内存在不同的多糖的组分,可以通过柱层析的方法分离。柱层析纯化多糖G4-1、G4-2、G4-3的化学组成如表7,其中G4-2蛋白质含量较高,占21.98%,进一步验证了G4-2洗脱过程中出现蛋白峰的原因,即G4-2是一种糖-蛋白质复合物。G4-3中几乎不含蛋白质,硫酸根和岩藻糖含量很高,说明G4-3是高度硫酸酯化的岩藻聚糖。而G4-1中岩藻糖含量最高,达到43.98%,氨基己糖、葡萄糖醛酸及硫酸根含量最低,说明G4-1是一种纯度较高的同多糖,这也是G4-1能被不含NaCl的洗脱液最先洗脱下来的原因。
2.3 海地瓜多肽和多糖的抗氧化活性
2.3.1 清除羟基自由基(·OH)的能力
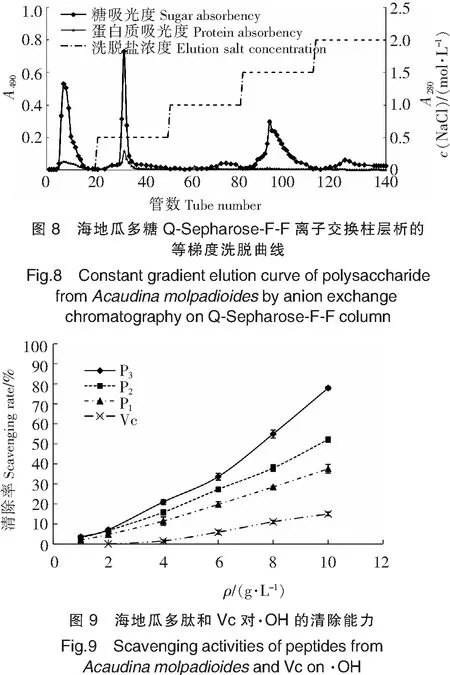
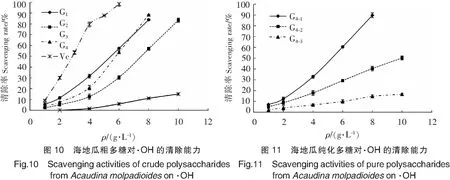
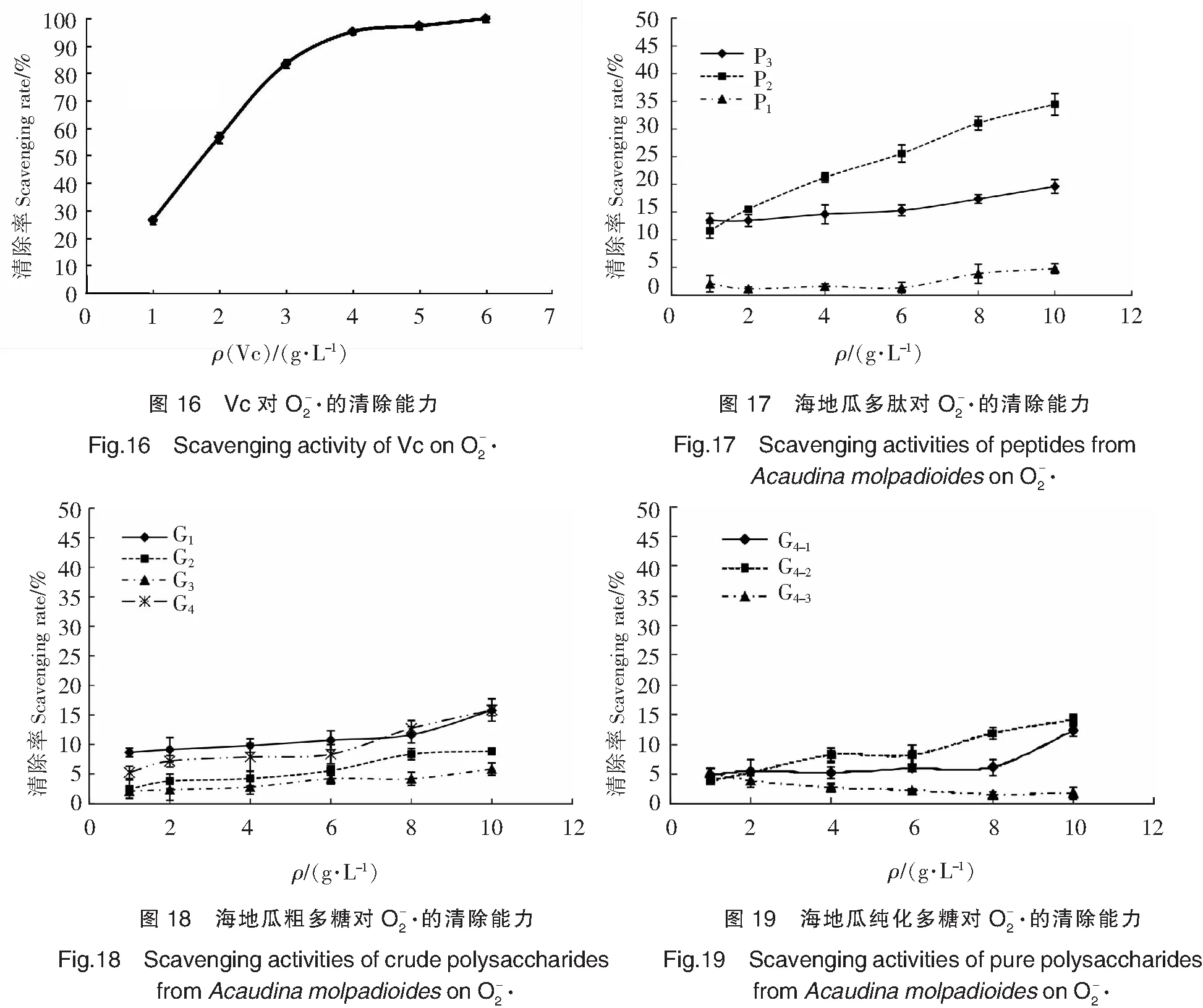
由图9~图11可以看出,海地瓜多肽、粗多糖和纯化多糖的·OH清除能力均随着质量浓度的增大显著增强,且均高于Vc。不同分子质量段海地瓜多肽的·OH清除能力随着分子质量的增大而降低,且差异较显著,分子质量最小P3对·OH的清除能力最强。不同分子质量段粗多糖中,G4的清除能力最强,质量浓度在6 g/L时·OH清除率已达到(98.42±1.89)%。3种海地瓜纯化多糖中,G4-1的·OH清除能力最强。
2.3.2 清除1,1-二苯基-苦肼基自由基(DPPH·)的能力
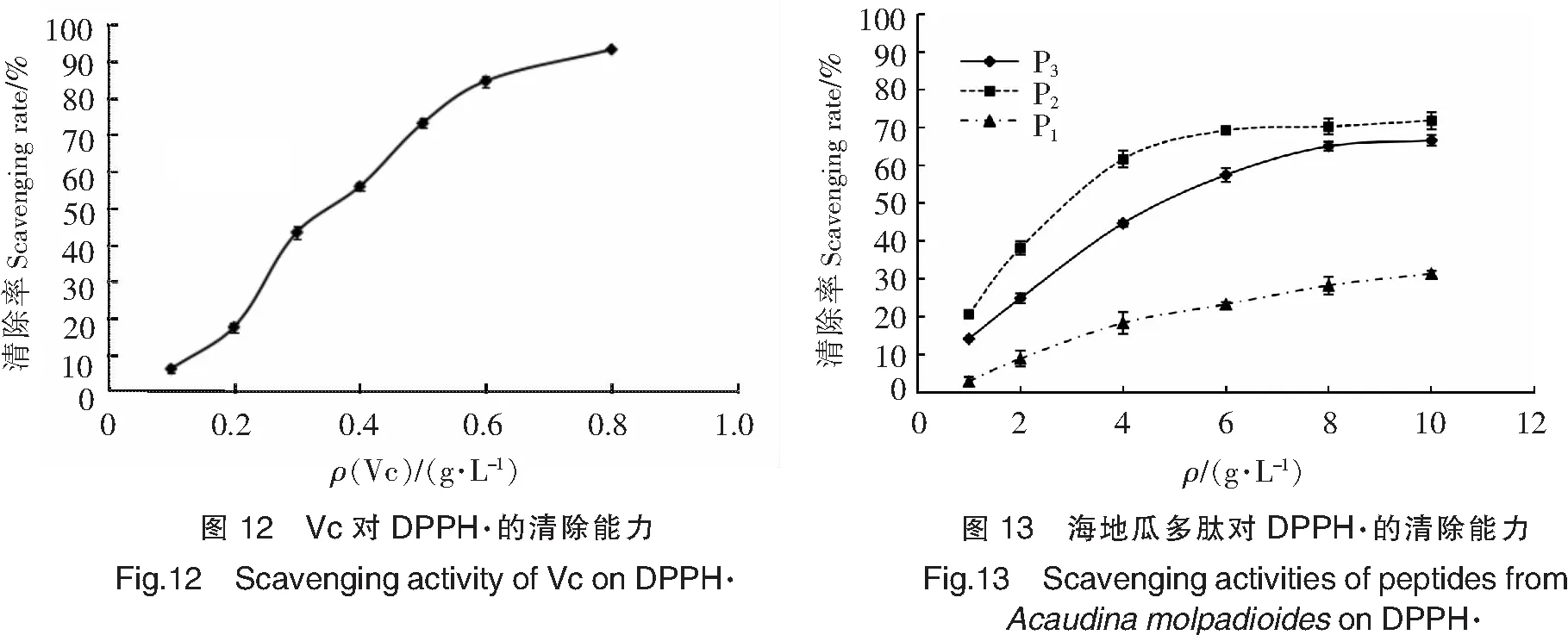
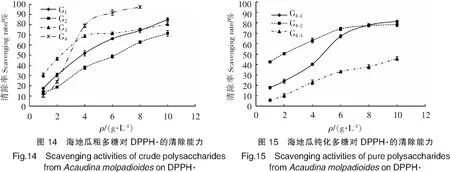
由图12可以看出,Vc在较低的质量浓度下表现出很强的DPPH·清除能力,而且随质量浓度增加,增幅较大。对比图13—图15可以看出,海地瓜多肽、粗多糖和纯化多糖组分的DPPH·清除能力均随质量浓度升高而增强,但是均低于Vc。海地瓜不同分子质量段多肽中,P2的DPPH·清除能力最强,在1~4 g/L范围内清除率迅速增大,之后保持很小幅度缓慢增大。海地瓜粗多糖中,G4在低质量浓度时表现出的DPPH·清除能力较弱,2~4 g/L范围内DPPH·清除率迅速升高,从(24.02±1.22)% 增至(79.11±1.72)%,之后一直保持最强的DPPH·清除能力。3种海地瓜纯化多糖中,G4-2的DPPH·清除能力最强,且在较低质量浓度1 g/L时,DPPH·清除率已达到(42.56±1.04)%,但增长趋势相对比较平缓。与·OH清除能力类似,G4-3的DPPH·清除能力最弱。
3 结论
1)本实验中选用胰蛋白酶对海地瓜体壁干粉进行一次酶解,在料液比(m/V)1∶40、加酶量2.4%、 pH 7.5、酶解温度45 ℃的条件下酶解8 h。然后通过截留分子质量10 ku的超滤膜分离得到海地瓜多肽,提取率达到(29.602±1.012)%。选用中性蛋白酶和木瓜蛋白酶复合使用进行二次酶解:先加入7%的中性蛋白酶,45 ℃酶解温度下酶解4 h;再加入8%的木瓜蛋白酶,60 ℃酶解温度下酶解4 h,整个过程pH值均为7.0,多糖提取率达到(14.511±0.162)%。
2)本实验中得到的最佳超滤条件为:操作压力为0.20 MPa,料液质量分数为6%,操作温度为35 ℃。按照从大分子质量到小分子质量的顺序对海地瓜多肽进行超滤分级,得到3个不同分子质量段的海地瓜多肽: P1(5~10 ku,48.47%),P2(1~5 ku,18.46%),P3(<1 ku,33.07%)。按照从小分子质量到大分子质量的顺序对海地瓜多糖进行超滤分级,得到4个不同分子质量段的海地瓜粗多糖: G1(<10 ku,63.09%),G2(10~100 ku,7.24%),G3(100~200 ku,4.67%),G4(>200 ku,25.00%)。
3)采用Q-Sepharose-Fast-Flow阴离子交换柱层析法对G4进行纯化,在0,0.5,1.5 mol/L洗脱盐浓度下,得到3种多糖组分G4-1、 G4-2和 G4-3。透析除盐、冷冻干燥得到乳白色棉絮状多糖样品。
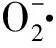
[]
[1]玉麟.中国动物志:棘皮动物门海参纲[M].北京:科学出版社,1997.
[2]王方国,张海生,周怀阳.海地瓜的营养成分及其开发利用设想[J].中国海洋药物,1998,66(2):52-54.
[3]伏纬华,吴凤梧,戚宝凤,等.海地瓜的研究-Ⅱ:海地瓜与黄玉海参营养成分的比较[J].中国海洋药物,1994,51(3):28-30.
[4]TAKASHI H,NOBUHIRO Z,KYOKO Y,et al.Recent advances in researches on physiologically active substances in holothurians[J].Journal of Ocean University of China,2005,4(3):193-197.
[5]LIU X,SUN Z,ZHANG M,et al.Antioxidant and antihyperlipidemic activities of polysaccharides from sea cucumberApostichopusjaponicus[J].Carbohydrate Polymers,2012,90(4):1664-1670.DOI:10.1016/j.carbpol.2012.07.047.
[6]LUO L,WU M,XU L,et al.Comparison of physicochemical characteristics and anticoagulant activities of polysaccharides from three sea cucumbers[J].Marine Drugs,2013,11(2):399- 417.
[7]CHOO P S.Population status,fisheries and trade of sea cucumbers in Asia[J].Fao Fisheries & Aquaculture Technical Paper,2008,5(16):81-118.
[8]PURCELL S W.Value,market preferences and trade of Bechedemer from Pacific Island sea cucumbers[J].Plos One,2014,9(4):1-8.
[9]BORDBAR S,ANWAR F,SAARI N.High-value components and bioactives from sea cucumbers for functional foods:a review[J].Marine Drugs,2011,9(10):1761-1805.DOI:10.3390/md9101761.
[10]KARIYA Y,MULLOY B,IMAI K,et al.Isolation and partial characterization of fucan sulfates from the body wall of sea cucumberStichopusjaponicusand their ability to inhibit osteoclastogenesis[J].Carbohydrate Research,2004,339(7):1339-1346.DOI:10.1016/j.carres.2004.02.025.
[11]WU M,XU S,ZHAO J,et al.Physicochemical characteristics and anticoagulant activities of low molecular weight fractions by free-radical depolymerization of a fucosylated chondroitin sulphate from sea cucumberThelenataananas[J].Food Chemistry,2010,122(3):716-723.
[12]WANG Y,SU W,ZHANG C,et al.Protective effect of sea cucumber(Acaudinamolpadioides) fucoidan against etha-nol-induced gastric damage[J].Food Chem,2012,133(4):1414-1419.DOI:10.1016/j.foodchem.2012.02.028.
[13]刘程惠,朱蓓薇,董秀萍,等.海参酶解产物的分离及其体外抗氧化作用的研究[J].食品与发酵工业,2007,33(9):50-53.
[14]LI Z,WANG H, LI J,et al.Basic and clinical study on the antithrombotic mechanism of glycosaminoglycan extracted from sea cucumber[J].Chinese Medical Journal,2000,113:8-13.
[15]ALTHUNIBAT O Y,HASHIM R B,TAHER M,et al.Invitroantioxidant and antiproliferative activities of three Malaysian sea cucumber species[J].European Journal of Scientific Research,2009,37(3):376-387.
[16]PAN S K,YAO D R,ZHOU M Q,et al.Hydroxyl radical scavenging activity of peptide from sea cucumber using enzyme complex isolated from the digestive tract of sea cucumber[J].African Journal of Biotechnology,2012,11(5):1214-1219.DOI:10.5897/AJB11.2578.
[17]LIU C H,WANG X J,YUAN W P,et al.Anti-fatigue and immune functions of sea cucumber oral liquid[J].Modern Food Science and Technology,2009,25(10):1115-1119.
[18]MAMELONA J,SAINT L R,PELLETIER E.Nutritional composition and antioxidant properties of protein hydrolysates prepared from echinoderm by products[J].International Journal of Food Science & Technology,2010,45(1):147-154.DOI:10.1111/j.1365-2621.2009.02114.x.
[19]DUBOIS M, GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Biochemistry,1956,28(3):350-356.
[20]LOWRY O H,ROSEBROUGH N J ,FARR A L ,et al.Protein measurement with the Folin phenol reagent[J].Biological Chemistry,1951,193:265-275.
[21]陈山,杨晓泉,郭祀远,等.大豆肽超滤分离纯化过程的研究[J].食品与发酵工业,2003,29:49-52.
[22]厉朝龙.生物化学与分子生物学实验技术[M].杭州:浙江大学出版社,2003:16-22.
[23]李贵荣.枸杞多糖的提取及其对活性氧自由基的清除作用[J].中国现代应用药学杂志,2002,19(2):94-96.
[24]梁引库.黄精多糖的脱色和脱蛋白及体外抗氧化活性研究[J].江苏农业科学,2013,41(5):240-243.
[25]张娅,李宝才.松茸多糖超声提取物抗氧化活性研究[J].化学与生物工程,2011,28(9):75-82.
[26]HATANO T,KAGAWA H,YASUHARA T ,et al.Two new flavonoids and other constituents in licorice root:their relative astringency and radical scavenging effects[J].Chemistry of Pharmacology Bulletin,1988,36(6):2090-2097.DOI:10.1248/cpb.36.2090.
[27]WU H,CHEN H,SHIAU C.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel (Scomberaustriasicus)[J].Food Research International,2003,36(9):949-957.DOI:10.1016/S0963-9969(03)00104-2.
[28]冯骏.海参多糖的分离纯化与化学组成的研究[D].厦门:集美大学,2014.
[29]展学孔,周海妹,马小花,等.海参多糖提取新工艺[J].中国实验方剂学杂志,2011,17(15):40- 42.
[30]冀利,孙曙光,孙玖玉,等.从浓缩枣汁超滤截留液中提取金丝小枣多肽和多糖[J].山东食品发酵,2013,168(1):3-10.
[31]罗晓航.PEF结合酶法提取鲍鱼脏器粗多糖及其抗氧化活性研究[D].福州:福建农林大学,2012.
[32]李霞,张峰,李永才,等.兰州百合不同部位多糖含量及抗氧化活性的比较[J].食品工业科技,2012(24):88-91.
