黄姑鱼(Nibea albiflora)gsdf基因的克隆及表达分析
2018-05-29韩兆方李完波林爱强崔晓莹王志勇
孙 莎,韩兆方,李完波,叶 坤,林爱强,崔晓莹,王志勇
(1.集美大学水产学院,福建 厦门 361021;2.农业部东海海水健康养殖重点实验室,福建 厦门 361021)
0 引言
长期以来,性别一直是生命科学领域研究的热点命题。鱼类在动物系统进化中处于承前启后的地位,其物种数量占已知脊椎动物的1/2以上[1],因而其性别决定的遗传基础及其机制研究一直广受关注。大量研究表明,脊椎动物的性别异型主要是进化过程中的遗传选择造成的[2],是胚胎、幼体和成体发育生长过程中基因差异表达的产物[3]。与控制其他组织生长发育的基因相比,涉及性腺分化发育的基因呈现明显的多变性和可塑性[4]。
随着研究的不断深入,鱼类性别的关键基因除了转录因子家族中的“明星基因”,如sry基因[5]和dmrt1基因[6]等,很多非转录因子家族的基因也被发现在性别决定中起着非常重要的作用。其中转化生长因子β超家族(TGF-β)的成员在性别分化和发育过程中发挥着举足轻重的作用,如吕宋青鳉(Oryziasluzonensis)[7]和裸盖鱼(Anoplopomafimbria)[8]中的gsdf基因,银汉鱼(Odontestheshatcheri)中的amhy基因[9],红鳍东方鲀(Takifugurubripes)中的amhrⅡ基因[10]以及罗非鱼Y染色体上重复的amh基因[11]等。TGF-β超家族成员在细胞生长、分化、凋亡及细胞动态平衡等方面发挥重要作用,其中bmp(bone morphogenetic proteins)、amh(antimüllerian hormone)等基因均涉及脊椎动物性腺的分化过程[12]。gsdf(gonadal soma derived factor)基因作为TGF-β超家族中的一种细胞因子,最先在虹鳟(Oncorhynchusmyliss)的原始生殖细胞(primordial germ cell,简称PGC)中被分离鉴定。在孵化后40d的虹鳟胚胎中,gsdf基因特异地在其性腺细胞表达,该基因对于维持虹鳟原始生殖细胞和精原细胞的正常增殖发育具有重要作用[13]。Yasushi等人[14]以寻找dmy基因下游的靶基因为目的构建了青鳉各个发育时期的cDNA文库,并从中筛选出与虹鳟gsdf基因同源的下游基因。为了进一步揭示gsdf基因在青鳉性别分化中的作用,Yasushi等人成功克隆了青鳉的gsdf基因并检测了该基因在青鳉发育各个时期的表达模式,研究结果表明gsdf基因在雄性青鳉的胚胎中高表达,而雌性个体中几乎不表达,性逆转的雄性个体中gsdf基因表达明显下降。随后在吕宋青鳉(O.luzonensis)中,gsdf被发现取代了dmy成为该物种的性别决定主效基因[13]。该研究结果再次揭示和肯定了gsdf基因在鱼类性别分化过程的重要角色。利用CRISPR/Cas9技术靶向敲除罗非鱼中的gsdf基因,导致遗传雄性(XY)的个体发生性逆转,过表达gsdf基因致使遗传为雌性(XX)个体的性腺发育为精巢,表明gsdf基因在罗非鱼的性别决定中也发挥了关键的作用[15]。因此,探索gsdf基因在鱼类性别决定通路中的角色,对解析性别决定和分化的分子机理具有重要意义。
黄姑鱼(Nibeaalbiflora)隶属于鲈形目(Perciforms)、石首鱼科(Sciaenidae)、黄姑鱼属(Nibea),主要分布在我国沿海、朝鲜半岛及日本南部海域[16]。黄姑鱼表现出显著的雌雄二态生长模式,15月龄黄姑鱼的雌性个体体重约是雄性个体的1.3倍[17],开展全雌化养殖,可望在不增加养殖量的情况下大幅度提高产量。高效地挖掘和筛选黄姑鱼性别决定分化相关基因并探讨其基因功能对于阐明黄姑鱼性别决定的分子机理具有重要意义。本研究拟克隆黄姑鱼gsdf基因的ORF序列全长,利用实时荧光定量PCR技术进一步检测和分析该基因在不同组织和不同发育时期性腺中的表达情况,以期为阐明黄姑鱼的性别决定和分化机理提供基础资料。
1 材料与方法
1.1 实验材料
实验所用的黄姑鱼均为人工养殖个体,采自福建省宁德市金铃水产科技有限公司。其中26日龄至390日龄的样品均为2016年3月繁育的鱼苗,育苗期间水温22~25 ℃,盐度为25~31。成鱼(540日龄)为性成熟但未产卵的样品,系来自2015年秋季繁育的鱼苗。
黄姑鱼遗传性别鉴定的材料取自于其鳍条组织,置于95%的乙醇中,-20 ℃保存备用。基因克隆的材料取自于性成熟黄姑鱼的性腺组织,组织表达分析的材料取自于性成熟黄姑鱼的性腺、肌肉、脾脏、胃、心脏、肝脏、脑、肾、眼和头肾,不同发育阶段的材料分别取自孵化后26 d、37 d、40 d、49 d、64 d、93 d、120 d、180 d(6月龄)、240 d(8月龄)、390 d(13月龄)及540 d(18月龄,性腺已发育成熟)的黄姑鱼,这些材料置于RNA保护液中,-80 ℃保存备用。
1.2 实验试剂
DNA提取试剂盒购自上海捷瑞生物工程有限公司;DNA凝胶回收试剂盒、GoScriptTMReverse Transcription System (Promega)购自上海泰京生物技术有限公司;Trans Zol Up Plus RNA Kit、感受态细胞DH5α购自北京全式金生物技术有限公司;TaqDNA聚合酶、pMD19-T、SYBR©Premix Ex TaqTMⅡ试剂盒购自宝生物工程(大连)有限公司(TaKaRa);引物由华大基因合成。
1.3 实验方法
1.3.1 黄姑鱼遗传性别鉴定
由于幼小的黄姑鱼个体无法通过外部形态与性腺组织学观察辨别其雌雄,需要通过提取基因组DNA并利用本实验室开发的黄姑鱼性别特异分子标记引物(见表1)对其进行遗传性别鉴定[18]。PCR产物经琼脂糖凝胶电泳检测判定:遗传雄性黄姑鱼个体能检测到一条258 bp的条带,而遗传雌性黄姑鱼个体没有扩增条带。
1.3.2 总RNA提取及cDNA链的合成
使用Trans Zol Up Plus RNA Kit试剂盒进行RNA提取,使用GoScriptTMReverse Transcription System (Promega)试剂盒按照其说明书合成cDNA的第一条链,后用内参基因β-actin引物(序列见表1)检测反转录效果。

表1 基因克隆和荧光定量所用到的引物
1.3.3 黄姑鱼gsdf基因的克隆
利用生物信息学方法从本实验室的黄姑鱼性腺转录组学研究数据中获得gsdf的开放阅读框序列,根据拼接的参考序列设计引物gsdf-orf-F/R(序列见表1),以黄姑鱼成鱼的性腺cDNA为模板扩增gsdf的开放阅读框片段。产物经琼脂糖凝胶电泳验证后,利用DNA回收试剂盒纯化回收并连入pMD19-T载体,转化到大肠杆菌DH5α感受态细胞中,挑取阳性克隆送到华大基因有限公司进行测序。用DNAMAN软件对测序所得数据和参考序列进行比对分析,并使用Primer Premier 5.0软件(http://www.premierbiosoft.com/)设计荧光定量PCR引物gsdf-F/R(序列见表1)。
1.3.4gsdf基因的生物信息学分析
分析蛋白质的物理参数:http://web.expasy.org/cgi-bin/protparam/protparam;
预测信号肽:http://www.cbs.dtu.dk/services/SignalP/;
分析蛋白质结构域:用NCBI的Conserved Domains(CD-Search)程序;
序列同源性分析:DNAMAN软件;
氨基酸多重序列比对:BioEidt软件;
构建系统进化树:MEGA 5.0软件(邻接法,Neighbor-Joining,NJ)。
1.3.5实时荧光定量PCR
选择β-actin基因为内参基因(引物为β-actin-F/R,序列见表1),使用LightCycler 480 (Roche,USA)荧光定量PCR仪,按照SYBR Premix Ex Taq Ⅱ试剂盒使用说明,采用qRT-PCR检测gsdf基因在不同组织和不同发育时期的表达情况(引物gsdf-F/R序列见表1),每个样品做3个重复。
1.3.6 数据处理
对实时荧光定量PCR结果,采用2-ΔΔCt方法计算每个样品目的基因的相对表达量,利用t-检验分析比较各组织不同性别中gsdf基因的雌雄表达量差异。
2 结果
2.1 遗传性别鉴定
对无法辨别性别的苗期个体进行遗传性别鉴定的结果如图1所示。由图1可知,遗传雄性个体可以检测到1条258 bp左右的特异条带,而遗传雌性个体则没有扩增条带。

2.2 gsdf基因的结构
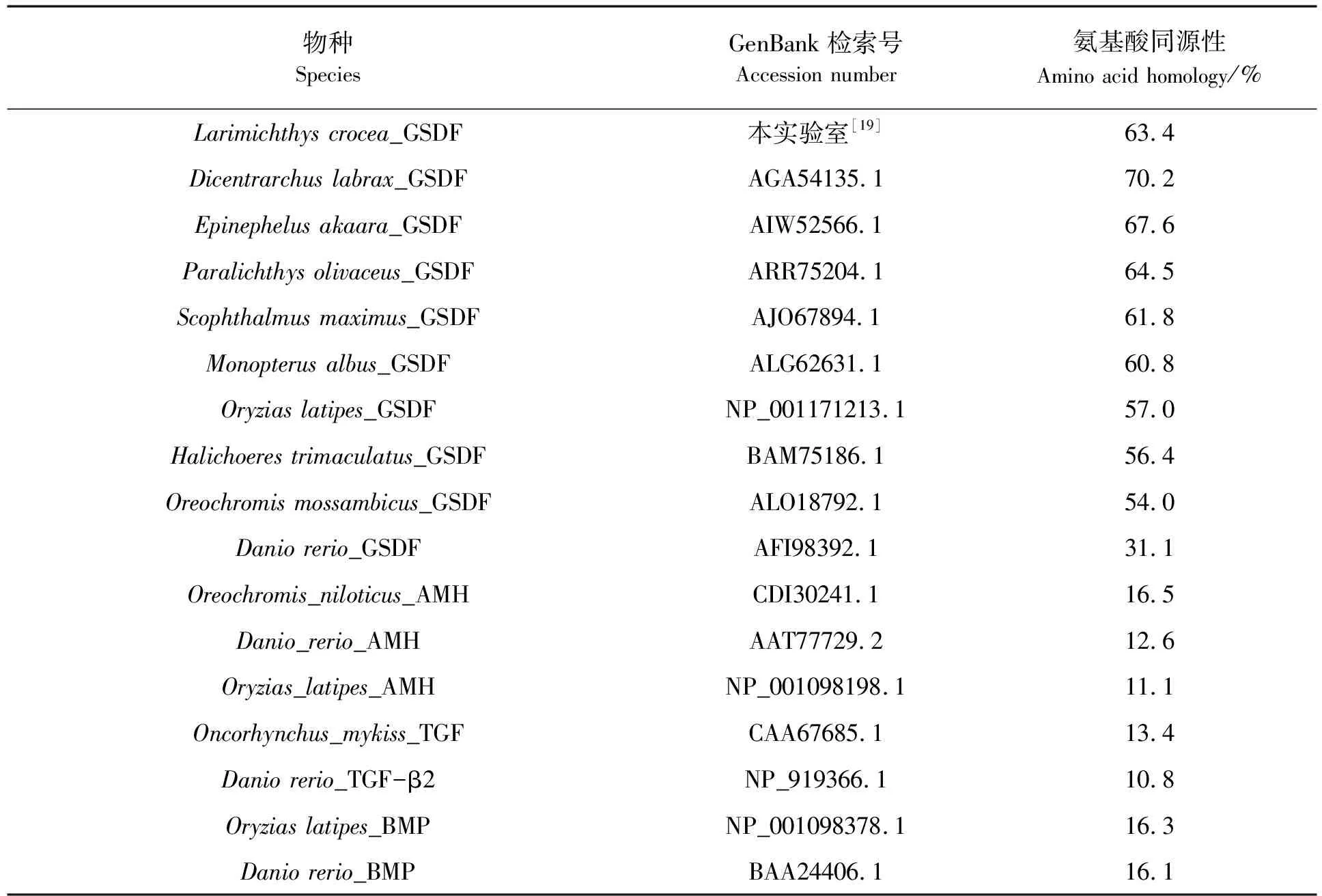
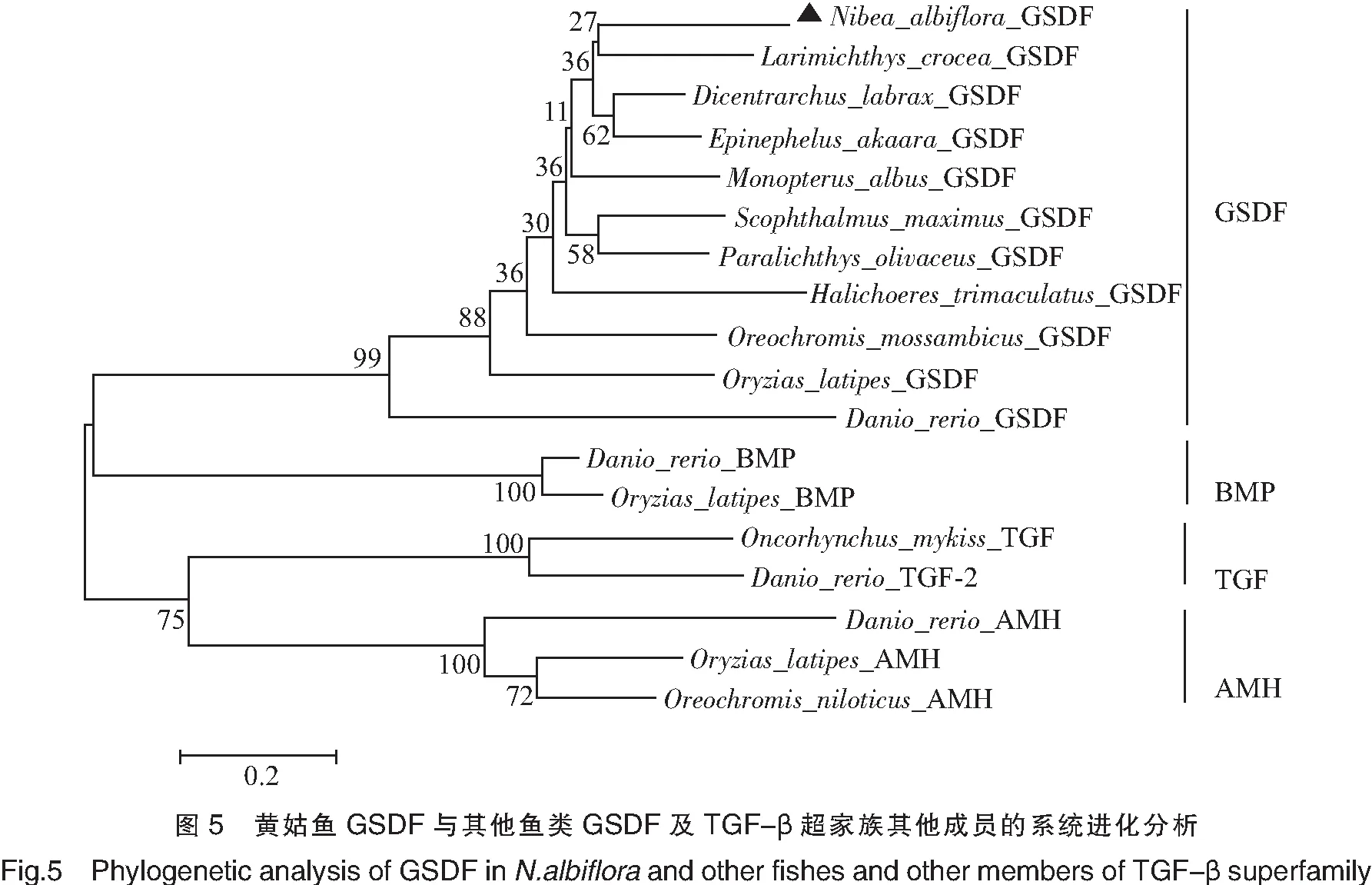
克隆获得黄姑鱼gsdf基因ORF长度为648 bp,编码215个氨基酸(见图2),预测蛋白质相对分子质量为22820.76 u,理论等电点(isoelectric point,pI)为5.22。黄姑鱼的gsdf与GenBank中可查到基因组序列的其他7种鱼类的gsdf基因一样,均包含5个外显子和4个内含子(见图3)。黄姑鱼gsdf编码蛋白有一个信号肽,包含19个氨基酸(图2中深色方框所示)。图4为用ClustalW对12种不同鱼类GSDF氨基酸序列进行比对的结果,TGF-β超家族保守结构域位于黄姑鱼GSDF第114-204氨基酸处,图4中星号标注为9个保守的半胱氨酸残基。表2为黄姑鱼GSDF与其他10种鱼类GSDF、以及几种鱼类AMH、TGF-β或BMP氨基酸序列比较分析的结果,从表2中可见:黄姑鱼GSDF与鲈鱼GSDF同源性最高,达70.2%;其次是石斑鱼(67.6%)和牙鲆(64.5%),与同属于石首鱼科的大黄鱼GSDF同源性为63.4%,与斑马鱼GSDF的同源性最低(只有31.1%),与鱼类TGF-β及AMH、BMP等其他TGF-β超家族成员的同源性则均低于20%。系统进化树(见图5)分析结果显示各种鱼类的GSDF同聚为一枝,而TGF-β超家族的其他成员分别聚为一枝;在GSDF分枝内部,黄姑鱼GSDF与大黄鱼GSDF首先聚合为同一个小分枝,显示两者的亲缘关系最近,而与斑马鱼的亲缘关系最远。



表2 黄姑鱼GSDF氨基酸序列与其他鱼类GSDF及TGF-β超家族其他成员的同源性分析
物种SpeciesGenBank检索号Accession number氨基酸同源性Amino acid homology/%Larimichthys crocea_GSDF本实验室[19]63.4Dicentrarchus labrax_GSDFAGA54135.170.2Epinephelus akaara_GSDFAIW52566.167.6Paralichthys olivaceus_GSDFARR75204.164.5Scophthalmus maximus_GSDFAJO67894.161.8Monopterus albus_GSDFALG62631.160.8Oryzias latipes_GSDFNP_001171213.157.0Halichoeres trimaculatus_GSDFBAM75186.156.4Oreochromis mossambicus_GSDFALO18792.154.0Danio rerio_GSDFAFI98392.131.1Oreochromis_niloticus_AMHCDI30241.116.5Danio_rerio_AMHAAT77729.212.6Oryzias_latipes_AMHNP_001098198.111.1Oncorhynchus_mykiss_TGFCAA67685.113.4Danio rerio_TGF-β2NP_919366.110.8Oryzias latipes_BMPNP_001098378.116.3Danio rerio_BMPBAA24406.116.1
2.3 gsdf基因在不同组织和不同发育阶段的表达分析
2.3.1 不同组织中的表达情况
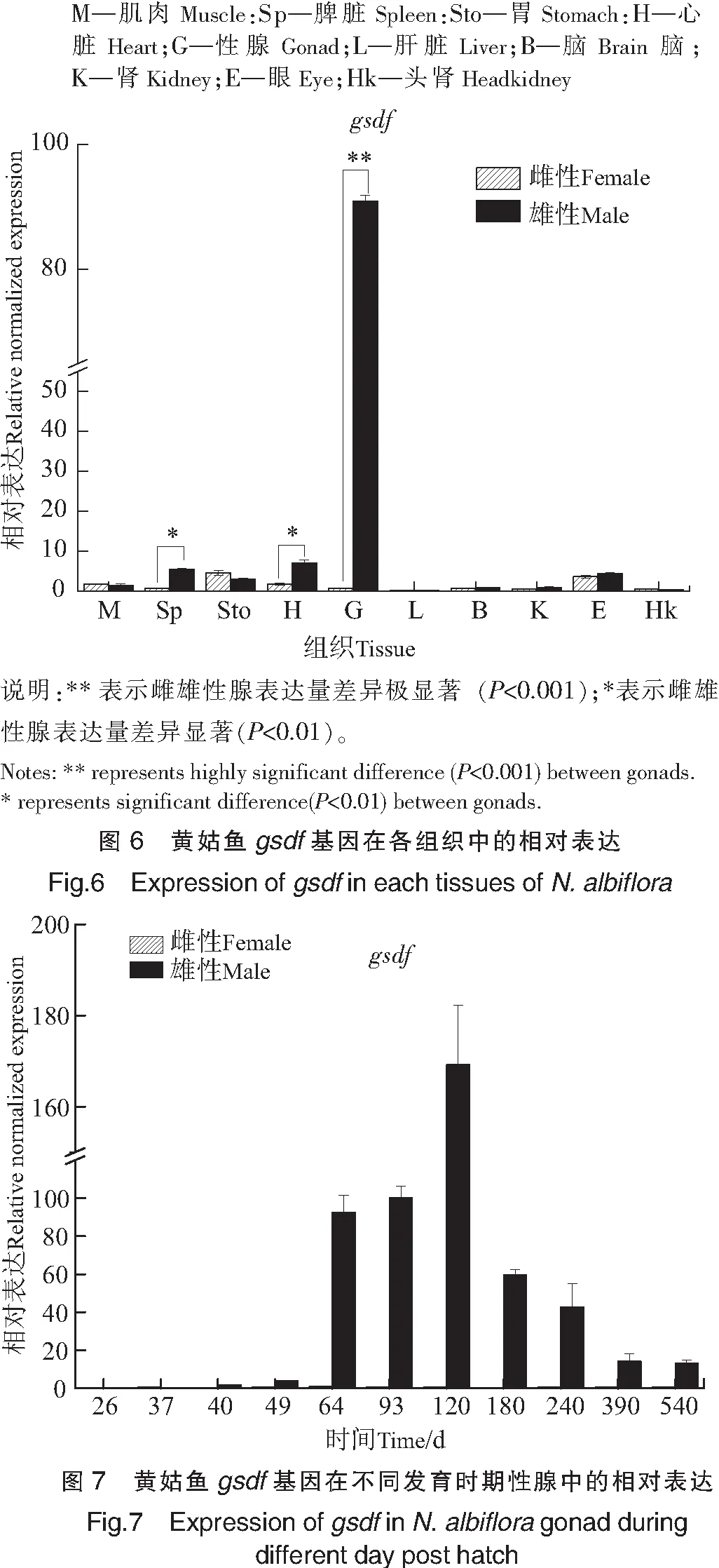
以β-actin基因为内参,利用实时荧光定量PCR检测黄姑鱼gsdf基因在性腺、心脏、肝脏、脾脏、肾、胃、脑、肌肉、眼和头肾共10个组织中的表达情况。结果如图6所示,黄姑鱼gsdf基因主要集中在精巢中表达,其表达量远远高于卵巢(P<0.001)。在雄鱼的心脏、脾脏、眼、胃中也有比较明显的表达,但与精巢相比其表达量都很低,其他组织中的表达量更低,肝脏中完全没有检测到表达;雌性黄姑鱼各组织中gsdf的表达量都很低,除了在肌肉、胃和眼中的表达量与雄鱼相近外,在肾脏、脑和卵巢中都只有痕量表达,在心脏和脾脏中的表达量也显著低于雄性(P<0.01)。
2.3.2 不同发育时期性腺中的表达情况
利用实时荧光定量PCR检测gsdf基因在黄姑鱼不同发育时期性腺中的表达量(见图7),结果进一步显示了该基因在雄性精巢中高表达的性别特异性表达特征。其中gsdf基因从孵化后第40天在雄鱼性腺中开始表达,第49天后表达量快速升高,在孵化后第120天表达量达到高峰,随后开始下降,在第180天时的表达量只有第120天时的35.3%,到第390天时表达量只有第120天时的8.3%,之后到第540天表达量基本保持稳定。在整个发育过程中gsdf基因在卵巢中的表达量相对极低,几乎检测不到其表达。
3 讨论
已有的研究表明,控制脊椎动物性腺发育的基因及机制具有多变性和可塑性,往往那些本不参与性别决定的基因可能通过基因复制或突变等途径跨越基因遗传的层级而被招募成为新的性别决定开关基因[20],导致在分类地位上相近、甚至同一个属不同物种的鱼类其性别决定的基因都可能不一样(如O.latipes[21]与O.luzonensis[22])。因此,每一个参与性别决定分化及发育的基因都具有深入剖析和研究的意义。
本研究首次克隆了黄姑鱼gsdf基因,序列比对和同源性分析的结果显示,黄姑鱼gsdf基因具有TGF-β超家族保守功能结构域和9个保守的半胱氨酸残基,提示这些半胱氨酸残基对于维持TGF-β超家族蛋白质的空间结构和行使其生理功能具有极其重要的作用。系统进化分析发现黄姑鱼gsdf基因同其他物种gsdf基因聚为一枝,明显有别于TGF-β超家族的其他成员,由此可以推测黄姑鱼gsdf与其他物种的gsdf有着同样或相似的功能。有趣的是黄姑鱼与大黄鱼同属于石首鱼科,但其gsdf的氨基酸序列与大黄鱼的相似性却低于与鲈鱼、石斑鱼和牙鲆的相似性,这一方面说明分类地位很近的物种之间其基因和所编码的蛋白质氨基酸序列除了与功能密切相关的区域外,其余区域也可以有较大的变化和差异,另一方面是否也暗示黄姑鱼与大黄鱼的gsdf之间存在着具体功能上的差别,值得进行比较研究。荧光定量PCR检测发现黄姑鱼gsdf基因在雄鱼精巢中表现为特异性高表达,除性腺外,gsdf基因在心脏、脾脏、胃、眼和肌肉等其他器官/组织中也能检测到一定量的表达,雌鱼胃、眼、肌肉、心脏、脾脏等中也能检测到少量的表达。作为TGF-β超家族的一员,这个结果与TGF-β超家族的成员对于细胞增殖分化、胚胎发育等多方面都起着重要作用的研究结论相一致,另一方面也提示该基因不太可能是黄姑鱼性别决定的关键起始基因。组织学研究结果表明孵化后第36天为黄姑鱼性别决定的关键时期,孵化后第61天在雄性黄姑鱼中可观察到无限性小叶组织的存在,标志着黄姑鱼雄性精巢开始分化[23]。本研究发现黄姑鱼gsdf基因在精巢未分化,孵化后第40天在雄鱼性腺中开始有明显表达,孵化后第49天表达量迅速升高,到孵化后第120天表达量达到高峰,此时黄姑鱼精巢已分化完成,正处于其快速发育和精原细胞快速增殖的阶段。之后随着精巢发育成型,gsdf基因的表达量显著下降,但在精巢发育成熟之后仍保持着一定的表达量。这些结果提示gsdf基因与黄姑鱼雄性性别分化与发育过程密切相关,同时对于维持精巢的继续发育也有重要作用,因为黄姑鱼生殖细胞是分批成熟,在整个生活史中性腺首次发育成熟后,仍然不断有新的生殖细胞生成与发育,但具体的作用机制,还有待今后深入研究。研究[19]表明大黄鱼精巢的gsdf基因在孵化后第41天检测有明显表达,孵化后第49天表达量显著升高,孵化后第123天达到高峰,随后表达量逐渐下降,到精巢发育成熟后gsdf基因的表达量下降到只有第123天的10%左右,而在雌鱼性腺中的表达量远远低于雄鱼性腺。与大黄鱼不同的是,黄姑鱼雌鱼在整个性腺分化、发育与成熟过程中gsdf基因都几乎检测不到其表达,或只有极少量的表达,其表达的性别特异性比大黄鱼更加明显,这也显示出两种鱼之间的差异。关于什么是黄姑鱼性别决定的关键起始基因,gsdf基因在黄姑鱼性别决定和分化中的角色和具体功能是什么,还需进一步研究阐明。本文为深入研究黄姑鱼性别决定、发育与分化的分子机制提供了有益的资料。
[]
[1]LONG J A.The rise of fishes :500 million years of evolution[M].Baltimore,Margland,U.S.:Johns Hopkins University Press,2011.
[2]BONDURIANSKY R,CHENOWETH S F.Intralocus sexual conflict[J].Trends in Ecology & Evolution,2009,24(5):280-288.
[3]WILLIAMS T M,CARROLL S B.Genetic and molecular insights into the development and evolution of sexual dimorphism[J].Nature Reviews Genetics,2009,10(10):797-804.
[4]HERPIN A,SCHARTL M.Plasticity of gene-regulatory networks controlling sex determination:of masters,slaves,usual suspects,newcomers,and usurpators[J].Embo Reports,2015,16(10):1260-1274.
[5]SINCLAIR A H,BERTA P,PALMER M S,et al.A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif[J].Nature,1990,346(6281):240-244.
[6]MATSUDA M,NAGAHAMA Y,AI S,et al.DMY is a Y-specific DM-domain gene required for male development in the medaka fish[J].Nature,2002,417(6888):559-563.
[7]MYOSHO T,OTAKE H,MASUYAMA H,et al.Tracing the emergence of a novel sex-determining gene in medaka,Oryziasluzonensis[J].Genetics,2012,191(1):163-170.
[8]RONDEAU E B,MESSMER A M,DAN S S,et al.Genomics of sablefish(Anoplopomafimbria):expressed genes,mitochondrial phylogeny,linkage map and identification of a putative sex gene[J].BMC Genomics,2013,14(1):452-470.
[9]HATTORI R S,STRSSMANN C A.A Y-linked anti-Müllerian hormone duplication takes over a critical role in sex determination[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(8):2955-2959.
[10]KAMIYA T,KAI W,TASUMI S,et al.A trans-species missense SNP in Amhr2 is associated with sex determination in the tiger pufferfish,Takifugurubripes(Fugu)[J].Plos Genetics,2012,8(7):e1002798.
[11]LI M,SUN Y,ZHAO J,et al.A tandem duplicate of anti-müllerian hormone with a missense SNP on the Y chromosome is essential for male sex determination inNiletilapia,Oreochromisniloticus[J].PLoS Genetics,2015,11(11):e1005678.
[12]HAQQ C M,DONAHOE P K.Regulation of sexual dimorphism in mammals[J].Physiological Reviews,1998,78(1):1-33.
[13]SAWATARI E,SHIKINA S,TAKEUCHI T,et al.A novel transforming growth factor-beta superfamily member expressed in gonadal somatic cells enhances primordial germ cell and spermatogonial proliferation in rainbow trout(Oncorhynchusmykiss)[J].Developmental Biology,2007,301(1):266-275.
[14]SHIBATA Y,PAUL-PRASANTH B,SUZUKI A,et al.Expression of gonadal soma derived factor (gsdf) is spatially and temporally correlated with early testicular differentiation in medaka[J].Gene Expression Patterns Gep,2010,10(6):283-289.
[15]JIANG D N,YANG H H,LI M H,et al.gsdfis a downstream gene of dmrt1 that functions in the male sex determination pathway of theNiletilapia[J].Molecular Reproduction & Development,2016,83(6):497-508.
[16]朱元鼎.中国石首鱼类分类系统的研究和新属新种的叙述[M].上海:上海科学技术出版社,1963.
[17]徐冬冬,詹炜,楼宝,等.网箱养殖黄姑鱼生长特性初步研究[J].渔业现代化,2010,37(5):34-36.
[18]SUN S,LI W B,XIAO S J,et al.Genetic sex identification and the potential sex determination system in the yellow drum(Nibeaalbiflora)[J].Aquaculture,DOI:10.1016/j.aquaculture.2018.03.042.
[19]林爱强,谢仰杰,徐双斌,等.大黄鱼gsdf和amh基因的克隆及表达分析[J].南方水产科学,2017,13(6):1-13.
[20]SCHARTL M.Sex chromosome evolution in non-mammalian vertebrates[J].Current Opinion in Genetics & Development,2004,14(6):634-641.
[21]MATSUDA M,NAGAHAMA Y,SHINOMIYA A,et al.DMY is a Y-specific DM-domain gene required for male development in the medaka fish[J].Nature,2002,417(6888):559-563.
[22]MYOSHO T,OTAKE H,MASUYAMA H,et al.Tracing the emergence of a novel sex-determining gene in medaka,Oryziasluzonensis[J].Genetics,2012,191(1):163-170.
[23]LOU B,XU D,GENG Z,et al.Histological characterization of gonadal sex differentiation inNibeaalbiflora[J].Aquaculture Research,2016,47(2):632-639.
