RUNX1-RUNX1T1阳性儿童急性髓细胞白血病融合转录本动态监测的临床意义
2018-05-28陆继冉赵晓曦张瑞东郑胡镛
陆继冉 高 超 赵晓曦 李 君 侯 贝 李 静 张瑞东 郑胡镛
儿童急性髓细胞白血病(AML)中近一半有染色体易位[1],其中t(8;21)(q22;q22.1) 约占12%[2],该易位可形成RUNX1-RUNX1T1融合基因,多见于FAB分型中的M2型[3]。既往研究认为,AML中RUNX1-RUNX1T1融合基因阳性是预后较好的生物学标志,但由于AML存在高度异质性,该融合基因阳性患儿中仍有30%~50%复发[4]。目前已有研究采用实时荧光定量PCR(RQ-PCR)技术动态监测AML患儿RUNX1-RUNX1T1转录本(融合转录本)水平,将其作为微小残留病(MRD)而评估治疗反应并预测预后。意大利儿童血液肿瘤协作组(AIEOP)的研究,纳入了49例采用AIEOP AML 2002/01方案治疗的RUNX1-RUNX1T1+AML患儿,第2次诱导治疗结束后融合转录本下降水平与累积复发率(CIR)呈负相关[5];我国Zhang等[6]的研究纳入70例采用DAH方案或AML-99方案诱导治疗的RUNX1-RUNX1T1+AML患儿,第1次诱导治疗结束后融合转录本下降>1.8 log水平者预后较好。提示在不同治疗方案背景下,对预后有预测价值的融合转录本的评价时间点和标准可能存在差异。本文对首都医科大学附属北京儿童医院(我院)2006年10月至2015年3月收治的采用BCH-AML 05方案治疗的RUNX1-RUNX1T1+AML患儿行融合转录本水平的动态观察并分析影响预后因素。
1 方法
1.1 研究设计 回顾性队列研究。收集采用BCH-AML 05方案治疗RUNX1-RUNX1T1+AML患儿的连续样本,对不同时间点(TP0~TP5)RUNX1-RUNX1T1融合转录本水平进行定量检测,以2017年12月31日为统一随访终点,分析预后与不同时间点融合转录本水平的相关性。
1.2 知情同意 本研究行融合转录本水平检测及资料收集均取得患儿监护人的知情同意。
1.3 纳入标准 于2017年11月1日从我院病历查询系统中检索,2006年10月1日至2015年3月31日在我院治疗并经MICM分型确诊伴有RUNX1-RUNX1T1+的全部AML患儿。同时收集在我院生物样本库中相应患儿骨髓样本。
1.4 BCH-AML 05方案和危险度分层标准 ①低危组仅限于具有良好染色体核型的患儿,包括t(8;21)、inv16(16号染色体倒位)和t(9;11);②高危组包括诱导Ⅰ后骨髓幼稚细胞数>20%、核型-5(5号染色体缺失)、核型-7(7号染色体缺失)、t(6;9)、MDS(骨髓增生异常综合征)转为AML、继发AML;③中危组为介于低危和高危之间,无良好核型者。
BCH-AML 05方案见图1,包括2个诱导治疗疗程(诱导Ⅰ、Ⅱ)和3个巩固治疗疗程(巩固Ⅰ、Ⅱ、Ⅲ)。中枢神经系统白血病(CNSL)的预防采用甲氨蝶呤(MTX)、地塞米松(Dex)、阿糖胞苷(Ara-C)三联鞘注,以上每个疗程各鞘注1次。高危患儿及部分具有同胞全合供者的中危患儿,如完成巩固I并达完全缓解(CR),行异基因造血干细胞移植(allo-HSCT)。

图1 AML 05方案及RUNX1-RUNX1T1转录本检测时间点(TP0~TP5)示意图
注 ADE:阿糖胞苷+柔红霉素+依托泊苷;ACE:安丫啶+阿糖胞苷+依托泊苷;MHA:米托蒽醌+大剂量阿糖胞苷;CLASP:阿糖胞苷+左旋门冬酰胺酶;12 g、18 g是指阿糖胞苷的质量。
1.5 资料提取及分组 从病志中采集:①患儿性别、入院年龄、FAB分型等,②初诊WBC、Hb、PLT计数,③诱导Ⅰ后骨髓涂片幼稚细胞数(%),④初诊时免疫表型(流式细胞术检测),⑤TP0~TP5融合转录本的检测情况。根据不同时间点融合转录本的水平将患儿分为高表达组和低表达组,分组界值分别为每104GUS中RUNX1-RUNX1T1拷贝数104、103、102、10、1和0。
1.6 检测方法
1.6.1 流式细胞术检测免疫表型 采用直接免疫荧光标记法标记活细胞,B淋巴系列单抗包括CD10、CD19、CD20、CD22、cCD79及细胞膜表面免疫球蛋白(SmIg)等;T淋巴系列单抗包括CD2、CD3、CD5、CD7、cCD3及末端脱氧核苷酸转移酶(TdT)等;髓系列单抗包括CD11b、CD13 、CD14、CD15、CD33、CD64、CD71、CD117、CD123及髓过氧化物酶(MPO);非特异性系列单抗包括CD9、CD38、CD34及人类白细胞抗原-DR(HLA-DR)。所有单抗、仪器和软件均购自美国Becton Dickinson公司。评分标准依据欧洲白血病免疫分型协作组(EGIL)的抗原积分系统[7],当积分>2.5分或阳性细胞率>20%时,可诊断急性白血病的细胞系来源。
1.6.2 融合转录本的定量检测 ①提取患儿骨髓标本的单个核细胞,严格按照Trizol试剂盒(Life Technology公司,美国)说明书提取总RNA。采用紫外分光光度计测定吸光度(A)值,A260/280值1.8~2.0为合格的样本,RNA浓度(μg·μL-1)=(A260×40×稀释倍数/1000)。采用随机逆转录引物(Invitrogen公司,美国),将2 μg RNA逆转录为cDNA,冻存于-20℃冰箱。②每个样本取80 ng cDNA,采用RQ-PCR技术(ABI Prism 7500型荧光定量PCR仪,美国Applied Biosystems公司)定量检测融合转录本水平。反应条件为50℃ 2 min,95℃ 10 min,95℃ 15 s,60℃ 1 min,共50个循环。以β葡萄糖苷酸酶(GUS)基因表达量为内参,对RUNX1-RUNX1T1表达水平进行标准化处理。每例标本的RUNX1-RUNX1T1和GUS均重复检测3次后取均值。检测结果以每104GUS中含有的RUNX1-RUNX1T1的拷贝数来表示(104GUS)。RUNX1-RUNX1T1和GUS的引物和探针序列参照文献[8, 9]。.
1.7 随访 入组患儿除已在病历查询系统中记录死亡者外,其余患儿均于2017年12月31日采用电话随访。随访存活或死亡。总生存(OS):从确诊之日起至患儿死亡或随访截止日未死亡的时间;无复发生存(RFS):从确诊之日起至患儿发生骨髓复发的时间或随访截止日未发生骨髓复发的时间。
1.8 统计学方法 采用SPSS 22.0和Graphpad Prism 5统计学分析。计数资料以%表示,RUNX1-RUNX1T1高表达组与低表达组间临床和生物学特征的比较采用χ2检验。生存分析采用Kaplan-Meier法,组间差异比较采用Log-rank 检验;Cox回归采用逐步向前法进行多因素预后分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 符合本文纳入标准的RUNX1-RUNX1T1患儿52例,男27例、女25例,中位年龄8(2~14)岁;FAB分型M2型46例(88.5%),M4型5例(9.6%),M5型1例(1.9%)。
图2显示52例患儿的临床转归,在诱导Ⅰ结束后,2例失访(放弃治疗,自动出院),移植5例,死亡2例,化疗45例,死亡19例。随访中死亡的21例,11例死于骨髓复发,10例死于化疗或移植并发症。随访中存活的29例中位随访时间62.2(34~134.3)个月。25例第1次长期CR中,移植3例,化疗22例,化疗复发14例中,8例移植,其中长期CR 4例。
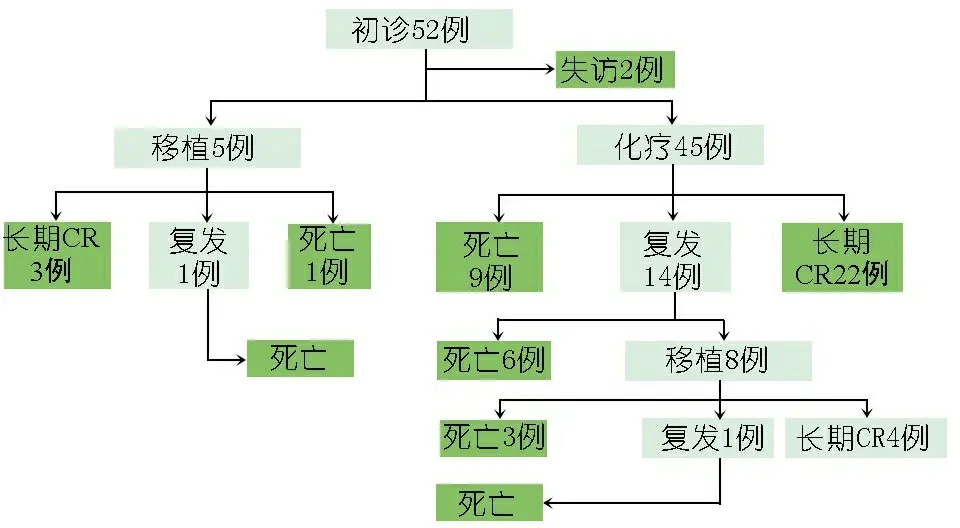
图2 52例RUNX1-RUNX1T1+AML患儿临床转归情况
2.2 不同时间点融合转录本的动态变化 各时间点患儿骨髓标本收集情况TP0为100%(52/52),TP1为57.7%(30/52),TP2为542%(26/48),TP3为68.2%(30/44),TP4为69.0%(29/42),TP5为86.8%(33/38)。TP0~TP5融合转录本水平中位数依次为7 409.16(1755.01~85064.94)、816.80(0.50~22000.00)、19.12(0~890.00)、5.63(0~15000.00)、0.33(0~810.00)、0.42(0~810.00)拷贝/104GUS。图3显示,TP1时融合转录本转阴率为0,此后逐渐升高,TP5仍有约60%的患儿未转阴。

图3 TP1~TP5融合转录本定量数据分布
2.3 初诊融合转录本高、低表达组患儿的临床和生物学特征比较 表1显示,初诊时高表达组(17/50,34%)和低表达组(33/50,66%)患儿的年龄、性别、WBC、Hb、PLT计数和骨髓幼稚细胞数等差异无统计学意义(P>0.05);免疫表型:除CD15(P=0.004)外,其他髓系和淋巴系抗原的表达在两组间差异均无统计学意义。初诊高表达组和低表达组患儿在TP1~TP5融合转录本水平差异均无统计学意义(χ2=0.001~0.096,P均>0.05)。
2.4 不同时间点融合转录本水平和初诊临床特征与预后的相关性分析 表2显示,TP0、TP1、TP5融合转录本水平,性别和初诊时PLT与5年OS相关;TP1、TP5 融合转录本水平和初诊时WBC与5年RFS相关。

表1 初诊 RUNX1-RUNX1T1转录本高、低表达组临床和生物学特征比较[n(%)]
注 各检测时间点融合转录本单位为拷贝/104GUS
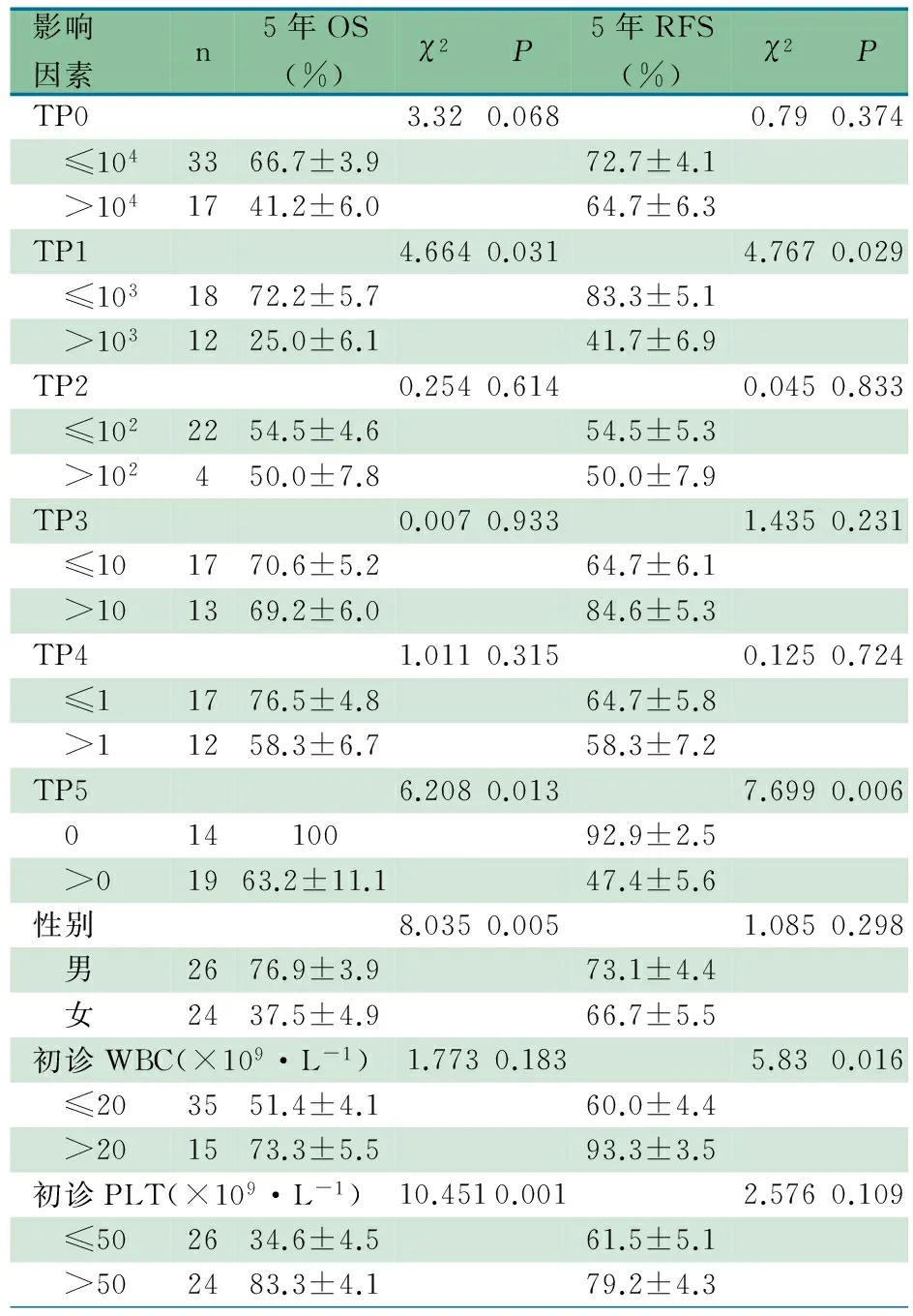
表2 TP0~TP5 RUNX1-RUNX1T1转录本水平和初诊临床特征与预后的相关性分析
注 各检测时间点融合转录本单位为拷贝/104GUS
2.5 影响RUNX1-RUNX1T1+AML患儿长期预后的多因素分析 表3显示,经Cox比例风险回归模型分析,TP1时融合转录本水平>103拷贝/104GUS是RUNX1-RUNX1T1+AML患儿5年OS的独立影响因素(HR=0.095,95%:CI:0.011~0.860,P=0.036)。表4显示,TP1、TP5时融合转录本水平和初诊时WBC≤20×109·L-1均不影响5年RFS。

表3 5年总生存率Cox比例风险回归模型分析
注 各检测时间点融合转录本单位为拷贝/104GUS;WBC、PLT单位:×109·L-1

表4 5年无复发生存率Cox比例风险回归模型分析
注 各检测时间点融合转录本单位为拷贝/104GUS;WBC单位:×109·L-1
3 讨论
1973年Rowley首先在AML中发现t(8;21)[4]。.在WHO发布的2001、2008和2016版急性白血病分型指南中,均将AML伴t(8;21)(q22;q22.1);RUNX1-RUNX1T1作为AML的一个独立亚型。本研究纳入的RUNX1-RUNX1T1+AML患儿5年OS为(58.0±7.1)%,与国内Zhang等[6][(65.6±6.5)%]和赖长城等[10][(54.6±8.7)%]的报告相近,均远低于德国AML-BFM 98临床试验的5年OS预测值(91%)[11],可能与AML-BFM 98方案中巩固治疗结束后继续进行含大剂量阿糖胞苷(3g·m-2,q 12 h·3d)的强化疗和长达12个月的维持治疗有关。本文病例中,大剂量阿糖胞苷仅用于诱导II后才达CR的中、高危组及无条件行allo-HSCT的患儿,且巩固治疗后无维持治疗。由此提示,增加大剂量阿糖胞苷的应用时间及巩固治疗后的维持治疗可能有助于对改善RUNX1-RUNX1T1+AML患儿的长期预后。
在免疫表型方面,本文初诊RUNX1-RUNX1T1高表达组患儿白血病细胞CD15均为阴性。CD15又称为粒细胞相关抗原,是细胞粘附分子(CAMs)家族成员,正常情况下,主要表达于成熟单核、粒细胞。有研究表明,RUNX1-RUNX1T1融合基因的大量表达影响了正常核结合因子(CBF)复合物对血细胞分化的调节,进而对正常血细胞的增殖、分化、凋亡造成干扰,从而导致白血病的发生[12]。因此,RUNX1-RUNX1T1融合转录本水平越高,髓系细胞被阻滞在分化早期阶段的可能性越大,CD15阴性率越高,也提示预后可能相对于融合转录本低表达者较差。本文生存分析显示,初诊时RUNX1-RUNX1T1低表达组的5年OS为(66.7±3.9)%,有高于高表达组[(41.2±6.0)%]的趋势,进一步提示初诊RUNX1-RUNX1T1表达水平可能是影响预后的因素。
文献报道[4]RUNX1-RUNX1T1+AML患儿复发率高达30%~50%,本研究中复发率为30%(15/50)。MRD与白血病复发密切相关[13],动态监测MRD对于评估患儿治疗反应和早期识别出具有高复发风险的患儿十分重要。Christopher等[14]的综述表明,国际上多个中心均已应用RQ-PCR技术检测融合转录本水平以评估RUNX1-RUNX1T1+AML患者的MRD,包括英国医学研究理事会(MRC)AML-15方案[15]、德国白血病临床协作组(GSF)AMLCG方案[16]、日本儿童白血病/淋巴瘤研究组(JPLSG)AML-05方案[17]和我国天津血液学研究所Zhang等[6]的研究。
本文分析了50例应用BCH-AML 05方案治疗的RUNX1-RUNX1T1+AML患儿治疗过程中不同时点(TP1~TP5) 融合转录本水平与预后的关系,发现融合转录本水平在TP1能否降至103拷贝/104GUS对患儿预后有影响,TP1融合转录本低和高表达组5年OS分别为(72.2±5.7)%和(25.0±6.1)%,5年RFS分别为(83.3±5.1)%和(41.7±6.9)%。多因素分析进一步证明了诱导I后(TP1)融合转录本水平>103拷贝/104GUS是患儿预后不良的独立影响因素,提示治疗早期融合基因的高表达是高复发风险的潜在预测因素。Zhang等[6]的研究也表明,在第1次诱导治疗结束后的RUNX1-RUNX1T1转录本水平(中位数30 464拷贝/104ABL,516~184 138)对患儿预后有显著影响,融合转录本低表达组(≤30 464拷贝/104ABL)和高表达组(>30 464拷贝/104ABL)5年OS分别为(89.5±5.8)%和(38.5±11.5)%(P<0.001),5年无病生存(DFS)分别为(86.7±6.2)%和(31.5±11.8)%(P<0.001);还发现,诱导I后融合转录本水平下降>1.8 log的高下降组的OS和DFS比低下降组高。另有研究发现,诱导II后的RUNX1-RUNX1T1表达水平对RUNX1-RUNX1T1+AML患儿预后的判定具有意义。如意大利AIEOP开展的AML 2002/01方案的多中心研究,根据第2次诱导治疗结束后融合转录本水平下降的不同数量级分组,>3 log组的6年CIR率为0,2~3 log组为20.4%,<2 log组有35.0%患儿复发[18]。因此,对RUNX1-RUNX1T1+AML患儿进行早期治疗评估可反映白血病细胞对化疗药物的敏感性,医生可根据评估结果及时调整治疗方案,以改善预后。
本研究还发现,治疗后期融合转录本水平与患儿预后具有相关性,治疗结束时(TP5)RUNX1-RUNX1T1转阴的患儿5年RFS可达93%,而阳性者仅为47%。北京大学人民医院等[19]开展的一项多中心研究也发现,巩固化疗结束时RUNX1-RUNX1T1定量>10-5(即未转阴)组与<10-5(即转阴)组复发率分别为60%和0(P=0.004)。以上说明,治疗结束时融合转录本持续阳性提示白血病细胞未被化疗彻底清除,可能成为今后复发的根源,临床医生需要考虑增加化疗时间或者调整方案,如考虑HSCT等。
此外,本文单因素分析发现,患儿性别和初诊PLT计数与5年OS相关,男性患儿OS优于女性患儿,与美国2002年发表的单中心研究结果一致[20]。但多因素分析后发现,性别和初诊PLT计数均不是RUNX1-RUNX1T1+儿童AML的独立预后因素。
综上所述,RUNX1-RUNX1T1+儿童AML在治疗过程中对融合转录本进行动态监测具有明确的临床意义,治疗早期融合转录本水平可以提示白血病细胞对化疗的敏感性,是预后的独立影响因素,而治疗结束时融合转录本转阴与否提示患儿体内白血病细胞是否被彻底清除,与患儿复发高度相关。
参考文献
[1] Creutzig U, van den Heuvel-Eibrink MM, Gibson B, et al. Diagnosis and management of acute myeloid leukemia in children and adolescents: recommendations from an international expert panel. Blood, 2012, 120(16): 3187-3205
[2] Grimwade D, Freeman SD. Defining minimal residual disease in acute myeloid leukemia: which platforms are ready for “prime time”? Hematology Am Soc Hematol Educ Program, 2014(1): 222-233
[3] Rowley JD. Biological implications of consistent chromosome rearrangements in leukemia and lymphoma. Cancer Res, 1984, 44(8): 3159-3168
[4] Leroy H, de Botton S, Grardel-Duflos N, et al. Prognostic value of real-time quantitative PCR (RQ-PCR) in AML with t(8, 21). Leukemia, 2005, 19(3): 367-372
[5] Pigazzi M, Manara E, Buldini B, et al. Minimal residual disease monitored after induction therapy by RQ-PCR can contribute to tailor treatment of patients with t(8, 21)RUNX1-RUNX1T1 rearrangement. Haematologica, 2015, 100(3): e99-101
[6] Zhang L, Cao Z, Ruan M, et al. Monitoring the AML1/ETO fusion transcript to predict outcome in childhood acute myeloid leukemia. Pediatr Blood Cancer, 2014, 61(10): 1761-1766
[7] Bene MC, Bernier M, Casasnovas RO, et al. The reliability and specificity of c-kit for the diagnosis of acute myeloid leukemias and undifferentiated leukemias. Blood, 1998, 92(2): 596-599
[8] Gabert J, Beillard E, van der Velden VH, et al. Standardization and quality control studies of “real-time” quantitative reverse transcriptase chain reaction of fusion gene transcripts for residual disease detection in leukemia- A Europe Against Cancer Program. Leukemia, 2003, 17(12): 2318-2357
[9] Beillard E, Pallisgaard N, van der Velden VH, et al. Evaluation of candidate control genes for diagnosis and residual disease detection in leukemia patients using “real-time” quantitative reverse-transcriptase polymetase chain reaction (RQ-PCR)- a Europe against cancer program. Leukemia, 2003, 17(12): 2474-2486
[10] 赖长城, 李艳红, 梁昌达, 等. AML1-ETO阳性的儿童急性髓系白血病的诊治分析. 江西医药, 2016, 51(7): 615-618
[11] von Neuhoff C, Reinhardt D, Sander A, et al. Prognostic impact of specific chromosomal aberrations in a large group of pediatric patients with acute myeloid leukemia treated uniformaly according to Trial AML-BFM 98. J Clin Oncol, 2010, 28(16): 2682-2689
[12] 邬志伟, 胡超杰, 徐修才, 等. 核心结合因子相关急性髓系白血病分子生物学及基因突变检测特点. 白血病·淋巴瘤, 2014, 23(7): 413-419
[13] 郭青, 张冰玉, 金润铭. 儿童急性髓系白血病微小残留病检测技术的应用进展. 国际儿科学杂志, 2016, 43(10): 760-762
[14] Hourigan CS, Gale RP, Gormley NJ, et al. Measurable residual disease testing in acute myeloid leukemia. Leukemia, 2017, 31(7): 1482-1490
[15] Yin JA, O'Brien MA, Hills RK, et al. Minimal residual disease monitoring by quantitative RT-PCR in core binding factor AML allows risk stratification and predicts relapse: results of the United Kingdom MRC AML-15 trial. Blood, 2012, 120(14): 2826-2835
[16] Schnittger S, Weisser M, Schoch C, et al. New score predicting for prognosid in PML-RARA+, AML1-ETO+, or CBFB-MYH11+acute myeloid leukemia based on quantification of fusion transcripts. Blood, 2003, 102(8): 2746-2755
[17] Matsuo H, Iijima-Yamashita Y, Yamada M, et al. Monitoring of fusion gene transcripts to predict relapse in pediatric acute myeloid leukemia. Pediatr Int, 2018, 60(1): 41-46
[18] Pigazzi M, Manara E, Buldini B, et al. Minimal residual disease monitored after induction therapy by RQ-PCR can contribute to tailor treatment of patents with t(8, 21)RUNX1-RUNX1T1 rearrangement. Haematologica, 2015, 100(3): e99-101
[19] 程翼飞, 柳彩凤, 张乐萍, 等. 实时定量反转录聚合酶链反应检测患儿急性粒细胞性白血病1-ETO融合基因的临床意义. 实用儿科临床杂志, 2008, 23(15): 1160-1211
[20] Rubnitz JE, Raimondi SC, Halbert AR, et al. Characteristics and outcome of t(8, 21)-positive childhood acute myeloid leukemia: a single institution’s experience. Leukemia, 2002, 16(10): 2072-2077
