我国医疗器械进口中存在的问题及监管制度的优化
2018-05-26刘洋李晓
刘洋 李晓
摘 要:自加入世界贸易组织以来,我国医疗器械进口贸易额呈现稳定增长态势,进口医疗器械的品种在扩大,部分医疗器械进口对国内医疗器械产品的创新起到了促进作用。当然,我国医疗器械进口也存在一些问题,本文进行详细的分析,并提出建立境外医疗器械企业生产现场检查制度,完善医疗器械进口代理人监管制度、强化海关口岸查验职责,推动与药监部门的合作,细化大型医用设备配置许可制度,提高医用诊疗设备的使用效率来提升我国对进口医疗器械安全有效使用的监管水平。
关键词: 医疗器械进口;存在问题;监管制度; 优化路径
一、我国医疗器械进口发展的现状
(一)医疗仪器及器械进口规模稳步增长
自我国加入世界贸易组织(WTO)以来,医疗器械进口规模不断增长。2017年,我国医疗器械进口额204亿美元,是2002年的10.7倍,年均增长率为17.1%。其中,医用敷料进口额3.68亿美元,医用耗材29.3亿美元,医院诊断与治疗设备146.3亿美元,保健康复用品16.5亿美元以及口腔器材77.8美元,与2016年相比分别增长了9.2%、11.3%、9.6%、12.0%和1167%。从医疗器械进口重点产品统计数据看,2017年我国医疗仪器及器械进口额97亿美元是2002年的8倍,年均增长率为14.9%(见表1)。
(二)医疗器械进口的范围不断扩展,主要以中高端醫疗器械为主
近十年来,我国医疗器械进口的范围不断扩展,主要进口中高端医院诊断与治疗设备。由于国产医疗器械不论是产能还是研发远远不能满足市场需求,中高端医疗器械产品严重仍依赖进口。三甲医院的中高端医疗器械大多来自美国、日本、德国的进口产品。2008年,我国医疗器械进口排名前十的产品为X射线机、超声、X射线断层扫描、核磁共振成像装置、内窥镜、监护仪、眼科设备、肾脏透析设备、麻醉设备与心电图记录仪。2015年,有43个品种的医疗器械产品进口额超过1亿美元的,同比增加了8个品种。其中,通用诊疗设备、彩色超声波诊断仪、弥补生理缺陷的康复用具、X射线断层检查仪、内窥镜、核磁共振成像装置等为主要进口产品。2016年,医用导管、插管、理化分析仪器、使用光学射线(紫外线、可见光、红外线)分光仪、分光光度计及摄谱仪、诊断类试剂、彩色超声波诊断仪、检镜切片机、X射线断层检查仪、医疗或兽医用X射线应用设备以及弥补生理缺陷的康复器具等医疗器械依赖进口。与2008年相比,我国进口医疗器械的产品范围扩大,品种与进口金额增加。
(三)部分医疗器械进口促进了国内中高端医疗器械的创新
近几年来,我国高端医疗器械产业发展较快,尤其是影像诊断设备逐步实现进口替代甚至走向出口,超声、监护等设备在国际市场的影响力也逐渐显现。2016年我国彩色超声波诊断仪进口9.4亿美元,出口5.3亿美元;X射线断层检查仪,进口6.83亿美元,出口4.19亿美元。随着创新医疗器械政策的推出,企业研发投入力度的加大,在影像设备领域,国产数字化医用X射线机(含平板DR)设备的技术水平得到快速发展,万东、联影、东软的产品逐渐占领国内DR市场,进入优秀国产医疗设备目录,逐渐被三甲医院采购。尤其万东医疗实现全影像链核心部件自主研发,有望成为放射影像领域成长快、规模大的产品线。2017年国内影像类设备(CT)市场占有率,通用电气32%、西门子26.2%、飞利浦22%、佳能10.7%、东软医疗7.4%、联影1.1%,其他0.5%。通过医疗器械中高端产品的进口,促进了国内医疗器械的创新发展。未来,体外诊断试剂、心血管及外科器械、血透以及医学影像等领域进口替代的空间巨大。
(四)医疗器械进口合格率高,来源地以德国、美国与日本等国家为主
2013-2017年期间进口产品合格率保持在84%以上(表2),并且进口医疗器械的合格率高于国产医疗器械合格率,说明进口医疗器械的技术质量水平确实较高;另一方面也可能由于外资产品抽检的批次较少原因造成的。我国医疗器械进口来源地以美国、德国、英国、瑞士、法国、荷兰与日本、新加坡等国家为主。2016年我国医疗器械主要进口的来源地分别为欧洲、北美洲与亚洲,占比分别为37%、33%与24.5%,主要进口国为德国、美国与日本,占比共达到60%。
二、医疗器械进口中存在的主要问题
近年来,我国医疗器械的进口量呈现持续增长态势,确保医疗器械产品的质量安全,防止不合格产品投入使用,加强对医疗器械的检验监管成为各级监管部门重要职责所在。我国医疗器械进口中存在一些问题,主要包括未提供医疗器械备案凭证、注册证、中文标签与说明书不合格、进口旧的医疗器械以及花费大量外汇进口,医疗器械却大量闲置,未发挥作用等。
(一)无进口医疗器械备案凭证或注册证
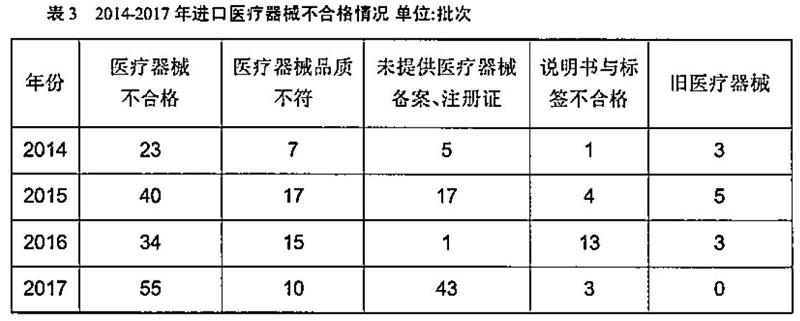
我国进口医疗器械以中高端产品为主,质量水平相对较高,质量状况较为稳定。然而,进口医疗器械不合格批次中,品质不符、有缺陷的医疗器械批次较高。未获得进口医疗器械备案或注册证书是进口医疗器械领域存在较为突出的问题。检验监管过程中发现冒用、盗用、滥用医疗器械注册证或备案凭证。利用海关监管的盲区或者产品复杂不易判别的特点,将医疗器械作为非医疗器械器械报关入境。2014-2017年,未提供医疗器械注册证书或备案凭证分别为5批次、17批次、1批次、43批次(表3)。2017年进口工业产品不合格为627批次,其中,医疗器械产品共55批次(占比8.8%),43批次产品无医疗器械注册证或备案凭证、货证不符或者生产日期不在医疗器械注册证有效期内。尤其以2017年8月份的批次居多,共有来自28个国家和地区的88个批次的进口工业品存在问题,医疗设备29批次所占比重为31.8%。此外,还存在主机是经过进口注册的合法医疗器械,而配套的耗材或软件未经注册或者假冒、重复使用的。
(二)进口医疗器械使用说明书、中文标签不符合要求
进口医疗器械产品的使用说明书和中文标签在《医疗器械监督管理条例》与其配套规章有明确要求。产品的使用说明书及中文标签是经医疗器械注册/备案部门审查的受控文件,其中包含了产品注册信息和产品技术要求,是境外医疗器械生产企业对中国市场销售产品的一种产品安全承诺。境外企业应当在产品最小销售单元中提供经注册/备案的说明书及中文标签。2014年-2017年医疗器械说明书或标签不合格项分别为1项、4项,13项和3项(表3)。2017年上海地区进口医疗器械33704批,不合格8863批,退运及销毁106批。其中,主要原因是中文标签和说明书不符合要求。
(三)仍存在少量旧的医疗器械进口
《货物进出口管理条例》与《机电产品进口管理办法》中明令禁止旧的、二手翻新医疗设备进境。旧医疗器械在使用中存在巨大的安全风险隐患,一方面旧的医疗器械难以保证其准确性与安全性,容易给患者造成伤害,甚至有可能引起医源性污染;另一方面会危及操作人员,造成对人群传播疾病。一些企业或个人经受不住进口旧的医疗器械高额非法利益的诱惑,不惜铤而走险,将旧的医疗器械伪报为新的医疗器械进口。2014年至2017年,口岸检出的“旧品属于禁止进口旧医疗器械”分别为3批次、5批次、3批次与0批次(见表2)。2015年4月飞利浦金科威(深圳)实业有限公司采取“以旧报新”的方式进口除颤极板(墨西哥)、监护仪用打印记录模组(加拿大)、除颤极板(奥地利)被责令退运。海关总署缉私局在2016年11月开展打击走私旧的医疗设备“1018”专案行动中,查缉走私旧的医疗设备400余台,案值约3.8亿元人民币,捣毁涉嫌走私旧的医疗设备团伙19个。
(四)花费巨额外汇进口的,医疗器械,却被使用单位大量闲置
我国医疗机构每年花费巨额外汇进口大量医疗设备,却大量闲置,未能很好发挥作用。2016年,北京审计局审计发现5家市屬公立医院设备闲置6.61亿元,3年没有使用。“十一五”期间,中央财政安排200余亿元用于医疗设备购置,医疗设备的引进,换来的却是大量设备的闲置,基层医院的医疗器械使用率不足40%。对于大型医疗设备关键看它的使用效率和效益,例如,在北京一台CT机一天要为70到80人次服务;然而在陕西、河南、山东等省的县级医院,一所医院一天下来最多只会有7到15位病患来照CT,使用效率明显不足。进口设备的售后与维修均由出口企业国内代理商负责,一旦由于某些原因导致维修延时,耗材供应中断,设备的使用将面临瘫痪,从而无法使用。
此外,进口医疗器械价格偏高,存在个别医院(进口商)与国外勾结骗汇套汇的可能。《2013中国医疗器械行业发展状况蓝皮书》指出,我国进口中高端医疗器械价格普遍高于欧美日等原产国50%-100%,如TOMO放射治疗系统等设备,在欧美日等国家多为250万美元,我国进口多在500万美元以上。多付出去的外汇可能是返还给进口商或医疗机构的佣金或者代理费。
三、医疗器械进口中监管制度优化途径
(一)强化境外医疗器械企业生产现场检查制度建设
进口医疗器械的境外生产企业应当按照根据《医疗器械监督管理条例》与相关配套规章建立与产品研制、生产有关的质量管理体系。医疗器械境外生产现场检查可以督促国外生产企业遵守中国医疗器械生产质量管理规范等相关法规,将产品注册、厂房与设施、质量控制、工艺流程、采购、文件管理等方面缺陷与问题事先处理好,控制了进口医疗器械的使用风险。医疗器械境外检查制度还有待进一步完善,医疗器械境外体系检查工作频次依然偏低。加强检查员队伍建设的同时,可以探索利用社会资源,如第三方认证机构进行境外体系检查的监管模式。
(二)完善医疗器械进口代理人监管制度
进口医疗器械境内代理人作为进口产品在中国境内的“责任人”,应当与境外生产企业一并对产品的安全有效性负责。进口医疗器械代理人除办理医疗器械注册或者备案事宜外,还应当承担相应食品药品监督管理部门、境外生产企业的联络;向境外生产企业如实、准确传达相关的法规和技术要求等责任。建立科学完整的“代理人”管理制度,落实代理人工作责任,定期对进口代理商进行专项飞行检查,明确进口医疗器械代理人积极参与境外医疗器械企业现场检查,做好沟通与协调工作。
(三)强化海关职责,推动与药监部门的合作
海关的出入境检验检疫部门严格实施进口医疗器械到货现场检验制度,强化对进口医疗器械检验监管,防止境内外不法商人通过以旧充新、以旧翻新等手段向国内转移旧的医疗器械。一旦发现,严格依法依规实施退运或销毁处理。构建海关与食品药品监督管理部门之间的数据共享渠道,保证产品注册、产品进出境信息的及时无缝衔接。借鉴美国食品药品管理局的经验,探索运用唯一医疗器械识别系统(Unique device identification,UDI),解决医疗器械产品注册、海关商品编码、商检技术标准与集中采购的价格等问题,建立产品质量安全信息追溯体系。
(四)细化大型医用设备配置许可制度,提高医用诊疗设备的使用效率
针对进口医疗器械闲置、未能有效发挥作用问题,2017年新修订的《医疗器械监督管理条例》规定,医疗机构配置大型医用设备须经省级以上卫生部门批准,并取得许可证,医疗机构未经许可擅自配置使用大型设备需接受相应的处罚。对大型医用设备配置实行许可证制度,可以制止医疗机构盲目追求高端设备、竞相拼设备,防止医疗机构从“以药养医”走向“以械补医”;同时,可以减少不必要的中高端医疗器械的盲目进口,促进现有医用设备的合理配置和有效使用,从而控制卫生费用过快增长。当然,《大型医用设备配置许可管理目录》中甲类、乙类目录需要动态调整,防治抑制了医疗机构自主采购医疗设备的合理要求。
(五)打击团伙走私活动,防止有重大安全隐患的医疗器械进入国内市场
进口医疗器械一般价格高,利润空间巨大,存在巨大的经济利益,一些不法分子不惜铤而走险采取虚报、伪报方式将医疗器械整机、整批或散件走私入境,或将医疗器械作为非医疗器械报关入境以及雇佣“水客”携带医疗器械入境,逃避缴纳进口关税以及进口许可证监管,不仅破坏了正常的进口秩序,而且使得医疗器械安全性与有效性难以保障。《医疗器械监督管理条例》修正案(草案征求意见稿)明确提出,医疗器械经营企业不得经营已使用的医疗器械,并明确了法律责任。海关缉私部门应当与出入境检验检疫部门一起对进口医疗器械产品进行风险等级评价,对高风险的进口医疗器械实施动态目录管理。进口高风险价格高的医疗器械实施境外装运前、口岸入境、目的地到货检验以及后续监督管理,防止有重大安全隐患的医疗器械进入国内市场。在海关缉私局内部,形成一盘棋思想,积极开展打击走私翻新医疗设备的打击活动,通过查处大案,抓获犯罪嫌疑人,对走私不法分子起到威慑作用。
参考文献:
[1]《医疗器械监督管理条例》(国务院令第680号).
[2]《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号).
[3]国家食品药品监督管理总局 《药品医疗器械境外检查管理规定(征求意见稿)》。http://www.sda.gov.cn/WS01/CL0050/220710.html .
[4]北京市食品药品监督管理局,《北京市进口医疗器械代理人管理规定(试行)》.
[5]蔡天智、苏畅,我国医疗器械对外贸易现状与发展报告,载于王宝亭、耿鴻武,中国医疗器械行业发展报告(2017)[D].北京,2017年10月,P184-186.
[6]陈静,进口医疗器械批次金额持续增长,不合格检出率近三成 2018年01月19日,中新网上海.
[7]刘砚青. 无奈的浪费:基层医院医疗设备为何过半闲置[J]. 中国经济周刊, 2013(25):75-77.
[8]李雨思,进口医疗器械价格高昂潜藏风险,中国经济网,2013年11月26日.
[9]6种进口医疗器械违法案件表现方式,医药经济报,2012年6月5日.
