‘红阳’猕猴桃乙烯催熟特性
2018-05-25李华佳朱永清袁怀瑜胡秋辉
袁 沙,李华佳,朱永清,李 可,袁怀瑜,徐 瑞,钟 杨,周 艳,胡秋辉*
中国是猕猴桃的发源地,栽培面积和产量均居世界第一位,目前国际上商品化的红肉猕猴桃主要来源于中国。四川作为中国猕猴桃的第二大产地,拥有良好的猕猴桃种植气候与条件[1],2016年四川省猕猴桃种植面积达到4.62万 hm2,产量达29.77万 t,其中‘红阳’猕猴桃的种植面积达3万 hm2,占全省栽培面积的65%;该品种因色泽美观,可溶性固形物含量高,果实风味极佳,深受消费者喜爱[2-3],成为四川省特色优势产业。
‘红阳’猕猴桃是中华系早熟品种,是目前成熟采收最早的猕猴桃品种,商业采收期通常在8月中下旬,须经过一段时间自然成熟后才能上市。随着人工催熟技术的发展与应用,为使该早熟品种能有计划地尽快上市,弥补早期国产猕猴桃市场的空白,提高‘红阳’猕猴桃食用品质,缩短猕猴桃后熟时间成为该领域的新兴研究方向。目前,人工催熟已成功应用于香蕉、芒果及番茄上,主要通过乙烯利或乙烯的作用来加速其成熟进程。外源乙烯对呼吸跃变型果实的作用主要是使呼吸跃变时间提前,诱导果实各种生理反应,加速果实的成熟衰老进程[4]。有研究表明乙烯催熟处理不仅能够实现果实的人工熟化调控,而且能够在不影响果实理化品质的基础上对果实的香味特征产生积极作用[5-7]。然而Burdon等[8]提出果实只有达到一定成熟度即营养物质积累到一定程度,具备较高发育水平并表现出某些生理特征时,对外源乙烯的刺激反应才会表现出来,体现出果实的品质特征,从而满足消费需求。此外处理温度、时间及乙烯添加量等是影响外源乙烯催熟效果的重要影响[9-10]。
本研究以‘红阳’猕猴桃为研究对象,通过对不同成熟度果实催熟后的指标分析,明确采用外源乙烯催熟实现猕猴桃早采上市的适宜采收期,并进一步探讨了乙烯添加量和温度条件对催熟效果的影响。为延长猕猴桃供应期提供理论依据,为‘红阳’猕猴桃催熟提供技术参考。
1 材料与方法
1.1 材料与试剂
实验所需‘红阳’猕猴桃(Actinidiachinensis Planch.var. rufopulpa [C.F. Liang et R.H. Huang] C.F. Liang et A.R.Ferguson)采自四川省成都市主产区的蒲江果园和邛崃果园,在果园以S型路线走动随机采摘的方式采收实验用果,采后2 h内运回实验室,取30 个果实作为采摘时初始指标的测定,剩余果实置于阴凉通风处24 h,散去田间热并完成果实愈伤,第二天进行催熟处理。
乙烯、二氧化碳标准气体 北京谱析科技有限公司;1 mol/L NaOH标准溶液 美国阿拉丁公司。
1.2 仪器与设备
TA.XT Plus质构仪 英国SMS公司;855机器人全自动滴定仪 瑞士万通中国有限公司;PAL-1数显糖度计 日本ATAGO公司;7890A气相色谱仪 美国Agilent公司;Tinytag View-4020温度数据采集器 英国Gemini Data Loggers公司。
1.3 方法
1.3.1 乙烯催熟不同成熟度‘红阳’猕猴桃的品质分析
于盛花期后(days after full bloom,DAFB)85 d开始,分别采收两个果园,每隔一周采一批果实(约150 个),共4 个批次(H1:DAFB 85 d;H2:DAFB 92 d;H3:DAFB 99 d;H4:DAFB 106 d),每批次果实采收后立即取30 个果实做果实初始指标检测,剩余果实在20 ℃条件下用100 μL/L的乙烯催熟[8],设置0 μL/L乙烯处理组作为对照,7 d催熟处理后1、3、5 d进行各项指标的检测。
1.3.2 不同添加量乙烯催熟对‘红阳’猕猴桃后熟的影响
分别选择H3、H4批次的‘红阳’猕猴桃330、390 个,H3批次在20 ℃下分别用0、25、50、75、100 μL/L添加量的乙烯对果实进行催熟,H4批次在相同温度下分别用0、10、25、50、75、100 μL/L添加量的乙烯处理。催熟处理后贮藏第1、3、5天检测各项指标。
1.3.3 不同温度下乙烯催熟对‘红阳’猕猴桃后熟的影响
另采收T1(DAFB 113 d)和T2(DAFB 127 d)两个批次的‘红阳’猕猴桃各约800 个,各取30 个果实进行初始指标测定,剩余果实分别在10 ℃和20 ℃下采用1.3.2节确定的适宜乙烯添加量进行催熟处理,设置0 μL/L乙烯处理组作为对照。
1.3.4 催熟操作
采收待催熟的果实置于催熟温度下24 h并利用温度数据采集器实时监测果心温度,待果心温度达到催熟温度后,将待催熟果实转移至容积为60 L催熟箱中,密封后由注射孔注入一定量的乙烯气体使箱内添加量达到催熟添加量(6 mL乙烯气体加入60 L催熟箱中,此时箱内乙烯添加量为100 μL/L)。24 h后,打开催熟箱散去乙烯,将猕猴桃分装于带托盘的纸盒中(18 个/盒),并用聚乙烯薄膜覆盖防止失水,继续放置在同温度下做不定期指标检测。
1.3.5 指标测定
1.3.5.1 果实与果心硬度的测定
果实与果心硬度使用质构仪进行测定[8]。装载不同尺寸的穿刺探头,下降速率5 mm/s、测定速率2 mm/s、测定距离7.9 mm,最大受力点记录为果实硬度,单位为N。果肉硬度的测定使用直径为7.9 mm的穿刺探头,在待测果实中间最大横径处削去1 mm厚度的果皮和果肉后测定,每个果实测定90°相邻的两个点,结果取两点平均值。在距离果柄端三分一处切去果柄端,选取留下的三分之二部分用于果心硬度的测定,使用直径为5 mm的穿刺探头做垂直测定。
1.3.5.2 可溶性固形物质量分数的测定
可溶性固形物质量分数(soluble solids content,SSC)采用数显式糖度计进行测定。取果实两端果肉,挤压取果汁,混匀后用胶头滴管取2 滴用于测定。
1.3.5.3 可滴定酸质量分数的测定
取果实两端果肉,挤压取果汁,混匀后取1 mL的果汁加50 mL的蒸馏水,用全自动滴定仪测定可滴定酸(titratable acid,TA)质量分数,滴定溶液为1 mol/L NaOH标准溶液,滴定终点为pH 8.2,结果以柠檬酸当量计,以%表示。
1.3.5.4 干物质质量分数的测定
在果实中端切取2 mm的薄片,称质量(m1)后置于65 ℃恒温干燥箱烘24 h,质量稳定后称质量(m2)。干物质(dry matter,DM)质量分数按下式进行计算。

1.3.5.5 呼吸速率与乙烯释放量的测定
果实呼吸速率以CO2释放量表示。取2 个猕猴桃置于2 000 mL的带橡胶塞的密封罐中,密封1 h后取1 mL气体采用气相色谱法测定。色谱分析条件:乙烯释放量的测定用HP-5毛细血管柱(30 m×320 µm,0.25 µm),柱温50 ℃保持3 min,进样口温度110 ℃,不分流,火焰离子化检测器,检测箱温度160 ℃,载气(N2)流速2 mL/min。
CO2释放量的测定用Kromat KB-PLOT Q键合聚苯乙烯-二乙烯基苯毛细管柱(30 m×530 µm,0.20 µm),进样口温度110 ℃,分流比20∶1,柱箱温度45 ℃保持1.5 min,热导检测器,检测箱温度200 ℃,载气(He)流速1 mL/min。
1.4 数据统计分析
每组实验做3 个平行,结果以x±s表示。采用SPSS 18.0软件对数据进行方差分析和多重比较,并用Origin 8.0软件作图。
2 结果与分析
2.1 乙烯催熟对不同成熟度‘红阳’猕猴桃后熟的影响
H1~H4批次采收的‘红阳’猕猴桃经100 μL/L乙烯在20 ℃下催熟后,果实硬度和果心硬度、TA质量分数相比初始指标和相同贮藏时间的对照组均有所下降,SSC升高(表1),说明外源乙烯加速果实熟化进程。H1~H4批次的果实经乙烯催熟后5 d,果实硬度由采收时的63.20~69.90 N下降至可食用状态(果实硬度在3.94~9.28 N范围内)[11-13],果心硬度也有所下降。猕猴桃果实对外源乙烯催熟的直观反应表现为果实硬度下降,研究表明,不同成熟阶段的猕猴桃果实在外源乙烯作用下硬度下降的程度和速率不同。当成熟度较低时,果实对乙烯作用有一定的响应,但硬度不能持续下降,只有成熟度达到一定阶段,在移除外源乙烯后,果实仍然具备继续熟化的能力,并达到可食用硬度。本研究中H1~H4批次采收的红阳猕猴桃经100 μL/L外源乙烯的作用后,果实在贮藏过程中硬度均可持续下降,并在5 d内达到可食用状态。

表1 不同成熟度采收‘红阳’猕猴桃经乙烯催熟后品质指标的变化Table 1 Quality attributes of ‘Hongyang’ kiwifruits ripened by ethylene with different maturation degrees
果实硬度对猕猴桃整体的食用品质至关重要,它与果实的甜度、酸度、风味等感官指标有很强的相关性[14]。猕猴桃的酸含量与硬度相关,即成熟度高且完全具备熟化能力的猕猴桃,在果实较硬时TA质量分数较高,直接影响食用品质[14-15],由表1可知,H1~H4批次的果实经100 μL/L乙烯催熟后第5天,果实硬度小于10 N,TA质量分数均在0.2%左右,由此可知,成熟度对软化后猕猴桃的TA质量分数影响较小。Crososto[15]、Burdon[16]等认为采收时果实的DM质量分数是影响猕猴桃熟化后SSC的关键因素,本研究结果显示随着采收时间的延迟,果实采收时DM质量分数从15.60%增加至17.00%(因为在后熟过程中,猕猴桃果实的DM质量分数几乎不发生变化,故只测定了采收时的质量分数),对应地其果实软化后的猕猴桃SSC也由12.70%增加到15.00%。相关的感官实验研究发现,果实SSC大于12.00%有助于提高消费者的接受程度[14],Lim等[5]认为猕猴桃的SSC达到14%~15%的范围才能够赋予其较好的滋味。‘红阳’猕猴桃是甜度较高的品种,Wang Mingzhong等[17]提出成熟后该品种SSC平均值可达19.6%;LI Huajia等[18]的研究中晚采的果实贮藏后SSC只能达到16%左右。同一品种猕猴桃的SSC受栽培地区、种植环境等影响,根据近3 年对本研究中产地情况的追踪,认为此产地的‘红阳’猕猴桃SSC高于15.0%时即可得到较好的食用品质。由表1可知,当猕猴桃达到一定成熟度(DM质量分数为17.0%)时,采用乙烯催熟24 h,贮藏第5天SSC达到15.0%,可得到一个较好的食用体验。综上可知,采用100 μL/L的乙烯催熟24 h后,各批次果实硬度均可达到可食用状态,而只有当果实达到一定成熟度(H4)时,其软化后才能被消费者所接受。其中H4批次果实采收日期为7月24日,SSC为5.46%,参考产地技术规范、‘红阳’采收标准[19-20]可知,采用外源乙烯可保证食用品质的前提下,实现猕猴桃的早采错季销售。
2.2 不同添加量乙烯催熟对‘红阳’猕猴桃后熟的影响
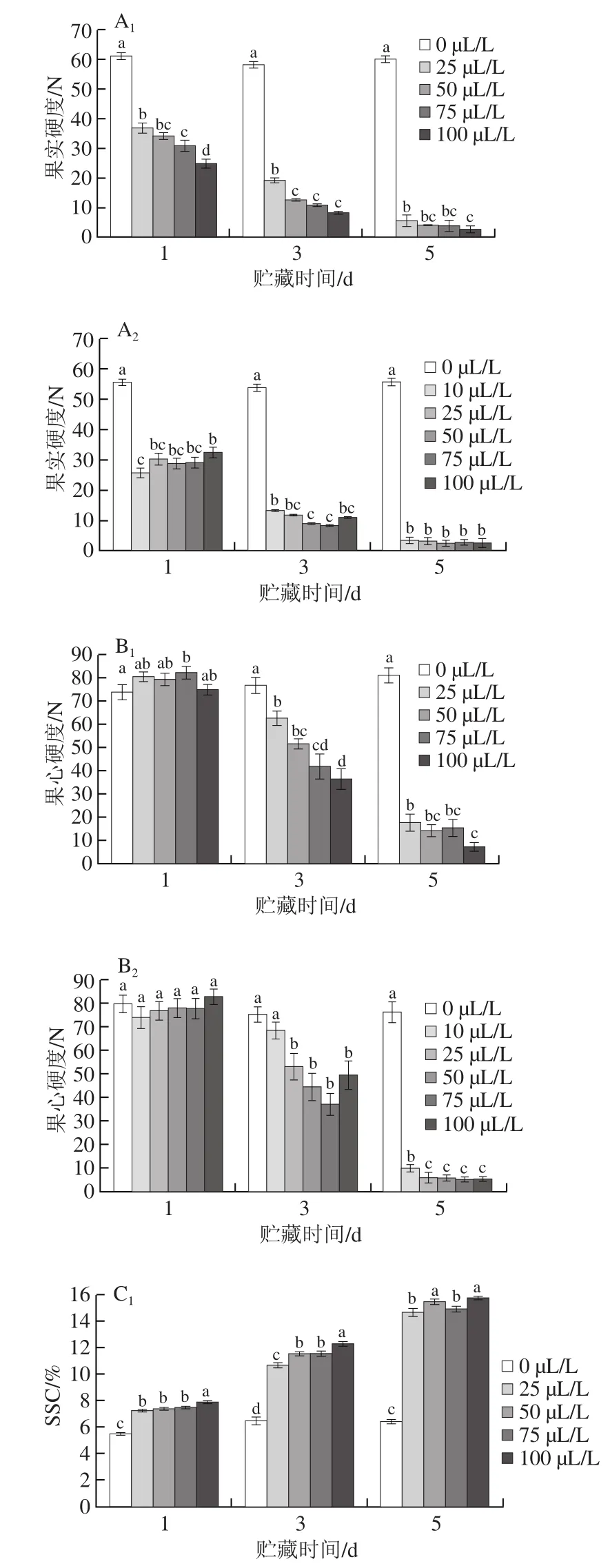

图1 20 ℃下不同乙烯添加量处理对 ‘红阳’猕猴桃果实硬度(A1、A2)、果心硬度(B1、B2)、SSC(C1、C2)和TA质量分数(D1、D2)变化的影响Fig. 1 Changes in fruit firmness (A1, A2), core firmness (B1, B2), SSC(C1, C2) and TA content (D1, D2) of ‘Hongyang’ kiwifruits treated with different concentrations of ethylene at 20 ℃
在20 ℃条件下,10~100 μL/L的乙烯处理均能引起‘红阳’猕猴桃果实硬度的下降(图1A1、A2),贮藏第1天H3、H4批次的果实硬度均下降50%左右,显著低于0 μL/L乙烯对照组(P<0.05);第3天果实硬度持续下降至10~20 N,第5天下降至5 N左右,达到可食用范围。H3和H4两个不同采收批次的果实经乙烯催熟处理后果实硬度变化趋势基本一致,达到可食用硬度的时间为贮藏后5 d左右。H3批次采收的果实经催熟后,不同添加量乙烯处理组之间在第1天表现出比较明显的硬度差异,且随着乙烯添加量的增加,果实硬度显著降低(P<0.05),但是在3~5 d达到可食用硬度的时候,不同乙烯添加量处理组之间的差异逐渐减小甚至消失。H4批次采收的果实经催熟后,不同乙烯添加量处理组之间的硬度差异较小,且不随添加量的变化呈现有规律的差异。猕猴桃果实单个个体之间的差异比较大,贮藏后熟化时间也存在先后的差异,因此熟化过程中,乙烯添加量造成的硬度差异可能由个体差异所导致的。Saltveit[21]提到猕猴桃在贮藏过程中,环境中30 μL/L的乙烯就会导致果实硬度发生明显的变化,而大部分应用和研究多以100 μL/L甚至更高添加量的乙烯来催熟呼吸跃变型的果实[5,22]。针对‘红阳’猕猴桃对乙烯催熟的反应表明,10~100 μL/L添加量的乙烯对果实硬度变化和达到可食用硬度范围的时间没有太大影响。
猕猴桃果实的食用部分由外部果肉、内部果肉和果心3 个部分组成,不同部位结构和质地差别较大[23]。Jackson[24]、White[25]等研究认为不同部位在采后阶段的硬度变化受到品种、采收成熟度、温度、处理条件的影响而不尽相同。本研究中果心硬度的变化滞后于果实硬度的变化(图1B1、B2)。H3、H4批次的猕猴桃果实经乙烯催熟处理后贮藏第1天的果心硬度与0 μL/L对照组相比没有发生显著的硬度下降(P>0.05),之后果心硬度开始下降。H3批次贮藏后第3天,乙烯处理组的果心硬度显著低于对照组,且随着乙烯添加量的增加,果心硬度显著降低(P<0.05);第5天,果心硬度下降至7.49~17.93 N,此时不同乙烯添加量处理之间差异减小。H4批次贮藏后第3天,25~100 μL/L各添加量的乙烯处理组间无显著差异,但是与0、10 μL/L处理组间存在显著差异;第5天果心硬度迅速下降至10 N以下,果心硬度接近果肉硬度。H4批次果实软化后果心硬度较H3批次更低,这与MacRae等[26]报道的较早采收的猕猴桃熟化后有较突出的硬心现象一致。
不同添加量乙烯催熟处理后,猕猴桃SSC和TA质量分数的变化随贮藏时间的延长分别呈现增高和降低的趋势(图1C1、C2、D1、D2),第5天两个批次的SSC都达到15.0%左右,TA质量分数降低至0.2%左右。在贮藏期间,H3、H4批次中10~100 μL/L的乙烯处理组之间SSC虽有一定的差异,但是差异不随乙烯添加量的变化呈现有规律的变化,因此SSC的差异可能主要是果实个体的差异引起的;TA质量分数也随贮藏时间的延长,不同添加量处理组差异减少,至第5天,10 μL/L与25~100 μL/L处理组之间存在显著差异,而25~100 μL/L添加量的乙烯处理组猕猴桃的TA质量分数几乎无显著差异。
综上所述,经不同添加量的乙烯(10~100 μL/L)催熟处理后,‘红阳’猕猴桃达到可食用硬度的时间基本一致,且第5天主要感官指标果实硬度、果心硬度和SSC差异较小;TA质量分数受一定程度的乙烯添加量影响,10 μL/L与25~100 μL/L处理组间存在显著差异。采用25~100 μL/L添加量的乙烯催熟(20 ℃)‘红阳’猕猴桃,3~5 d即可完成快速软化,且软化后不同添加量处理组间SSC和TA质量分数无显著差异。因此在温度实验中选取较低添加量的25 μL/L乙烯处理即可完成催熟。
2.3 不同温度下乙烯催熟对‘红阳’猕猴桃后熟的影响
在不同温度下采用乙烯处理,较早采收的T1批次果实硬度变化呈现了慢-快-慢的三段式曲线[13],在较晚采收的T2批次中,由于采收时成熟度较高,呈现快-慢的两段式曲线[27](图2A1、A2)。两个批次20 ℃下25 μL/L乙烯处理组果实在催熟后第1天硬度就表现出明显的下降,且在所有处理组中下降速率最快,T1、T2批次猕猴桃分别在第5天、第3天由采收时的57.53 N和46.65 N下降到小于10 N,第7天、第4天达到5 N左右。20 ℃下两个批次的对照组(0 μL/L)果实在0~5 d内果实硬度几乎没有下降,之后出现快速下降,在10~12 d低于5 N。10 ℃下T1、T2批次中的乙烯处理组与对照组间的果实硬度变化很相似,达到10 N的时间为贮藏后1~17 d且随后能维持稳定一段时间。对比T1、T2批次,20 ℃下贮藏的果实与10 ℃相比,果实软化进程加速,更快达到可食用阶段。

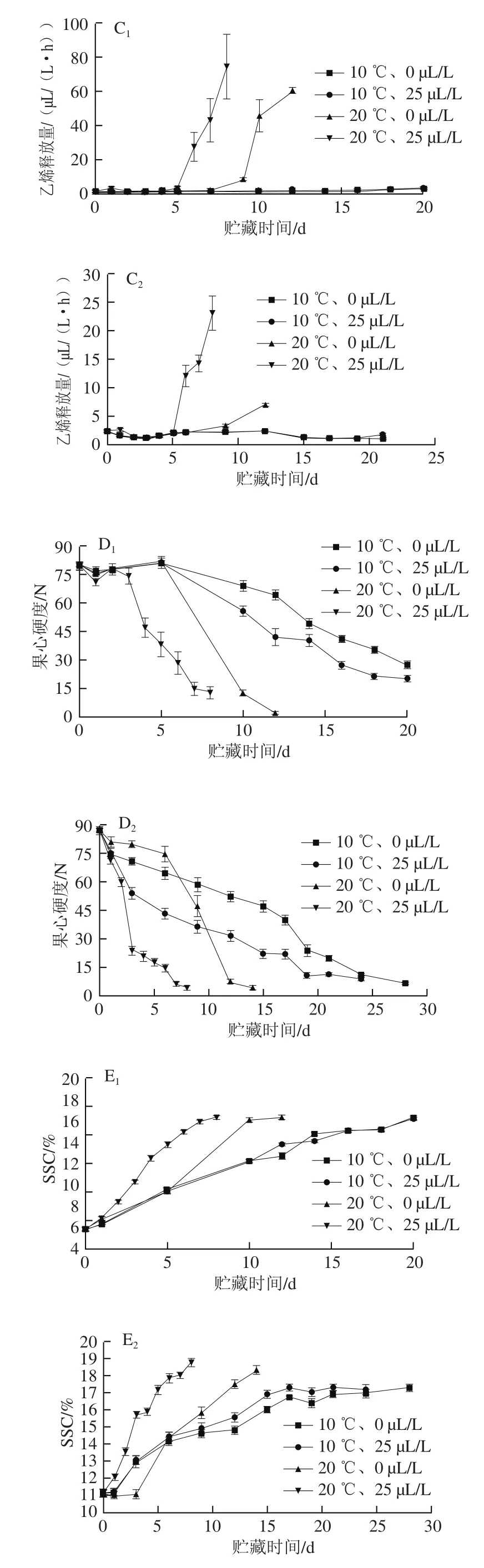

图2 10 ℃和20 ℃下乙烯催熟对‘红阳’猕猴桃果实硬度(A1、A2)、呼吸速率(B1、B2)、乙烯释放量(C1、C2)、果心硬度(D1、D2)、SSC(E1、E2)、TA质量分数(F1、F2)的影响Fig. 2 Changes in fruit firmness (A1, A2), respiration rate (B1, B2),ethylene production (C1, C2), core firmness (D1, D2), SSC (E1, E2) and TA(F1, F2) of ‘Hongyang’ kiwifruits with ethylene ripening at 10 and 20 ℃
猕猴桃的硬度下降与采收时果实成熟度和采后处理温度、时间及乙烯添加量有关[28]。本研究中,猕猴桃呼吸速率变化受到乙烯添加量和温度的影响(图2B1、B2),直观地反映在果实硬度的变化。T1、T2批次中25 μL/L乙烯催熟的两个处理组果实在外源乙烯的作用下,第1~2天最先出现呼吸高峰,果实硬度开始下降,之后20 ℃乙烯处理组呼吸速率有所回落但始终高于初始水平,而10 ℃乙烯处理组果实的呼吸速率也在催熟后贮藏第1天升高,特别是T1批次呼吸速率升高至1.16 g CO2/(kg·h),之后逐渐下降至初始水平并保持稳定。20 ℃下T1、T2批次的对照组果实硬度有一个短期的维持(3~5 d),之后果实硬度开始快速下降,对应呼吸速率分别在第5天和第3天开始升高,直到第9~10天达到呼吸高峰,此阶段正是果实硬度的快速下降阶段;而10 ℃对照组呼吸速率始终处于初始水平,没有明显的呼吸高峰出现。因此,即使外源乙烯的作用会加快猕猴桃呼吸高峰的到来并启动果实软化,去除外源乙烯后,随后的呼吸速率和硬度变化更多的是受到温度的影响。
从果实的乙烯释放量(图2C1、C2)可以看出,催熟处理后,两个批次各个处理组的果实在贮藏期1~4 d内乙烯释放量并没有立即升高,说明猕猴桃受到外源乙烯的影响后,果实合成内源乙烯的机制并没有立即启动。对于T1、T2批次猕猴桃,20 ℃、25 μL/L乙烯处理组乙烯释放量明显的增加均出现在第5天以后,20℃、0 μL/L乙烯处理组均出现在9~10 d,此时果实硬度均低于10 N。有研究也表明,猕猴桃只有在完全熟化至硬度降低到10 N以下才开始大量产生内源乙烯[29],因此在硬度较高时内源乙烯引起猕猴桃软化的作用很十分小。
果心硬度的下降趋势与果实硬度很相似(图2D1、D2)。T1批次20 ℃、25 μL/L的果心硬度在贮藏期0~3 d短暂地维持平衡,随后快速下降,此时对应的果实硬度也处于快速下降期;T2批次20 ℃、25 μL/L的果心硬度在0~3 d快速下降,与果实硬度变化速率一致,随后缓慢下降;10 ℃下T1、T2批次的果心硬度分别在第5天、第1天快速下降,同步于果实硬度的快速下降期。果心硬度始终高于果实硬度,且贮藏在20 ℃下猕猴桃最终果心硬度明显低于10 ℃下贮藏的果实。Li Huajia等[30]研究结果表明,‘海沃德’猕猴桃在低温0 ℃下贮藏,果心硬度呈线性速率下降,且在同一贮藏时间获得的猕猴桃的果心硬度高于果实硬度;MacRae等[26]发现,在0 ℃下贮藏的猕猴桃与采收后在20℃下熟化的猕猴桃相比,果心硬度与果实硬度之间的差异更大;Marsh等[31]也对果实硬度处于4.4~7.3 N的一批果实进行感官评价发现,4 ℃和10 ℃下成熟的果实比在0 ℃贮藏的果实其果心硬度以及果实纤维质口感更佳,由此可见低温抑制了果心硬度的下降。另外,对比T1、T2批次中10 ℃乙烯处理组和对照组发现,两组间的果心硬度之差明显大于果实硬度之差,在果心硬度快速下降阶段,25 μL/L处理组的果心硬度始终低于其对照组,随果心硬度逐渐降低,两者间差距也逐渐缩小,说明外源乙烯催熟有助于果心硬度的下降。
经过一段时间的贮藏,T1批次中‘红阳’猕猴桃各组处理果实的最终SSC均在16.0%左右,T2批次的SSC均大于17%(图2E1、E2);T1、T2批次各处理组的TA质量分数均在0.20%~0.25%范围内(图2F1、F2)。Marsh等[30]研究认为在不同温度下后熟的果实,其酸的组成成分存在差异,贮藏温度会改变果实内部柠檬酸、苹果酸和奎尼酸这3 种主要酸之间的平衡,高温加速果实的呼吸速率[32],从而加速特定的酸代谢[33]。
综合可知,在较高温度(20 ℃)下,外源乙烯能加快猕猴桃呼吸高峰的到来,增加乙烯释放量,缩短猕猴桃熟化进程;在较低温度(10 ℃)下,外源乙烯虽在一定程度上增加了呼吸强度,但很快回归到初始水平,同时乙烯释放量始终保持初始水平,其软化进程与对照组相似,表明温度是影响乙烯的催熟作用重要因素。
3 结 论
不同成熟度采收的‘红阳’猕猴桃经乙烯催熟24 h后,贮藏第5天其果实硬度均达到可食用状态,但只有当猕猴桃达到一定成熟度(DM质量分数大于17%)时,催熟软化后的果实才有一个好的食用体验,可被消费者接受。而采用不同添加量的乙烯(0~100 μL/L)催熟‘红阳’猕猴桃,25~100 μL/L添加量的乙烯处理组间果实硬度、果心硬度、SSC和TA质量分数4 个指标基本均无显著性差异且均可达到食用要求,选择较低添加量的25 μL/L催熟处理即可加速猕猴桃的软化进程。温度是影响乙烯的催熟作用重要因素,在较高温度(20 ℃)下,乙烯催熟可明显缩短软化进程,在较低温度(10 ℃)下,乙烯催熟效果不明显。
红阳猕猴桃可以通过适当提早采收、人工催熟后食用,或是将正常采收后硬度较高的果实进行人工催熟,既能提早上市、缩短熟化周期,又能保持较好的猕猴桃风味和品质,满足消费的需求。本实验研究了采收期、乙烯添加量和温度对催熟后果实的生理影响,对‘红阳’猕猴桃人工催熟的方案进行了探讨,为猕猴桃人工催熟技术的进一步研究提供了理论参考。
参考文献:
[1] 屈振江, 周广胜. 中国主栽猕猴桃品种的气候适宜性区划[J]. 中国农业气象, 2017, 38(4): 257-266. DOI:10.3969/j.issn.1000-6362.2017.04.007.
[2] 叶昕, 李昆同. “红阳”猕猴桃采收成熟度及1-MCP对果实保鲜的效果[J]. 四川农业大学学报, 2011, 29(3): 374-377. DOI:10.3969/j.issn.1000-2650.2011.03.014.
[3] 丁捷, 刘书香, 宋会会, 等. 红阳猕猴桃果实生长发育规律[J]. 食品科学, 2010, 31(20): 473-476.
[4] 李敏. 乙烯调控早熟苹果果实软化和裂果机理的初步研究[D].泰安: 山东农业大学, 2013: 1-4.
[5] LIM S, LEE J G, LEE E J. Comparison of fruit quality and GCMS-based metabolite profiling of kiwifruit ‘Jecy green’: natural and exogenous ethylene-induced ripening[J]. Food Chemistry, 2017, 234:81-92. DOI:10.1016/j.foodchem.2017.04.163.
[6] GUNTHER C S, MARSH K B, WINZ R A, et al. The impact of cold storage and ethylene on volatile ester production and aroma perception in ‘Hort16A’ kiwifruit[J]. Food Chemistry, 2015, 169: 5-12.DOI:10.1016/j.foodchem.2014.07.070.
[7] 李岩. 乙烯在薄皮甜瓜果实香气物质合成中的作用与调控[D]. 沈阳: 沈阳农业大学, 2012: 41-42.
[8] BURDON J, PIDAKALAP P, MARTIN P, et al. Postharvest performance of the yellow-fleshed ‘Hort16A’ kiwifruit in relation to fruit maturation[J]. Postharvest Biology and Technology, 2014, 92:98-106. DOI:10.1016/j.postharvbio.2014.01.004.
[9] 廉韶斌, 郝利平, 王愈. 不同温度下香蕉催熟过程中品质变化的研究[J]. 食品科技, 2014, 39(12): 54-58. DOI:10.13684/j.cnki.spkj.2014.12.011.
[10] 贾晓辉, 王文辉, 佟伟, 等. 温度和乙烯对京白梨后熟进程及其品质的影响[J]. 食品科学, 2010, 31(16): 282-285.
[11] 张秀玲, 张敏, 唐国宪. 不同催熟条件对果实成熟特性影响[J]. 北方园艺, 2002(2): 54-56. DOI:10.3969/j.issn.1001-0009.2002.02.037.
[12] HERTOG M L, JEFFERY P B, GWANPUA S G, et al. A mechanistic model to describe the effects of time, temperature and exogenous ethylene levels on softening of kiwifruit[J]. Postharvest Biology and Technology, 2016, 121: 143-150. DOI:10.1016/j.postharvbio.2016.08.002.
[13] BONGHI C, PAGNI S, VIDRIH R, et al. Cell wall hydrolases and amylase in kiwifruit softening[J]. Postharvest Biology and Technology,1996, 9(1): 19-29. DOI:10.1016/0925-5214(96)00025-7.
[14] STEC M G, HODGSON J A, MACRAE E A, et al. Role of fruit firmness in the sensory evaluation of kiwifruit (Actinidia deliciosa cv Hayward)[J]. Journal of the Science of Food and Agriculture, 1989,47(4): 417-433. DOI:10.1002/jsfa.2740470404.
[15] CROSOSTO G U, MITCHELL F G, ARPAIA M L. The effect of growing location and harvest maturity on the storage performance and quality of Hayward kiwifruit[J]. Journal of the American Society for Horticultural Science, 1984, 109(4): 584-587.
[16] BURDON J, PIDAKALA P, MARTIN P, et al. Fruit maturation and the soluble solids harvest index for Hayward kiwifruit[J].Scientia Horticulturae, 2016, 213: 193-198. DOI:10.1016/j.scienta.2016.10.027.
[17] WANG Mingzhong, LI Mingzhang, MENG Aiguo. Selection of a new red-fleshed kiwifruit cultivar ‘Hongyang’[J]. Acta Horticulturae, 2003,610: 115-117.
[18] LI Huajia, ZHU Yongqing, LUO Fangyao, et al. Use of controlled atmospheres to maintain postharvest quality and improve storage stability of a novel red-fleshed kiwifruit (Actinidiachinensis Planch.var. rufopulpa)[C.F. Liang et R.H. Huang]C.F. Liang et A.R.Ferguson)[J]. Journal of Food Processing and Preservation, 2015, 39:907-914. DOI:10.1111/jfpp.12303.
[19] 农业部. 猕猴桃采收与贮运技术规范: NY/T 1392—2015[S]. 北京:中国标准出版社, 2015: 1-4.
[20] 黄涛. 大棚栽培条件下红阳猕猴桃生长发育及果实品质的研究[D].雅安: 四川农业大学, 2012: 1-2.
[21] SALTVEIT M E. Effect of ethylene on quality of fresh fruits and vegetables[J]. Postharvest Biology and Technology, 1999, 15(3): 279-292. DOI:10.1016/S0925-5214(98)00091-X.
[22] 郑明锋. 乙烯催熟香蕉品质变化的动态数学模型[J]. 中国农学通报,2006, 22(10): 311-315. DOI:10.3969/j.issn.1000-6850.2006.10.075.
[23] HOPPING M E. Structure and development of fruit and seeds in Chinese gooseberry (Actinidia Chinensis Planch.)[J]. New Zealand Journal of Botany, 1976, 14(1): 63-68. DOI:10.1080/002882 5X.1976.10428651.
[24] JACKSON P J, HARKER F R. Changes in firmness of the outer pericarp, inner pericarp, and core of Actinidia species during ripening[J]. New Zealand Journal of Experimental Agriculture, 1997,25: 185-189. DOI:10.1080/01140671.1997.9514005.
[25] WHITE A, DE SILVA H N, REQUEJO-TAPIA C, 等. 猕猴桃属14个物种果实软熟性状评价[C]. 吉首: 中国园艺学会猕猴桃分会首届学术及产品发展研讨会, 2004: 217-225.
[26] MACRAE E A, BOWEN J H, STEC M G H. Maturation of kiwifruit(Actinidia deliciosa cv Hayward) from two orchards: differences in composition of the tissue zones[J]. Journal of the Science of Food and Agriculture, 1989, 47(4): 401-416. DOI:10.1002/jsfa.2740470403.
[27] MACRAE E A, LALLU N, SEARLEA N, et al. Changes in the softening and composition of kiwifruit (Actinidia deliciosa) affected by maturity at harvest and postharvest treatments[J]. Journal of the Science of Food and Agriculture, 1989, 49(4): 413-430. DOI:10.1002/jsfa.2740490404.
[28] HERTOG M L, NOCHOlSON S E, JEFFERY P B. The effect of modified atmospheres on the rate of firmness change of ‘Hayward’kiwifruit[J]. Postharvest Biology and Technology, 2004, 31(3): 251-261.DOI:10.1016/j.postharvbio.2003.09.005.
[29] RITENOUR M A, CRISOSTO C H, GAMER D T, et al. Temperature,length of cold storage and maturity influence the ripening rate of ethylene-preconditioned kiwifruit[J]. Postharvest Biology and Technology, 1999, 15(2): 107-115. DOI:10.1016/S0925-5214(98)00074-X.
[30] LI Huajia, BILLING D, PIDAKALA P, et al. Textural changes in ‘Hayward’ kiwifruit during and after storage in controlled atmospheres[J]. Scientia Horticulturae, 2017, 222: 40-45.DOI:10.1016/j.scienta.2017.05.013.
[31] MARSH K, ATTANAYAKE S, WALKER S, et al. Acidity and taste in kiwifruit[J]. Postharvest Biology and Technology, 2004, 32(2): 159-168. DOI:10.1016/j.postharvbio.2003.11.001.
[32] 刘晓燕, 王瑞, 梁虎, 等. 不同温度贮藏贵长猕猴桃采后生理和品质变化[J]. 江苏农业科学, 2015, 43(6): 264-267. DOI:10.15889/j.issn.1002-1302.2015.06.086.
[33] CRISOSTO C H, CRISOSTO G M. Understanding consumer acceptance of early harvested ‘Hayward’ kiwifruit[J]. Postharvest Biology and Technology, 2001, 22(3): 205-213. DOI:10.1016/S0925-5214(01)00097-7.
