草苁蓉多糖对氧化应激所致血管内皮细胞凋亡的抑制作用
2018-05-25崔香丹朱洁波刘莉园全吉淑尹学哲
崔香丹,何 鑫,朱洁波,刘莉园,全吉淑,*,尹学哲,*
血管内皮细胞覆盖于血管内壁表面的单层扁平或多角形的细胞,组成血管第1道屏障,可分泌血管活性物质,具有调节血流、参与物质交换、调节血压、抑制血小板聚集及血栓形成等功能,其损伤是引起高血压和动脉粥样硬化等心脑血管疾病发病的关键因素[1-2]。血管内皮细胞损伤多与氧化应激有关,当血管内皮细胞处于氧化应激状态时会诱导细胞内活性氧(reactive oxygen species,ROS)大量生成,导致细胞氧化损伤和功能障碍[1-2]。引起内皮细胞损伤的因素有多种,如过氧化氢、氧化低密度脂蛋白、末端晚期糖基化终末产物、血管紧张素Ⅱ、细菌脂多糖、肿瘤坏死因子-α等[1-2]。过氧化氢是目前应用最为广泛的氧化应激损伤剂之一,易透过细胞膜,可诱导内皮炎症和内皮细胞凋亡[1-4]。叔丁基过氧化氢(tert-butyl hydroperoxide,tBHP)是近年来常用的稳定的氧化应激损伤剂,损伤机制基本与过氧化氢相同,但具有稳定、不易分解的优势[1,5]。故本研究采用tBHP损伤血管内皮细胞制备其氧化应激损伤模型。
草苁蓉(Boschniakia rossica Fedtsch. et Flerov.)为列当科草苁蓉属多年生寄生性草本植物,具有延年益寿、滋补强身、补肾壮阳以及润肠止血等功效[5-8]。近年来的研究表明,草苁蓉具有抗氧化、抗炎、保肝及抗癌等作用[6-8]。草苁蓉多糖(Boschniakia rossica polysaccharides,BRPS)是草苁蓉的重要活性成分[9-12],无毒且具有抗高脂血症和免疫增强等功能[9-10],提示其在抗动脉硬化方面的应用潜能。本课题组新近研究还发现,BRPS对氧化应激所致肝细胞氧化损伤及凋亡具有抑制作用[11-12],鉴于其较强的抗氧化作用以及抗肝细胞氧化应激能力,推测BRPS可能对血管内皮细胞的氧化应激损伤也有保护作用。但目前为止,BRPS对血管内皮细胞损伤的保护作用尚不清楚。因此,本研究采用tBHP诱导血管内皮细胞氧化损伤模型,探讨BRPS对血管内皮细胞氧化损伤以及凋亡的抑制作用,旨在为草苁蓉的开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
人脐静脉血管内皮细胞(human umbilical vein endothelial cell,HUVEC) 南京凯基生物技术有限公司;DMEM培养基 以色列Bioind公司;胎牛血清 美国Gemini公司;四甲基偶氮唑盐(methylthiazolyldiphenyl-tetrazolium bromide,MTT)、胰蛋白酶、小鼠β-actin抗体、兔抗小鼠二抗、羊抗兔二抗美国Sigma-Aldrich公司;丙二醛(malondialdelyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、还原型谷胱甘肽(reduced glutathione,GSH)测试盒 南京建成科技有限公司;Hoechst33342、ROS测试盒、JC-1线粒体跨膜电位(mitochondrial membrane potentials,ΔΨm)测试盒、原位末端标记(TdT-mediated dUTP nick end labeling,TUNEL)细胞凋亡测试盒、细胞浆蛋白提取试剂盒、细胞线粒体分离试剂盒 碧云天生物技术有限公司;兔Bcl-2抗体、兔Bax抗体、兔细胞色素c(cytochrome c,Cyt c)抗体、小鼠Bid抗体、兔Caspase-3抗体、兔Caspase-3抗体、兔Caspase-8抗体、兔Caspase-9抗体、兔Cyt c氧化酶IV(Cyt c oxidase IV,Cox4)抗体 美国Cell Signaling Technology公司。
1.2 仪器与设备
二氧化碳细胞培养箱 美国Shel Lab公司;高速冷冻离心机 德国Eppendorf公司;酶标仪 深圳雷杜公司;迷你垂直板电泳仪、迷你转印槽 美国Bio-Rad公司;化学发光凝胶成像分析系统 上海培清科技有限公司。
1.3 方法
1.3.1 BRPS的提取及活性成分测定
BRPS采用常规醇沉法提取,用Sevag法除蛋白质[13]。用苯酚-硫酸法[14]测定其多糖质量分数为86.5%。
1.3.2 BRPS对HUVEC毒性的测定
细胞于含体积分数10%胎牛血清的DMEM培养液中进行常规培养及传代。取对数生长期细胞接种于96 孔板,使细胞密度为5×104个/mL。待细胞完全贴壁后,换入含BRPS的无血清培养液使其质量浓度分别为12.5、25.0、50.0、100.0、200.0 mg/L。24 h后,MTT法测定570 nm波长处的OD值,并根据下式计算细胞存活率[5]。以细胞存活率大于等于90%为标准确定BRPS安全剂量[15]。
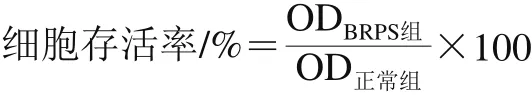
DOI:10.7506/spkx1002-6630-201809020
中图分类号:TS201.2;R285.5 文献标志码:A 文章编号:1002-6630(2018)09-0127-07
引文格式:崔香丹, 何鑫, 朱洁波, 等. 草苁蓉多糖对氧化应激所致血管内皮细胞凋亡的抑制作用[J]. 食品科学, 2018, 39(9):127-133. DOI:10.7506/spkx1002-6630-201809020. http://www.spkx.net.cn
CUI Xiangdan, HE Xin, ZHU Jiebo, et al. Inhibition of Boschniakia rossica polysaccharides on oxidative stress-induced apoptosis in vascular endothelial cells[J]. Food Science, 2018, 39(9): 127-133. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201809020. http://www.spkx.net.cn
1.3.3 BRPS对tBHP损伤HUVEC存活率的影响
取对数生长期细胞接种于96 孔板,贴壁后换入BRPS无血清培养液使BRPS质量浓度分别为100、50、25 mg/L,依次记为BRPS100组、BRPS50组和BRPS25组(BRPS高、中和低剂量组)。培养24 h后,损伤组和BRPS各剂量组加tBHP溶液使其质量浓度为200 μmol/L,损伤12 h,正常组细胞则换入正常培养液。用MTT法测定各组细胞存活率。
1.3.4 细胞ROS水平的检测
采用二氯荧光素乙酰乙酸盐(dichlorofluorescein diacetate,DCFH-DA)法检测[16]。取对数生长期细胞接种于6 孔板爬片内,细胞分组及处理同上。细胞固定后,换入DCFH-DA无血清培养液,避光孵育20 min。封片后在荧光显微镜下观察,并用Image J软件进行自动荧光定量分析。ROS作用下生成的二氯荧光素(dichlorofluorescein,DCF)可产生强绿色荧光,根据其荧光强度可衡量细胞内ROS水平[16]。
1.3.5 细胞MDA、GSH水平和SOD活力的检测
将细胞接种于6 孔板,细胞分组和损伤处理同上。收集并裂解细胞,离心取上清液。按照测试盒说明书操作步骤测定细胞MDA、GSH含量和SOD活力。
1.3.6 ΔΨm的检测
细胞线粒体跨膜电位(mitochondrial membrane potentials,ΔΨm)采用JC-1染色法检测[17]。细胞分组及处理、制作爬片和固定方法同上。细胞固定后,换入JC-1染色工作液,避光孵育20 min。封片后在荧光显微镜下观察。ΔΨm高时,JC-1可形成聚合物,产生红色荧光;ΔΨm较低时,JC-1为单体,产生绿色荧光,可根据红、绿色荧光比值衡量ΔΨm水平[17]。
1.3.7 Hoechst染色法检测细胞凋亡
采用Hoechst33342染色法检测[18]。分组及处理、制作爬片和固定方法同上。细胞固定后,换入Hoechst33342染色液,封片后在荧光显微镜下观察。细胞发生凋亡时,因细胞膜通透性升高,Hoechst33342染色液进入细胞内与已受损的DNA结合发出强蓝色荧光,而正常细胞则发出均匀弥散的弱荧光,可根据细胞形态特征及荧光强度可综合评价细胞凋亡水平[18]。
1.3.8 TUNEL染色法检测细胞凋亡
TUNEL染色技术被认为是检测细胞凋亡的金标准[19]。分组及处理同上。制作爬片和固定细胞,换入TUNEL检测液,避光孵育60 min。封片后在荧光显微镜下观察[19],并用Image J软件进行自动荧光定量分析。
1.3.9 Western blot法检测细胞Bax、Bcl-2、Cyt c、tBid、Caspase蛋白的表达
将细胞接种于培养皿中,细胞分组和损伤处理同上。收集细胞,提取总蛋白、胞浆蛋白和线粒体蛋白。依次进行电泳、转膜、一抗及二抗孵育,化学发光法显色后进行灰度分析[20]。
1.4 数据统计分析
结果以 ±s表示。利用SPSS 20.0统计软件,采用单因素方差分析和t检验进行数据分析,P<0.05为差异有统计学意义。
2 结果与分析
2.1 BRPS对HUVEC的毒性
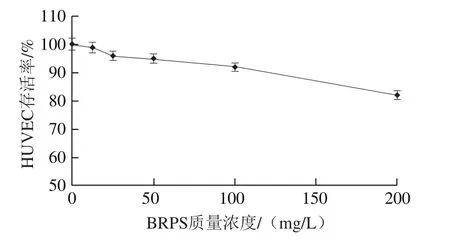
图1 BRPS对HUVEC的毒性Fig. 1 Cell toxicity of BRPS on HUVEC
研究表明,BRPS高质量浓度时具有一定的细胞毒性[11-12]。因此,首先用MTT法检测单纯BRPS对HUVEC存活率的影响,结果见图1。BRPS质量浓度小于等于100 mg/L时,HUVEC存活率均大于90%,与正常组比较,差异无统计学意义(P>0.05),不显示细胞毒性。因此,本研究选取100、50、25 mg/L作为BRPS干预剂量进行后续研究。
2.2 BRPS对tBHP损伤HUVEC存活率的影响
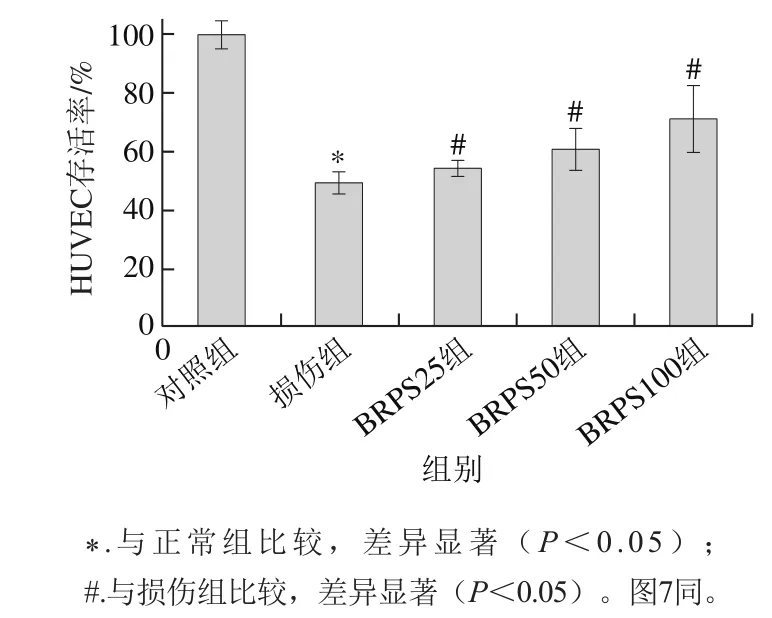
图2 BRPS对tBHP损伤HUVEC存活率的影响Fig. 2 Effect of BRPS on viability of HUVEC injured by tBHP
tBHP是氧化应激损伤剂,可诱发细胞内自由基生成,并引发细胞膜的脂质过氧化,导致细胞损伤和死亡[2,16]。由图2可知,与正常组比较,tBHP损伤组HUVEC存活率显著降低(P<0.05),为(49.4±4.1)%;而BRPS高、中和低剂量组HUVEC存活率分别为(71.3±11.2)%、(60.8±7.3)%和(54.3±3.2)%,与损伤组比较升高44.3%、23.1%和9.9%,差异显著(P<0.05)。提示BRPS预处理能抑制tBHP所致HUVEC氧化应激损伤。
2.3 BRPS对tBHP损伤HUVEC ROS水平的影响
tBHP是氧化应激损伤剂,氧化应激所致ROS在细胞内过量蓄积是引发血管内皮细胞损伤的主要原因[2]。荧光探针DCFH-DA本身没有荧光,但在细胞内可水解成DCFH,继而被过量ROS氧化生成DCF并发出绿色荧光[16]。

图3 BRPS对tBHP诱导的ROS生成的影响Fig. 3 Effect of BRPS on tBHP-induced ROS formation in HUVEC
如图3所示,与正常组比较,损伤组细胞产生强绿色荧光,荧光强度增高44 倍,提示细胞内ROS水平升高;而BRPS高、中和低剂量组细胞则产生微弱绿色荧光,与损伤组比较荧光强度分别下降93.1%、82.2%和64.6%,差异显著(P<0.05);且随BRPS质量浓度的升高,荧光强度呈减弱趋势;提示BRPS预处理降低细胞内ROS水平。
2.4 BRPS对HUVEC MDA、GSH、SOD水平的影响
氧化应激主要来源于细胞内自由基生成增多及抗氧化防御体系破坏;打破机体的氧化与抗氧化平衡,机体便会产生氧化应激损伤[20-21]。SOD等抗氧化酶及GSH等抗氧化剂可共同形成细胞内抗氧化防御体系,有效对抗细胞内氧化应激损伤[20-21]。
由表1可见,与正常组比较,损伤组内皮细胞SOD活力和GSH含量显著降低(P<0.05),MDA水平显著升高(P<0.05);与损伤组比较,BRPS组内皮细胞SOD活力与GSH含量显著升高(P<0.05),MDA水平显著降低(P<0.05),提示BRPS预处理可上调HUVEC抗氧化防御能力。

表1 BRPS对HUVEC SOD活力、GSH和MDA含量的影响(n= 6)Table 1 Effect of BRPS on SOD activity, and GSH and MDA contents of HUVEC (n= 6)
2.5 BRPS对HUVEC ΔΨm的影响
线粒体是氧化磷酸化进行的场所,也是ROS产生的主要场所[3,17]。当细胞内积累过量ROS时,线粒体膜结构受损,线粒体渗透性转换通道继而开放,导致ΔΨm下降[3,17]。而这种ΔΨm的下降被认为是细胞凋亡过程中最早发生的事件[22]。JC-1是检测ΔΨm的荧光探针,ΔΨm较高时,在线粒体基质中形成聚合物,产生红色荧光;ΔΨm较低时,不能形成聚合物而形成单体,产生绿色荧光[17]。

图4 BRPS对HUVEC ΔΨm水平的影响Fig. 4 Effect of BRPS on ΔΨm of HUVEC
如图4所示,与正常组比较,损伤组内皮细胞ΔΨm降低;与损伤组比较,BRPS组细胞ΔΨm增高,随BRPS剂量的升高,红色荧光呈增强趋势;绿色荧光呈减弱趋势;提示BRPS抑制tBHP所致HUVEC ΔΨm的下降。
2.6 HUVEC Hoechst33342染色结果
氧化应激诱导的血管内皮细胞损伤以及继发的细胞凋亡是心血管疾病发生的核心事件[23]。Hoechst33342是可穿透细胞膜的蓝色荧光染料,可用于细胞凋亡的检测。它使正常细胞发出较弱蓝色荧光,而细胞发生凋亡时,细胞膜通透性发生改变,染色液大量进入细胞内,加上细胞DNA结构受损,结合增强,荧光强度变强[18]。

图5 HUVEC Hoechst33342染色结果Fig. 5 Hoechst33342 staining of HUVEC
由图5可见,正常组细胞蓝色荧光弱,染色均匀弥散,细胞数量较多。损伤组细胞荧光强,细胞数量明显减少,可见细胞核发生固缩、核内呈颗粒状明亮蓝色荧光,出现明显凋亡特征。BRPS组细胞核内颗粒状明亮蓝色荧光呈逐渐减弱趋势,大部分细胞蓝色荧光均匀弥散,接近正常组细胞特征。
2.7 BRPS对HUVEC凋亡的影响
细胞凋亡具有特定的生物化学和形态学变化特征,常用的检测方法有形态学检测、DNA片段化、线粒体膜电位、TUNEL法等,而TUNEL染色技术被认为是检测细胞凋亡的金标准[19]。


图6 BRPS对tBHP诱导的HUVEC凋亡的影响Fig. 6 Effect of BRPS on tBHP-induced apoptosis in HUVEC
如图6所示,正常组几乎看不到凋亡细胞;损伤组部分细胞出现核固缩等早期凋亡特征,与正常组比较,凋亡细胞明显增多;与损伤组比较,BRPS组凋亡细胞明显减少,BRPS高、中和低剂量组荧光强度分别下降59.1%、46.9%和32.5%,差异显著(P<0.05);且随BRPS剂量的升高呈递减趋势。提示BRPS抑制tBHP所致HUVEC凋亡。
2.8 BRPS对HUVEC Caspase活化的影响
细胞凋亡主要有线粒体凋亡途径、死亡受体途径以及内质网应激途径,而Caspase活化是细胞凋亡的典型生物化学特征,前二者分别以Caspase9和Caspase8为该途径的关键酶,激活下游的凋亡执行者Caspase3,完成凋亡通路的最后共同环节[24-25]。
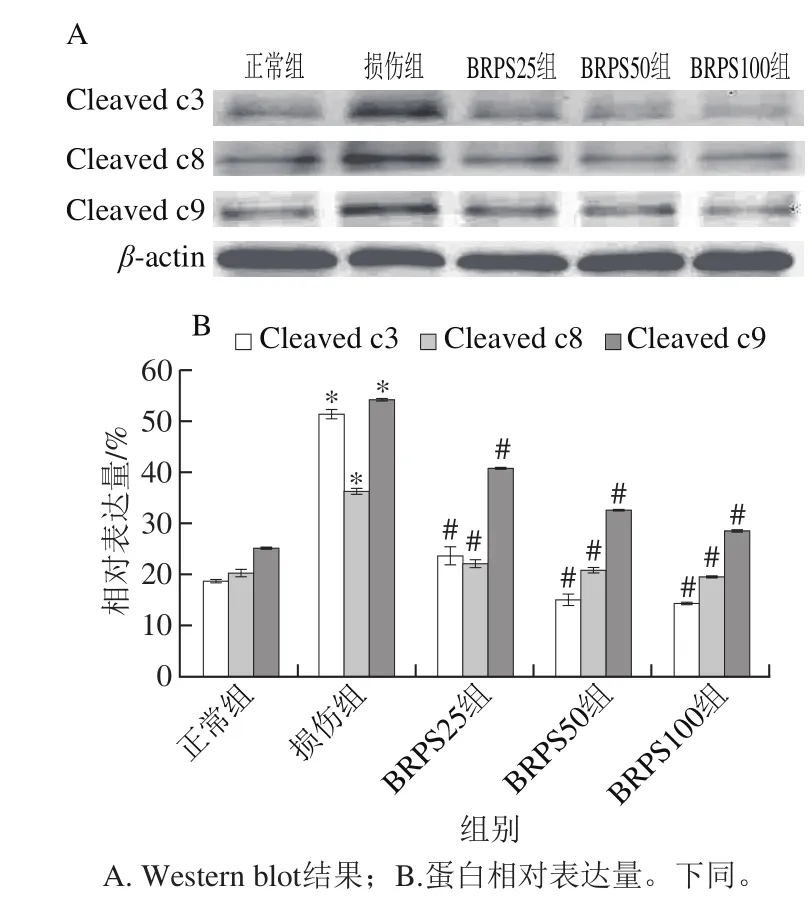
图7 BRPS对HUVEC Caspase活化片段表达的影响Fig. 7 Effect of BRPS on the expression of active caspase subunits in HUVEC
由图7可见,与正常组比较,损伤组细胞Caspase活化片段Cleaved caspase3(Cleaved c3)、Cleaved caspase8(Cleaved c8)和Cleaved caspase9(Cleaved c9)表达显著升高(P<0.05),分别为正常组的2.8、2.1 倍和3.0 倍;与损伤组比较,BRPS组细胞Caspase活化片段Cleaved c3、Cleaved c8、Cleaved c9表达显著降低(P<0.05),其中BRPS高剂量组中各活化片段的表达分别下降70.6%、45.9%和47.2%,提示BRPS抑制tBHP所致HUVEC Caspase的活化,从而抑制HUVEC凋亡。
2.9 BRPS对HUVEC胞浆Cyt c蛋白表达的影响
线粒体在细胞凋亡中处于核心地位[3]。线粒体膜通透性的改变以及ΔΨm的下降使Cyt c从线粒体释放至胞浆中,激活Caspase9及其下游的Caspase-3,从而诱导Caspase依赖性的经典线粒体凋亡途径[3,26]。
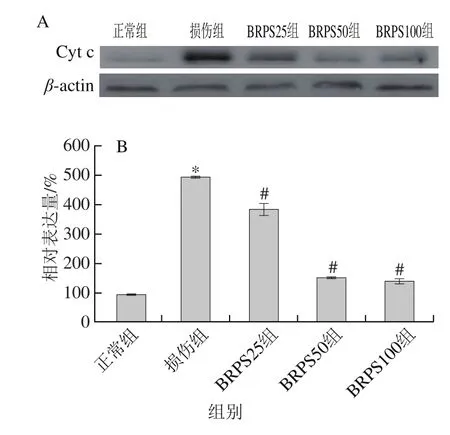
图8 BRPS对HUVEC胞浆Cyt c水平的影响Fig. 8 Effect of BRPS on cytoplasmic Cyt c in HUVEC
如图8所示,与正常组比较,损伤组HUVEC胞浆Cyt c蛋白水平显著升高(P<0.05),为正常组的5.4 倍;与损伤组比较,BRPS组HUVEC胞浆Cyt c蛋白水平显著下降(P<0.05),BRPS高、中和低剂量组中分别下降71.4%、69.4%和22.4%;提示BRPS减少tBHP所致HUVEC线粒体Cyt c的释放,抑制Caspase依赖的HUVEC凋亡。
2.1 0 BRPS对HUVEC Bcl-2、Bax和Bid蛋白表达的影响
Bcl-2家族在细胞凋亡过程中起关键作用,按功能可分为抗凋亡和促凋亡蛋白,后者又分成多结构域蛋白和只有BH3结构蛋白,代表性成员分别有Bax和Bid等[18,27]。抗凋亡成员,如Bcl-2,可保护线粒体完整性,阻止Cyt c释放以及随后的Caspase9活化,因此,抗凋亡成员和促凋亡成员之间平衡决定着细胞存亡,与细胞凋亡关系密切[18,28]。Bid蛋白可介导死亡受体凋亡途径,经Caspase8切割形成有活性的Bid截短片段(truncated Bid,tBid),转移至线粒体上,促进Cyt c的释放,从而导致Caspase9和Caspase3的激活[29]。

图9 BRPS对HUVEC Bcl-2和Bax蛋白表达的影响Fig. 9 Effect of BRPS on the expression of Bcl-2 and Bax proteins in HUVEC

图10 BRPS对HUVEC线粒体tBid水平的影响Fig. 10 Effect of BRPS on mitochondrial tBid of HUVEC
如图9、10所示,与正常组比较,损伤组细胞Bax蛋白表达上调1.5 倍,Bcl-2蛋白表达下调0.5 倍,Bax/Bcl-2比值升高2.8 倍,线粒体tBid水平升高1.1 倍,差异均显著(P<0.05);与损伤组比较,BRPS高、中和低剂量组细胞Bax相对表达量分别降低57.1%、44.3%和19.0%,Bcl-2相对表达量分别升高136.4%、27.3%和9.1%,Bax/Bcl-2比值分别下降81.9%、56.3%和25.8%,线粒体tBid水平分别下降45.5%、44.5%和36.4%,差异显著(P<0.05),提示BRPS可通过阻止Bid活化以及降低Bax/Bcl-2比值而抑制HUVEC凋亡。
3 讨 论
氧化应激是常见的应激损伤,主要表现为细胞内生成过量ROS,并造成细胞损伤和死亡。血管内皮细胞对氧化应激非常敏感,过量ROS可使内皮细胞膜脂质、蛋白质和核酸发生变性损伤,导致内皮细胞结构受损和功
能丧失[1]。tBHP是氧化应激诱导剂,以tBHP为损伤剂构建内皮细胞氧化应激损伤模型已非常普遍和成熟[30-32]。本实验结果显示,tBHP对HUVEC显示细胞毒性,表现为细胞存活率降低,ROS生成水平升高,抗氧化防御能力下降,线粒体Cyt c的释放增多,ΔΨm下降,细胞凋亡增多。提示tBHP引发HUVEC氧化应激损伤,导致HUVEC凋亡,这与前人报道相吻合[30-32]。本研究结果显示,BRPS预处理能增高HUVEC存活率,降低细胞ROS水平,增强抗氧化防御能力,升高ΔΨm水平,抑制细胞凋亡,提示BRPS能改善tBHP诱导的HUVEC氧化应激损伤,抑制细胞凋亡。从分子水平发现,BRPS下调HUVEC线粒体Cyt c的释放,下调线粒体tBid水平,降低Bax/Bcl-2比值,抑制Caspase-3、Caspase-8和Caspase-9的活化。据文献报道,Caspase-9的激活由线粒体凋亡途径介导,而Caspase-8的激活和Bid的切割需要死亡受体的介导[26-29]。因此,BRPS对HUVEC凋亡的抑制作用可能与线粒体途径和死亡受体途径均有关。综上所述,BRPS可清除HUVEC内自由基,减轻氧化应激损伤,抑制氧化应激所致HUVEC凋亡,对心血管疾病的防治起到积极作用。本研究为草苁蓉的开发利用提供了科学依据。
参考文献:
[1] 马桂鑫, 赵文文, 陈修平. 血管内皮细胞损伤模型及中药保护作用研究进展[J]. 中草药, 2014, 45(2): 276-283. DOI:10.7501/j.issn.0253-2670.2014.02.023.
[2] 邵佩兰, 徐明, 郭晓丹, 等. 红枣色素对H2O2诱导血管内皮细胞损伤的保护作用[J]. 食品科学, 2017, 38(9): 173-178. DOI:10.7506/spkx1002-6630-201709028.
[3] 周广亮, 丛贺, 全吉淑, 等. 榆干离褶伞溶栓酶对氧化应激损伤人脐静脉内皮细胞的保护作用[J]. 食品科学, 2016, 37(1): 171-175.DOI:10.7506/spkx1002-6630-201601030.
[4] 王玉娇, 周广亮, 刘雪, 等. 榆干离褶伞溶栓酶对过氧化氢损伤血管内皮细胞的保护机制研究[J]. 食品科技, 2017, 42(3): 268-271.DOI:10.13684/j.cnki.spkj.2017.03.052.
[5] 何鑫. 草苁蓉多糖对叔丁基过氧化氢引起血管内皮细胞凋亡的保护作用[D]. 延吉: 延边大学, 2017: 2.
[6] 赵文玺, 金梅花, 李天, 等. 草苁蓉水萃取物对四氯化碳致肝损伤小鼠肝脏氧化应激的干预作用[J]. 中国中药杂志, 2013, 38(6): 875-878. DOI:10.4268/cjcmm20130621.
[7] 汪霞, 周微, 李天, 等. 草苁蓉环烯醚萜对肝癌前病变大鼠血清标志酶及抗氧化活性的影响[J]. 食品科技, 2010, 35(7): 242-245.DOI:10.13684/j.cnki.spkj.2010.07.075.
[8] 尹学哲, 王玉娇, 尹基峰, 等. 草苁蓉提取物对HepG2细胞氧化应激损伤的保护作用[J]. 食品科学, 2015, 36(15): 173-178. DOI:10.7506/spkx1002-6630-201515032.
[9] LIU Y, SHENG Y, YUAN G X, et al. Purification and physicochemical properties of different polysaccharide fractions from the water extract of Boschniakia rossica and their effect on macrophages activation[J].International Journal of Biological Macromolecule, 2011, 49(5): 1007-1011. DOI:10.1016/j.ijbiomac.2011.08.024.
[10] 尹学哲, 许惠仙, 金爱花, 等. 草苁蓉提取物对高脂血症家兔血浆脂蛋白脂质过氧化的影响[J]. 中国实验方剂学杂志, 2010, 16(11):132-134. DOI:10.13422/j.cnki.syfjx.2010.11.043.
[11] 全吉淑, 王玉娇, 尹基峰, 等. 草苁蓉多糖对HepG2细胞氧化应激的抑制作用[J]. 食品研究与开发, 2016, 37(11): 6-9. DOI:10.3969/j.issn.1005-6521.2016.11.002.
[12] 尹学哲, 王玉娇, 尹基峰, 等. 草苁蓉多糖对过氧化氢损伤HepG2细胞NF-κB表达的影响[J]. 中国老年学杂志, 2016, 36(13): 3108-3110.DOI:10.3969/j.issn.1005-9202.2016.13.007.
[13] 宋全胜. 草苁蓉根茎粗多糖的分离纯化及其部分性质的研究[D].延吉: 延边大学, 2005: 10.
[14] 张媛媛, 张彬. 苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J]. 食品科学, 2016, 37(4): 158-163. DOI:10.7506/spkx1002-6630-201604028.
[15] 韩林, 李健, 林欣, 等. 黄芪甲苷对Chang Liver细胞酒精性和非酒精性氧化损伤的保护作用[J]. 中国中药杂志, 2014, 39(22): 4430-4435.DOI:10.4268/cjcmm20142229.
[16] ZHANG M, PAN H, XU Y, et al. Allicin decreases lipopolysaccharideinduced oxidative stress and inflammation in human umbilical vein endothelial cells through suppression of mitochondrial dysfunction and activation of Nrf2[J]. Cellular Physiology and Biochemistry, 2017,41(6): 2255-2267. DOI:10.1159/000475640.
[17] CHU P, HAN G Z, AHSAN A, et al. Phosphocreatine protects endothelial cells from methylglyoxal induced oxidative stress and apoptosis via the regulation of PI3K/Akt/eNOS and NF-κB pathway[J]. Vascular Pharmacology, 2017, 91: 26-35. DOI:10.1016/j.vph.2016.08.012.
[18] HOU X L, TONG Q, WANG W Q, et al. Dihydromyricetin protects endothelial cells from hydrogen peroxide-induced oxidative stress damage by regulating mitochondrial pathways[J]. Life Sciences, 2015,130: 38-46. DOI:10.1016/j.lfs.2015.03.007.
[19] 杨细飞, 贺春娥, 汤瑞华, 等. Hoechst33342/PI双染法和TUNEL染色技术检测神经细胞凋亡的对比研究[J]. 癌变·畸变·突变, 2014,26(3): 180-184. DOI:10.3969/j.issn.1004-616x.2014.03.005.
[20] 何鑫, 刘春彦, 尹基峰, 等. 祁州漏芦通过下调JNK和NF-κB抑制H2O2致肝细胞凋亡[J]. 中国中药杂志, 2017, 42(6): 1189-1193.DOI:10.19540/j.cnki.cjcmm.20170121.013.
[21] 刘佳, 李肖楠, 孙思铭, 等. 硫酸锌对血管内皮细胞氧化应激保护作用的研究[J]. 中国免疫学杂志, 2017, 33(2): 170-173. DOI:10.3969/j.issn.1000-484X.2017.02.002.
[22] 王超云, 张树平, 许勇, 等. 红花黄色素B对AngⅡ诱导内皮细胞线粒体损伤的保护作用[J]. 药学学报, 2012, 47(6): 811-815.DOI:10.16438/j.0513-4870.2012.06.006.
[23] 陈国钦, 黎锦亮, 张稳柱, 等. 姜黄素对过氧化氢诱导内皮细胞凋亡及衰老的影响[J]. 广东医学, 2017, 38(8): 1155-1158. DOI:10.13820/j.cnki.gdyx.20170425.004.
[24] 邱志凌, 张军平, 郭晓辰. 内质网应激与血管内皮细胞凋亡的研究进展[J]. 中国医学科学院学报, 2014, 36(1): 102-107. DOI:10.3881/j.issn.1000-503X.2014.01.019.
[25] 肖卫民, 蒋碧梅, 石永忠, 等. 过氧化氢通过线粒体通路和死亡受体通路诱导心肌细胞凋亡[J]. 中国动脉硬化杂志, 2003, 11(3): 185-188. DOI:10.3969/j.issn.1007-3949.2003.03.001.
[26] 冯阳, 刘建军, 黄钢. 线粒体膜通透性转换孔结构与功能研究进展[J].上海交通大学学报(医学版), 2012, 32(3): 356-360. DOI:10.3969/j.issn.1674-8115.2012.03.026.
[27] 梁芙蓉, 秦建全, 沈晓云. 凋亡通路中Bax和Bak蛋白的激活模型[J]. 生命的化学, 2011, 31(6): 858-862. DOI:10.13488/j.smhx.2011.06.006.
[28] LIU Y J, CHEN X Z, LI J. Resveratrol protects against oxidized low density lipoprotein induced human umbilical vein endothelial cell apoptosis via inhibition of mitochondrial derived oxidative stress[J].Molecular Medicine Reports, 2017, 15(5): 2457-2464. DOI:10.3892/mmr.2017.6304.
[29] DAVIDSON M T, DEITCH E A, LU Q, et al. Trauma-hemorrhagic shock mesenteric lymph induces endothelial apoptosis that involves both caspase-dependent and caspase-independent mechanisms[J].Annals of Surgery, 2004, 240(1): 123-131. DOI:10.1097/01.sla.0000129341.94219.cf.
[30] 周曦, 易龙, 金鑫, 等. SIRT1/UCP2通路在白藜芦醇抑制血管内皮细胞氧化应激损伤中的作用[J]. 第三军医大学学报, 2013, 35(16):1671-1675. DOI:10.16016/j.1000-5404.2013.16.006.
[31] KIM D H, CHO K H, MOON S K, et al. Cytoprotective mechanism of baicalin against endothelial cell damage by peroxynitrite[J]. Journal of Pharmacy and Pharmacology, 2005, 57(12): 1581-1590. DOI:10.1211/jpp.57.12.0008.
[32] ZHAO W W, FENG H T, SUN W, et al. Tert-butyl hydroperoxide(t-BHP) induced apoptosis and necroptosis in endothelial cells: roles of NOX4 and mitochondrion[J]. Redox Biology, 2017, 11: 524-534.DOI:10.1016/j.redox.2016.12.036.
