热处理对大豆分离蛋白结构和凝胶性的影响
2018-05-25陶汝青滕建文
陶汝青,夏 宁*,滕建文
热处理使蛋白质亚基发生解离、疏水基团暴露,有利于大豆蛋白凝胶的形成。而热处理强度的差异是大豆蛋白凝胶发生差异的主要原因。Kato等[1]研究发现,蛋白质加热处理温度越高、时间越长,蛋白质网络结构就被破坏得越严重。热处理会破坏蛋白质的双螺旋结构,80 ℃以上的温度对大豆蛋白进行热处理会引起二级结构发生显著的变化,且蛋白质的刚性结构会被解离[2]。在大豆蛋白热制凝胶过程中大豆蛋白的β-折叠含量会降低,而无规卷曲的含量会提高[3]。热变性程度对蛋白质的二硫键、疏水相互作用的影响不同,这会直接影响到以大豆蛋白凝胶特性为基础的传统豆腐类产品的凝胶特性。周淑红等[4]在豆腐制备过程中加入二硫苏糖醇(dithiothreitol,DTT),发现随着DTT浓度的增加,豆腐的凝胶强度降低,说明巯基的氧化和二硫键的形成对其凝胶强度具有一定的影响。段文达等[5]研究发现,在大豆蛋白凝胶制作的过程中加入十二烷基硫酸钠(sodium dodecyl sulfate,SDS),随着SDS添加量的增加,大豆蛋白形成凝胶的时间会缩短,这说明肽链充分展开,疏水基团暴露,有利于凝胶网络的形成。包中宇[6]研究发现,随着超声处理时间的延长,大豆蛋白凝胶样品巯基含量增加,这说明超声处理使巯基暴露到蛋白质表面,在凝胶形成过程中二硫键更容易形成,所以凝胶样品游离巯基含量降低。
由于传统豆腐类产品的凝胶成型过程中,均需要一定的温度条件使其中的大豆蛋白变性,进而形成不同凝胶强度的豆类制品;因此为了进一步阐述大豆蛋白凝胶中蛋白的变性程度对其凝胶强度的影响,本研究将对不同热处理温度和时间下大豆分离蛋白(soy protein isolate,SPI)的亚基组成、二级结构、自由氨基、游离巯基、表面疏水性进行测定,以期明确SPI的热变性程度与其凝胶性的关系,为通过控制蛋白的变性程度来控制凝胶类豆制品的加工特性提供理论依据。
1 材料与方法
1.1 材料与试剂
SPI采用碱溶酸沉法[7]自制。
葡萄糖酸-γ-内酯(gluconic acid lactone,GDL)市售;三羟甲基氨基甲烷(tris aminomethane,Tris)、丙烯酰胺、十二烷基硫酸钠(sodium dodecyl sulfonate,SDS)、四甲基乙二胺(tetramethyl ethylene diamine,TEMED)、N,N’-甲叉双丙烯酰胺 北京鼎国生物技术有限责任公司;邻苯二甲醛(orthophthalaldehyde,OPA)、亮氨酸(99%)、溴化钾、二硫硝基苯(5,5′-dithio-2-nitrobenzoate,DTNB)美国Sigma-Aldrich公司;磷酸二氢钠、磷酸氢二钠山东玉岭化工有限公司;8-苯胺-1-萘磺酸(8-anilino-1-naphthalesulfonic,ANS) 上海谱振生物科技有限公司。
1.2 仪器与设备
DC-1500真空冷冻干燥机 上海达程实验设备有限公司;UV-1601PC紫外分光光度计、ST16R冷冻离心机赛默飞世尔科技(中国)有限公司;RF-5301PC荧光分光光度计 日本岛津公司;Nicolet iS10傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR)仪美国热电公司;DYY-6C型电泳仪 北京市六一仪器厂;TA.XT plus质构仪 英国Stable Micro Systems公司;TGL-16G高速台式离心机 上海医用分析仪器厂。
1.3 方法
1.3.1 样品制备
不同热处理温度下的SPI样品:将质量分数9%的SPI溶液分别置于70、75、80、85、90、95 ℃条件下水浴加热10 min,取出一部分热处理后的SPI溶液,冷却,用于测定亚基组成、自由氨基浓度、游离巯基含量、表面疏水性及二级结构(将热处理后的SPI溶液冻干成粉末),以未进行热处理的SPI样品作对照;另一部分加热温度为70、80、90、95 ℃的SPI溶液中添加0.33 g/100 mL的GDL,80 ℃条件下保温30 min,冷却后测定蛋白的凝胶强度及失水率,同时做空白实验(对照组,不加热)。
不同热处理时间下的SPI样品:将质量分数9%的SPI溶液置于90 ℃条件下分别水浴加热5、10、20、30、40、50、60 min,取出一部分热处理后的SPI溶液,冷却,用于测定亚基组成、自由氨基浓度、游离巯基含量及表面疏水性;另一部分加热时间为5、10、15、20 min的SPI溶液中添加0.33 g/100 mL的GDL,80 ℃条件下保温30 min,冷却后测定蛋白的凝胶强度及失水率。
热处理后SPI在不同保温温度与时间下的样品:将质量分数9%的SPI溶液分别置于90 ℃下水浴加热10 min,然后添加0.33 g/100 mL的GDL,分别在70、80、90 ℃条件下保温20、30、40、50、60 min,冷却后测定蛋白的凝胶强度及失水率。
1.3.2 热处理后SPI的结构与理化性质测定
1.3.2.1 自由氨基浓度的测定
采用OPA法[8]测定自由氨基浓度。取加热处理后的5 mg/mL SPI溶液200 μL与4 mL OPA混合,于35 ℃条件下反应2 min,用紫外分光光度计在340 nm波长处测定吸光度A340nm。以L-亮氨酸为标准物绘制标曲,算出SPI中自由氨基的浓度。
1.3.2.2 游离巯基含量的测定
参考Beveridge等[9]的实验方法。取加热处理后的0.1 mg/mL SPI溶液2 mL,加入80 μL Ellman试剂(4 mg/mL DTNB),立即混匀,静置5 min后,在412 nm波长处测吸光度(A412nm),再计算游离巯基含量,公式如式(1)所示。
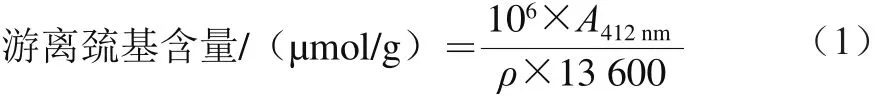
式中:13 600为摩尔消光系数/(L/(mol·cm));ρ为蛋白质溶液的质量浓度/(mg/mL)。
1.3.2.3 表面疏水性的测定
表面疏水性的测定参考文献[10]。取4 mL加热处理后的0.1~0.5 mg/mL SPI溶液与20 μL ANS溶液混合,设定激发波长为365 nm,发射波长为520 nm,狭缝校正均为5 nm,用荧光分光光度计测定混合液的荧光强度。表面疏水性用荧光强度-蛋白质质量浓度曲线的斜率表示。
1.3.3 SDS-PAGE测定
采用SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)不连续缓冲系统进行还原电泳和非还原电泳,分离胶体积分数为7.5%,浓缩胶体积分数为4%,制备还原电泳样品缓冲液时添加β-巯基乙醇,样品缓冲液上样量为10 µL,V(甲醇)∶V(冰醋酸)∶V(纯水)=100∶100∶800的脱色液脱色。
1.3.4 FTIR的测定
将处理后的SPI样品采用溴化钾压片,用FTIR仪进行扫描。扫描范围为4 000~400 cm-1,分辨率4 cm-1,扫描次数8次。扫描后的图谱用Omnic软件校正后,再用PeakFit v4.12软件对酰胺Ⅰ带1 600~1 700 cm-1波段的图谱进行分析,根据峰面积计算各二级结构组分的比例。
1.3.5 热处理后SPI的功能特性测定
1.3.5.1 凝胶强度的测定
凝胶强度的测定参考文献[11],将SPI凝胶冷却成型后,切成1 cm×1 cm×1 cm的均匀小块,置于物性测试仪上测定其凝胶强度。SPI凝胶强度为当用仪器测定时使SPI破碎的最大力,单位是g。质构参数:探头型号P/0.5,测前速率1.0 mm/s,测试速率2.0 mm/s,测后速率1.0 mm/s,测定距离8.0 mm。
1.3.5.2 凝胶失水率的测定
凝胶失水率的测定参考文献[12],将SPI凝胶切成0.3 cm×0.3 cm×0.3 cm的小粒,称取5~10 g的SPI凝胶装入10 mL离心管中,以4 000 r/min离心30 min,然后小心倒出离心管内被离心析出的水,并用滤纸将残留在离心管壁的水吸干净,最后称质量。失水率的计算如式(2)所示。
式中:m1为离心前凝胶质量/g;m2为离心后凝胶质量/g。
1.4 数据统计分析
所有实验重复3 次,取平均值,用Origin 8.6和SPSS 17.0软件进行统计和方差分析(ANOVA),用Duncan法进行差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 热处理温度和时间对SPI自由氨基浓度的影响

图1 热处理温度(A)和时间(B)对SPI自由氨基浓度的影响Fig. 1 Effect of heat treatment temperature (A) and time (B) on free amino group content of SPI
对蛋白质进行热处理,在热处理过程中蛋白质一级结构发生变化,蛋白质会被分解,导致自由氨基浓度变化,通过自由氨基浓度的测定可以反映蛋白质的变性情况。图1A为热处理温度对SPI自由氨基浓度的影响,未进行热处理时SPI中自由氨基浓度为0.02 mmol/L,随着热处理温度的升高,SPI中自由氨基浓度增加;当热处理温度为95 ℃时自由氨基浓度为1.28 mmol/L,自由氨基浓度的提高反映了SPI分子链的断裂或降解,这说明随着热处理温度的升高,蛋白质分解加剧。
图1B为热处理时间对SPI自由氨基浓度的影响,在90 ℃下热处理5 min时自由氨基的浓度为0.26 mmol/L,随着热处理时间的延长,SPI中自由氨基的浓度先迅速增加之后变化不明显,热处理60 min时自由氨基浓度为0.65 mmo/L;这说明SPI受热分解主要发生在加热过程的开始阶段。郭凤仙[13]研究也发现随着热处理温度的升高,SPI中自由氨基浓度迅速增加,热处理的前期自由氨基浓度升高比较显著,随后上升缓慢。这可能是因为受热初期,SPI热变性程度增加,蛋白结构发生展开或蛋白发生解离,所以自由氨基浓度有所提高;随着热处理时间的延长,SPI可能发生了氧化而变性,蛋白质发生聚集,最终产生不溶性沉淀,所以自由氨基浓度上升比较缓慢[14-15]。
2.2 热处理温度和时间对SPI游离巯基含量的影响

图2 热处理温度(A)和时间(B)对SPI游离巯基含量的影响Fig. 2 Effect of heat treatment temperature (A) and time (B) on free thiol content of SPI
图2 A为热处理温度对SPI游离巯基含量的影响。未进行热处理时游离巯基的含量为19.85 µmol/g,热处理从70 ℃升高到80 ℃,游离巯基含量虽然增加但并不显著(P>0.05);当热处理温度提高到85 ℃以上时,游离巯基含量增加显著(P<0.05),并在95 ℃时达到最大,为85.29 μmol/g。这可能与大豆球蛋白(glycinin,11S)和β-伴大豆球蛋白(β-con-glycinin,7S)的热变性有关。一般情况下7S热变性的温度范围是68~82 ℃,11S热变性的温度是83~95 ℃[16-18],由于温度低于80 ℃时主要引起7S变性,而7S中游离巯基含量比较少,所以游离巯基含量增加不明显,且在相对较低的热处理温度下,蛋白质亚基之间相互接触比较少,这样的条件容易导致聚集体的形成;所以70~80 ℃温度范围内,巯基含量上升较慢[15]。马丹等[19]研究发现,随着热处理温度的升高,SPI中巯基暴露加剧,游离巯基含量不断增加。
图2B为热处理时间对SPI中自由巯基含量的影响。热处理从5 min延长到10 min时,自由巯基含量从31.99 μmol/g增加到70.22 μmol/g,之后随着热处理时间的延长自由巯基的含量不断下降,这可能与生成的可溶性聚集物有关;随着热处理时间的延长,11S中解离的游离巯基进一步生成新的二硫键,同时游离的巯基也可能会发生氧化,最终导致游离巯基的含量减少。李理特等[20]在95 ℃条件下对不同处理时间豆浆的游离巯基含量进行测定,发现随着豆浆热处理时间的延长,游离巯基含量先增加后降低,热处理时间为10 min时游离巯基含量达到最大值。Hashizume等[21]研究也发现在豆浆加热过程中巯基会发生氧化,最终影响豆腐凝胶强度。
2.3 热处理温度和时间对SPI表面疏水性的影响
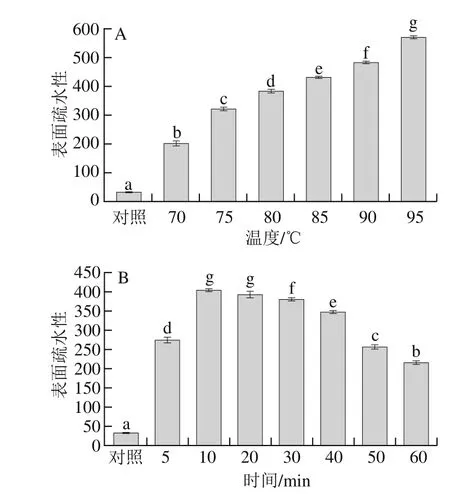
图3 热处理温度(A)和时间(B)对SPI表面疏水性的影响Fig. 3 Effect of heat treatment temperature (A) and time (B) on surface hydrophobicity of SPI
图3 A为热处理温度对SPI表面疏水性的影响。未进行热处理的SPI的表面疏水性为39.01,随着热处理温度的升高,SPI的表面疏水性大幅度提高,热处理温度为95 ℃时,表面疏水性达到最高,为569.86。这可能是因为随着热处理温度的升高,SPI热变性加剧,分子链展开,暴露出更多的疏水基团,从而引起表面疏水性增加。王中江等[22]研究发现,热处理温度提高会导致大豆蛋白表面疏水性增加。Matsudomi等[23]研究了热处理温度对豆浆表面疏水性的影响,发现当热处理温度升高时,豆浆中大豆蛋白的表面疏水性也会升高。
图3B为热处理时间对SPI中表面疏水性的影响。热处理5 min时SPI的表面疏水性为274.91,热处理从5 min延长至10 min时,SPI的表面疏水性显著增加(P<0.05),并且在10 min时达到最大,为404.09,之后随着热处理时间的延长,蛋白质的表面疏水性降低,当热处理60 min时,表面疏水性仅为215.56。这可能是因为随着热处理时间的延长,蛋白质间相互作用加强,蛋白质的表面疏水性增加,当表面疏水相互作用达到一定程度时,蛋白质的亚基会聚集形成共价键及氢键等结构,最终导致蛋白质疏水相互作用降低。李理特等[20]研究热处理时间对豆浆中表面疏水性的影响发现,95 ℃热处理10 min的豆浆中大豆蛋白的荧光强度最强,之后随着时间的延长,豆浆的荧光强度明显降低。
2.4 热处理温度和时间对SPI亚基的影响
大豆蛋白主要由11S和7S组成,11S主要成分为酸性亚基和碱性亚基,酸性亚基分子质量约为35 kDa,碱性亚基分子质量约为18 kDa;7S主要成分是α、α′、β 3 种亚基,分子质量分别约为65、62、57 kDa[24]。

图4 不同热处理温度(A)和时间(B)后SPI的SDS-PAGE图Fig. 4 SDS-PAGE analysis of SPI at different heat treatment temperatures (A) and times (B)
由图4A可知,当热处理温度提高时,进样槽口残留的聚集体就会增多,而且分离胶中每一条条带的颜色也逐渐加深,这可能是因为随着热处理温度的升高,SPI热变性程度加剧,引起SPI分子亚基的解离,解离后SPI的分子质量变小,最终蛋白质分子形成聚集体,这与Feng等[25]研究结果相似。从图4A还原图谱中可看出,分离胶顶层条带变浅,这说明生成的大分子聚集体中可能含有二硫键[26]。
由图4B可知,在非还原状态下,随着热处理时间的延长,电泳槽口中聚集体不断增多,这是因为大分子质量聚集体形成。无论是还原图谱还是非还原图谱都可以看出,随着加热时间的延长,条带中11S的B亚基颜色变浅,这可能是因为11S由于热变性而发生解离,最终导致11S中B亚基生成不溶性沉淀[27]。
2.5 热处理温度对SPI二级结构的影响
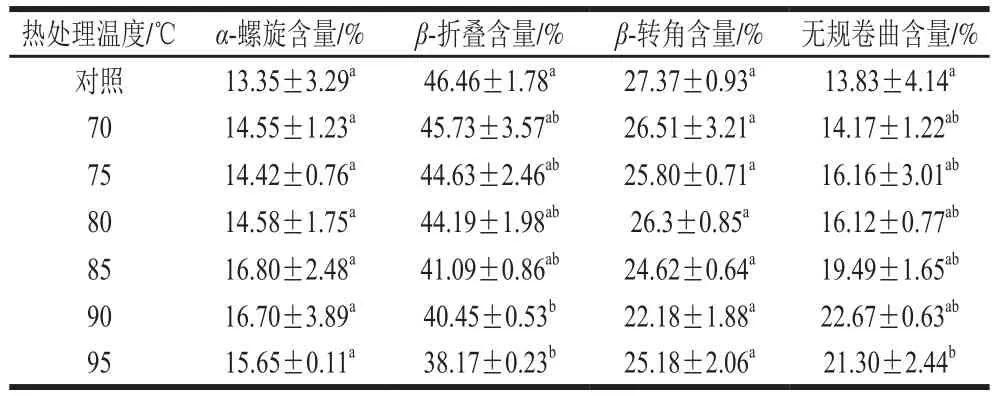
表1 热处理温度对SPI二级结构的影响Table 1 Effect of heat treatment temperature on secondary structure of SPI
由表1可看出,不经过任何热处理的SPI的二级结构中β-折叠含量最高,Pleitz[28]和Marcone[29]等研究发现SPI二级结构以β-折叠为主。随着热处理温度的升高,蛋白质二级结构中各组分含量的变化比较复杂,其中β-折叠的含量降低,α-螺旋的含量有所提高,无规卷曲的含量增加。王中江等[22]研究发现,与未经过任何热处理的SPI相比,经过热处理后SPI的α-螺旋含量会增加,β-折叠含量会降低。李杨等[30]通过分析热处理SPI的红外光谱发现,相比于未进行任何热处理的蛋白质样品,热处理使SPI中的α-螺旋结构含量增加,而β-折叠结构含量降低。在研究热处理对其他蛋白的影响时也发现,热处理会导致蛋白质二级结构中的β-折叠含量的下降[31]。
2.6 热处理温度和时间对SPI凝胶性的影响
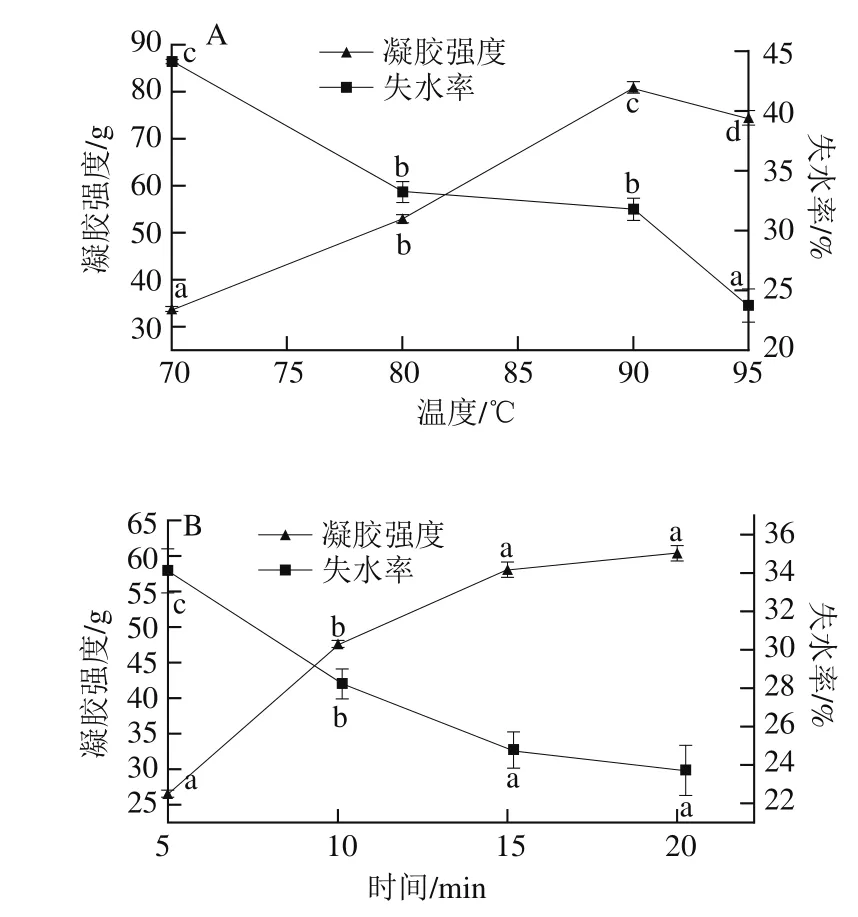
图5 热处理温度(A)和时间(B)对SPI凝胶性质的影响Fig. 5 Effect of heat treatment temperature (A) and time (B) on gel property of SPI
图5 为热处理温度和时间对SPI凝胶性的影响。热处理温度从70 ℃提高到90 ℃时,凝胶强度从33.38 g提高到80.85 g,95 ℃时凝胶强度为74.51 g;这可能是由于温度高于90 ℃后SPI的热变性更严重,对凝胶强度的影响不利。随着温度的升高,失水率降低,这可能是因为蛋白质分子受热变性后,温度的升高导致蛋白质的活性基团不断暴露,蛋白质分子之间相互结合,形成三维网络结构越来紧密,所以失水率降低。热处理从5 min提高到20 min,SPI的凝胶强度从26.49 g提高到60.35 g,失水率也明显下降,15 min之后,随着热处理时间的延长,形成凝胶的强度虽有增加但幅度不大。这可能是因为在热处理初期,随着加热时间的延长蛋白质分子之间相互作用增加,之后随着加热时间的延长,维持蛋白质凝胶的三维网络结构基本达到最大,所以凝胶强度的变化不大。张海瑞等[32]研究发现,在90 ℃条件下,随着热处理时间的延长,SPI形成凝胶的凝胶强度呈上升趋势。
2.7 保温温度和时间对SPI凝胶性的影响
SPI凝胶制备过程中,保温凝固的温度与时间也是SPI形成凝胶的关键因素。图6为凝胶保温温度和时间对SPI凝胶性质的影响。在相同保温时间条件下,随着保温凝胶温度的升高,SPI凝胶强度增加、失水率降低。在相同的保温温度条件下,随着保温时间的延长,形成凝胶的强度增加,失水率有所降低。在30 min之前,随保温时间的延长,凝胶强度增加比较明显,30 min之后凝胶强度虽有上升但幅度不大,这可能是因为当凝胶保温达到一定时间时,保温时间对凝胶网络结构的影响趋于饱和,所以形成凝胶的强度、失水率变化不明显。综合考虑选择90 ℃条件下保温30 min来制备凝胶比较合适。
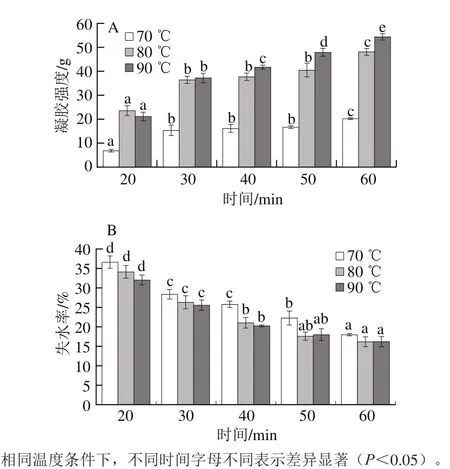
图6 保温温度和时间对SPI凝胶强度(A)和失水率(B)的影响Fig. 6 Effect of temperature and holding time on gel strength (A) and water loss rate (B) of SPI gel
3 结 论
以SPI为原料,研究热处理温度和时间对SPI自由氨基浓度、游离巯基含量、凝胶强度及失水率等的影响,并对热处理后的SPI在热致凝胶过程中的保温温度与时间对其凝胶性质的影响进行分析,以期为以大豆蛋白为主要凝胶机制原料的大豆产品的制备提供理论依据和工艺的参考。热处理加剧SPI亚基的解离与聚集,并导致SPI二级结构中β-折叠含量明显下降,α-螺旋含量有所提高,无规卷曲含量明显增加。随着热处理温度从70 ℃提高到95 ℃,SPI中自由氨基浓度、游离巯基含量以及表面疏水性分别从0.02 mmol/L、19.85 μmol/g及39.01提高到1.28 mmol/L、85.29 μmol/g与569.86,此过程中制成SPI凝胶的强度先增加后降低,凝胶失水率逐渐减小;随着热处理时间从5 min延长到60 min,自由氨基浓度呈先显著上升后趋于平缓的趋势,游离巯基含量及表面疏水性则先显著上升后呈现降低趋势,此过程中制成SPI凝胶的强度先显著提高后趋于平缓;因此一定范围内自由氨基浓度、自由巯基含量及表面疏水性的提高有利于SPI凝胶的形成。当保温温度升高或时间延长时,SPI形成凝胶的强度呈逐渐上升趋势,同样凝胶的失水率仍呈下降趋势。综上考虑,制备SPI凝胶的最佳条件为:热处理90 ℃、15 min,并在后续的热致凝胶过程中,进行90 ℃、30 min保温处理,而此时的SPI变性程度可以为以SPI为主要凝胶机制原料的大豆类产品凝胶提供工艺参考依据。
参考文献:
[1] KATO A, TANIMOTO S, MURAKI Y, et al. Relationships between conformational stabilities and surface functional properties of mutant hen egg-white lysozymes constructed by genetic engineering[J].Journal of Agricultural and Food Chemistry, 1994, 42(1): 227-230.DOI:10.1021/jf00037a041.
[2] 李岩涛, 秦贵信, 龙国辉. 热处理对β-伴大豆球蛋白二级结构的影响[J]. 吉林农业, 2013(2): 79-80. DOI:10.3969/j.issn.1674-0432.2013.04.065.
[3] WANG C H, DAMODARAN S. Thermal gelation of globular proteins:influence of protein conformation on gel strength[J]. Journal of Agricultural and Food Chemistry, 1991, 39(3): 433-438. DOI:10.1021/jf00003a001.
[4] 周淑红, 陈野, 张敏, 等. 盐卤浓浆豆腐凝胶形成作用力的研究[J]. 食品研究与开发, 2013, 34(12): 15-19. DOI:10.3969/j.issn.1005-6521.2013.12.005.
[5] 段文达, 翁頔, 潘思轶, 等. 分子间作用力对大豆蛋白凝胶形成的影响[J]. 食品科学, 2009, 30(13): 60-63. DOI:10.3321/j.issn:1002-6630.2009.13.013.
[6] 包中宇. 超声波技术对大豆分离蛋白功能性质、结构及凝胶特性的影响[D]. 南昌: 南昌大学, 2015: 40.
[7] KOSHIYAMA I. Chemical and physical properties of a 7S protein in soybean globulins[J]. Cereal Chemistry, 1968, 45(9): 394-404.
[8] CHURCH F C, HAROLD E, PORTE D H, et al. Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins 1[J]. Journal of Dairy Science, 1983,66(6): 1219-1227. DOI:10.3168/jds.S0022-0302(83)81926-2.
[9] BEVERIDGE T, TOMA S J, NAKAI S. Determination of SH- and SS-groups in some food proteins using Ellman’s reagent[J]. Journal of Food Science, 2006, 39(1): 49-51. DOI:10.1111/j.1365-2621.1974.tb00984.
[10] OBATA A, MATSUURA M. Decrease in the gel strength of tofu caused by an enzyme reaction during soybean grinding and its control[J]. Bioscience Biotechnology and Biochemistry, 1993, 57(4):542-545. DOI:10.1271/bbb.57.542.
[11] 闫洁. 方便豆腐脑粉加工技术的研究[D]. 无锡: 江南大学, 2008: 10.DOI:10.7666/d.y1397690.
[12] 李汴生. 超高压处理对蛋白质和多糖胶体特性的变化及其机理研究[D]. 广州: 华南理工大学, 1997: 20-21.
[13] 郭凤仙. 热处理对大豆分离蛋白结构及功能特性的影响[D]. 无锡:江南大学, 2009: 13-19. DOI:10.7666/d.y1584043.
[14] 李庆云. 热处理大豆分离蛋白乳浊液中油脂氧化与蛋白氧化相互作用关系研究[D]. 广州: 华南理工大学, 2016: 27.
[15] 郭凤仙. 大豆蛋白在贮藏过程中品质下降机制及控制途径[D]. 无锡: 江南大学, 2015: 10-11.
[16] GERMAN B, DAMODARAN S, KINSELLA J E. Thermal dissociation and association behavior of soy proteins[J]. Journal of Agricultural and Food Chemistry, 1982, 30(5): 807-811. DOI:10.1021/jf00113a002.
[17] MCKlEM L K. Investigation of molecular forces involved in gelation of commercially prepared soy protein isolates[D]. North Carolina:North Carolina State Univeraity, 2002: 23.
[18] SORGENTINI D A, WAGNER J R, ANON A C. Effects of thermal treatment of soy protein isolate on the characteristics and structurefunction relationship of soluble and insoluble fractions[J]. Journal of Agricultural and Food Chemistry, 1995, 43(9): 2471-2479.DOI:10.1021/jf00057a029.
[19] 马丹, 张超, 马越, 等. 热处理对大豆分离蛋白可食性膜性能和结构的影响[J]. 食品科学, 2010, 31(1): 102-104.
[20] 李里特, 汪立君, 李再贵, 等. 大豆蛋白热变性程度对豆腐品质的影响[J]. 中国粮油学报, 2002, 17(1): 1-4. DOI:10.3321/j.issn:1003-0174.2002.01.001.
[21] HASHIZUME K, MAEDA M, WATANABE W. Studies on the preparing conditionds of soybean milk for tofu making. II. relationship of heating and cooling condition to hardness of tofu[J]. Nihon Shokuhin Kogyo Gakkaishi, 1978, 25(7): 387-391.
[22] 王中江, 江连洲, 李杨, 等. 热处理时间及温度对大豆分离蛋白二级结构及表面疏水性的影响[C]//中国食品科学技术学会第九届年会论文集, 哈尔滨: 中国食品科学技术学会, 2012: 169-175.
[23] MATSUDOMI N, MORI H, KOBAYASHI K. Emulsifying and foaming properties of heat-denatured soybean 11S globulins in relation to their surface hydrophobicity[J]. Agricultural Biological Chemistry,1985, 49(4): 915-919. DOI:10.1080/00021369.1985.10866853.
[24] YUAN Y J, VELEV O D, CHEN K, et al. Effect of pH and Ca2+induced associations of soybean proteins[J]. Journal of Agricultural and Food Chemistry, 2002, 50(17): 4953-4958. DOI:10.1021/jf025582d.
[25] FENG H, XIONG Y L. Interaction of myofibrillar and preheatedsoy proteins[J]. Journal of Food Science, 2002, 67(8): 2851-2856.DOI:10.1111/j.1365-2621.2002.tb08827.
[26] 叶荣飞, 杨晓泉, 郑田要, 等. 热变性和热聚集对大豆分离蛋白溶解性的影响[J]. 食品科学, 2008, 29(7): 106-108. DOI:10.3321/j.issn:1002-6630.2008.07.019.
[27] PETRUCCELLI S, ANON M C. Thermal aggregation of soy protein isolates[J]. Journal Agricultural Food Chemistry, 1995, 43(12): 3035-3041. DOI:10.1021/jf00060a009.
[28] PLEITZ P, DAMASCHUN G. The structure of the 11S seed globulins from various plant species: comparative investigations by physical methods[J]. Studia Biophysical, 1986, 116(3): 153-173.
[29] MARCONE M F, BONDI M C, YADA R Y. Isolation of soybean 11S globulin by isoelectric precipitation and sephacryl S-300 gel filtration chromatography: a new purification technique[J]. Bioscience Biotechnology and Biochemistry, 1994, 58(2): 413-415. DOI:10.1271/bbb.58.413.
[30] 李杨, 王中江, 王瑞, 等. 不同热处理条件下大豆分离蛋白的红外光谱分析[J]. 食品工业科技, 2016, 37(8): 104-109. DOI:10.13386/j.issn1002-0306.2016.08.013.
[31] MILLS E N, HUANG L, NOELT R, et al. Formation of thermally induced aggregates of the soya globulin β-conglycinin[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 2001, 1547(2): 339-350. DOI:10.1016/S0167-4838(01)00199-6.
[32] 张海瑞, 何志勇, 秦昉, 等. 热处理制备高凝胶性大豆分离蛋白的工艺[J]. 食品与发酵工业, 2012, 38(3): 81-84. DOI:10.13995/j.cnki.11-1802/ts.2012.03.029.
