TACE联合阿帕替尼治疗中晚期原发性肝癌的临床疗效分析
2018-05-25徐勤高珊缪继东宋怡兵
徐勤 高珊 缪继东 宋怡兵
(自贡市第四人民医院, 1.肿瘤科; 2.耳鼻喉科,四川 自贡 643000)
原发性肝癌临床发病率逐年增长,在肿瘤相关死亡中居第二位[1]。肝脏具有双重血运,转移复发早,故临床上发现肝癌时已多为中晚期,手术难以切除。因此,肝动脉介入化疗栓塞术(TACE)是中晚期无法切除原发性肝癌的主要治疗方法之一,但单纯的TACE治疗后仍有残癌,尚需辅以化疗药物治疗。目前应用于肝癌治疗的有效化疗药物极少,索拉非尼是一类能够选择性地靶向多种受体酪氨酸激酶的药物,通过抑制肿瘤新生血管形成,促进肿瘤细胞凋亡,发挥抗肿瘤作用而广泛应用于临床中晚期肝癌的治疗,但价格昂贵,临床应用受限。甲磺酸阿帕替尼通过高度选择性竞争VEGFR-2及其受体结合位点,阻断下游信号转导,抑制酪氨酸激酶的生成从而抑制肿瘤组织新血管的生成[2],已成为一个多靶点抗肿瘤药物,且近来临床研究证实甲磺酸阿帕替尼对中晚期肝细胞癌具有相当的疗效[3-4]。我们自近年采取TACE治疗中晚期原发性肝癌患者的同时,采用联合阿帕替尼治疗,取得了一定疗效,与索拉非尼联合TACE治疗肝癌的临床疗效进行比较,现报告如下。
1 资料与方法
1.1 一般材料 依据巴塞罗那(Barclona clinic liver cancer,BCLC)肝癌临床分期标准,回顾性分析2014年1月~2016年12月自贡市第四人民医院住院的原发性肝癌BCLC B期和C期患者共42例,经临床诊断标准确诊为原发性肝癌,根据实体瘤RECIST标准至少含1个可测量病灶,无法手术或拒绝外科手术,且未进行干预性治疗预计生存时间大于3个月者,参加试验患者均自愿签署知情同意书,并通过伦理委员会审查。排除标准如下:ECOG评分>2分;肝功child-puphC级;大量腹腔积液者;本研究前曾确诊或治疗过其他恶性肿瘤;既往神经或精神病史;存在严重高血压、糖尿病、肝肾疾病者。42例患者分为实验组21例采用TACE联合阿帕替尼治疗;对照组21例采用TACE联合索拉非尼治疗,均于治疗后1周开始口服阿帕替尼或索拉非尼。
1.2 治疗方法 TACE治疗:两组均采用Seldinger技术经皮股动脉穿刺,动脉造影了解肿瘤大小、部位、血供以及门静脉异位血栓等情况,选择性将导管送至肿瘤供血之靶动脉血管后,经导管缓慢注入5-氟尿嘧啶750mg,顺铂60mg,表阿霉素60mg 共3种药物,依据患者个体确定用药剂量,在依据肿瘤大小、血供类型注入碘化油化疗药乳剂以及明胶海绵进行化疗栓塞。根据患者情况决定是否行第2次TACE治疗,于TACE治疗前后一周停口服分子靶向药物。两组均于TACE治疗后1周开始口服分子靶向药物,1~2周后根据患者情况调整用药。对照组服用索拉非尼(拜耳公司)400mg,日2次口服,4周为1周期,如发生药物相关的剂量限制性毒性时,根据患者情况,将剂量调整至400mg日1次口服的方案,如果患者仍因不良反应不能耐受,将剂量调整至400mg隔日一次口服的方案,如果患者仍因不良反应不能耐受或治疗直至PD选择停药。实验组服用甲磺酸阿帕替尼(恒瑞公司)750mg,日1次口服,4周为1周期,如发生药物相关的剂量限制性毒性时,根据患者情况,将剂量调整至500mg日一次口服的方案,如果患者仍因不良反应不能耐受,将剂量调整至250mg日一次口服的方案,如果患者仍因不良反应不能耐受或治疗直至PD选择停药。当患者为PD时根据情况选择放疗或消融治疗或BSC等治疗。于TACE治疗后3月评价客观缓解率及临床获益率,治疗后1年评价生存率,两组均评价不良反应,两组均给予最佳支持治疗(包含营养治疗、止痛、保肝、水化等)。
1.3 观察指标及评定标准 两组治疗前、治疗后每月行血尿常规、肝肾功能检查,两组治疗前、治疗后3月复查甲胎蛋白(AFP),同时行心电图、超声或增强CT对肝脏进行影像学检查,对比观察病灶变化及不良反应等指标。采用新的实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)标准评价治疗后3个月客观有效率和疾病控制率、治疗1年后生存率。疗效分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable response,SD)、疾病进展(progressive response,PD),客观缓解率(objective response rate,ORR)为(CR+PR)/患者总数×100%,疾病控制率(disease control rate,DCR)为(CR+PR+SD)/患者总数×100%。采用WHO抗癌药物急性及亚急性毒性不良反应表现和分级标准判定药物的毒副不良反应,分为0-Ⅳ级。

2 结果
2.1 两组样本一般情况 患者分期B期和C期分别为30例、12例,其中男29例,女13例,年龄41~70岁,两组患者分期、性别、年龄以及child-puph分级等情况差异无统计学意义(P>0.05),见表1。
表1两组患者一般情况比较
Table1Thecomparisonofgeneralconditionbetweenthetreatmentgroupandthecontrolgroup

组别n性别(男/女)年龄(岁)child-puph分级(A/B)实验组2116/556.75±8.9118/3 B期 C期 147183对照组2113/855.05±9.4720/1 B期 C期 1652012=0.4672=1.033t=0.5852=1.105
2.2 两组近期疗效比较 实验组与对照组均为TACE治疗后3个月评价客观缓解率,经χ2检验差异无统计学意义(χ2=0.095,P>0.05),及疾病控制率比较,经χ2检验差异无统计学意义(χ2=0.525,P>0.05),见表2。
2.3 两组患者1年生存率比较 实验组与对照组治疗后1年生存率,两组间比较,实验组(57.14%)与对照组(61.90%),经χ2检验比较差异无统计学意义(χ2=0.099,P>0.05)。

表2 两组患者近期疗效比较Table 2 The comparison of Clinical efficacy between the two groups
2.4 两组间不良反应比较 两组间主要不良反应均为腹泻、高血压、骨髓抑制、恶性呕吐、皮肤反应、蛋白尿等,两组治疗过程中主要不良反应均为Ⅰ~Ⅱ级不良反应,实验组有1例病例出现III度骨髓抑制血小板减少,1例病例出现III度皮肤黏膜反应,停用口服阿帕替尼,未见Ⅳ级不良反应出现,不良反应经对症处理后好转,实验组上述不良反应发生高于对照组,在高血压、皮肤黏膜反应方面,两组经χ2检验比较差异有统计学意义(P<0.05),见表3。

表3 两组患者不良反应比较Table 3 The comparasion of adverse reactison between the two groups
注:与对照组相比,①P<0.05
2.5 两组治疗前后甲胎蛋白(AFP)变化比较 实验组治疗后3月AFP下降幅度明显高于治疗前,经t检验差异有统计学意义(t=8.86,P<0.05) ,对照组治疗后3月AFP下降幅度明显高于治疗前,经t检验差异有统计学意义(t=10.033,P<0.05),治疗后3月实验组与对照组相比,经t检验差异无统计学意义(t=-1.258,P>0.05),见表4。
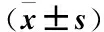
Table4ThecomparisonofAFPexpressionbetweenthetreatmentgroupandthecontrolgroup

组别nAFP(ng/mL)实验组21 治疗前833.26±91.85 治疗后3月352.41±110.77①对照组21 治疗前919.11±109.57 治疗后3月421.43±75.31①
注:与治疗前相比①P<0.05
3 讨论
在我国,原发性肝癌发病率高居恶性肿瘤的第三位,而临床上发现肝癌时已多属中晚期,手术难以切除且进展快,肝癌总体上化疗有效率偏低,只能进行姑息性治疗[1],其肿瘤相关死亡中在肺癌之后居第二位。肝动脉介入化疗栓塞术(TACE)是目前无法手术切除的中晚期肝癌的主要治疗方法之一,临床上通过联合使用化疗药物增加肝癌抗肿瘤治疗效应[5-7]。但单纯的TACE治疗存在局限性,仍有残癌,容易复发,很多患者难以坚持多次TACE。同时也有专家报道TACE治疗后所形成的肿瘤组织缺氧会诱导VEGF过度表达及新生血管产生,是肿瘤复发和转移的重要环节,因此需要联合抗血管生成药物,抑制再生血管,减少肿瘤复发和转移以增加临床疗效[8-9]。
索拉非尼已被多个临床研究证实有效[10-11],是目前在全球范围内获得批准用于肝癌系统性治疗的分子靶向药物。索拉非尼具有多靶点抗肿瘤活性,对RAF激酶、血管内皮生长因子-2、血管内皮生长因子-3、血小板衍生生长因子受体-β等多种酪氨酸激酶活性具有抑制作用,通过抑制上述信号传导通络,从而抑制肿瘤组织新血管的生成,从而治疗肿瘤[12-13]。TACE联合索拉非尼治疗晚期肝癌已经报道证实有较好的临床疗效,能弥补单纯TACE的不足[14-16]。但该药价格较高,限制了在我国的广泛使用,而临床又缺乏其他可供选择应用于肝癌分子靶向治疗的药物。
甲磺酸阿帕替尼是我国自主研发的口服多靶点抗肿瘤药物,服用方便,通过高度选择性竞争VEGFR-2及其受体结合位点,阻断下游信号转导,并抑制酪氨酸激酶的生成,这些作用机制赋予了阿帕替尼靶向抗肿瘤,又抑制肿瘤新生血管生成的作用[17-18]。近年研究证明,甲磺酸阿帕替尼对中晚期肝细胞癌具有一定疗效[19-20],且TACE联合阿帕替尼也有报道证实治疗中晚期肝癌有较好的临床疗效[21-23]。
本研究比较了阿帕替尼与索拉非尼分别联合TACE治疗中晚期肝癌的临床疗效,结果显示,用阿帕替尼联合TACE治疗中晚期原发性肝癌,近期疗效较高,治疗后3月甲胎蛋白较治疗前明显下降,1年生存能有一定获益,与索拉非尼组相比差异无统计学意义;两组治疗过程中主要不良反应均为Ⅰ-Ⅱ级不良反应,虽然阿帕替尼组高血压、皮肤粘膜反应等不良方面高于索拉非尼组,但多数不良反应轻微,经过处理不良反应在可控范围内。
4 结论
TACE联合阿帕替尼与联合索拉非尼临床疗效基本等同,副反应可控,因其价格相对实惠,可作为临床治疗中晚期原发性肝癌的一种有效的化疗选择。
【参考文献】
[1]Alveslr C,Alves D,Guz B,etal.A dvanced hepatocellular carcinoma.Review of targeted molecular drugs[J].Ann Hepatol,2011,10(1):21-27.
[2]冯久桓,秦叔逵,王琳.甲磺酸阿帕替尼的研究现状与进展[J].临床肿瘤学杂志2017,22(4):345-356.
[3]Kou P,Zhang Y,Shao WB,etal.Significant efeacy and well safety of apatinib in an advanced liver cancer patient:a case report and literature review[J].Oncotarget,2017 Mar,8(12):20510-20515.
[4]王宝泉,张岳林,聂春辉,等.阿帕替尼联合TACE治疗原发性肝癌疗效观察[J].心理医生,2017,23(3):64-65.
[5]胥栋,袁伟东.肝动脉插管化疗栓塞术治疗原发性肝癌临床疗效分析[J].实用肝脏病杂志,2015,(2):195-196.
[6]杨建军,党冬梅.TACE治疗肝癌患者30例疗效分析[J].临床医学,2017年6月:16-18.
[7]Luo J,Guo RP,Lai EC,etal.Transarterial chemoembolization for unresectable hepatocelllular carcinoma with portal vein tumor thrombosis:a prospective comparative study[J].Ann Sung Oncol,2011,18(2):413-420.
[8]姚雪松,闫东,刘德忠,等.TACE联合索拉非尼治疗不能手术切除肝细胞癌的不良反应与疗效[J].中国介入影像与治疗学,2013,10(4):230-234.
[9]王卫东,黄巧胜,倪嘉延,等.TACE与索拉非尼联合治疗中晚期肝癌临床研究的Meta分析[J].临床放射学杂志,2015,34(11):1816-1821.
[10] Llovet JM,Ricci S,Mazzaferro V,etal.Sorafenib in advanced hepatocellular carcinoma[J].N Engl Med,2008,(24);359(4):378-390.
[11] Bruix J,Raoul JL,Sherman M,etal.Efficacy and safety of sorafenib in patients with advanced hepatocellular carcinoma:subanalyses of a phase III trial[J].J Hepatol,2012,57(4):821-829.
[12] Guo X,Xiong L,Zou L,etal.L1 cell adhesion molecule overexpression in hepatocellular carcinoma associates with advanced tumor progression and poor patient survival[J].Diagn Pathol,2012, 13,7:96.
[13] 沈艺南,卢军华.肝细胞癌相关分析靶向治疗研究进展[J].临床肝胆病杂志,2015,31(1):130-133.
[14] Wu FX,Chen J,Bai T,etal..The safety and efficacy of transarterial chemoembolization combined with sorafinib and sorafenib mono-therapy in patients with BCLC stage B/C hepatocellular carcinoma[J].BMC Cancer, 2017, 12;17(1):645.
[15] 张鹏,顾爱丽,石东梅,等.TACE联合索拉非尼治疗晚期肝癌的疗效观察[J].北方药学,2017,14(5):102-103.
[16] 蒲军,彭秀兰.TACE联合索拉菲尼分子靶向治疗晚期肝癌远期疗效体会[J].中国医院用药评价与分析,2016,16(01):101.
[17] 朱丹,赵宏伟,赵健琦,等.肿瘤分子靶向药物阿帕替尼的临床研究进展.中国医院药学杂志,2017,37(2):194-198.
[18] 鲁丁瑜,李娜,李志平.多靶点抗肿瘤新药阿帕替尼的研究进展[J].华西药学杂志,2017,32(1):104-108.
[19] 宋锦添,陈奕贵,许春伟,等.阿帕替尼治疗53例晚期原发性肝癌的疗效,2017,37(3):557-563.
[20] 廖景升,刘琦,黎焕君,等.甲磺酸阿帕替尼治疗晚期原发性肝癌疗效及安全性观察[J].海南医学,2017,28(5):714-716.
[21] 金鑫荔,卢伟.TACE联合阿帕替尼治疗中晚期肝细胞癌[J].中国介入影像与治疗学,2017,14(4):200-204.
[22] 李威,满文玲,郭欢庆,等.TACE联合甲磺酸阿帕替尼治疗中晚期肝癌的临床研究[J].肿瘤药学,2017,7(1):74-78.
[23] Lu W,Jin XL,Yang C,etal.Comparison of efficacy between TACE combined with apatinib and TACE alone in the treatment of intermediate and advanced hepatocellular carcinoma:A single-center randomized controlled trial[J].Cancer Biol Ther,2017, 3,18(6):433-438.
