P2Y4受体在面神经损伤后再生过程中的作用*
2018-05-25高颖娜陈世彩王伟陈东辉李孟郑宏良
高颖娜 陈世彩 王伟 陈东辉 李孟 郑宏良
面神经及其相关的肌肉组织共同调节面部表情和基本的面部功能,其损伤后会引起面瘫。尽管目前面神经损伤修复的显微外科手术使神经再生的精确度有了一定的提高,但90%面瘫患者面神经功能仍难以完全恢复[1]。因此,深入研究神经再生的机制以促进神经有效再生和功能恢复至关重要。
周围神经损伤后影响其功能恢复的主要决定因素在于轴突准确再生至原来的靶器官,重新形成运动终板,使其获得充分的神经再支配,雪旺氏细胞在此过程中起关键作用。在神经再生过程中,轴突释放的嘌呤及其代谢产物作为信号分子和神经递质,与胶质细胞上的嘌呤能P1和P2受体结合,参与调控周围神经损伤后的再生及髓鞘的形成[2];其中激活P2Y受体可促发Ca2+的内流,同时激活ERK/MAPK、p38MAPK、RhoA/Rock等多条信号转导通路,而这正是调控雪旺氏细胞增殖、活化、迁移和髓鞘形成及维持所必需的[3,4]。P2Y受体拮抗剂苏拉明(suramin)可阻断再生轴突的嘌呤能递质ATP与雪旺氏细胞上P2Y2、P2Y11等受体的结合,使再生的大鼠坐骨神经运动神经元轴突数量明显减少,从而影响其功能恢复[5]。
前期研究结果提示,P2Y4 受体激活可能调控雪旺氏细胞的迁移和轴突的延伸[6],但能否促进神经再生和功能恢复及其可能的机制尚不清楚,故本研究拟通过构建大鼠面神经损伤再生模型并对P2Y4受体进行药物干预,观察P2Y4受体在面神经损伤后神经再生及面肌功能恢复过程中的作用。
1 材料与方法
1.1实验动物及分组 30只健康成年雄性SD大鼠(清洁级,上海斯莱克实验动物有限责任公司),体重200~250 g,随机分为3组:0.9%生理盐水对照组(对照组)、P2Y4受体激动剂组(激动剂组)和P2Y4受体拮抗剂组(拮抗剂组),每组10只。所有动物实验均已通过海军军医大学附属长海医院实验动物伦理委员会批准。
1.2P2Y4受体激动剂及拮抗剂的选择 本实验选用MRS4062作为大鼠P2Y4受体的选择性激动剂,适宜浓度50 μM,活性蓝2(Reactive Blue2)作为大鼠P2Y4受体的拮抗剂,适宜浓度100 μM[7~9]。
1.3Nuerolac可吸收共聚高分子外周神经套接管的准备 在植入动物体内前,首先将内径1.5 mm的Nuerolac在无菌条件下分割成长度约4 mm的小段用于行神经断端桥接,然后置入37 ℃恒温水中浸泡3分钟,使套接管更加柔韧,利于缝合时针头穿过管壁。
1.4ALZET植入式胶囊渗透压泵的准备 将胶囊渗透压泵灌注、称重后置入37 ℃的生理盐水中孵育60小时,使胶囊渗透压泵达到均衡、稳定的泵出速率。
1.5构建面神经损伤神经再生室及P2Y4受体药物干预的稳定动物模型 所有大鼠适应性饲养,并观察24小时,以排除特发性面神经损伤。选取右侧面神经构建神经损伤再生模型,左侧面神经作为正常对照侧,不做手术处理。
各组动物腹腔注射10%水合氯醛(40 mg/kg)全身麻醉后,取右侧耳后切口,于茎乳孔处开始向外耳道软骨的下方至咬肌后缘顺行分离暴露面神经颅外段的主干,长度约5.21±0.48 mm,于中点处切断面神经主干,采用内径1.5 mm、长度4 mm的Neurolac可吸收共聚高分子外周神经套接管,将神经近心端和远心端分别置入套管内各1 mm,并以11-0的无损伤缝合线将套管与神经两断端外膜各缝合1~2针固定,完成桥接,形成神经再生室。
各组大鼠完成面神经损伤后,均采用ALZET植入式胶囊渗透压泵(型号2006,剂量200 μl,0.15 μl/h)进行药物干预。将预先准备好的分别灌满0.9%生理盐水、50 μM MRS4062、100 μM活性蓝2溶液的胶囊泵分别植入对照组、激动剂组及拮抗剂组大鼠的后背部皮下,将其导管接头调整至神经再生室周围靠近面神经近心端的位置,5-0的缝线缝合固定,以确保泵内的药液定点、均匀、持续地缓释到神经再生室周围;逐层缝合创面,完成P2Y4受体药物干预的稳定动物模型。术后连续注射青霉素40万单位3天。
1.6大鼠面肌功能的观察及分级 模型建立后每日观察各组大鼠双侧触须的对称性及运动情况、瞬目反射。正常情况下,触须向前竖起并伴有节律性地拂动,用针筒吹其一侧眼睛可使双侧眼睑活动而瞬间闭合。根据de Farial[10]提出的大鼠面神经离断模型的评分系统,以正常左侧为对照,将触须拂动和瞬目反射各分为5个等级,制定面肌功能评分表(表1)。采用双盲法对各组大鼠分别评分后,将二者的评分相加进行评估分析。

表1 大鼠面肌功能评分表
1.7大鼠面肌诱发肌电图检测 术后6周同法分离暴露双侧面神经后,采用德国Axion肌电图仪检测并记录面肌诱发电位,先左侧,后右侧;将记录电极平行于大鼠口轮匝肌准确插入其中,刺激电极放置于面神经主干近心端的表面;刺激电流设定为1 ms脉冲模式,调整电流刺激强度,分别记录双侧面肌诱发电位的最大振幅和峰潜伏期。
1.8大鼠面肌及面神经的取材与处理 完成肌电图检查后,分离并切取右侧上唇轮匝肌,大小约0.3 cm×0.3 cm×0.1 cm;靠近神经再生室的下方切取面神经远心端约0.3 cm。同法切取左侧上唇轮匝肌和左侧面神经远心端作为正常对照。标本立即置入4%多聚甲醛固定液中固定24 h,流水冲洗24 h,梯度酒精法脱水,二甲苯进行透明,石蜡包埋。
1.8.1面神经甲苯胺蓝染色 面神经以石蜡包埋后行4 μm半薄切片,脱腊至水,蒸馏水浸洗3~5分钟,0.1%甲苯胺蓝液(Sigma公司)浸染10 min,水洗洗去多余染液,脱水,二甲苯透明,中性树胶封固。40倍光镜下观察面神经干内有髓神经纤维,每个样本随机选取3个视野,并采用NIKON数字图像系统ACT-1采集图像、拍照记录,图像分析软件计数每个视野的有髓神经纤维数,计算后获得单位面积内的有髓神经纤维数目。
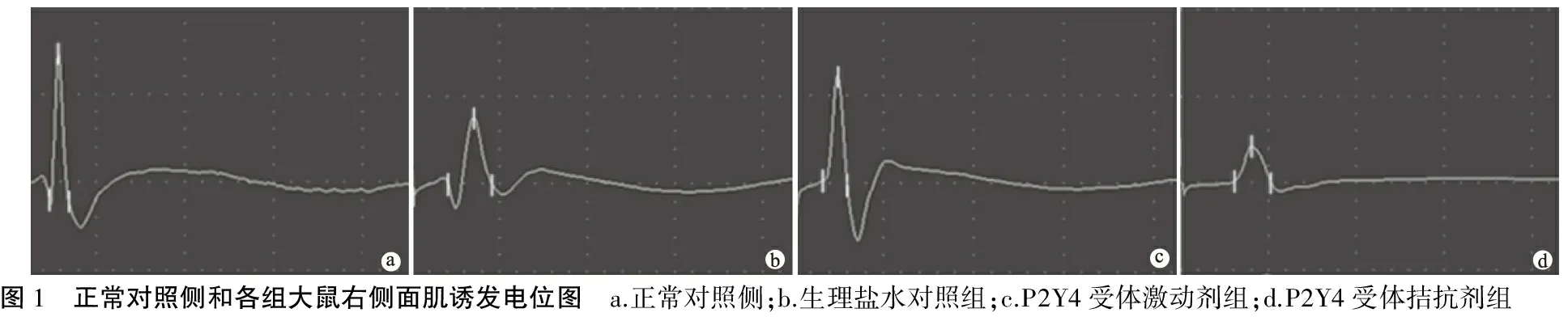
1.8.2面肌Masson染色 面肌标本石蜡包埋后行8 μm薄层切片,脱腊至水,苏木素染5~10 min,流水稍洗;1%盐酸酒精分化,流水冲洗数分钟,丽春红酸性品红液中染5~10 min,流水稍冲洗,1%磷钼酸溶液中染1~3 min,不用水洗直接入苯胺蓝染液复染5 min,1%冰醋酸处理1 min,95%酒精脱水数次,无水酒精脱水、二甲苯透明、中性树胶封固。20倍光镜下观察染色结果,显示骨骼肌纤维呈红色,结缔组织胶原纤维呈蓝色,随机选取3个视野,同法获得每个视野内肌纤维数目和平均肌纤维直径。
1.9统计学方法 剔除每组死亡动物,剩余动物模型中所取得的实验数据以Exel表格建库,所有数据用均数±标准差表示,采用SPSS l9.0统计软件先进行各组方差齐性检验,符合条件方差齐性,各组间均数比较采用单因素方差分析(ANOVA)和t检验;不符合条件方差齐性,采用非参数检验。
2 结果
实验过程中生理盐水对照组、P2Y4受体激动剂组和P2Y4受体拮抗剂组分别有2、3、2只大鼠死亡,6周时三组动物模型分别存活8、7、8只。
2.1各组大鼠面肌运动恢复情况观察 大鼠左侧面肌功能正常,右侧术后即发生面瘫,可见触须倒向尾部,均无节律性拂动,瞬目反射均消失,眼睑均无法闭合。术后4周时,P2Y4受体激动剂组均能观察到轻微的触须拂动,并逐日增强,刺激眼睑可有肌肉颤动,但无闭合;对照组和P2Y4受体拮抗剂组分别只有4只和1只大鼠出现轻微的触须颤动,无瞬目反射。术后6周时激动剂组触须摆动明显但仍不对称,睑裂闭合3/4;对照组均可见中度触须摆动,其中4只睑裂闭合3/4,4只闭合1/2;P2Y4受体拮抗剂组可见轻度至中度触须摆动,睑裂闭合1/2。各组大鼠术后4、6周面肌功能评分见表2,可见术后4、6周时P2Y4受体激动剂组面肌功能评分优于对照组,P2Y4受体拮抗剂组差于对照组和P2Y4受体激动剂组,差异均有统计学意义(均为P<0.05)。提示激活P2Y4受体能更好的促进面神经再生、面肌功能恢复。
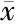
表2 各组大鼠术后4、6周面肌功能评分(分,±s)
2.2各组大鼠面肌诱发肌电图检查结果 大鼠左侧面肌在0.4~0.6 mA电流时即可记录到面肌诱发电位最大振幅和峰潜伏期,分别为5.63±2.16 mV、2.04±0.56 ms。术后6周时对照组、P2Y4受体激动剂组、P2Y4受体拮抗剂组右侧面肌的最大振幅分别为左侧的70.6%、84.2%、54.1%,潜伏期分别为左侧的134.5%、116.7%、151.2%,与左侧相比差异均有统计学意义(均为P<0.05);且P2Y4受体激动剂组最大振幅明显高于生理盐水对照组,潜伏期明显短于生理盐水对照组;P2Y4受体拮抗剂组最大振幅则明显低于生理盐水对照组和激动剂组,潜伏期明显长于生理盐水对照组和激动剂组,差异均有统计学意义(P<0.05)(表3、图1)。

表3 术后6周各组大鼠右侧面肌诱发电位最大振幅、峰潜伏期及单位面积内有髓神经纤维数目、肌纤维数目和肌纤维平均直径±s)
2.3各组面神经远心端主干有髓神经纤维组织数量及组织形态学变化 光镜下见正常面神经形态良好,外膜光滑完整,滋养血管清晰可见,神经纤维数量、直径均正常,染色均一,无脱髓鞘改变,单位面积内有髓神经纤维数目为1 351±104根。术后6周时,P2Y4受体激动剂组面神经形态相对较接近正常,可见大量的有髓轴突再生,神经外膜结构基本完整,较清晰,神经纤维排列较均匀;拮抗剂组面神经形态结构恢复相对较差,再生的轴突数目较少,外膜欠清晰,排列欠均匀、较稀疏;对照组神经纤维组织形态恢复情况介于二者之间。对照组、P2Y4受体激动剂组和P2Y4受体拮抗剂组单位面积内有髓纤维数目分别为正常侧的72.9%、83.6%和56.9%,各组均较正常侧减少,差异均有统计学意义(均为P<0.05)。但P2Y4受体激动剂组单位面积内有髓纤维数目明显多于对照组,而P2Y4受体拮抗剂组明显少于对照组和激动剂组,差异均有统计学意义(均为P<0.05)(表3、图2)。
2.4各组大鼠面肌纤维数目、平均直径以及组织形态学变化 正常侧面肌纤维排列整齐紧密,直径粗大,肌纤维间结缔组织极少(图3a)。术后6周时,生理盐水对照组的面肌恢复尚可(图3b),肌纤维密度和直径中等,单位面积内肌纤维数目和平均直径分别为正常侧的72.7%和69.5%,差异均有统计学意义(P<0.05);P2Y4受体激动剂组的面肌从形态上比其它两组更接近正常侧(图3c),密度较大,排列较为紧密,直径较粗大,其单位面积内肌纤维数目和平均直径分别为正常对照侧的85.7%和86.0%,差异均有统计学意义(P<0.05);而P2Y4受体拮抗剂组的面肌恢复则较差(图3d),肌纤维数量较少,分布稀疏,直径细小,其单位面积内肌纤维数目和平均直径分别为正常对照侧的54.7%和53.3%,差异均有统计学意义(P<0.05);但P2Y4受体激动剂组单位面积内肌纤维数目和平均直径明显大于对照组,而P2Y4受体拮抗剂组均小于对照组和激动剂组,差异均有统计学意义(P<0.05)(表3、图3)。

3 讨论
周围神经损伤后,雪旺氏细胞的定向迁移对指引再生和芽生的轴突回到去神经支配的终板起着重要作用,这个过程包括复杂的细胞和分子事件以及精细的调控机制[5,11]。研究表明,细胞外的核苷酸类与一些嘌呤能P2Y受体结合后会引起细胞内的Ca2+瞬间升高,从而通过一系列的信号转导机制参与周围神经轴突再生和髓鞘重塑等过程[12];但是上述作用具体由P2Y家族的哪个亚型调控尚不清楚。近些年来的研究发现P2Y4受体参与了神经元的分化[13],其在大鼠坐骨神经损伤后吻合口远端有强表达,提示其可能参与了周围神经损伤后的病理生理改变和神经再生修复过程[14]。本课题组前期研究结果也提示雪旺氏细胞上的P2Y4受体表达的时空改变可能通过调控雪旺氏细胞的功能而在兔喉返神经再生过程中起着潜在的重要作用[6]。然而,到目前为止,尚没有直接描述雪旺氏细胞上P2Y4受体激活后影响靶器官功能恢复的报道。
本研究结果显示,各组大鼠面神经损伤修复后面肌功能均有不同程度的恢复,虽仍无法完全恢复正常,但使用P2Y4受体选择性激动剂MRS4062可明显促进面神经的轴突再生,术后6周其有髓神经纤维和面肌纤维的数量及肌纤维的直径均较对照组增加;而使用活性蓝2阻断P2Y4受体则使大鼠面神经轴突再生明显减少;可见,激活P2Y4受体明显促进了大鼠面肌运动功能的恢复,进一步表明P2Y4受体在面神经损伤再生过程中的重要作用。
离断的神经修复后其失神经支配肌肉的功能恢复程度取决于神经再支配的运动单位数量。通常再生神经纤维无法全部通过断端, 只有一部分神经纤维可以重新支配肌肉。再生神经至少恢复30%的正常运动单位才能支配所有失神经肌肉,否则肌肉将萎缩,变得更小更弱,肌纤维比正常更少[15],因此,及时有效地使失神经的肌肉获得充分的神经再支配是决定靶器官功能恢复程度的关键。前期研究结果显示,正常大鼠喉返神经雪旺氏细胞上的P2Y4 受体表达极弱,几乎无法被检测到;而在神经损伤后的早期,其表达量显著增高,在损伤后期再生完成时又迅速下调至正常水平[6],其在时间上的表达变化规律与文献报道的神经再生过程中的一些细胞粘附分子(如神经细胞粘附因子NCAM)、细胞骨架蛋白(如vimentin)的表达规律基本一致,均在周围神经损伤后表达增高,而这些分子正是雪旺氏细胞迁移、轴突诱向生长以及髓鞘重塑过程中所必需的[16,17],这也进一步表明P2Y4受体可能通过调控多条信号转导通路激活下游的细胞粘附分子和细胞骨架蛋白的表达,导致雪旺氏细胞的迁移、轴突的延伸和髓鞘的形成,从而促进周围神经的再生。因此,通过药物激活P2Y4受体,可以使再生的轴突更准、更快地向神经远心端生长,使失神经靶器官更早、更好地获得神经再支配,从而减少肌肉萎缩、纤维化的发生;而阻断P2Y4受体后雪旺氏细胞迁移活动减弱,再生的神经纤维数量明显较少,肌肉无法获得有效的神经再支配而引起大量纤维结缔组织增生,使其功能明显减退;这也与本研究中的各组大鼠面肌肌电图研究结果相一致,进一步证实激活P2Y4受体面神经功能可得到更好的恢复,而拮抗剂组则效果不佳。
综上所述,本研究结果显示激活P2Y4 受体可以明显促进受损面神经髓鞘形成和轴突再生,从而促进面肌功能的恢复;而抑制P2Y4受体则使面神经再生受阻,面肌功能恢复较差。这也进一步明确了P2Y4受体对面神经再生的促进作用,但其确切的分子机制和可能的信号转导机制有待进一步的研究加以阐明。
4 参考文献
1 Brushart TM, Gerber J, Kessens P, et al. Contributions of pathway and neuron to preferential motor reinnervation[J].Journal of Neuroscience,1998, 18:8674.
2 Borvendeg SJ, Gerevich Z, Gillen C, et al. P2Y receptor-mediated inhibition of voltage-dependent Ca2+channels in rat dorsal root ganglion neurons[J].Synapse, 2003, 47:159.
3 Yu H, Zhu L, Li C, et al. ERK1/2 and AKT are vital factors in regulation of the migration of rat Schwann cells[J].Journal of Veterinary Medical Science, 2015, 77:427.
4 Ogata T, Iijima S, Hoshikawa S. Opposing extracellular signal-regulated kinase and Akt pathways control Schwann cell myelination[J].Journal of Neuroscience, 2004, 24:6724.
5 Vrbova G, Mehra N, Shanmuganathan H, et al. Chemical communication between regenerating motor axons and Schwann cells in the growth pathway[J].European Journal of Neuroscience, 2009,30:366.
6 Chen SC, Xia SW, Sun Y, et al. Expression of purinergic receptor P2Y4 in Schwann cell following nerve regeneration[J].International Journal of Clinical & Experimental Medicine, 2015, 8:13203.
7 Maruoka H, Jayasekara MPS, Barrett MO, et al. Pyrimidine nucleotides with 4-alkyloxyimino and terminal tetraphosphate δ-ester modifications as selective agonists of the P2Y4 receptor[J].Med Chem, 2011, 54:4018.
8 Bogdanov YD, Wildman SS, Clements MP, et al. Molecular cloning and charact erization of rat P2Y4 nucleotide receptor[J]. British Journal of Pharmacology, 1998, 124:428.
9 Burnstock G, Verkhratsky A. Purinergic signalling and the nervous system[M]. Berlin Heidelberg:Springer-Verlag,2012.190~197.
10 de Faria SD,Testa JR,Borin A, et al. Standardization of techniques used in facial nerve section and facial movement evaluation in rats[J]. Brazilian Journal of Otorhinolaryngology,2006, 72:341.
11 Tam SL, Gordon T. Neuromuscular activity impairs axonal sprouting in partially denervated muscles by inhibiting bridge formation of perisynaptic Schwann cells[J].Journal of Neurobiology,2003, 57:221.
12 Orriss IR, Gueneri D, Hajjawi MO. Activation of the P2Y2 receptor regulates bone cell function by enhancing ATP release[J]. Journal of Endocrinology, 2017, 233:JOE-17-0042.
13 Hussl S, Boehm S. Functions of neuronal P2Y receptors[J].Pfl gers Archiv European Journal of Physiology, 2006, 452:538.
14 薄占东,赵劲民,苏伟,等.大鼠坐骨神经损伤后嘌呤P2Y4受体表达变化的实验研究[J].广西医科大学学报, 2009, 26:103.
15 Stennert ER,Kreutzberg GW,Michel O,et al.The facial nerve:an update on clinical and basic neuroscience research[M].America:Springer-Verlag,1994.S21~23.
16 Bachelin C,Zujovic V,Buchet D,et al. Ectopic expression of polysialylated neural cell adhesion molecule in adult macaque Schwann cells promotes their migration and remyelination potential in the central nervous system[J].Brain A Journal of Neurology,2010,133:406.
17 Chang IA,Oh M,Kim MH,et al. Vimentin phosphorylation by Cdc2 in Schwann cell controls axon growth via β1-integrin activation [J].The FASEB Journal,2012,26:2401.
