葡萄糖氧化酶诱导大鼠血管纹边缘细胞氧化应激模型的建立与评估*
2018-05-25胡泠影张圆圆曾峰华清泉
胡泠影 张圆圆 曾峰 华清泉
内耳细胞的过氧化损伤与多类神经性聋有关[1,2]。研究表明血管纹边缘细胞(marginal strial cell,MC)很容易受到过氧化损害,MC在维持耳蜗内高钾状态、淋巴高渗透压、耳蜗内高电位等特殊电生理特征方面有重要意义,是维持耳蜗毛细胞生理功能的必要条件[3,4]。过氧化损伤通常由活性氧(reactive oxygen species,ROS)引起,细胞内ROS增多时,会引起细胞内DNA、蛋白质和脂质的过氧化损伤,破坏细胞的结构和功能,引发细胞凋亡、坏死或组织功能的损害[5,6]。目前氧化应激模型多采用葡萄糖氧化酶(glucose oxidase,GO)法,GO可模拟氧化环境,使细胞稳定产生H2O2[7~9]。国内外已经建立了体外培育MC的一系列方法,本研究拟采用GO处理体外培育的MC来建立大鼠耳蜗MC的过氧化损伤模型,并评价该模型的稳定性和可靠性,为进一步探究MC氧化损伤的分子机制奠定基础。
1 材料与方法
1.1大鼠耳蜗MC的提取及培养 取3日龄以内的SD幼鼠(42只,每次用4~8只,分7次完成,分别用于以下实验)耳蜗,用75%酒精浸泡10分钟后,去除幼鼠双侧颞骨,在显微镜下从耳蜗顶部至底部逐层解剖分离得到血管纹细胞。将所得组织剪碎至约0.5 mm后用II型胶原酶在37 ℃恒温箱中消化30分钟,随后800~1 000 rpm离心机离心5分钟;去除上清液,将细胞转移至上皮细胞培养基中(EpiCM,Scien Cell, USA)置于5%CO2的37 ℃恒温培养箱中培养待用[10]。
1.2大鼠MC的鉴定 提取培养的MC用角蛋白-18(CK18)作为标记物通过免疫荧光法进行细胞鉴定[10]。将所提取的MC接种至多聚赖氨酸(Sigma-Aldrich, St. Louis, MO,USA)处理过的盖玻片上,置于12孔细胞培养板中制作细胞爬片,待MC爬片形成单层细胞结构后,弃掉培养基,磷酸盐缓冲液(PBS)清洗3次后,用4%的多聚甲醛在室温下固定15分钟,随后再用PBS清洗3次;用0.3% TritonX-100(Sigma-Aldrich, St. Louis, MO,USA)将MC破膜处理20分钟,然后用PBS清洗三次;5%的血清白蛋白(BSA)封闭20分钟后,用CK18抗体(1∶50,Abcam,Cambridge, MA, USA)在4 ℃下孵育过夜,随后用抗兔的IgG二抗(1∶100)在室温下孵育30分钟,然后用PBS清洗三次。洗涤MC并用4′6-二脒基-2-苯基吲哚(DAPI,Sigma-Aldrich,St. Louis, MO,USA)在室温下染色3分钟后,在荧光显微镜下观察并鉴定。
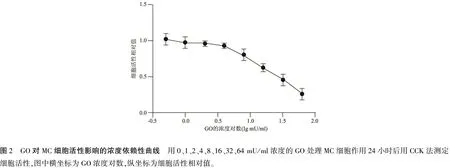
1.3CCK8法检测GO对MC损伤的半抑制浓度(half maximal inhibitory concentration, IC50)值 用CCK8法(Dojindo Laboratories, Kumamoto, Japan)检测细胞活性,以获得GO对MC损伤的IC50值。将MC接种于96孔板中,待细胞形成单层结构而且细胞融合度约为90%时,每孔加入0、1、2、4、8、16、32、64 mU/ml的GO,每个浓度制作3个复孔,处理24小时;随后每孔加入20 μl的CCK8工作液,37 ℃孵育1.5小时后,450 nm下酶标仪检测每孔的吸光度值(OD值)。以不含细胞的孔为调零组,GO浓度为0 mU/ml的孔为空白组,其余组为浓度梯度组,各组细胞活性%=(各浓度梯度组OD值-调零组OD值)/(空白组OD值-调零组OD值)×100%,制作GO对MC凋亡作用的浓度依赖曲线,据此得出GO对MC损伤的IC50值。
1.4流式细胞术及荧光显微镜检测原代MC内ROS的表达 细胞内活性氧的水平用荧光分子探针DCFH-DA(Beyotime, Shanghai, China)检测,将MC接种于6孔板内,分为以下两组:用GO处理的MC作为实验组,处理时间为24小时,GO浓度采用1.3中所测算的IC50值;以不加GO处理的MC作为对照组,处理时间同实验组;然后,用DCFH-DA(10 μM)室温下孵育30分钟后,用流式细胞术和荧光显微镜检测两组ROS的表达。
1.5超氧化化物歧化酶(SOD)活性的检测 实验组及对照组细胞产生的超氧化物歧化酶活性通过WST试剂盒检测(Sigma-Aldrich, St. Louis, MO,USA),高水溶性的四唑盐WST-1被样品中的O2-氧化生成甲臜,其浓度与SOD活性成正比,然后用酶标仪在450 nm波长下检测样品吸光度。SOD标准样品的浓度范围是0.001~200 Units/ml,样品的蛋白浓度用BCA法测定,单位为mg/ml,SOD的相对活性的单位为Units/mg。
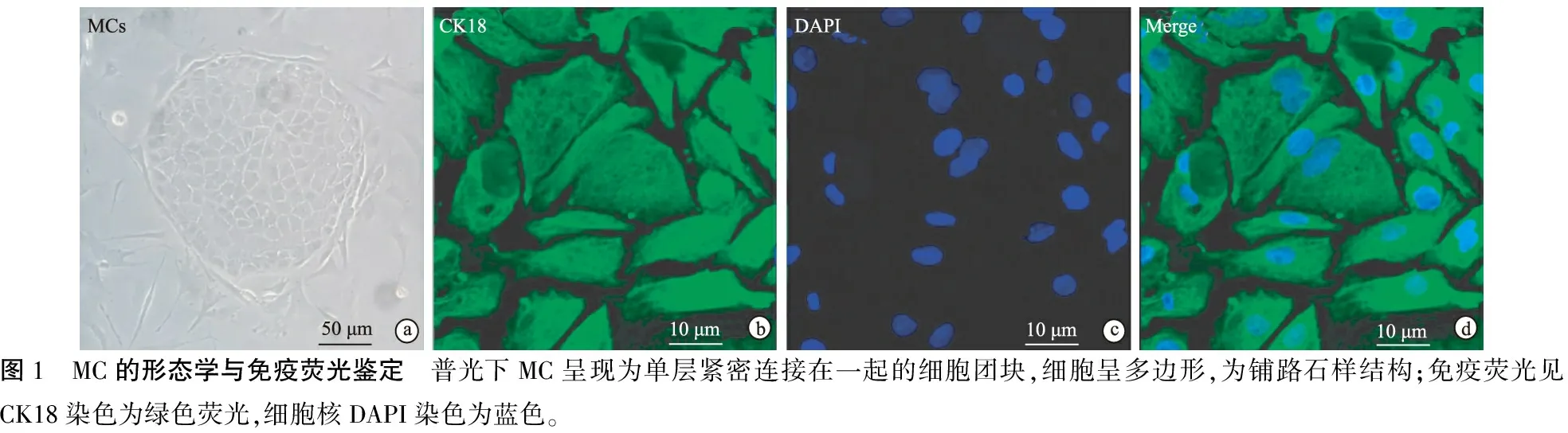
1.6Western-blot检测MC的凋亡蛋白 提取原代MC之后,将其均匀接种至6孔板中(细胞数量3.0×105个/孔),实验组及对照组MC分别处理24小时后,每孔加入含有1 mM的phenylmethylsulfonyl fluoride(PMSF)RIPA裂解液100 μl,在4 ℃下处理30分钟,BCA法测定聚腺苷酸二磷酸核糖转移酶-1(PARP1)和凋亡蛋白cleaved-caspase 3的蛋白浓度。用12%的SDS-page缓冲液电泳,将蛋白质转至PVDF膜,用抗PARP1,cleaved-caspase-3,β-actin (Cell Signaling Technology, MA, USA)等抗体4 ℃下孵育过夜。化学偶联二抗室温下孵育1小时后检查印记的发光值,用Image Lab软件分析灰度值,用β-actin灰度值(DPI)作为基准量。
1.7流式细胞术检测细胞凋亡 用Annexin V-FITC和propidium iodide (PI)双标进行细胞凋亡的检测。实验组和对照组分别处理24小时之后,用PBS清洗3次,胰蛋白酶消化至约80%的细胞发生皱缩后终止消化,离心机1 000 rpm离心5分钟后弃掉悬液,用PBS清洗2次,用包含有5 μlAnnexin V-FITC和5μlPI的100 μl 1×结合缓冲液重悬MC,室温避光孵育15分钟,随后用流式细胞仪检测(BD Biosciences, Carlsbad, CA)细胞凋亡情况。
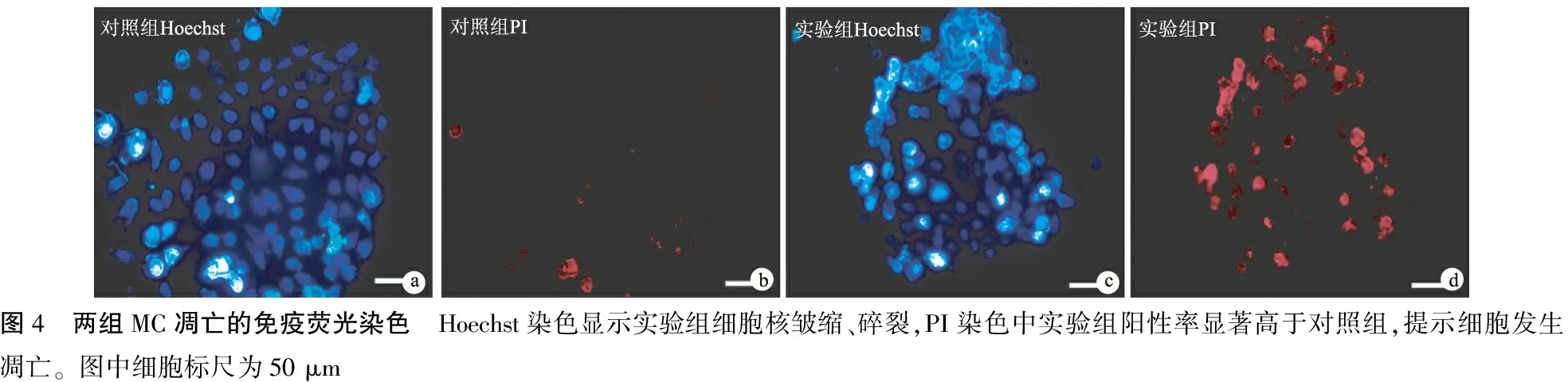
1.8荧光试剂盒检测MC凋亡 用荧光试剂盒Hoechst/PI检测GO处理后细胞的凋亡。将MC接种于多聚赖氨酸预处理过的12孔细胞培养板中,待细胞分散形成单层结构后,加入Hoechst33258溶液,使其终浓度为1 mg/ml,在37 ℃下处理7分钟。PBS清洗后,加入PI染液,使其终浓度为5 mg/ml,冰浴处理,PBS清洗之后,将培养板置于倒置荧光显微镜下(LSCM)观察,记录400~500 nm下的蓝光和红光,其中蓝光标记Hoechst,红光标记PI。用Corel Draw X5(Corel, Canada)软件获取图像。
1.9统计学方法 应用SPSS19.0 (IBM, USA)统计软件分析数据,Western-blot结果采用Image Lab软件(NIH,USA)进行分析,实验组与对照组的对比采用独立样本t检验或卡方检验。
2 结果
2.1原代MC的培养与鉴定 大鼠MC呈多边形,有明显的边界,细胞之间紧密连接形成单层铺路石样结构,免疫荧光中CK8染色为强阳性(图1)。
2.2GO对MC活性的影响 用梯度浓度的GO处理MC 24小时后,MC出现不同比例的凋亡,GO对MC损伤的浓度依赖曲线见图2,算得IC50=32.9 mU/ml [18.93,57.24]。
2.3实验组MC中ROS和SOD浓度 流式细胞学及免疫荧光检测结果提示,实验组MC内ROS产生量较对照组显著增多(P=0.021 8);WST法检测结果显示,实验组SOD活性显著下降(P=0.002 7)(图2、表1)。
2.4原代MC中凋亡相关蛋白的表达 Western-blot检测结果提示,实验组中凋亡蛋白cleaved-caspase-3以及聚腺苷酸二磷酸核糖转移酶-1(PARP1)的表达升高(图3、表1)。
2.5GO对MC凋亡的诱导 实验组细胞凋亡率较对照组增高(P=0.000 7)(图3、表1)。Hoechst染色结果显示GO处理后MC核发生皱缩、碎裂,PI染色结果示实验组细胞凋亡率更高(P=0.021 8)(图4)。
3 讨论
氧化应激反映细胞内ROS生成和清除的不平衡状态,是许多疾病中细胞损伤的病理生理基础[11~13]。内耳MC中的线粒体和过氧化物酶体系均可产生ROS,其中线粒体是主要产生部位[14,15],同时,细胞通过小分子抗氧化物质、抗氧化酶和具有抗氧化作用的代谢酶组成的抗氧化系统维持细胞内氧化还原的平衡状态。病理情况下,ROS过量产生,超过细胞自身的抗氧化系统清除能力时,便会出现细胞受损甚至凋亡,引起其功能损害[16,17]。SOD作为细胞内氧自由基清除剂,对氧化应激引起的内耳毛细胞及听觉神经元损伤具有保护作用,病理状况下SOD的活性可被抑制。20世纪80年代以来,许多学者已经先后报道了耳蜗MC在老年性聋、药物性聋、噪声性聋中的氧化损伤机制。耳蜗细胞的代谢非常旺盛,可产生大量ROS,生理情况下,ROS被耳蜗自身的抗氧化酶系统清除;病理状态下,ROS的清除速率下降,会对耳蜗尤其是MC产生功能性的损伤,导致耳蜗内环境紊乱,诱发各种类型的神经性聋[18~21]。因此建立稳定可靠的耳蜗MC氧化应激损伤模型对于进一步探究其分子机制的意义重大。
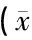
表1 实验组和对照组凋亡相关指标ROS、SOD含量对比±s)
GO在基础实验中主要用来模拟过氧化环境,GO与过氧化氢酶组成一个氧化还原酶系统,能够氧化β-D-葡萄糖生成H2O2和D-葡萄糖酸内酯。H2O2属活性氧,生理状态下它能够促进细胞的代谢和增殖;但是过多的H2O2会导致包膜脂质体过氧化、线粒体损伤、DNA损伤,促进细胞凋亡[22,23]。本研究中先采用不同浓度的GO处理MC 24小时后,发现随着GO浓度升高,MC活性逐渐降低,凋亡率逐渐升高,由此测得GO对MC损伤的IC50值为32.9 mU/ml,与最近发表文献结果[24,25]相近。采用IC50值浓度(32 mU/ml)的GO作为供氧剂处理MC24小时以后,ROS和SOD检测结果显示,实验组MC中ROS生成增多、SOD活性下降,细胞内氧化还原系统失衡,说明本研究成功建立了MC的过氧化应激模型。
对过氧化损伤致神经性聋机制的研究一定程度上依赖可靠的动物模型。本研究在用GO诱导大鼠MC氧化应激后,结合常用的一些凋亡相关评价指标对所建模型的可靠性进行了评价,可见,Western-blot检测结果显示实验组MC中cleaved-caspase-3表达量增高,与国内的一些研究结果[26]相同。聚腺苷酸二磷酸核糖转移酶-1(PARP1)表达升高与细胞内凋亡的发生相关[27],本研究中实验组PARP1表达较对照组明显升高;本研究采用Annexin V-FITC和propidium iodide (PI)法对比两组细胞的凋亡水平,结果显示实验组细胞凋亡率高于对照组,说明32 mU/ml的GO显著地促进了MC的凋亡,与最新研究结果相近[26]。此外,Hoechst/PI染色也是常用的细胞凋亡检测方法,Hoechst染料进入包膜通透性发生改变的凋亡细胞内与DNA结合并染色,本研究结果显示实验组的细胞核发生皱缩、碎裂,说明细胞发生了凋亡。以上这些结果均说明,IC50浓度的GO处理的MC确实发生了明显的氧化应激,并导致细胞凋亡,验证了该模型的可靠性和稳定性。
综上所述,本研究采用GO作用于体外培养MC的方法成功建立了稳定可靠的大鼠耳蜗MC的氧化应激损伤模型,为今后进一步深入研究MC过氧化损伤的分子机制及临床治疗奠定了基础。
4 参考文献
1 Yuan H, Wang X, Hill K, et al. Autophagy attenuates noise-induced hearing loss by reducing oxidative stress[J]. Antioxidants &Redox Signaling, 2015, 22:1308.
2 Henderson D, Bielefeld EC, Harris KC, et al. The role of oxidative stress in noise-induced hearing loss[J]. Ear and Hearing, 2006, 27:1.
3 Wu X, Steigelman KA, Bonten E, et al. Vacuolization and alterations of lysosomal membrane proteins in cochlear marginal cells contribute to hearing loss in neuraminidase 1 deficient mice[J]. Biochimicaet Biophysica Acta (BBA)-Molecular Basis of Disease, 2010, 1802:259.
4 罗蓉, 孔维佳, 程华茂. 线粒体毒素诱导突发性耳聋模型血管纹损伤机制的研究[J]. 中国组织化学与细胞化学杂志, 2009, 18:128.
5 张坤生, 田荟琳. 过氧化氢酶的功能及研究[J]. 食品科技, 2007, 32:8.
6 Rewerska A, Pawelczyk M, Rajkowska E, et al. Evaluating D-methionine dose to attenuate oxidative stress-mediated hearing loss following overexposure to noise[J]. European Archives of Oto-Rhino-Laryngology, 2013, 270: 1513.
7 Panayiotidis M, Tsolas O, Galaris D. Glucose oxidase-produced H2O2induces Ca2+-dependent DNA damage in human peripheral blood lymphocytes-Its mechanism and measurement in mammalian systems[J]. Free Radic Biol Med, 1999, 26:548.
8 Rost D, Welker A, Welker J, et al. Liver-homing of purified glucose oxidase: a novel in vivo model of physiological hepatic oxidative stress (H2O2)[J]. Journal of Hepatology, 2007, 46:482.
9 Cholia RP, Kumari S, Kumar S, et al. An in vitro study ascertaining the role of H2O2and glucose oxidase in modulation of antioxidant potential and cancer cell survival mechanisms in glioblastoma U-87 MG cells[J]. Metabolic Brain Disease, 2017, 32: 1705.
10 Zhao XY, Sun JL, Hu YJ, et al. The effect of overexpression of PGC-1 alpha on the mtDNA4834 common;deletion in a rat cochlear marginal cell senescence model[J]. Hear Res, 2013, 296:13.
11 Siomek A, Tujakowski J, Gackowski D, et al. Severe oxidatively damaged DNA after cisplatin treatment of cancer patients.[J]. International Journal of Cancer, 2006, 119:2228.
12 Kolaczkowska EKP. Neutrophil recruitment and function in health and inflammation[J]. Nature Reviews Immunology, 2013, 13:159.
13 王时俊, 邹云增, 孙爱军,等. 氧化应激在乙醛引起的心肌细胞凋亡中的作用[J]. 中国病理生理杂志, 2008, 24:1464.
14 雷义, 金文达, 陈锋. 活性氧与线粒体损伤[J]. 中南医学科学杂志, 2006,5:23.
15 Fariss MW, Chan CB, Patel M, et al. Role of mitochondria in toxic oxidative stress[J]. Molecular Interventions, 2005, 5:94.
16 Thomas JP, Lautermann J, Liedert B, et al. High accumulation of platinum-DNA adducts in strial marginal cells of the cochlea is an early event in cisplatin but not carboplatin ototoxicity[J]. Molecular Pharmacology, 2006, 70:23.
17 Casares C, Ram rez-Camacho R, Trinidad A, et al. Reactive oxygen species in apoptosis induced by cisplatin: review of physiopathological mechanisms in animal models[J]. European Archives of Oto-Rhino-Laryngology, 2012, 269:2455.
18 Ren H, Zhou X, Luan Z, et al. The relationship between carotid atherosclerosis, inflammatory cytokines, and oxidative stress in middle-aged and elderly hemodialysis patients[J]. International Jouranl of Nephrology,2013, 9:25, 2013.
19 Kaur M, Sandhir R. Comparative effects of acute and chronic carbofuran exposure on oxidative stress and drug-metabolizing enzymes in liver[J]. Drug &Chemical Toxicology, 2006, 29:415.
20 Tafazoli S, Spehar DD, O'Brien PJ. Oxidative stress mediated idiosyncratic drug toxicity[J]. Drug Metabolism Reviews, 2005, 37:311.
21 Henderson D, Bielefeld EC, Harris KC, et al. The role of oxidative stress in noise-induced hearing loss[J]. Ear and Hearing, 2006, 27:1.
22 钱中清, 曾耀英, 王通,等. VEGF诱导血管内皮细胞产生H2O2及其促增殖作用[J]. 中国病理生理杂志, 2007, 23:533.
23 周健洪, 黎晖, 宋述财,等. 过氧化氢对骨髓间充质干细胞增殖活性的影响[J]. 广东医学, 2005, 26:1199.
24 Zhang Y, Yang Y, Zhen X, et al. Decreased poly(ADP-ribose) polymerase 1 expression attenuates glucose oxidase-induced damage in rat cochlear marginal strial cells[J]. Molecular Neurobiology, 2016, 53:5971.
25 Huang Q, Shen HM. To die or to live: the dual role of poly(ADP-ribose) polymerase-1 in autophagy and necrosis under oxidative stress and DNA damage[J]. Autophagy, 2009, 5:273.
26 Jiang HY, Yang Y, Zhang YY, et al. The dual role of poly(ADP-ribose) polymerase-1 in modulating parthanatos and autophagy under oxidative stress in rat cochlear marginal cells of the striavascularis[J]. Redox Biology, 2018, 14:361.
27 Chiarugi A, Moskowitz M A. PARP-1: a perpetrator of apoptotic cell death[J]? Science, 2002, 297:200.
