PTEN在动脉粥样硬化中的表达及对血管内皮细胞增殖凋亡的影响研究
2018-05-25闫博阳赵津璋
闫博阳 赵津璋 陈 虹
(黑龙江省佳木斯市中心医院,佳木斯 154002)
动脉粥样硬化是一种常见的心血管系统疾病,也是多种心脑血管疾病发生的基础,血管内皮细胞(Vascular endothelial cell,VEC)和平滑肌细胞受损是动脉粥样硬化发生的重要原因,其受损后可以引发血管内膜增生、斑块沉积等现象[1,2]。研究表明,动脉粥样硬化的发生与细胞凋亡有关,而VEC凋亡在动脉粥样硬化过程中发挥重要作用,VEC大量凋亡会引起单层内皮通透性增加,导致平滑肌细胞、单核细胞进入到内膜,损害血管,形成斑块[3,4]。
第10号染色体同源缺失性磷酸酶-张力蛋白(Phosphatase and tensin homolog deleted on chromo-some 10,PTEN)具有双特异性的磷酸酶活性,能够调控细胞的生长、凋亡等过程,并且在癌症发生、心肌缺血再灌注、心肌肥厚等疾病发生过程中也具有调控作用,对于血管内皮细胞生物学行为、心脏发育、胰岛素信号转导等具有重要意义[5,6]。研究显示,ox-LDL刺激后的VEC中PTEN表达下调,参与动脉粥样硬化的发生[7]。为了明确PTEN在动脉粥样硬化组织中的表达,探讨PTEN在VEC增殖凋亡中的作用,本研究构建动脉粥样硬化小鼠模型,并通过体外分离培养大鼠VEC,以期为研究动脉粥样硬化发病机制奠定基础。
1 材料与方法
1.1材料 20只ApoE-/-小鼠,雄性,6~8周龄,体重18~20 g,购自南京君科生物工程有限公司;SD雄性大鼠8只,6周龄,体重160~180 g购自佳木斯大学动物实验室;PTEN和甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPD-H)引物均由南京金斯瑞合成;Real time-PCR试剂盒、cDNA合成试剂盒购自大连TaKaRa;RNA提取试剂盒购自北京TIANGEN;蛋白提取试剂盒购自上海 BestBio;二喹啉甲酸(Bicinchoninic acid,BCA)蛋白提取试剂盒购自美国Biomiga ;氧化低密度脂蛋白(Cu-oxidized LDL,ox-LDL)购自北京索莱宝;鼠尾胶原购自美国Sigma;磷酸化的STAT3(p-STAT3)一抗、信号转导与转录因子3(Signal transducers and activators of transcription 3,STAT3)一抗、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved cysteinyl aspartate specific proteinase 3,Cleaved Caspase-3)一抗、PTEN一抗均购自美国Abcam;GAPDH一抗购自美国Santa Cruz;Lpofectamine 2000购自美国Invitrogen。
1.2方法
1.2.1动脉粥样硬化小鼠模型构建 ApoE-/-小鼠20只随机分为两组,每组10只,分别为实验组和对照组。实验组小鼠用高脂饲料(含有1%胆固醇和15%猪油)饲喂。对照组用正常的饲料饲喂。两组小鼠均不限制饮水,饲养时间为12周。用10%水合氯醛腹腔注射麻醉(3.5 ml/kg),取实验组小鼠的动脉粥样硬化组织和对照组的正常动脉组织检测PTEN水平。
1.2.2Real time-PCR检测组织中PTEN水平 取动脉粥样硬化组织和对照组的正常动脉组织,提取RNA,紫外分光光度计检测RNA样品的浓度及纯度。反转录合成cDNA,Real time-PCR检测PTEN水平,内参为GAPDH,以2-ΔΔCt方法计算PTEN表达。PTEN上游引物为5′-TCAGACTTTTGTAATTTGTGTATG-3′,下游引物5′-ACAGGCTCCCAGACA-TGACA-3′。GAPDH上游引物为5′-CAGCGACACCCACTCCTC-3′,下游引物5′-TGAGGATCCACCA-CCCTGT-3′。程序为:95℃ 15 min;94℃ 15 s;58℃ 30 s;72℃ 30 s,共40个循环。
1.2.3Western blot检测组织中PTEN水平 取动脉粥样硬化组织和对照组的正常动脉组织,提取组织蛋白,BCA法定量,蛋白与5×Loading buffer以4∶1混合煮沸5 min。每孔中加入40 μg进行电泳,SDS-PAGE凝胶用5%浓缩胶和10%分离胶,蛋白还未到达分离胶前用80V电压,到达分离胶后用100V电压。转膜:4℃,250 mA,将蛋白转印至硝酸纤维素膜,转膜时间为90 min。封闭:放在5%牛血清白蛋白中,37℃孵育60 min。一抗孵育:600倍稀释,4℃过夜。二抗孵育:1∶600倍稀释,1∶2 000倍稀释,37℃,90 min。显色以GAPDH为内参,Quantity one分析蛋白水平。
1.2.4VEC分离培养 参照文献[8],取SD雄性大鼠血管组织,放在DMEM中,在无菌条件下用镊子把血管外的结蹄组织和脂肪组织剥离以后,磷酸盐缓冲液(Phosphate buffered saline,PBS)洗涤3次,转移到培养皿中,把血管外翻使血管内膜暴露在外,用灭菌线把血管的两头折入以后结扎,用DMEM反复洗涤内膜,把血管放在0.2%的胶原酶中,在37℃,5%CO2培养箱中培养1 h。用含有20%的DMEM洗涤2次,将血管剪成2 mm2左右的组织块,内膜向下种植到用鼠尾胶原包被过的培养瓶中,加入20%的DMEM,37℃,5%CO2培养箱中培养12 h 后,再加入1 ml的新鲜细胞培养液。观察细胞长满细胞瓶壁以后,加入0.25%的胰蛋白酶消化1 min,1 000×g离心10 min,用20%胎牛血清的DMEM悬浮细胞,接种到细胞培养瓶中。本次实验所用细胞均为第3代细胞。
1.2.5MTT检测ox-LDL对细胞增殖活性的影响 取上述VEC,以每毫升含有105个细胞接种到96孔细胞培养板中,分别用含有ox-LDL浓度为0、6、12、24、48 μg/ml的细胞培养液培养细胞,每个浓度梯度设置5复孔。每孔中加入200 μl的细胞培养液,培养48 h后,加入5 mg/ml的MTT溶液孵育4 h。将上清液吸除后,加入二甲基亚砜溶液150 μl,混合后,酶标仪490 nm检测吸光度(Absorbance,A值)。计算细胞存活率。以0 μg/ml ox-LDL作用组为对照,计算细胞存活率,细胞存活率=(ox-LDL作用组A值÷对照组A值)×100%。实验重复3次,取均值。
1.2.6细胞分组及转染 VEC分为对照组、ox-LDL组、PTEN组,对照组和ox-LDL组细胞转染对照载体(pSicoR)。PTEN组细胞转染PTEN过表达载体(pSicoR-PTEN),步骤参照Lipofectamine 2000转染试剂。转染后ox-LDL组、PTEN组分别用含有24 μg/ml的ox-LDL的细胞培养液培养细胞,对照组细胞用不含ox-LDL的细胞培养液培养。培养48 h ,用Real time-PCR和Western blot法检测PTEN表达水平,步骤参照1.2.2和1.2.3,同时用MTT法检测各组细胞培养48 h的存活率,步骤同1.2.5。
1.2.7流式细胞术检测细胞凋亡 对照组、ox-LDL组、PTEN组细胞分别按照1.2.6中处理后,培养48 h,胰蛋白酶消化细胞,用冰预冷的PBS将细胞调整为每毫升含有106个细胞,取1 ml的细胞悬浮液,离心,收集细胞沉淀,加入200 μl的结合缓冲液,加入5 μl的碘化丙啶(Propidium iodide,PI)和膜联蛋白 V-FITC(Annexin V-FITC),室温孵育15 min,加入300 μl的结合缓冲液,在60 min内用流式细胞仪检测细胞凋亡情况。对照组、ox-LDL组、PTEN组细胞培养48 h后,Western blot法检测 p-STAT3、STAT3、Cleaved Caspase-3水平,步骤参照1.2.3。
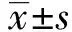
2 结果
2.1PTEN在动脉粥样硬化组织中的表达 结果如图1和表1所示,正常组织和动脉粥样硬化组织中PTEN mRNA水平依次为:1.00±0.12、0.47±0.10。PTEN蛋白水平依次为:0.45±0.06、0.18±0.02。动脉粥样硬化组织中PTEN mRNA和蛋白水平均明显低于正常组织,差异具有统计学意义(P<0.05)。动脉粥样硬化组织中PTEN水平下调。
2.2ox-LDL对VEC增殖影响 结果如表2所示,0、6、12、24、48 μg/ml的ox-LDL刺激后的VEC存活率依次为:(100.00±11.52)%、(83.24±6.14)%、(70.41±3.69)%、(51.58±3.75)%、(35.69±2.87)%。6、12、24、48 μg/ml的ox-LDL刺激后的VEC存活率明显低于0 μg/ml,差异具有统计学意义(P<0.05)。VEC的存活率随着ox-LDL作用浓度的升高而降低。24 μg/ml的ox-LDL刺激后的VEC存活率接近50%,后续选用24 μg/ml的ox-LDL作用于VEC。
2.3各组细胞中PTEN表达水平 结果如图2和表3所示,对照组、ox-LDL组、PTEN组PTEN mRNA依次为:1.00±0.08、0.42±0.03、0.69±0.05,PTEN 蛋白依次为:0.53±0.06、0.17±0.03、0.34±0.02。ox-LDL组细胞中PTEN mRNA和蛋白水平均明显低于对照组,差异具有统计学意义(P<0.05)。
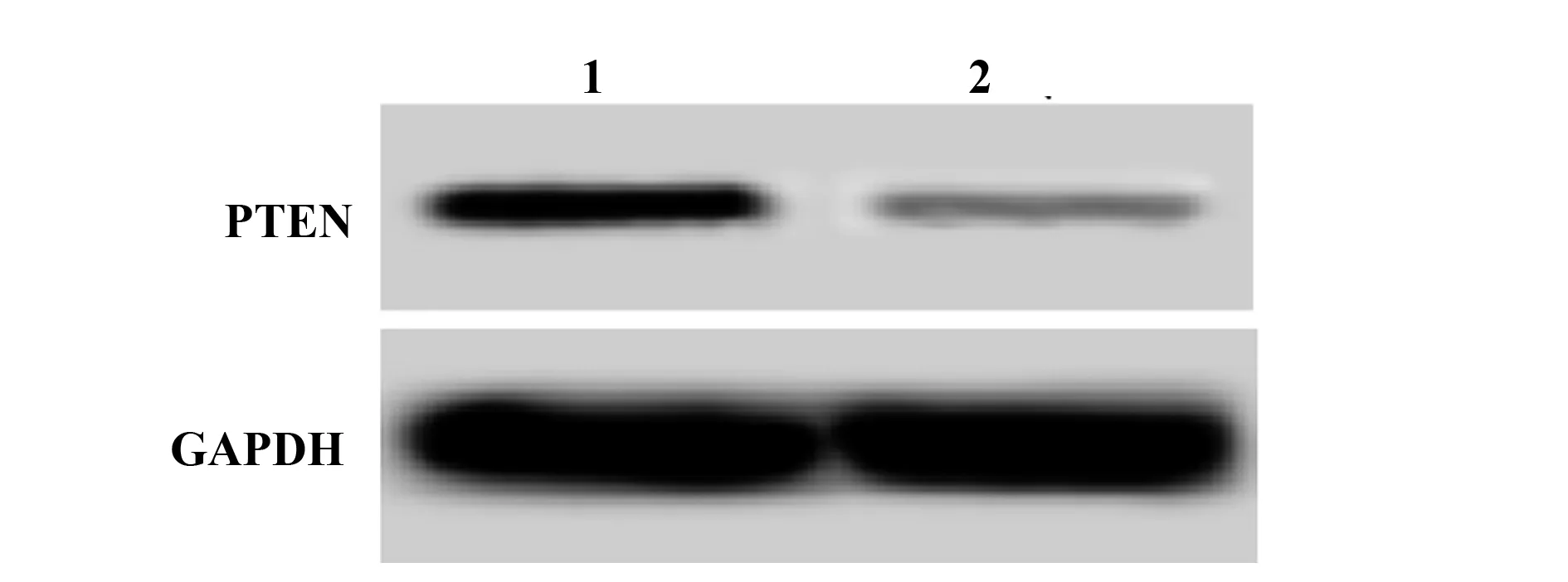
图1 Western blot检测PTEN在动脉粥样硬化组织中的表达Fig.1 Expression of PTEN in atherosclerosis tissues detected by Western blotNote:1.Normal tissue;2.Atherosclerotic tissue.
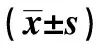

TissuemRNAProteinNormaltissue100±012045±006Atherosclerotictissue047±0101)018±0021)
Note:Compared with normal tissues,t1=5.212,t2=7.394,1)P<0.05.
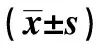
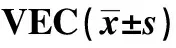
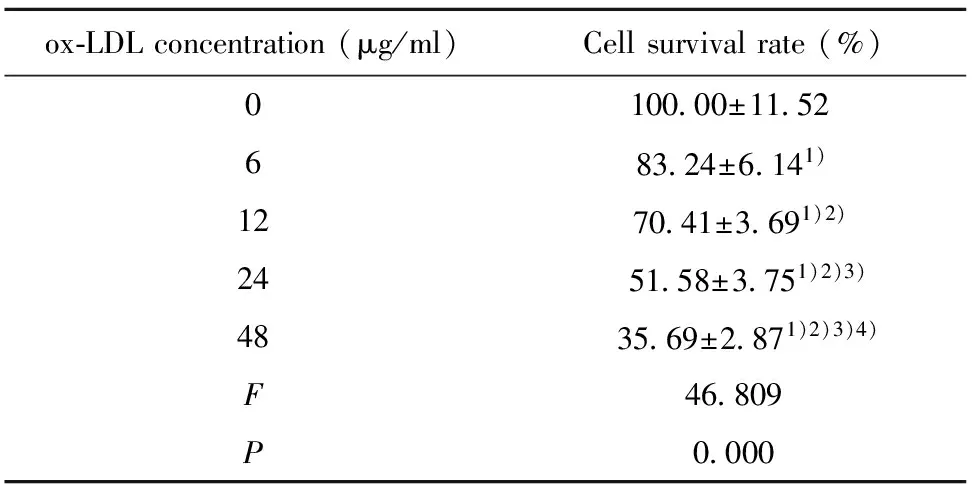
ox⁃LDLconcentration(μg/ml)Cellsurvivalrate(%)010000±115268324±6141)127041±3691)2)24 5158±3751)2)3)48 3569±2871)2)3)4)F46809P0000
Note:Compared with 0 μg/ml,t1=3.195,t2=5.642,t3=9.232,t4=12.261,1)P<0.05;compared with 6 μg/m,t1=2.446,t2=6.036,t3=9.066,2)P<0.05;compared with 12 μg/ml,t1=3.590,t2=6.620,3)P<0.05;compared with 24 μg/ml,t=3.030,4)P<0.05.
PTEN组细胞中PTEN mRNA和蛋白水平均明显高于ox-LDL组,差异具有统计学意义(P<0.05)。ox-LDL能够降低VEC中PTEN的表达,转染PTEN过表达载体能够提高VEC中PTEN的水平。
2.4各组细胞增殖凋亡检测结果 如图3和表4所示,对照组、ox-LDL组、PTEN组细胞存活率依次为:(100.00±9.36)%、(49.28±6.71)%、(74.62±5.73)%,细胞凋亡率依次为:(5.85±0.06)%、(44.25±3.28)%、(23.42±2.54)%。ox-LDL组细胞存活率明显低于对照组,而凋亡率明显高于对照组,差异具有统计学意义(P<0.05)。PTEN组细胞存活率明显高于ox-LDL组,而凋亡率明显低于ox-LDL组,差异具有统计学意义(P<0.05)。ox-LDL促进VEC凋亡,抑制VEC增殖,而PTEN能够减缓ox-LDL对VEC增殖凋亡的作用。
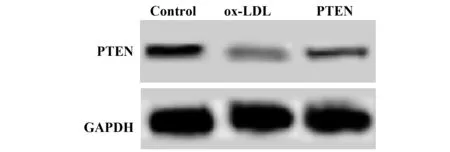
图2 Western blot检测ox-LDL刺激后细胞中PTEN表达Fig.2 PTEN expression detected by Western blot in cells after ox-LDL stimulation
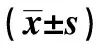
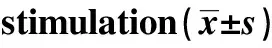
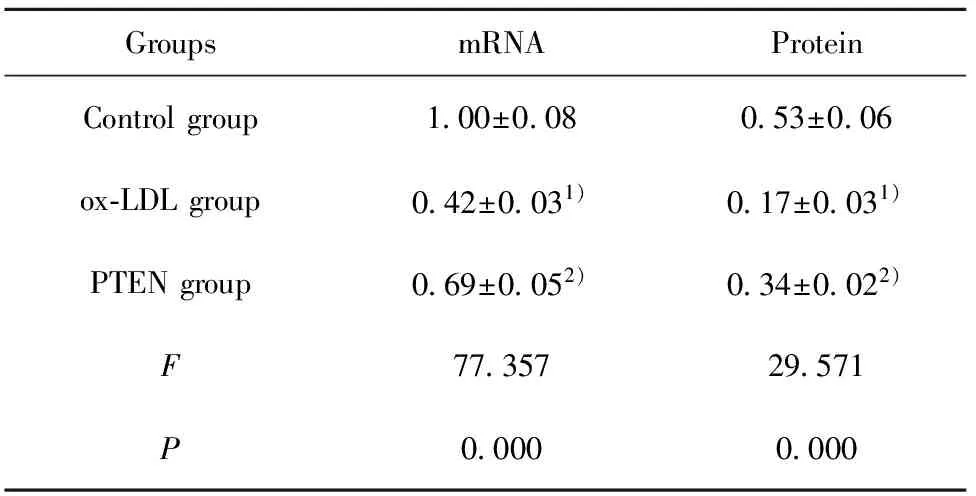
GroupsmRNAProteinControlgroup100±008053±006ox⁃LDLgroup042±0031)017±0031)PTENgroup069±0052)034±0022)F7735729571P00000000
Note:Compared with the control group,t1=12.429,t2=10.910,1)P<0.05;compared with ox-LDL group,t1=6.643,t2=5.758,2)P<0.05.
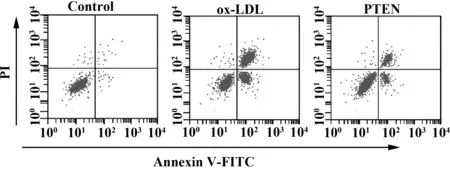
图3 流式细胞术检测细胞凋亡情况Fig.3 Cell apoptosis detected by flow cytometry
2.5p-STAT3、STAT3、Cleaved Caspase-3水平检测结果 如图4和表5所示,对照组、ox-LDL组、PTEN组细胞p-STAT3水平依次为:0.85±0.08、0.32±0.03、0.58±0.04,细胞STAT3水平依次为:2.11±0.25、2.13±0.21、2.12±0.20,细胞Cleaved Caspase-3水平依次为:0.28±0.04、2.05±0.16、0.82±0.06。ox-LDL组细胞p-STAT3水平明显低于对照组,而Cleaved Caspase-3水平明显高于对照组,差异具有统计学意义(P<0.05)。PTEN组细胞p-STAT3水平明显高于ox-LDL组,而Cleaved Caspase-3水平明显低于ox-LDL组,差异具有统计学意义(P<0.05)。
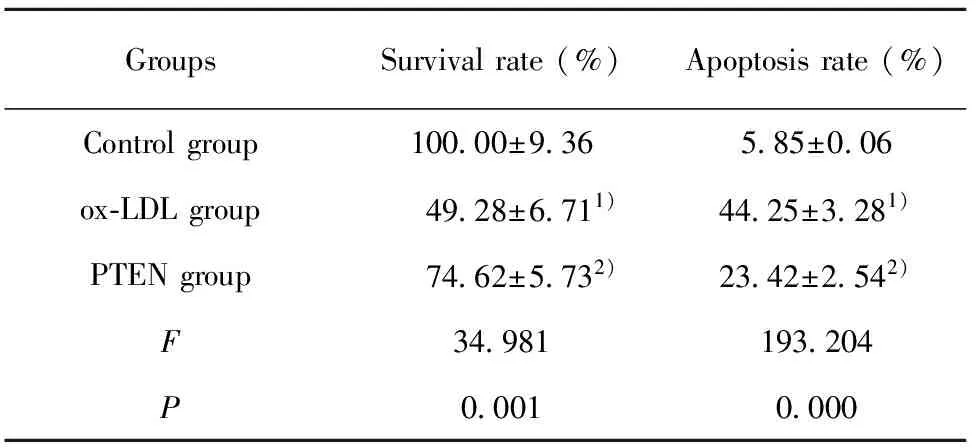
GroupsSurvivalrate(%)Apoptosisrate(%)Controlgroup10000±936585±006ox⁃LDLgroup4928±6711)4425±3281)PTENgroup7462±5732)2342±2542)F34981193204P00010000
Note:Compared with the control group,t1=8.364,t2=19.634,1)P<0.05;compared with ox-LDL group,t1=4.186,t2=8.983,2)P<0.05.
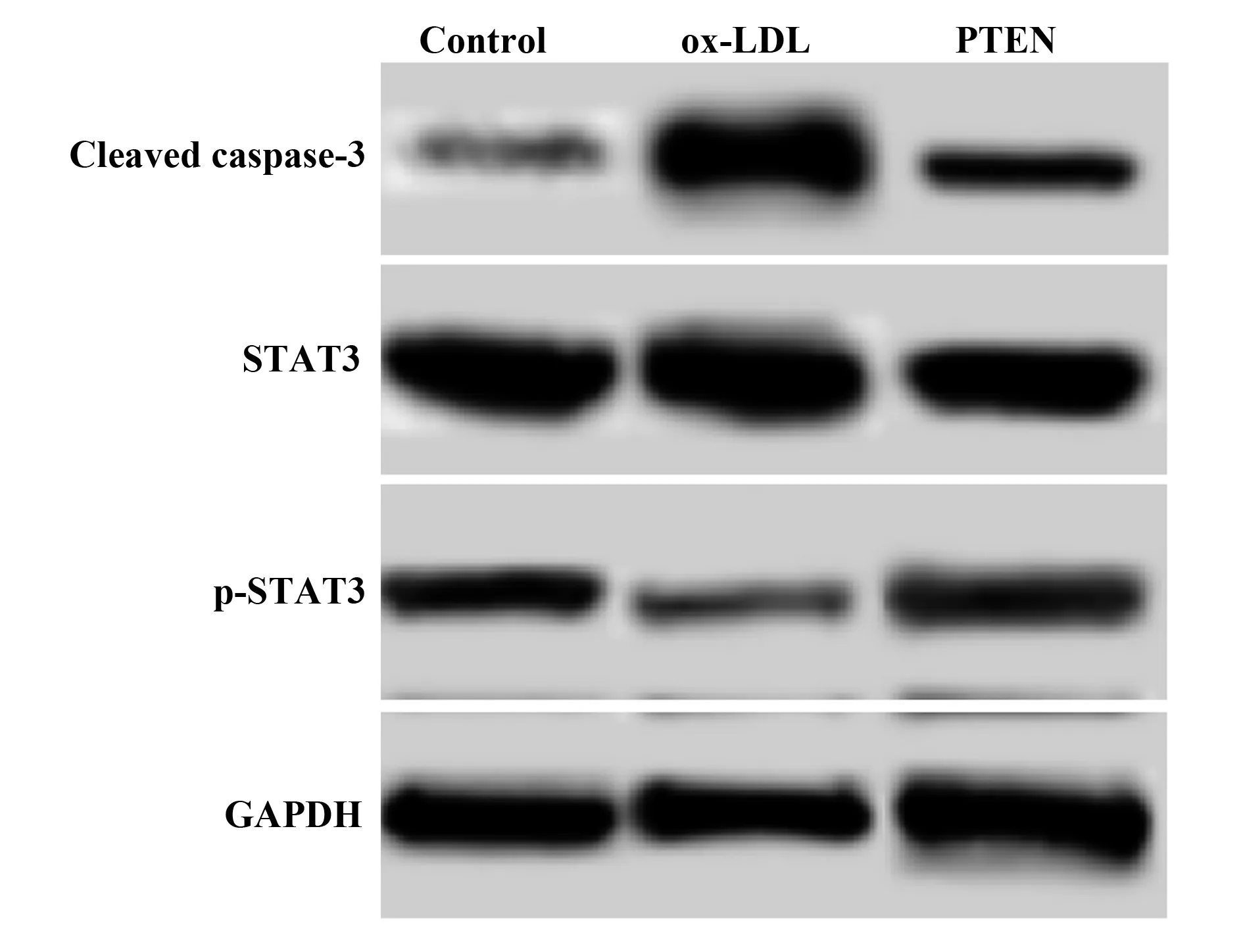
图4 Western blot检测p-STAT3、STAT3、Cleaved Caspase-3水平Fig.4 p-STAT3,STAT3,Cleaved Caspase-3 levels detected by Western blot
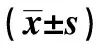
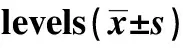
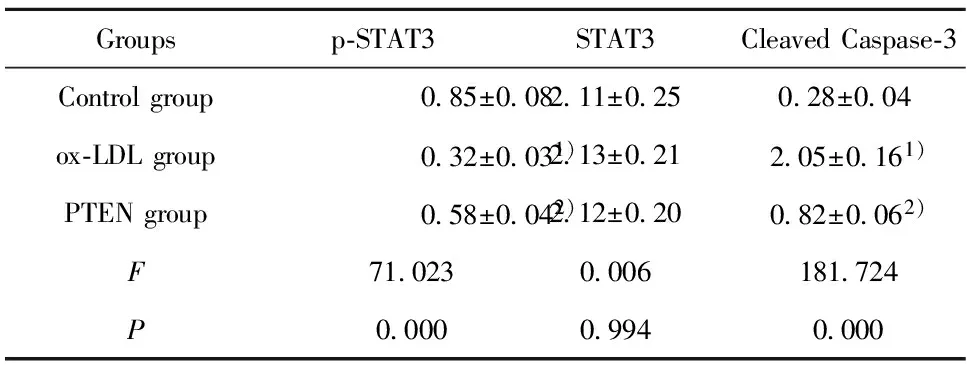
Groupsp⁃STAT3STAT3CleavedCaspase⁃3Controlgroup085±008211±025028±004ox⁃LDLgroup032±0031)213±021205±0161)PTENgroup058±0042)212±020082±0062)F 710230006181724P 000009940000
Note:Compared with the control group,t1=11.918,t2=17.768,1)P<0.05;compared with ox-LDL group,t1=6.071,t2=2.901,2)P<0.05.
3 讨论
人的PTEN基因可以编码403个氨基酸,其含有两个功能结构域,C2区域和磷酸酶区域,磷酸酶结构域调控酶催化过程,而C2区在PTEN与膜脂的结合中发挥关键作用,在PTEN的C端含有能够与PDZ结合的区域,是PTEN与相关支架蛋白结合的重要区域,其还具有自身的去磷酸功能,这些PTEN的结构域和自身特点是其调控细胞生长、凋亡等过程的重要基础[9-12]。研究显示,PTEN在心肌肥大、动脉粥样硬化等心血管疾病中具有调控功能。动脉粥样硬化的发生与细胞免疫炎症、血管内皮细胞凋亡等相关[13,14]。PTEN具有抗炎作用,能够通过调控中性粒细胞的趋化减弱组织炎症,并且能够抑制血管平滑肌细胞的迁移,延缓动脉粥样硬化的发生[15,16]。本研究结果显示,动脉粥样硬化小鼠中PTEN表达水平下降,PTEN可能与动脉粥样硬化的发生有关。
动脉粥样硬化的发生不仅与平滑肌细胞、免疫细胞等有关,其中VEC也参与动脉粥样硬化的发生[17]。研究显示,动脉粥样硬化与细胞的大量凋亡有关,VEC大量凋亡可以引起VEC数量急剧减少,引起单层内皮通透性发生改变,平滑肌细胞和单核细胞迁移到内膜后,造成内膜损伤,VEC凋亡是动脉粥样硬化发生的早期事件[18-21]。本研究通过体外分离培养大鼠VEC,用ox-LDL处理后发现PTEN的表达水平也明显下调,与动脉粥样硬化组织中检测结果相符合,PTEN在动脉粥样硬化中表达下调。本研究通过细胞转染的方法提高VEC中PTEN的表达水平,结果发现,过表达PTEN后的VEC经过ox-LDL处理后的细胞增殖活性有所升高,细胞凋亡率有所降低,PTEN抑制ox-LDL对VEC的损伤。
细胞的生长和凋亡与细胞内信号通路的传导有关,是受到多种基因严格调控的过程[22]。STAT3是目前发现的与肿瘤关系最为密切的STAT蛋白家族成员之一,在相关细胞因子的作用下,STAT3磷酸化水平升高,导致STAT3被激活,能够促进细胞的生长[23-25]。Caspase蛋白家族参与细胞凋亡过程,Caspase-3、Caspase-7、Caspase-6等是凋亡执行子,可以通过与底物特应性结合诱导细胞凋亡的发生,而Caspase-3活化后是细胞凋亡不可逆的标志,也是Caspase家族中最为重要的成员之一[26-28]。研究显示,STAT3能够促进VEC增殖,抑制VEC凋亡[29,30]。本研究结果显示,ox-LDL能够抑制VEC中STAT3的磷酸化,而PTEN可提高STAT3磷酸化水平,PTEN可能通过促进STAT3信号通路影响VEC增殖和凋亡。
综上所述,PTEN在动脉粥样硬化组织中表达下调,ox-LDL促进VEC凋亡,抑制VEC增殖,而过表达PTEN可以抑制VEC凋亡,促进VEC增殖,作用机制可能与STAT3信号通路的激活有关。本研究结果为探讨PTEN在动脉粥样硬化中的作用奠定了基础,对研究动脉粥样硬化发病机制具有重要意义。本研究存在一定的局限性,PTEN在血管内皮细胞中的作用机制是否与STAT3有关还需要进一步验证,并且在后续实验中会继续探讨PTEN对其他相关信号通路的作用。
参考文献:
[1] Littlewood TD,Bennett MR.Apoptotic cell death in atherosclerosis[J].Curr Opin Lipidol,2003,14(5):469-475.
[2] Fuster JJ,Fernández P,González-Navarro H,etal.Control of cell proliferation in atherosclerosis:insights from animal models and human studies[J].Cardiovasc Res,2010,86(2):254-264.
[3] Harrison DG.Physiological aspects of vascular endothelial cell interactions in hypertension and atherosclerosis[J].Acta Anaesthesiol Scand Suppl,1993,37(s99):10-15.
[4] Song CL,Wang JP,Xue X,etal.Effect of circular anril on the inflammatory response of vascular endothelial cells in a rat model of coronary atherosclerosis[J].Cell Physiol Biochem,2017,42(3):1202-1212.
[5] 薛 锐,夏中元,孟庆涛.PTEN在神经系统损伤、心血管疾病发生发展中的作用研究进展[J].山东医药,2016,56(3):93-94.
Xue R,Xia ZY,Meng QT.Research progress on the role of PTEN in the development of nervous system injury and cardiovascular disease[J].Shandong Med,2016,56(3):93-94.
[6] Bretónromero R,Kalwa H,Lamas S,etal.Role of PTEN in modulation of ADP-dependent signaling pathways in vascular endothelial cells[J].Biochim Biophys Acta,2013,1833(12):2586-2595.
[7] Wang GF,Shi CG,Sun MZ,etal.Tetramethylpyrazine attenuates atherosclerosis development and protects endothelial cells from ox-LDL[J].Cardiovasc Drugs Ther,2013,27(3):199-210.
[8] Langenfeld A,Julien S,Schraermeyer U.An improved method for the isolation and culture of retinal pigment epithelial cells from adult rats[J].Graefes Arch Clin Exp Ophthalmol,2015,253(9):1493-1502.
[9] Huynh A,Dupage M,Priyadharshini B,etal.The phosphatase PTEN-mediated control of PI-3 kinase in Tregs cells maintains homeostasis and lineage stability[J].Nat Immunol,2015,16(2):188-196.
[10] Yang X,Cheng Y,Li P,etal.A lentiviral sponge for miRNA-21 diminishes aerobic glycolysis in bladder cancer T24 cells via the PTEN/PI3K/AKT/mTOR axis[J].Tumour Biol,2015,36(1):383-391.
[11] Zheng J,Wu C,Xu Z,etal.Hepatic stellate cell is activated by microRNA-181b via PTEN/Akt pathway[J].Mol Cell Biochem,2015,398(1-2):1-9.
[12] Zhang Y,Zheng L,Ding Y,etal.MiR-20a induces cell radioresistance by activating the PTEN/PI3K/Akt signaling pathway in hepatocellular carcinoma[J].Int J Radiat Oncol Biol Phys,2015,92(5):1132-1140.
[13] 于林君,祝善俊,周裔忠,等.PTEN抑制钙/钙调神经磷酸酶信号通路、负性调控血管紧张素Ⅱ所致心肌细胞肥大[J].中华心血管病杂志,2006,34(6):541-545.
Yu LJ,Zhu SJ,Zhou YZ,etal.Angiotensin II induced cardiac hypertrophy is blocked by PTEN via suppressing Ca2+/Calcineurin[J].Chin J Cardiol,2006,34(6):541-545.
[14] 李 勇,杨 特,沈 怡.miRNA-26a抑制ox-LDL介导的HAECs凋亡作用的机制研究[J].重庆医学,2016,45(36):5052-5055.
Li Y,Yang T,Shen Y.Study on the mechanism of miRNA-26a inhibiting ox-LDL mediated of HAECs [J].Chongqing Med,2016,45(36):5052-5055.
[15] Dong X,Yu LG,Sun R,etal.Inhibition of PTEN expression and activity by angiotensin II induces proliferation and migration of vascular smooth muscle cells[J].J Cell Biochem,2013,114(1):174-182.
[16] Ittner A,Block H,Reichel CA,etal.Regulation of PTEN activity by p38δ-PKD1 signaling in neutrophils confers inflammatory responses in the lung[J].J Exp Med,2012,209(12):2229-2246.
[17] Hu D,Mohanta SK,Yin C,etal.Artery Tertiary Lymphoid Organs Control Aorta Immunity and Protect against Atherosclerosis via Vascular Smooth Muscle Cell Lymphotoxin β Receptors[J].Immunity,2015,42(6):1100-1115.
[18] Singh V,Rana M,Jain M,etal.Curcuma oil attenuates accelerated atherosclerosis and macrophage foam-cell formation by modulating genes involved in plaque stability,lipid homeostasis and inflammation[J].Br J Nutr,2015,113(1):100-113.
[19] Dong JS,Yu YJ,Seo YS,etal.Interleukin-32α inhibits endothelial inflammation,vascular smooth muscle cell activation,and atherosclerosis by upregulating timp3 and reck through suppressing microRNA-205 biogenesis[J].Theranostics,2017,7(8):2186-2203.
[20] Rask-Madsen C,Li Q,Freund B,etal.Loss of insulin signaling in vascular endothelial cells accelerates atherosclerosis in apolipoprotein e null mice[J].Cell Metab,2010,11(5):379-389.
[21] Onat D,Brillon D,Colombo PC,etal.Human vascular endothelial cells:a model system for studying vascular inflammation in diabetes and atherosclerosis[J].Curr Diab Rep,2011,11(3):193-202.
[22] 王晓敏,席晓甜,刘海云,等.菟丝子总黄酮对血管平滑肌细胞凋亡及凋亡相关蛋白的影响[J].中国老年学杂志,2015,35(20):5742-5744.
Wang XM,Xi XT,Liu HY,etal.Effects of total flavonoids from semen cuscutae on vascular smooth muscle cell apoptosis and apoptosis related protein[J].Chin J Gerontol,2015,35(20):5742-5744.
[23] Dutzmann J,Daniel JM,Bauersachs J,etal.Emerging translational approaches to target STAT3 signalling and its impact on vascular disease[J].Cardiovasc Res,2015,106(3):365-74.
[24] 陈纯静,陈 恩,林 琳,等.沙眼衣原体持续感染状态下 STAT3-TLR2 信号轴的变化初探[J].中国免疫学杂志,2015,31(5):585-589.
Chen CJ,Chen E,Lin L,etal.Primary study on the change of STAT3-TLR2 signal axis in Chlamydia trachomatis persistent infection[J].Chin J Immunol,2015,31(5):585-589.
[25] Wang X,Chen L,Liu J,etal.In vivotreatment of rat arterial adventitia with interleukin-1β induces intimal proliferation via the JAK2/STAT3 signaling pathway[J].Mol Med Rep,2016,13(4):3451-3458.
[26] Yu J,Ma M,Ma Z,etal.HDAC6 inhibition prevents TNF-α-induced caspase 3 activation in lung endothelial cell and maintains cell-cell junctions[J].Oncotarget,2016,7(34):54714-54722.
[27] 闫昆明,刘 英,张 芮,等.新生大鼠缺氧缺血性脑损伤 caspase-3 表达与自由基损伤机制的研究[J].中国免疫学杂志,2015,31(8):1094-1097.
Yan KM,Liu Y,Zhang R,etal.Study on the expression of Caspase-3 and free radical injury in hypoxic-ischemic brain damage of neonatal rats[J].Chin J Immunol,2015,31(8):1094-1097.
[28] D′Mello SR,Kuan CY,Flavell RA,etal.Caspase-3 is required for apoptosis-associated DNA fragmentation but not for cell death in neurons deprived of potassium[J].J Neurosci Res,2015,59(1):24-31.
[29] 刘雅琦,顾金海,孟 锐,等.神经胶质瘤细胞与人脑微血管内皮细胞之间STAT3信号的交互作用[J].中国肿瘤生物治疗杂志,2015,22(4):432-437.
Liu YQ,Gu JH,Meng R,etal.STAT3 activation is involved in the interaction of glioma and brain microvascular endothelial cells[J]. Chin J Cancer Biotherapy,2015,22(4):432-437.
[30] Platt DH,Bartoli M,Elremessy AB,etal.Peroxynitrite increases VEGF expression in vascular endothelial cells via STAT3[J].Free Radic Biol Med,2005,39(10):1353-1361.