Sel1L对小鼠骨髓源树突状细胞的影响①
2018-05-25颜楠楠赵传祥肖腾飞高凤威周文慧邵启祥龙乔明夏
许 洁 颜楠楠 赵传祥 李 慈 吴 仪 肖腾飞 高凤威 周文慧 邵启祥 龙乔明夏 圣
(江苏大学医学院免疫学与免疫检验学教研室, 镇江 212013)
内质网(Endoplasmic reticulum,ER)是真核生物加工和折叠蛋白质的重要场所[1]。在此过程中,葡萄糖的缺失、异常的Ca2+调节以及缺氧等都可以影响蛋白质折叠,导致未折叠以及错误折叠的蛋白质在腔内聚集[2],从而诱导内质网应激(ER Stress)。错误折叠的蛋白质不断积累可以触发未折叠蛋白反应(UPR)。该反应由三个内质网跨膜受体介导,即转录活化因子6(ATF6)、肌醇依赖酶1(IRE1)和蛋白激酶R样内质网激酶(PERK)。UPR通过上调分子伴侣的表达、减少蛋白质翻译以及诱导ER相关降解作用(ER associated degradation,ERAD),从而减轻腔内的蛋白质负荷[3-5]。
Sel1L(Suppressor/enhancer of Lin-12-like)是参与ERAD的E3连接酶羟甲基戊二酰基还原酶降解蛋白1(Hrd1)的衔接蛋白。有研究表明,Sel1L基因与多种癌症类型的肿瘤发生、干细胞分化、胰腺上皮细胞分化等有关[6-8],而人类自身免疫性甲状腺疾病和人类阿尔兹海默病中已鉴定出Sel1L基因的变异[9,10]。然而,Sel1L分子如何调控体内ERAD和ER稳态尚未清楚。
树突状细胞(Dendritic cell,DCs)是机体重要的抗原提呈细胞,在激发免疫应答和诱导免疫耐受两方面均起关键作用。其在分化和发育过程中,有大量蛋白质的合成与折叠,内质网在这一过程中起到重要作用,而Sel1L分子是维持内质网内环境稳态所必不可少的。本研究即利用Cre-Loxp重组系统构建CD11c+Sel1L基因敲除小鼠制备骨髓源树突状细胞,以探究Sel1L对树突状细胞的影响。
1 材料与方法
1.1材料
1.1.1实验动物 Sel1Lf/f小鼠由苏州大学龙乔明教授惠赠,CD11c-Cre+/-小鼠(JAX 007567)和H2-K b-OVA323-339肽抗原特异性的OTII小鼠(购自Jackson Lab)。实验时,由Sel1Lf/f小鼠与CD11c-Cre+/-小鼠进行交配,产下子代小鼠的基因型经基因型PCR鉴定后,筛选出Sel1Lf/fCD11c-Cre+/-小鼠。所有实验均使用6~12周龄的雌性小鼠,并用野生型同窝小鼠作对照组。
1.1.2主要试剂 RPMI1640 培养基、胎牛血清(PAA公司),6孔、24孔、96孔细胞培养板(Nunc公司),总RNA提取试剂Trizol、逆转录试剂盒、SYBR Green荧光染料(TaKaRa公司),脂多糖(LPS)、卵清蛋白(OVA)(Sigma公司),CFSE荧光染料(Invitrogen公司),RIPA裂解液、PMSF液(碧云天公司),CD11c-Percp-cy5.5、CD11b-FITC、CD11b-PE、CD80-PE、CD86-PE、MHC-Ⅰ-FITC、MHC-Ⅱ-FITC、CD4-PE(eBioscience公司),Biotin磁分选试剂盒(Stem cell公司),兔抗Sel1L抗体(Abcam公司),β-actin-HRP抗体(Santa Cruz公司),BCA试剂盒(Thermo公司);超净工作台(苏州净化厂),细胞培养箱(Thermo公司),Western Blot系列设备、PCR仪、CFX96定量PCR仪(Bio-Rad公司),倒置式生物显微镜(Nikon公司),BD Accuri C6流式细胞仪、BD FACSCantoTMⅡ流式细胞仪(BD公司)。
1.2方法
1.2.1小鼠骨髓源树突状细胞(BMDCs)的体外培养 参照文献[11]进行。将Sel1Lf/f型(WT)小鼠与Sel1Lf/fCD11c-Cre+/-型(KO)小鼠分别处死后,取出股骨与胫骨,用无菌PBS液冲洗骨髓腔,制备骨髓细胞。用含10%FCS、GM-CSF(10 ng/ml)、IL-4(1 ng/ml)的RPMI1640培养基将骨髓细胞在37℃、5%CO2条件下培养7 d后,收集并纯化CD11c+细胞,作为未成熟BMDC细胞。经LPS(终浓度1 μg/ml)刺激18 h细胞作为成熟BMDC细胞。
1.2.2Western blot检测BMDCs中Sel1L蛋白的表达 分别将WT型与KO型小鼠诱导培养7 d的BMDC细胞按每孔6×105细胞加入到24孔板中,加入LPS刺激后继续培养18~24 h。收集细胞,加入RIPA裂解液提取蛋白,Western blot检测WT型与KO型小鼠BMDCs中Sel1L蛋白的表达。
1.2.3Sel1L对BMDCs膜表面共刺激分子和MHC-Ⅰ、MHC-Ⅱ的影响 BMDC细胞的处理与准备同1.2.2。收集细胞,用大鼠血清封闭10 min后,4℃条件下,分别加入荧光素标记MHC-Ⅰ、MHC-Ⅱ、CD11c、CD80、CD86,孵育20 min。标记完成后,将细胞用PBS洗2遍后,用流式细胞分析仪检测标记细胞的荧光信号,Flowjo软件分析数据。
1.2.4ELISA法检测上清中细胞因子的分泌 收集WT型与KO型小鼠的BMDCs的培养上清液。按照ELISA试剂盒(eBioscience)的使用说明分别检测上清中IL-6、IL-12p70的含量。
1.2.5实时荧光定量检测Sel1L对BMDCs分泌IL-6、IL-12的影响 BMDC细胞的处理与准备同1.2.2。收集细胞,加入TRIZOL裂解液提取其总RNA。按照逆转录试剂盒说明书将1 μg RNA逆转录为cDNA,以β-actin为内参,以cDNA为模板,定量检测扩增IL-6、IL-12基因的表达。所用引物序列如下:β-actin上游序列TGGCGCTTTTGACT-CAGGAT,下游序列GGGATGTTTGCTCCAACCAA;IL-6上游序列GAGGAGACTTCACAGAGGATAC,下游序列GACTCTGGCTTTGTCTTTCTTG;IL-12上游序列GGTTTGCCATCGTTTTG,下游序列 GGGTCTTTCCAGAGCCT。实时荧光定量 PCR反应体系:SYBR Premix EX TaqTMⅡ 5 μl、ddH2O 4.1 μl、上下游引物各0.2 μl、cDNA 0.5 μl,总反应体系10 μl。扩增条件为95℃ 5 s、58℃ 20 s、72℃ 31 s、39个循环。用2-ΔΔCT法计算相关基因表达。
1.2.6Sel1L对BMDCs激活抗原特异性CD4+T细胞增殖能力的评估 BMDC细胞的处理与准备同1.2.2。将BMDCs用OVA323-339肽孵育6 h。取肽抗原特异性OT-Ⅱ小鼠脾脏,研磨、破红后,用PBS洗一次。去上清,1 ml PBS重悬,将细胞数调整到1×108ml-1转移至分选管中,补加PBS至总体积为1 ml。加试剂盒中FcR blocker 10 μl,加Biotin抗体6 μl,室温15 min;加Biotin Selection Cocktail 100 μl,室温15 min;加Magnetic Particles 50 μl,室温 10 min;补加分选缓冲液至分选管总体积2.5 ml,混匀,将分选管插入分选磁铁中,室温5 min,弃去液体;加缓冲液混匀,再重复分选2次。加PBS吹打混匀细胞,加CFSE(终浓度2.5 μmol/L)于37℃避光孵育10 min。将经OVA孵育的BMDCs用PBS洗1次后,与来自OT-Ⅱ TCR转基因小鼠的CD4+T细胞共培养,二者比例为2×104∶ 2×105,37℃、5%CO2条件下培养4 d后,用荧光抗体CD4-PE标记细胞,用流式细胞仪检测T细胞的增殖情况。
1.3统计学分析 实验数据用GraphPad Prism 6.0软件分析处理。两组之间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1Sel1Lf/fCD11c-Cre+/-小鼠BMDCs中Sel1L的表达 如图1所示,在未成熟BMDCs中,KO型小鼠相对于WT型小鼠来说,Sel1L基因几乎不表达,而成熟BMDCs中趋势更明显。说明Sel1Lf/fCD11c-Cre+/-小鼠体内Cre重组酶与Sel1L基因loxp位点结合,实现了Sel1L基因的条件性敲除。
2.2Sel1L对BMDCs增殖效率的影响 从图2的结果可以看出,相对于WT型小鼠,KO型小鼠的CFSE的荧光强度右移,但细胞总数并没有明显差异,说明Sel1L的缺失导致BMDCs的分化增殖效率降低。
2.3Sel1L对BMDCs细胞膜表型的影响 值得注意的是,我们发现在未成熟BMDCs的表面上MHC-Ⅰ轻微升高,而MHC-Ⅱ表达则显著降低。用LPS诱导18 h以后,导致WT型BMDCs中MHC-Ⅱ表达明显增加,但未能升高KO型DC中的MHC-Ⅱ的表达。相比之下,MHC-Ⅰ依旧轻微上调,而CD80、CD86的表达水平并未被Sel1L缺失所改变(如图3)。这表明小鼠中Sel1L的缺失导致BMDCs的MHC-Ⅱ的表达下降。
2.4Sel1L对BMDCs细胞分泌IL-6、IL-12的影响 对未成熟BMDCs与成熟BMDCs进行比较,结果显示,LPS刺激后的成熟DCs分泌更高水平的炎性因子,与此同时,来自KO型小鼠的BMDCs,IL-6以及IL-12p70的mRNA水平明显升高(图4A)。另外,我们又收集了各组DCs的上清液,用ELISA的方法检测了IL-6、IL-12p70的表达水平,从而在蛋白水平上进一步验证了这一结果。
2.5Sel1L增强BMDCs细胞激活抗原特异性CD4+T细胞的增殖 DCs是专职抗原提呈细胞,通过MHC分子与T细胞表面受体相结合,将抗原呈递给T细胞,产生T细胞活化信号,进而诱导其增殖分化。为进一步探究Sel1L的缺失对DCs这一功能的影响,我们将OVA323-339抗原特异性CD4+T细胞进行CFSE标记后,与OVA323-339孵育的成熟BMDCs共培养,分析CD4+T细胞的CFSE荧光强度从而反映CD4+T细胞的增殖情况。当与WT型小鼠BMDCs共培养时,OT-Ⅱ小鼠的CD4+T细胞大量增殖。相反,与KO型小鼠的BMDCs共培养时,OT-Ⅱ小鼠的CD4+T细胞增殖减少。因此,DC中Sel1L基因缺失会削弱CD4+T细胞的激活。见图5。
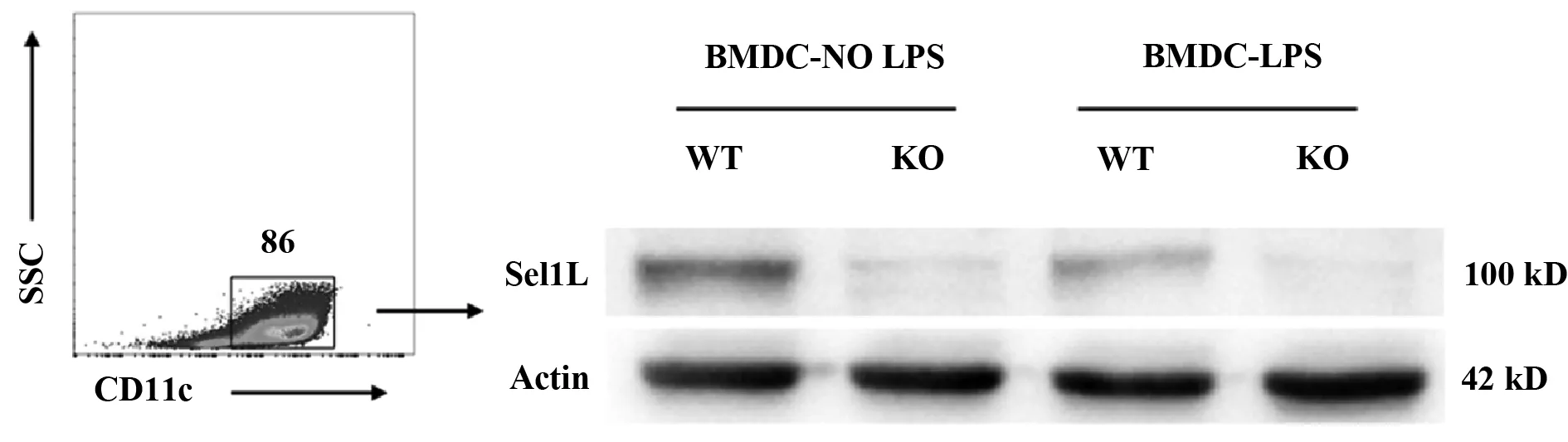
图1 在树突状细胞中敲除Sel1L基因Fig.1 Targeted disruption of Sel1L gene in DCs
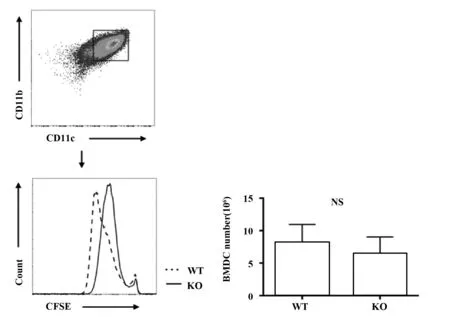
图2 Sel1L基因对BMDCs增殖的影响Fig.2 Effects of Sel1L gene on proliferation of BMDCsNote:Data were shown as significance.
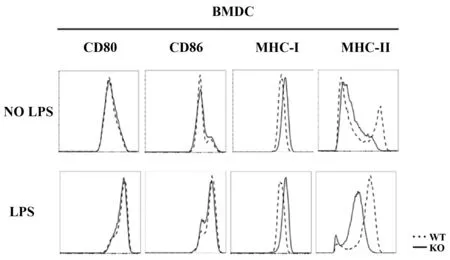
图3 Sel1L基因对BMDCs细胞膜表型的影响Fig.3 Effects of Sel1L gene on phenotype of BMDCs
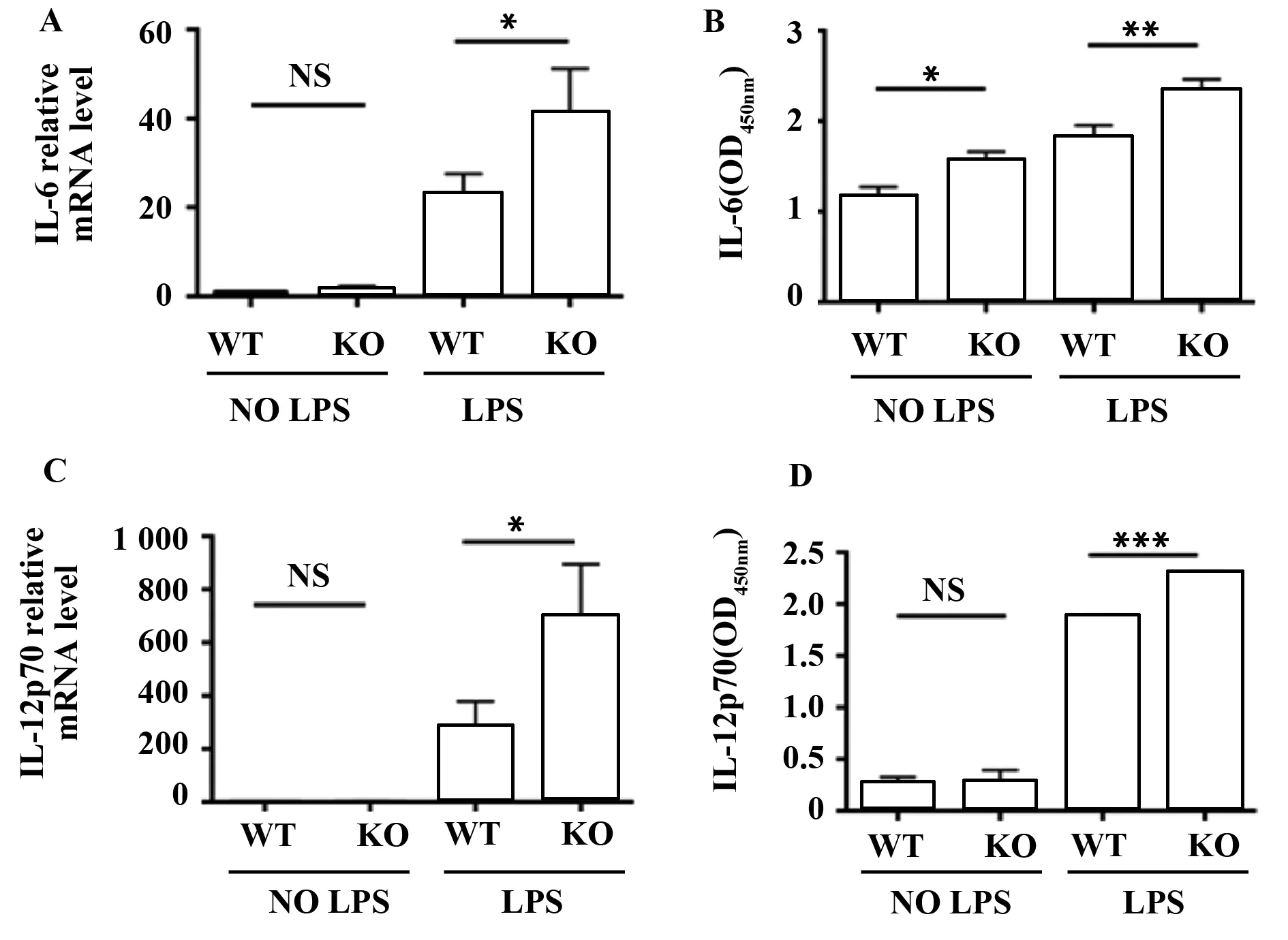
图4 Sel1L基因对BMDCs细胞因子的影响Fig.4 Effects of Sel1L gene on BMDCs cytokines secretionNote:Data were shown as significance.
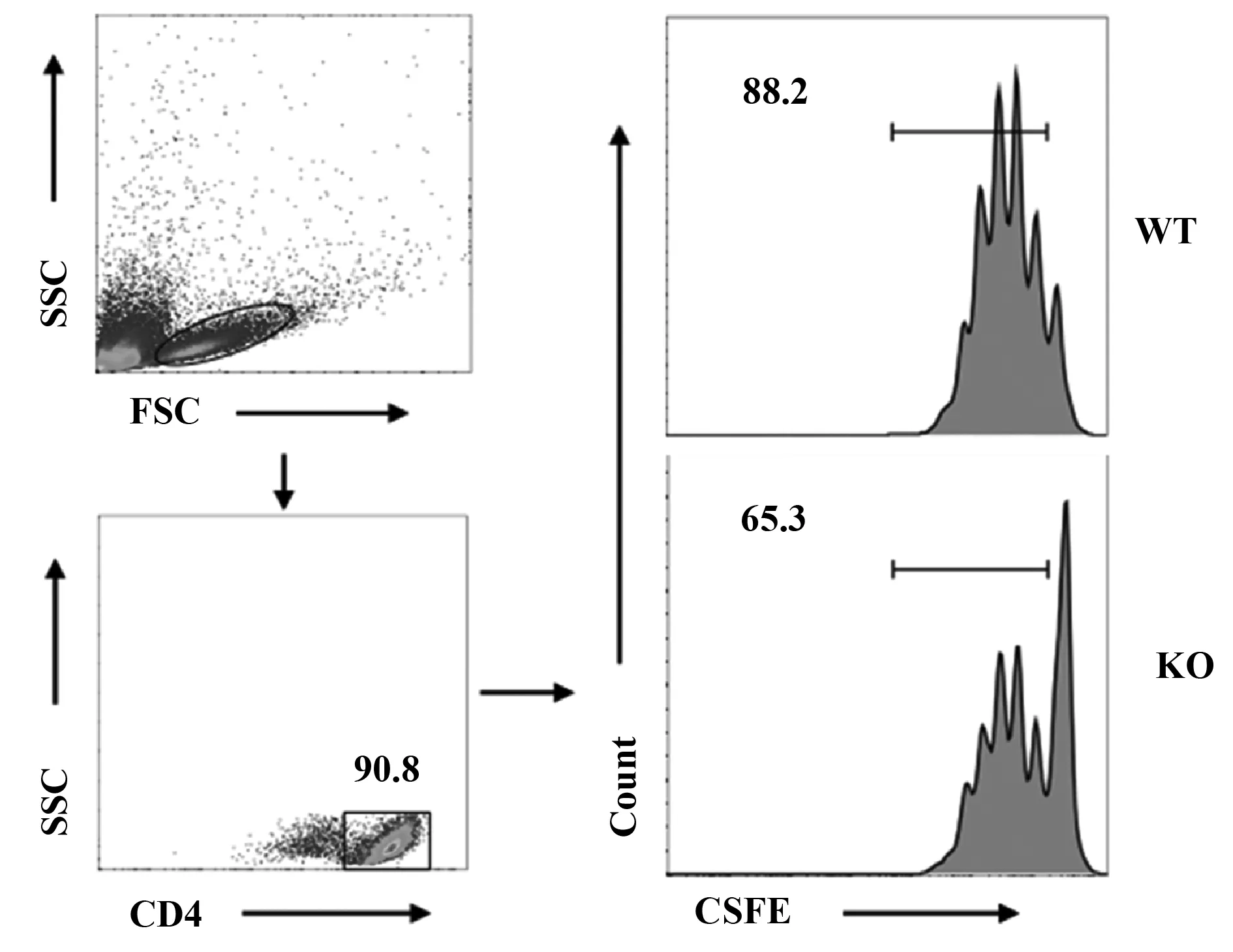
图5 Sel1L基因对BMDCs激活抗原特异性CD4+T细胞增殖能力的影响Fig.5 Effects of Sel1L gene on capability of BMDCs in priming OVA specific CD4+T cell proliferation
3 讨论
多种细胞应激可导致内质网功能障碍,并最终导致蛋白质折叠能力和蛋白质折叠负荷之间的不平衡。有报道认为,蛋白质的异常折叠与糖尿病、心肌缺血、心脏肥大、动脉粥样硬化以及心力衰竭等有关[12-14]。内质网应激可以通过ERAD,负责识别和易位内质网中的末端错误折叠或未折叠的蛋白,将其靶向胞质蛋白酶体降解。已有文献报道Sel1L在哺乳动物ERAD和内质网稳态中具有不可或缺的作用[15,16]。我们的研究表明Sel1L缺失能降低BMDCs诱导分化过程中的增殖效率,并显著降低MHC-Ⅱ的表达。有研究显示ER跨膜E3泛素连接酶Hrd1通过促进BLIMP1泛素化和降解,进而增强MHC-Ⅱ表达[16]。BLIMP1是一种IFN-β基因的转录阻遏蛋白,是分化效应CD8+T细胞和CD8+T细胞记忆应答所必需的[17],并且在经LPS刺激的BMDCs中显著表达,在DCs存活中起重要作用[18],但Sel1L作为Hrd1的衔接蛋白是否是通过此途径调节MHC-Ⅱ的表达尚不清楚。同时我们数据显示Sel1L的缺失能上调MHC-Ⅰ的表达,有研究认为,内质网中错误折叠的MHC-Ⅰ能被Sel1L-Hrd1复合物识别并催化[19],这与我们的结果相符。因此,Sel1L可能选择性调节MHC-Ⅱ的表达,并降解BMDCs中错误折叠的MHC-Ⅰ。
DC是专职抗原呈递细胞,在固有免疫和适应性免疫中发挥重要作用。在成熟过程中,DCs上调共刺激分子以及MHC-Ⅱ类分子,从而可以有效地将抗原呈递给初始T细胞。此外,成熟的DC产生和分泌促炎细胞因子和趋化因子来吸引和激活先天效应细胞,并诱导特定辅助性T细胞(Th)亚群的发育[20,21]。在DC抗原提呈的过程中,有大量蛋白质的合成与折叠,而错误折叠的多肽则保留在内质网中,并被ERAD机制识别和逆转录。哺乳动物具有许多ERAD复合物,其中Sel1L-Hrd1复合物是最具保守性和生物化学特征的。本实验表明当DC细胞缺失Sel1L基因时,其抗原递呈能力受到抑制,分泌因子的能力上调。IRE1α在多种细胞类型中作为Sel1L-Hrd1 ERAD复合物的内源性底物,其信号转导在肠道炎症以及肿瘤疾病中起到重要作用[22,23],但Sel1L基因究竟是通过哪种分子机制影响DC细胞的免疫调节作用,还需后续实验研究。
参考文献:
[1] Liu CY,Wong HN,Schauerte JA,etal.The protein kinase/endoribonuclease IRE1alpha that signals the unfolded protein response has a luminal N-terminal ligand-independent dimerization domain[J].J Biol Chem,2002,277(21):18346-18356.
[2] Ellgaard L,Helenius A.Quality control in the endoplasmic reticulum[J].Nat Rev Mol Cell Biol,2003,4(3):181-191.
[3] Sun S,Shi G,Sha H,etal.IRE1alpha is an endogenous substrate of endoplasmic-reticulum-associated degradation[J].Nat Cell Biol,2015,17(12):1546-1555.
[4] Harding HP,Zhang Y,Ron D.Protein translation and folding are coupled by an endoplasmic-reticulum-resident kinase[J].Nature,1999,397(6716):271-274.
[5] Kaufman RJ,Scheuner D,Schroder M,etal.The unfolded protein response in nutrient sensing and differentiation[J].Nat Rev Mol Cell Biol,2002,3(6):411-421.
[6] Biunno I,Cattaneo M,Orlandi R,etal.SEL1L a multifaceted protein playing a role in tumor progression[J].J Cell Physiol,2006,208(1):23-38.
[7] Cardano M,Diaferia GR,Cattaneo M,etal.mSEL-1L(Suppressor/enhancer Lin12-like)protein levels influence murine neural stem cell self-renewal and lineage commitment[J].J Biol Chem,2011,286(21):18708-18719.
[8] Li S,Francisco AB,Munroe RJ,etal.SEL1L deficiency impairs growth and differentiation of pancreatic epithelial cells[J].BMC Dev Biol,2010,10:19.
[9] Ban Y,Taniyama M,Tozaki T,etal.SEL1L microsatellite polymorphism in Japanese patients with autoimmune thyroid diseases[J].Thyroid,2001,11(4):335-338.
[10] Saltini G,Do minici R,Lovati C,etal.A novel polymorphism in SEL1L confers susceptibility to Alzheimer's disease[J].Neurosci Lett,2006,398(1-2):53-58.
[11] Xia S,Guo Z,Xu X,etal.Hepatic microenvironment programs hematopoietic progenitor differentiation into regulatory dendritic cells,maintaining liver tolerance[J].Blood,2008,112(8):3175-3185.
[12] Schnell S.A model of the unfolded protein response:pancreatic beta-cell as a case study[J].Cell Physiol Biochem,2009,23(4-6):233-244.
[13] Glembotski CC.Endoplasmic reticulum stress in the heart[J].Circ Res,2007,101(10):975-984.
[14] Glembotski CC.The role of the unfolded protein response in the heart[J].J Mol Cell Cardiol,2008,44(3):453-459.
[15] Sun S,Shi G,Han X,etal.Sel1L is indispensable for mammalian endoplasmic reticulum-associated degradation,endoplasmic reticulum homeostasis,and survival[J].Proc Natl Acad Sci U S A,2014,111(5):E582-591.
[16] Yang H,Qiu Q,Gao B,etal.Hrd1-mediated BLIMP-1 ubiquitination promotes dendritic cell MHCII expression for CD4 T cell priming during inflammation[J].J Exp Med,2014,211(12):2467-2479.
[17] Rutishauser RL,Martins GA,Kalachikov S,etal.Transcriptional repressor Blimp-1 promotes CD8(+) T cell terminal differentiation and represses the acquisition of central memory T cell properties[J].Immunity,2009,31(2):296-308.
[18] Son M,Kim SJ,Diamond B.SLE-associated risk factors affect DC function[J].Immunol Rev,2016,269(1):100-117.
[19] Burr ML,van den Boomen DJ,Bye H,etal.MHC class I molecules are preferentially ubiquitinated on endoplasmic reticulum luminal residues during HRD1 ubiquitin E3 ligase-mediated dislocation[J].Proc Natl Acad Sci U S A,2013,110(35):14290-14295.
[20] Mosmann TR,Cherwinski H,Bond MW,etal.Two types of murine helper T cell clone.I.Definition according to profiles of lymphokine activities and secreted proteins.1986[J].J Immunol,2005,175(1):5-14.
[21] Macatonia SE,Hosken NA,Litton M,etal.Dendritic cells produce IL-12 and direct the development of Th1 cells from naive CD4+T cells[J].J Immunol,1995,154(10):5071-5079.
[22] Kaser A,Lee AH,Franke A,etal.XBP1 links ER stress to intestinal inflammation and confers genetic risk for human inflammatory bowel disease[J].Cell,2008,134(5):743-756.
[23] Cubillos-Ruiz JR,Silberman PC,Rutkowski MR,etal.ER stress sensor XBP1 controls anti-tumor immunity by disrupting dendritic cell homeostasis[J].Cell,2015,161(7):1527-1538.