PD-L1在胃癌患者手术前后外周血T细胞和单核细胞上的表达及意义①
2018-05-25丁思思黄莉莉梁含思张学光
丁思思 黄莉莉 梁含思 张 允 曹 磊 张学光
(苏州大学附属第一医院江苏省临床免疫研究所,江苏省胃肠道肿瘤免疫重点实验室,苏州 215007)
胃癌发病率和死亡率居恶性肿瘤第三、第四位,是全球最常见的高危害恶性肿瘤之一[1]。在对其发展机制的长期研究中,人们发现机体免疫系统可影响肿瘤的发生发展。研究证实,多种细胞因子和免疫卡控点分子的表达与胃癌的发生、发展以及转移相关,改变这些免疫分子的表达水平可以影响胃癌的发展与转归[2]。
PD-L1( Programmed cell death-Ligand 1)是负性共刺激分子B7家族成员之一。近年来,随着肿瘤免疫治疗的兴起,PD-L1越来越引起人们的重视。人 PD-L1基因位于人染色体9p24,mRNA可表达于正常人和小鼠包括心、肝、脾、 肾等多种组织[3,4]。蛋白水平上,PD-L1在活化的T细胞、B细胞、树突状细胞、巨噬细胞、NK细胞、血管内皮细胞、间充质干细胞和培养的骨髓来源的肥大细胞上也均有表达[5-10]。研究发现,PD-L1分子异常表达于多种肿瘤细胞表面,包括胃癌、膀胱癌、神经胶质瘤、黑色素瘤、肺癌、卵巢癌、结肠癌等[11-16]。
肿瘤细胞表达的PD-L1分子通过与浸润的T细胞表面的PD-1受体结合可以诱导T细胞凋亡或无能,从而介导肿瘤细胞的免疫逃逸。PD-L1分子在肿瘤组织浸润淋巴细胞及其亚群上表达可影响肿瘤微环境中肿瘤细胞与浸润的免疫细胞之间的相互作用,且其在肿瘤细胞中的表达程度与肿瘤的发生发展以及患者预后密切相关[17]。肿瘤细胞通过诱导此类负性分子受体的表达逃避细胞毒性T淋巴细胞(Cytotoxic T lymphocyte,CTL)的杀伤作用,减弱机体抗肿瘤免疫应答。而特异性阻断PD-1/PD-L1抑制信号可上调IFN-γ、IL-2、IL-10的分泌,有效促进肿瘤特异性CD8+T细胞的活化增殖[18],使机体中失能的效应性免疫细胞恢复生物学功能,增强淋巴细胞对肿瘤抗原的识别及杀伤能力,从而提高机体清除肿瘤的能力[18]。
本研究采用流式细胞术检测PD-L1在胃癌患者术前术后外周血T细胞和单核细胞上的表达变化规律,发掘其作为可能生物标志物的价值,为胃癌的预警和免疫干预提供有效的靶点,也将为免疫治疗开拓新途径。
1 资料与方法
1.1资料
1.1.1临床资料 收集2015年1月~2016年12月在苏州大学附属第一医院就诊的胃腺癌原发病例44例(男24例,女20例),平均年龄为(58.6±13.2)岁。临床分期为:T1、T2期14例,T3、T4期30例;N0 16例,N1 6例,N2 11例,N3 11例;M0 44例,M1 0例。所有患者均为手术住院治疗的原发性胃癌,均经病理组织学确诊,采血前均未接受手术、放疗及化疗等抗肿瘤治疗,并在所有患者术后4~7 d 内进行复查和随访。所有胃癌患者均排除心肾功能异常,基础代谢性疾病,系统性红斑狼疮、类风湿等免疫性疾病,且在术中或术后无严重并发症。同时选取性别和年龄匹配的健康人血液标本18例(男11 例,女7例),平均年龄(50.4±10.6)岁作为健康对照组。本研究经过苏州大学附属第一医院医学伦理学委员会批准,患者知情同意。
1.1.2试剂和仪器 鼠抗人PD-L1-PE荧光素标记单克隆抗体(Biolegend公司,美国);鼠抗人CD3-FITC、CD4-PE-CY5、CD8-PE-CY7、CD14-FITC荧光素标记单克隆抗体(Miltenyi biotec公司,德国);PE标记的小鼠IgG作为同型对照(Beckman Couher公司,美国);红细胞裂解液(Beckman Coulter公司,美国);流式细胞仪(Coulter Epics XL flow cytometer,Beckman Coulter公司,美国)。
1.2方法
1.2.1胃癌患者血液标本的收集 分别在术前24 h 内和术后第3天,于清晨6:00,用EDTA抗凝管采集受试胃癌患者和健康志愿者空腹静脉血2 ml备用。
1.2.2流式细胞术检测细胞表面分子 全血细胞按50 μl/test,并依次分别加入以下抗体:①空白对照;②CD3(FITC)3 μl;③CD4(PE)1 μl;④CD4(PC5)1 μl;⑤CD8(PC7)1 μl;⑥CD3(FITC)3 μl+CD4(PC5)1 μl +CD8(PC7)1 μl;⑦CD3(FITC)3 μl+CD4(PC5)1 μl +CD8(PC7)1 μl +PD-L1(PE)1 μl;⑧CD14(FITC)3 μl;⑨CD14(FITC) 3 μl +PD-L1(PE)1 μl,4℃避光反应20~30 min。每管加入红细胞裂解液300 μl,充分振荡后置于40℃水浴锅5 min,加2 ml PBS终止反应,1 200 r/min离心5 min,弃上清。加入PBS 500 μl成细胞悬液,流式细胞仪检测各指标表达。
2 结果
2.1胃癌患者外周血T细胞表面PD-L1表达水平无显著变化 流式细胞术选取外周血CD3+CD4+T细胞和CD3+CD8+T细胞,检测其表面PD-L1的表达(图1)。结果显示,胃癌患者CD3+CD4+T细胞的PD-L1表达为(11.1±6.4)%,而健康对照组则为(9.8±5.6)%,两者无统计学差异(P=0.453 2),如图2A所示。胃癌患者CD3+CD8+T细胞的PD-L1表达为(13.9±12.0)%,而健康对照组为(12.0±7.1)%,两者差异也无统计学意义(P=0.558 9),如图2B所示。
2.2胃癌患者外周血CD14+单核细胞表面PD-L1表达水平显著增加 流式细胞术选取外周血CD14+单核细胞,检测其表面PD-L1的表达(图3)。结果显示,胃癌患者外周血CD14+单核细胞表面PD-L1的表达显著高于健康对照组[(29.2±16.7)% vs (17.5±9.7)%,P=0.007 3],如图4所示。
2.3胃癌患者手术后外周血T细胞PD-L1表达水平显著增加 通过流式细胞术检测胃癌患者手术前后外周血T细胞PD-L1的表达,结果显示,与手术前相比,44例胃癌患者术后CD3+CD4+T细胞表面PD-L1的表达显著高于术前水平[(15.8±8.2)% vs(11.1±6.4)%,P=0.001 5](图5A);与此结果相类似,术后CD3+CD8+T细胞表面PD-L1的表达也显著高于术前水平[(22.5±13.3)% vs(13.9±12.0)%,P=0.000 2](图5B)。
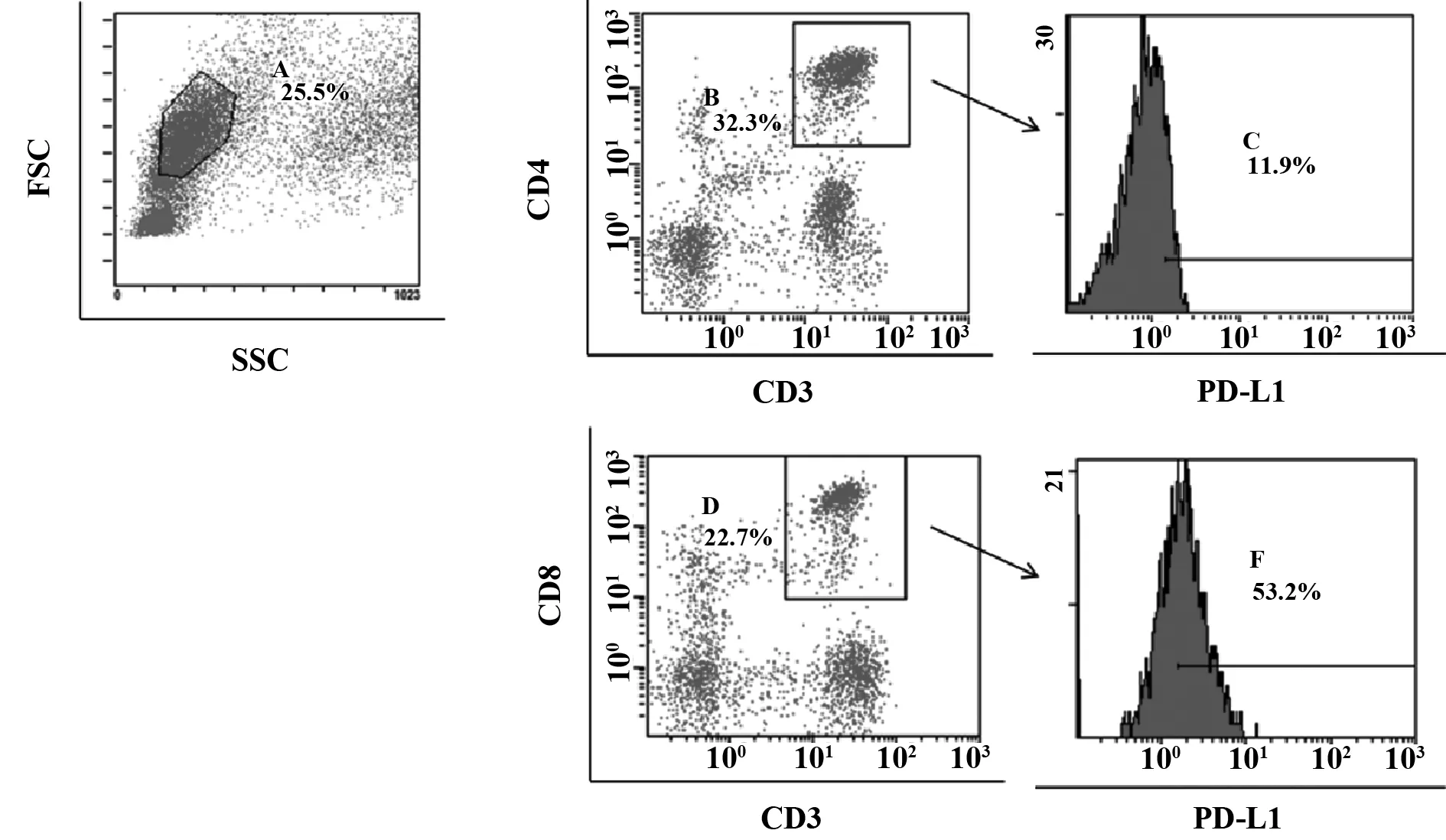
图1 流式细胞术检测CD3+CD4+T细胞和CD3+CD8+T细胞表面PD-L1表达的流程图Fig.1 Expression of PD-L1 on CD3+CD4+T cells and CD3+CD8+T cells was detected by flow cytometry
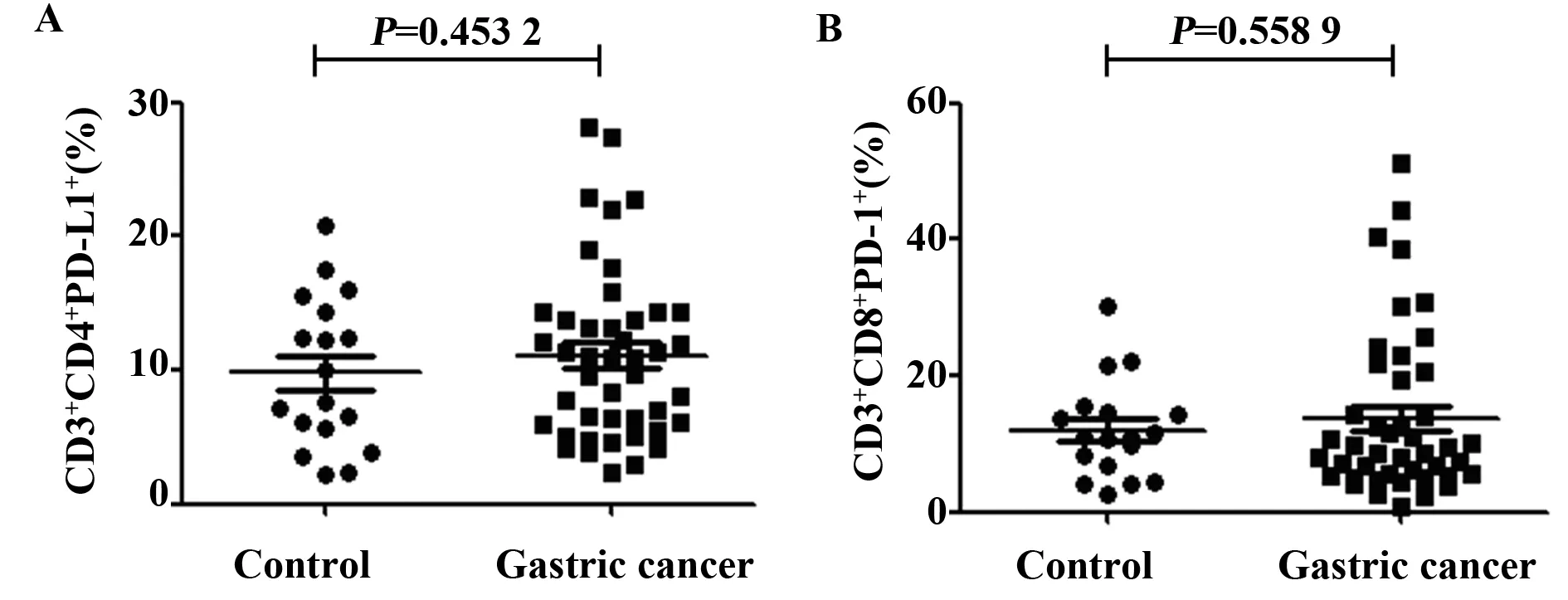
图2 胃癌患者CD3+CD4+T细胞和CD3+CD8+T细胞表面PD-L1的表达Fig.2 Expression of PD-L1 on CD3+CD4+T cells and CD3+CD8+T cells in patients with gastric cancer
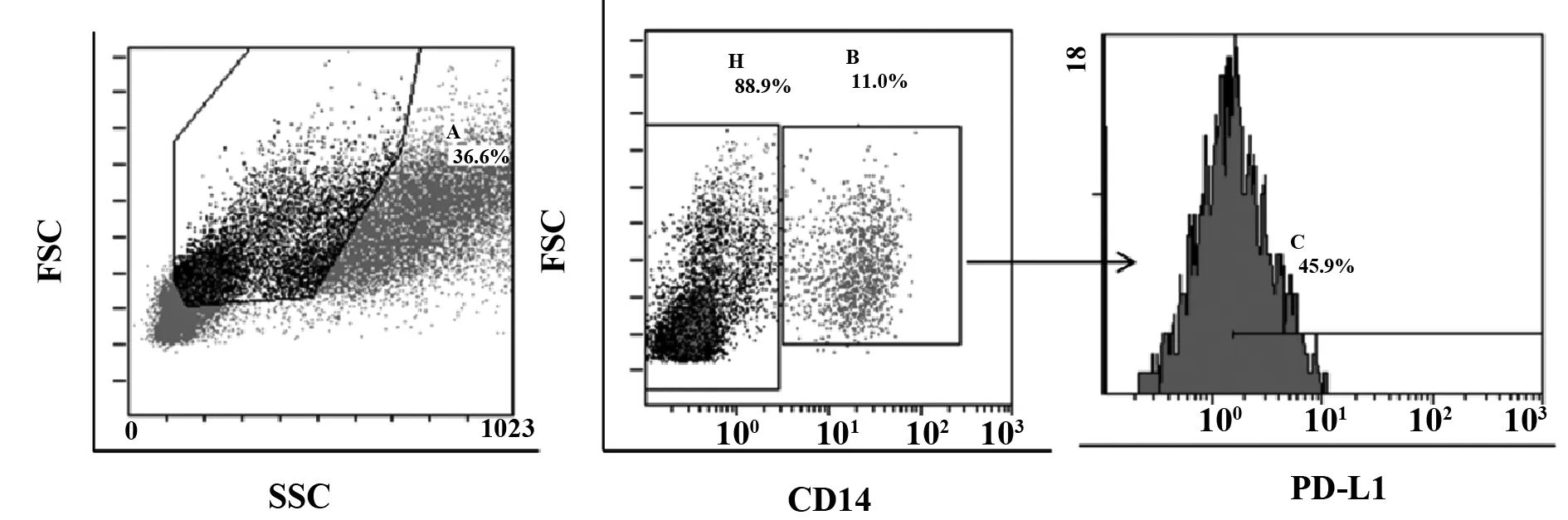
图3 流式细胞术检测CD14+单核表面PD-L1表达的流程图Fig.3 Detection of PD-L1 expression on CD14+ monocytes by flow cytometry
2.4胃癌患者手术后外周血CD14+单核细胞PD-L1表达水平与术前相比无显著变化 进一步通过流式细胞术检测外周血CD14+单核细胞表面PD-L1的表达,结果显示,在CD14+单核细胞中,术后CD14+细胞中PD-L1的表达水平与手术前相比无显著变化[(33.8±17.3)% vs(29.2±16.7)%,P=0.082 8](图6)。
2.5胃癌患者手术后外周血T细胞PD-1表达水平无显著变化 通过流式细胞术检测胃癌患者手术前后外周血T细胞PD-1的表达,结果显示,与手术前相比,44例胃癌患者术后CD3+CD4+T细胞表面PD-1的表达无显著统计学差异[(25.6±9.9)% vs(26.9±8.9)%,P=0.505 5](图7A); 与此结果相类似,术后CD3+CD8+T细胞表面PD-1的表达与术前相比也无统计学差异[(26.5±14.6)% vs(29.9±10.4)%,P=0.1187](图7B)。
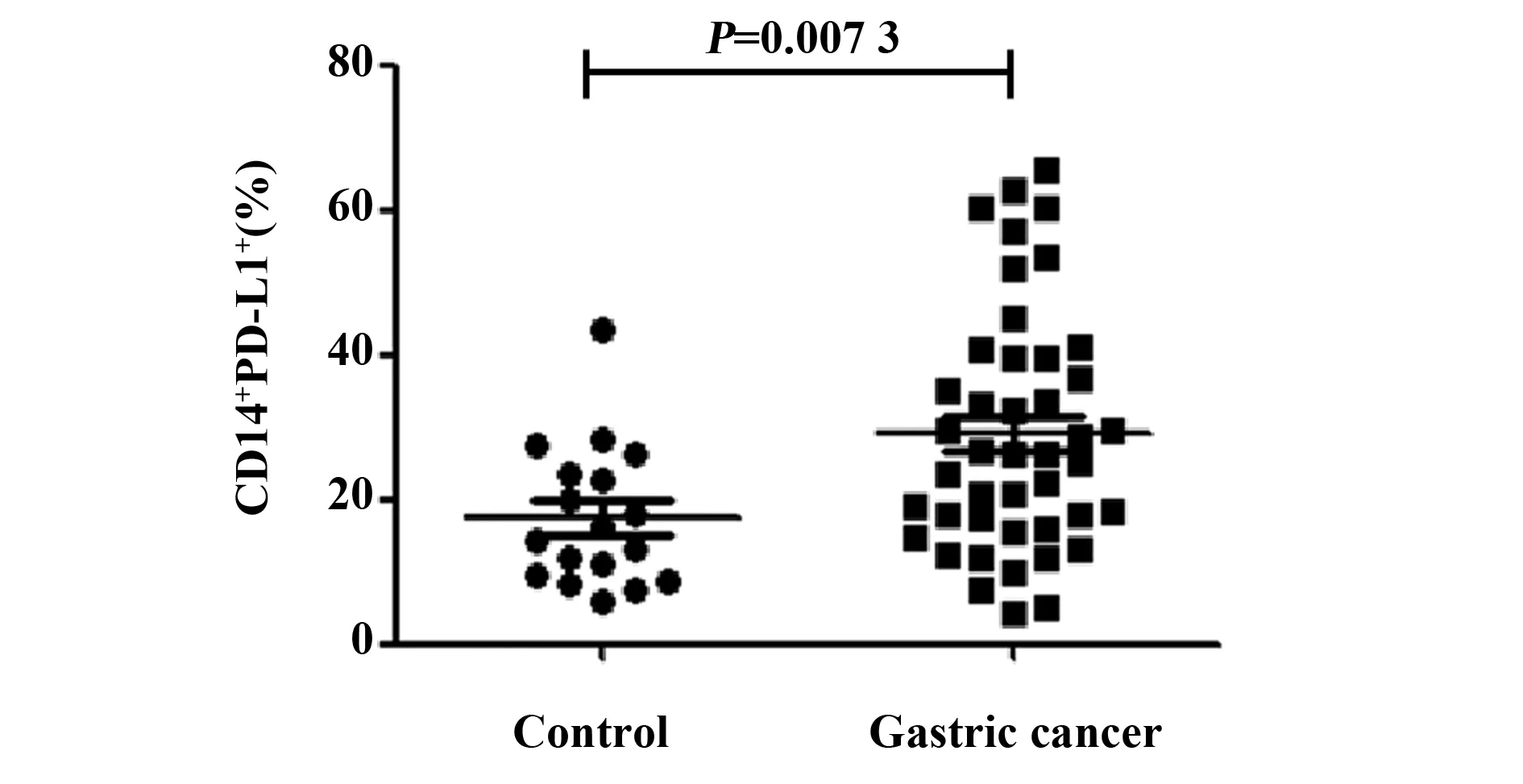
图4 胃癌患者CD14+单核细胞表面PD-L1的表达Fig.4 Expression of PD-L1 on CD14+ monocytes in patients with gastric cancer
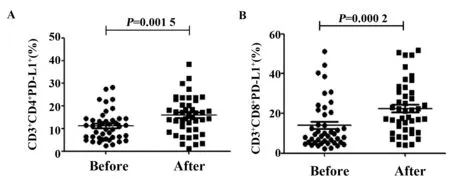
图5 胃癌患者术前术后CD3+CD4+T细胞和CD3+CD8+T细胞表面PD-L1的表达Fig.5 Expression of PD-L1 on CD3+CD4+T cells and CD3+CD8+T cells in patients with gastric cancer before and after surgery
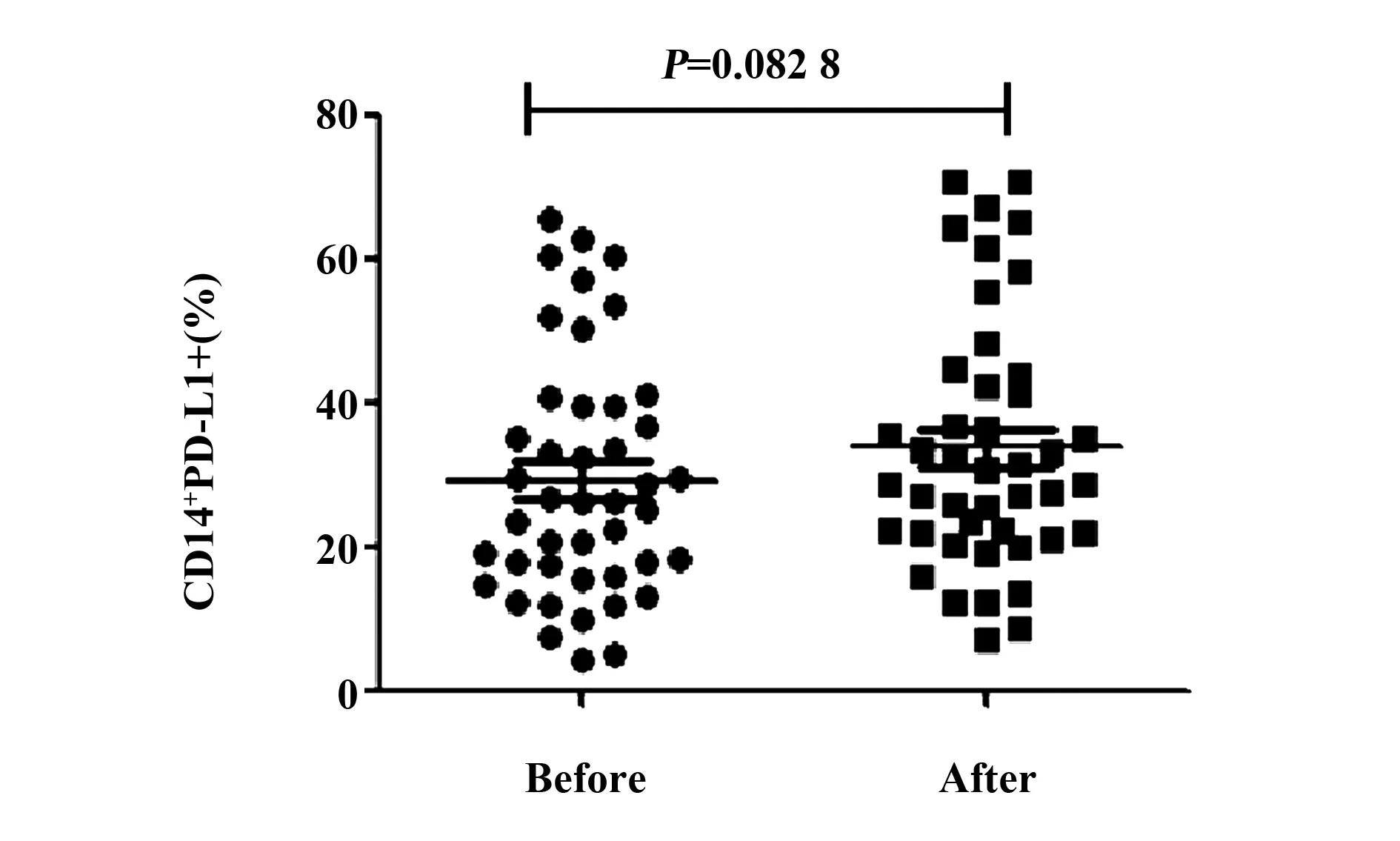
图6 胃癌患者术前术后CD14+单核细胞表面PD-L1的表达Fig.6 Expression of PD-L1 on CD14+ monocytes in patients with gastric cancer before and after surgery
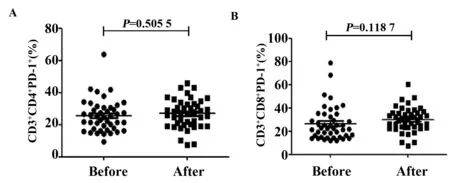
图7 胃癌患者术前术后CD3+CD4+T细胞和CD3+CD8+T细胞表面PD-1的表达Fig.7 Expression of PD-1 on CD3+CD4+T cells and CD3+CD8+T cells in patients with gastric cancer before and after surgery
3 讨论
胃癌的发病率高,疾病相关死亡率高,晚期胃癌患者的中位总生存期仅12 个月,且临床治疗手段有限[19]。免疫卡控点分子在细胞免疫应答过程中起到负性调控作用,正常情况下参与维持机体免疫耐受、防止组织免疫损伤等过程,并在肿瘤发生过程中与免疫逃逸密切相关[20]。PD-L1作为一种负性共刺激分子,以膜型和可溶型两种形式存在,构成精确的调节网络,参与免疫应答的启动、抗原信息传递以及免疫应答的适时中止。可溶性PD-L1可由树突状细胞、单核细胞及活化的T 细胞分泌,存在于正常人的外周血[21],而肿瘤患者的肿瘤细胞也可分泌可溶性的负性共刺激分子到外周血中。有文献报道,肿瘤患者外周血血浆的可溶性PD-L1表达显著高于正常人[22,23]。此外,正常外周血的单核细胞、激活的T 细胞均表达多种负性共刺激分子如PD-L1、B7-H3和B7-H4等,可能在应激、炎症的免疫应答中发挥作用,同时负性共刺激分子表达受到肿瘤组织微环境相关细胞因子的调控。
多项研究表明,PD-L1在正常胃组织中几乎不表达,而在胃癌组织中表达阳性率可达40%~50%[24-26],目前有关胃癌PD-L1的研究主要集中在肿瘤组织中,而其在胃癌患者外周血T细胞和单核细胞中表达水平的相关研究甚少,鉴于目前实体肿瘤的PD-L1表达与外周血细胞的PD-L1表达之间的关系尚不清楚,本研究中我们检测了44例胃癌患者和18例健康人外周血T细胞和单核细胞上的PD-L1的表达,发现胃癌组CD14+单核细胞表面PD-L1表达显著高于健康对照组。那么肿瘤患者外周血中高表达PD-L1的CD14+细胞是怎么产生的呢?会不会是肿瘤组织中浸润的单核-巨噬细胞进入血液循环,又或是机体针对肿瘤组织产生全身的免疫反应从而使得外周血单核细胞的PD-L1表达增加?这些问题都有待进一步研究解决。另一方面,血液中单核细胞PD-L1表达增加能不能作为潜在的肿瘤筛选标志?这也是我们关心的问题,接下来我们将进一步增加样本量进行系统的分析。而对44例胃癌患者术前术后外周血单核细胞PD-L1表达的分析结果显示,术前术后单核细胞的PD-L1表达百分比没有明显改变,这提示我们,外周血单核细胞PD-L1表达增加更有可能是全身的免疫反应而不太可能是肿瘤组织的CD14+细胞脱落而来。
本研究同时检测了外周血CD4+T细胞和CD8+T细胞表面PD-L1的表达,结果显示,胃癌患者T细胞的PD-L1表达水平较健康人无统计学差异,这提示外周血T细胞的PD-L1表达与胃癌之间可能并没有直接的联系,而单核细胞的PD-L1表达则更可能与肿瘤相关。有趣的是,与术前相比,术后无论是CD4+T细胞还是CD8+T细胞表面PD-L1表达均显著上调,之所以造成这种情况,一方面可能是手术创伤引起的炎症反应导致了T细胞PD-L1的上调;另一方面,随着肿瘤的切除,PD-L1在应激的免疫应答中发挥作用,持续激活PD-1通路可抑制肿瘤抗原特异性T细胞活化,削弱T细胞抗肿瘤活性,从而出现了应激反应导致PD-L1上调。此外,T细胞上PD-1的术前术后检测结果并无统计学差异,提示术后T细胞的抑制功能并没有发生改变,这个结果也提示我们,在应激作用下PD-L1在T细胞上表达的功能有可能并不依赖于PD-1的表达。
总而言之,外周血单核细胞的PD-L1可能与胃癌的发生以及肿瘤免疫的状态有关,对该指标的检测有助于胃癌的初步筛查。此外,外周血T细胞的PD-L1与患者的创伤和全身免疫状态有关,但对胃癌的发生和肿瘤免疫的作用还有待进一步研究。
以PD-1/PD-L1抑制剂为代表的免疫检查点抑制剂,在多期临床试验中成效显著,为肿瘤生物治疗带来新的机遇。至2016年12月31日,已有2种PD-1抗体(Nivolumab和Pembrolizumab) ,1种PD-L1抗体(Atezulizumab) 通过FDA 批准正式进入临床应用。通过监测胃癌患者外周血细胞PD-L1的表达水平,为进一步发掘PD-L1分子作为肿瘤分子靶标提供了新的实验依据,也对评价胃癌治疗效果、疾病进展及预后具有重要价值。
参考文献:
[1] Chen W,Zheng R,Baade PD,etal.Cancer statistics in China,2015[J].Ca A Cancer J Clinicians,2016,66(2):115.
[2] Uedo N,Iishi H,Tatsuta M,etal.Longterm outcomes after endoscopic mucosal resection for early gastric cancer[J].Gastric Cancer,2006,9(2):88-92.
[3] Freeman GJ,Long AJ,Iwai Y,etal.Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation[J].J Exp Med,2000,192(7):1027-1034.
[4] Özkaynak E,Wang L,Goodearl A,etal.Programmed Death-1 targeting can promote allograft survival[J].J Immunol,2002,169(11):6546-6553.
[5] Dong H,Zhu G,Tamada K,etal.B7-H1,a third member of the B7 family,co-stimulates T-cell proliferation and interleukin-10 secretion[J].Nat Med,1999,5(12):1365.
[6] Curiel TJ,Wei S,Dong H,etal.Blockade of B7-H1 improves myeloid dendritic cell-mediated antitumor immunity[J].Nat Med,2003,9(5):562-567.
[7] Saudemont A,Jouy N,Hetuin D,etal.NK cells that are activated by CXCL10 can kill dormant tumor cells that resist CTL-mediated lysis and can express B7-H1 that stimulates T cells [J].Blood,2005,105(6):2428.
[8] Mazanet MM,Hughes CCW.B7-H1 is expressed by human endothelial cells and suppresses T cell cytokine synthesis [J].J Immunol,2002,169(7):3581.
[9] Augello A,Tasso R,Negrini SM,etal.Bone marrow mesenchymal progenitor cells inhibit lymphocyte proliferation by activation of the programmed death 1 pathway[J].Eur J Immunol,2005,35(5):1482-1490.
[10] Nakae S,Suto H,Iikura M,etal.Mast cells enhance T cell activation:importance of mast cell costimulatory molecules and secreted TNF[J].J Immunol,2006,176(4):2238.
[11] Ikeda S,Okamoto T,Okano S,etal.PD-L1 is upregulated by simultaneous amplification of the PD-L1,and JAK2,genes in non-small cell lung cancer[J].J Thoracic Oncol,2016,11(1):62.
[12] Wang T,Zhao Y,Peng L,etal.Tumor-activated neutrophils in gastric cancer foster immune suppression and disease progression through GM-CSF-PD-L1 pathway[J].Gut,2017,66(11):1900-1911.
[13] Masugi Y,Nishihara R,Yang J,etal.Tumour CD274 (PD-L1) expression and T cells in colorectal cancer[J].Gut,2017,66(8):1463.
[14] Baptista MZ,Sarian LO,Derchain SF,etal.Prognostic significance of PD-L1 and PD-L2 in breast cancer[J].Hum Pathol,2016,47(1):78.
[15] Oliveira-Costa JP,Carvalho AFD,Silveira GGD,etal.Gene expression patterns through oral squamous cell carcinoma development:PD-L1 expression in primary tumor and circulating tumor cells[J].Oncotarget,2015,6(25):20902-20920.
[16] 马宝镇,高全立.抗PD-1及PD-L1在肿瘤治疗中的进展[J].中国免疫学杂志,2017,33(5):796-800.
Ma BZ,Gao QL.Progress of anti PD-1 and PD-1 in the treatment of tumor[J].Chin J Immunol,2017,33(5):796-800.
[17] Ohaegbulam KC,Assal A,Lazar-Molnar E,etal.Human cancer immunotherapy with antibodies to the PD-1 and PD-L1 pathway[J].Trends in Molecular Medicine,2015,21(1):24.
[18] Chen L.Co-inhibitory molecules of the B7-CD28 family in the control of T-cell immunity[J].Nat Rev Immunol,2004,4:336-347.
[19] Cetin B,Gumusay O,Cengiz M,etal.Advances of molecular targeted therapy in gastric cancer[J].J Gastrointest Cancer,2016,47(2):125-134.
[20] Topalian SL,Drake CG,Pardoll DM.Immune checkpoint blockade:a common denominator approach to cancer therapy[J].Cancer Cell,2015,27(4):450.
[21] Yi Q,Li Q,Ren T,etal.Upregulation of PD-L1 and APE1 is associated with tumorigenesis and poor prognosis of gastric cancer[J].Drug Design Devel Therapy,2015,9:901-909.
[22] Geng Y,Wang H,Lu C,etal.Expression of costimulatory molecules B7-H1,B7-H4 and Foxp3+Tregs in gastric cancer and its clinical significance[J].Int J Clin Oncol,2015,20(2):273.
[23] Hou J,Yu Z,Xiang R,etal.Correlation between infiltration of Foxp3+regulatory T cells and expression of B7-H1 in the tumor tissues of gastric cancer[J].Exp Mol Pathol,2014,96(3):284-291.
[24] Eto S,Yoshikawa K,Nishi M,etal.Programmed cell death protein 1 expression is an independent prognostic factor in gastric cancer after curative resection[J].Gastric Cancer,2016,19(2):466-471.
[25] Tamura T,Ohira M,Tanaka H,etal.Programmed Death-1 Ligand-1 (PDL1) expression is associated with the prognosis of patients with stage II/III gastric cancer[J].Anticancer Res,2015,35(10):5369-5376.
[26] Kim JW,Nam KH,Ahn SH,etal.Prognostic implications of immunosuppressive protein expression in tumors as well as immune cell infiltration within the tumor microenvironment in gastric cancer[J].Gastric,2016,19(1):42.