骨髓间充质干细胞移植对实验性大鼠缺血性脑梗死免疫炎性反应的影响研究①
2018-05-25何霞崔璨陈敏
何 霞 崔 璨 陈 敏
(郑州大学第一附属医院,郑州 450052)
脑梗死属于神经内科高发疾病,占脑血管疾病的75.0%,发病早期治疗措施不当临床死亡率将超过10.0%[1]。脑梗死发病机制相对复杂,普遍认为是由于脑血管供应发生障碍,造成脑部出现缺血、缺氧,从而引起脑部组织发生局限性坏死、脑软化,其病因较多,包括动脉粥样硬化、高血压、糖尿病等,严重影响我国居民健康[2]。目前,临床上对于脑梗死以超早期溶栓、脑神经保护等治疗为主,该方案虽然能降低临床死亡率,延缓病情发展,但是临床治疗预后较差,存活患者中仍然有50.0%~70.0%患者伴有不同程度的后遗症,难以达到预期治疗效果[3]。生物学研究认为:成熟的神经元由于特殊的结构,当期发生受损后将无法再生[4],因此脑梗死患者发病后由于神经元发生坏死性缺血,成为治疗发病后残疾的重要原因。
随着医疗技术的不断发展,干细胞在脑梗死中得到应用,对于其基础、临床前期研究获得的成果相对较多[5]。骨髓间充质干细胞属于特殊的干细胞,具有取材方便、免疫原性低、能自体移植等特点,成为脑梗死治疗的首选干细胞。动物实验结果表明[6]:将骨髓间充质干细胞用于脑梗死中有助于促进脑梗死神经功能恢复,并且该治疗方法是有效的,能为脑梗死临床治疗提供新的方法。文献报道显示:脑梗死能诱发自身内源性神经干/前体细胞的增殖,细胞能自发移植到梗死病灶周围,在多种酶作用下向神经元、胶质细胞分化[7]。但是,多数增殖的内源性神经干/前体细胞存活周期较短,难以对脑梗死的治疗发挥实质性作用[8]。研究表明[9]:将骨髓间充质干细胞用于实验性SD大鼠脑梗死中有助于提高机体免疫,降低炎性反应,但是不同学者试验结果存在争议。因此,本课题以2015年3月~2017年5月实验室进行实验的SD大鼠65例作为研究对象,探讨骨髓间充质干细胞移植对实验性大鼠缺血性脑梗死免疫炎性反应的影响。
1 材料与方法
1.1材料
1.1.1实验动物 以2015年3月~2017年5月进行随机对照实验的SD大鼠65例作为研究对象,清洁级。65只SD大鼠体质量67.3~91.5 g,平均(77.45±4.75)g,所选动物均由医学动物实验中心提供,许可证号:scxk2008-0020。研究中对于SD大鼠的处理均符合《关于善待实验动物的指导下意见》原则[10],饲养时控制实验室恒温(20±2)℃,恒湿 50%~60%,大鼠常规饲养,自由摄食、饮水,光照12 h,建模前12 h禁食,实验均通过医院动物委员会批准同意,在郑州大学第一附属医院神经内科完成。
1.1.2主要仪器和试剂 胰蛋白酶、Ⅱ型胶原酶(Amreseo公司,State of Ohio,USA)、多聚甲醛(北京化工厂)、水合氯醛(国药集团化学试剂有限公司)、CO2培养箱(Thermo Forma公司)、倒置相差显微镜(IX-71-S8F,Olympus,Japan)、高速冷冻离心机 Sigma 1-15K(德国赛多利斯公司)、手术器械一套(医院提供)。
1.2方法
1.2.1实验性大鼠缺血性脑梗死模型建立 利用改良Zea-longa线栓法阻断大脑中动脉成功构建实验性大鼠缺血性脑梗死模型。手术前动物禁食、禁饮4 h,根据无菌手术操作进行,利用Marker笔在尼龙栓线在距离头端1.8 cm部位进行标记,碘伏消毒后备用。利用10.0%水合氯醛对大鼠进行腹腔注射麻醉(剂量0.35 ml/100 g),待麻醉生效后10 min将大鼠固定在固定板上,去除颈部的毛发,利用碘伏完成皮肤消毒,从颈部正中作长为1.5 cm的切口,范围为颈部到下颌反折部位,剪开阔筋膜,充分暴露右侧胸锁乳突肌,并且在胸锁乳突肌、颈前肌群部位向深部分离,暴露颈动脉鞘。建模过程中避免损伤迷走神经,利用6-0丝线沿着颈外动脉和右侧颈总动脉离分叉8 mm部位进行结扎,颈内动脉及右侧颈总动脉仅单一套线不进行结扎,利用血管钳牵拉颈内动脉,压闭颈总动脉完成血流的阻断后控制剪开的右侧颈总动脉。在右侧颈总动脉分离叉5 mm部位作小切口,置入尼龙线直到颈内动脉。单结轻微结扎右侧颈总动脉,控制血液反流但是避免栓线阻碍,松开颈内动脉的牵拉套线,利用显微镊子夹住,利用镊子沿着颈内动脉方向插入,当栓线上标记的1.8 cm达到右侧颈总动脉分叉部位时停止插入,双结扎右侧颈总动脉套线,缝合手术切口,栓线尾端暴露在切口外2 h后拔除1 cm实现血流的再灌注,剪断外部栓线,完成实验性大鼠缺血性脑梗死模型建立。大鼠出现运动障碍,动脉栓塞对侧肢体不如同侧灵活、跛行视为建模成功[11,12]。
1.2.2骨髓间充质干细胞分离、培养 取5只大鼠,利用1%异戊巴比妥钠(注射量3 ml/kg)腹腔内麻醉,采用断颈方法处死大鼠,去除双侧股骨、胫骨及肌肉,剪断骨骺,充分暴露骨髓腔,利用PBS进行冲洗,收集骨髓细胞,经反复吹打后制备单细胞悬液,将其接种在37℃,浓度为5%CO2中连续培养,24 h后全量换液,以后每周换液1次,待细胞生长融合70.0%~80.0%时,开始传代培养,取第3代细胞备用[13,14]。
1.2.3模型大鼠处理 将建模成功后的大鼠60只,随机分为模型组、对照组和实验组,每组20只。模型组建模成功后仅进行血管结扎,不插入线栓;对照组在病灶部位注入3 ml等体积PBS;实验组在病灶部位注入10 μl第三代骨髓间充质干细胞,取原切口,在右侧胸锁乳突肌内侧钝性分离确定右侧颈内动脉,利用1 ml注射器进行穿刺,沿着颈内动脉方向注射10 μl(细胞数量为1×105个)骨髓间充质干细胞稀释液,将预留丝线收紧后,结扎右侧颈外动脉,止血后完成切口缝合[15]。
1.2.4观察指标 ①骨髓间充质干细胞细胞形态。取少许分离、培养的骨髓间充质干细胞,在倒置显微镜下观察细胞的形态[16]。②荧光显微镜观察。取少许分离、培养的骨髓间充质干细胞,在显微镜下计算细胞数目,利用离心机进行离心,然后加入CD34-PE单抗、CD44-FITC、CD29-异硫氰荧光素(FITC)进行标记以及CD45-藻红蛋白(PE),在28℃的黑暗条件下进行30 min保存,然后在荧光显微镜下,观察细胞绿色荧光蛋白的标记率[17]。③神经功能评分。对大鼠进行3个月试验,参考Longa和Bederson方法对三组大鼠神经功能进行评分,采用0~5分制法进行评定,0分:无神经功能症状;4分:不能走路且意识丧失[18]。④炎性因子水平。三组大鼠治疗后次日早晨尾静脉抽取2 ml静脉血,采用酶联免疫吸附试验测定IL-6、IFN-γ、IL-10及TGF-β水平,有关操作严格遵循仪器步骤完成[19]。⑤免疫水平。三组大鼠治疗后1个月、2个月及3个月采集静脉血标本,血清分离后采用流式细胞术测定CD4+CD25+Tregs细胞占CD4+T细胞的百分比[20]。
2 结果
2.1实验动物数量分析 本课题中纳入65只SD大鼠,所有大鼠均根据要求完成相关实验,中途无脱落。
2.2分离制备细胞形态 倒置显微镜下第3天第1代骨髓间充质干细胞体积增大,呈多角形或长梭形,细胞开始聚集,第3代细胞迅速增殖,排列具有一定的方向性,呈旋涡状生长,并且具有多层,界限不清,见图1。
2.3骨髓间充质干细胞荧光显微镜观察 荧光显微镜观察结果表明:获得细胞中大部分区域被荧光标记,获得的细胞为骨髓间充质干细胞,见图2。
2.4三组大鼠治疗后不同时间点神经功能评分比较 对照组与模型组治疗后1个月、2个月及3个月神经功能评分比较差异无统计学意义(P>0.05);实验组后1个月、2个月及3个月神经功能评分,低于对照组与模型组(P<0.05),见表1。
2.5三组大鼠治疗后3个月炎症因子水平比较 对照组与模型组IL-6、IFN-γ、IL-10及TGF-β水平比较差异无统计学意义(P>0.05);实验组治疗后3个月IL-6、IFN-γ水平,高于对照组(P<0.05);实验组治疗后3个月IL-10及TGF-β水平,低于对照组(P<0.05),见表2。
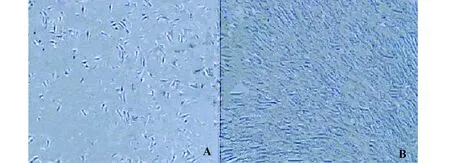
图1 骨髓间充质干细胞倒置显微镜形态(×200)Fig.1 Bone marrow mesenchymal stem cells inverted microscope morphology(× 200)Note:Fig.A shows the first generation of bone marrow mesenchymal stem cell morphology;Fig.B shows the third generation of bone marrow mesenchymal stem cell morphology.
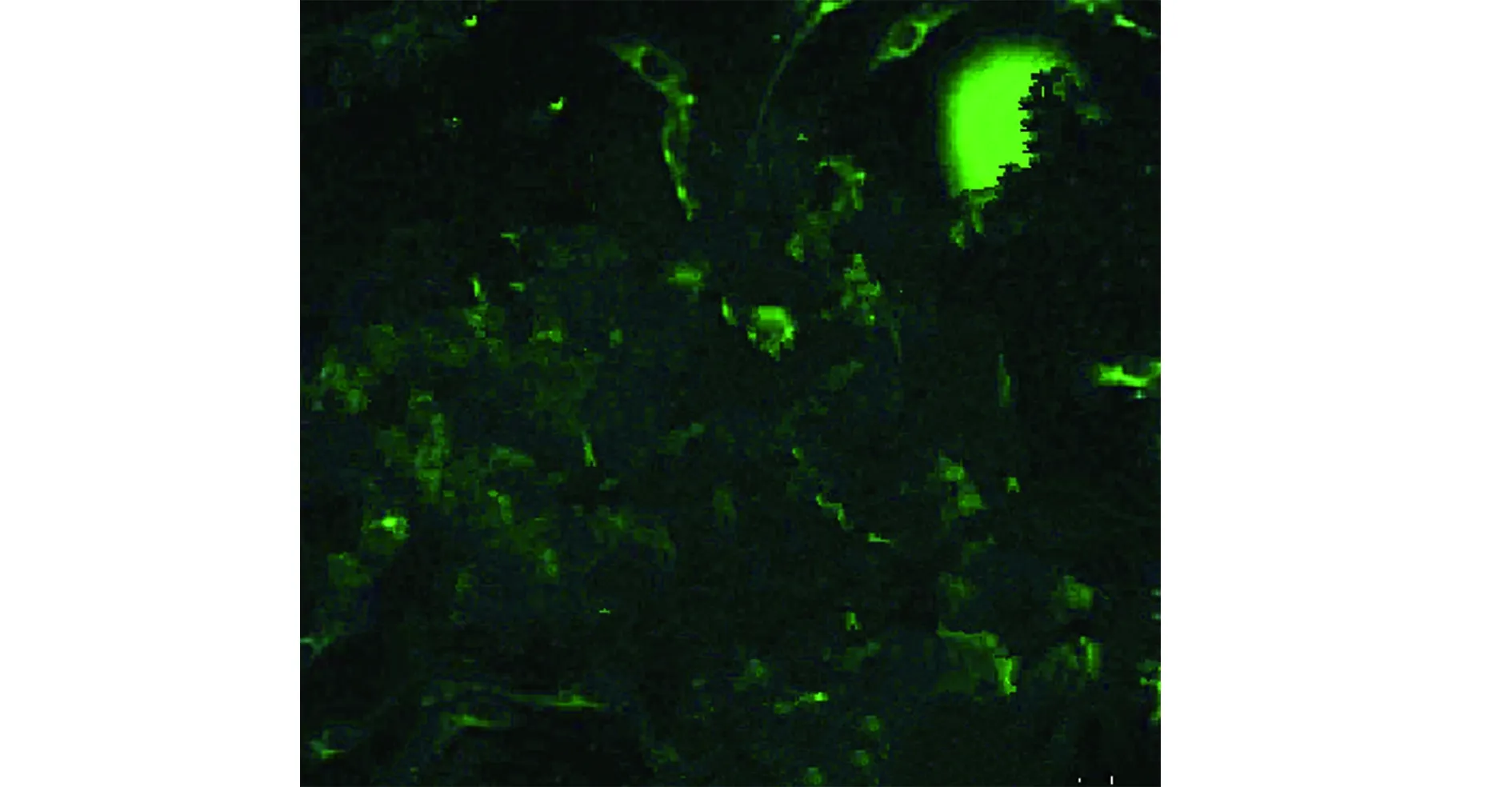
图2 骨髓间充质干细胞荧光显微镜观察(×400)Fig.2 Fluorescence microscopy of bone marrow mesen-chymal stem cells(× 400)Note:Most of the area in the figure is covered by blue fluorescence.
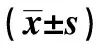

Groupsn1month2months3monthsObservationgroup20231±0891)2)184±0731)2)084±0211)2)Controlgroup20302±094231±084155±034Modelgroup20304±096233±085157±036
Note:Compared with the control group,1)P<0.05;compared with the model group,2)P<0.05.
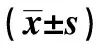
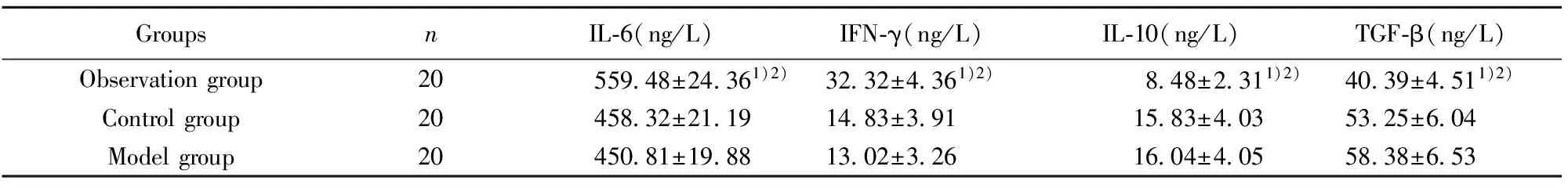
GroupsnIL⁃6(ng/L)IFN⁃γ(ng/L)IL⁃10(ng/L)TGF⁃β(ng/L)Observationgroup2055948±24361)2)3232±4361)2)848±2311)2)4039±4511)2)Controlgroup2045832±21191483±3911583±4035325±604Modelgroup2045081±19881302±3261604±4055838±653
Note:Compared with the control group,1)P<0.05;compared with the model group,2)P<0.05.
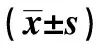


Groupsn1month2months3monthsObservationgroup20746±4351)2)1325±4621)2)1683±4711)2)Controlgroup20542±231894±3471093±404Modelgroup20541±229893±3411089±401
Note:Compared with the control group,1)P<0.05;compared with the model group,2)P<0.05.
2.6三组大鼠治疗后不同时间点免疫水平比较 三组大鼠治疗后免疫水平均得到明显提高;对照组与模型组免疫水平比较差异无统计学意义(P>0.05);实验组大鼠治疗后1个月、2个月及3个月CD4+CD25+Tregs细胞占CD4+T细胞的百分比,高于对照组与模型组(P<0.05),见表3。
3 讨论
根据我国第三次全国死亡病因调查结果表明:脑血管疾病已经成为威胁我国居民健康的首要死亡原因,占死亡总数的22.45%,属于是一种单病种致死、致残率较高的疾病,严重影响我国居民健康及生活[21]。脑梗死占脑血管病的70.0%,且对于欧美发达国家甚至达到85.0%,因此,加强脑梗死的防治对改善预后具有重要的意义[22]。目前,临床上对于脑梗死以溶栓治疗为主,该方案虽然能延缓疾病发展,但是治疗时间窗过短,符合溶栓治疗适应证患者相对较少,治疗时容易增加颅内出血风险[23]。
干细胞可以分为胚胎干细胞与成体干细胞两种[24]。胚胎干细胞属于是一种高度未分化的细胞,具备发育全能性,能分化出所有成体动物的组织、器官。而成体干细胞则具备与胚胎干细胞相类似的分化能力。骨髓间充质干细胞由于特性相对稳定,来源充足,易于冷冻保存及体外扩增,细胞具备较强的自我更新、多向分化潜能,能分泌大量生长因子,有助于促进血管的生成和再生[25]。因此,骨髓间充质干细胞属于组织工程中离心的“种子细胞”。本课题中,采用贴壁法能完成大鼠骨髓间充质干细胞分离制备,结果表明:倒置显微镜下第3天第1代骨髓间充质干细胞体积增大,呈多角形或长梭形,细胞开始聚集,第3代细胞迅速增殖,排列具有一定的方向性,呈旋涡状生长,并且具有多层,界限不清;荧光显微镜观察结果表明:获得细胞中99%被荧光标记,获得的细胞为骨髓间充质干细胞。提示采用贴壁法能实现对大鼠骨髓间充质干细胞的分离、提取和制定,并且经过对细胞鉴定后看出:制备培养的细胞为骨髓间充质干细胞,能为后续试验的顺利开展奠定基础。国外学者研究表明:骨髓间充质干细胞对于脑梗死具有神经保护作用,有助于提高机体免疫,降低炎症因子水平[26]。因此,本课题中以大鼠作为研究对象,利用改良Zea-longa线栓法阻断大脑中动脉成功构建实验性大鼠缺血性脑梗死模型,该建模方法相对简单,能获得较高的成功率,并且建模对于实验室仪器要求较低。
本课题中,将分离制备的骨髓间充质干细胞抑制到实验性脑梗死大鼠中,以PBS及模型组进行对比,结果表明:实验组治疗后1个月、2个月及3个月神经功能评分,低于对照组与模型组(P<0.05)。提示骨髓间充质干细胞的使用有助于改善大鼠神经功能。骨髓间充质干细胞用于实验性大鼠缺血性脑梗死模型中机制如下:(1)骨髓间充质干细胞的移植能促进神经功能再生,能维持缺血神经细胞的存活,从而促进神经功能缺损的恢复。国内学者试验表明:脑缺血模型大鼠移植骨髓间充质干细胞后在血清中存在诸多促进神经修复的再生细胞因子,利于大鼠神经功能缺损的修复[27]。(2)骨髓间充质干细胞的移植有助于促进血管的再生,能提高内源性血管生成因子的表达,从而提高血管内皮细胞的增生,缓解脑局部缺血、缺氧[28];(3)脑梗死大鼠建模后神经元细胞通过缺血后再灌注方式发生凋亡,而骨髓间充质干细胞的抑制则能延缓凋亡的周期,缓解氧化应激引起的自由基损伤[29]。(4)脑梗死的发生、发展属于是一个多因素过程,涉及免疫炎症反应,该反应是由于浸润的免疫细胞、巨噬细胞、T淋巴细胞共同作用引起,能产生炎症介质及细胞因子,包括:IL-6、IFN-γ、IL-10及TGF-β等,而移植骨髓间充质干细胞则能减少由于脑梗死引起的炎症因子,有助于调节机体免疫,减轻局部免疫炎症反应,利于神经功能早期恢复[30]。本研究中,实验组治疗后3个月IL-6、IFN-γ水平,高于对照组(P<0.05);实验组治疗后3个月IL-10及TGF-β水平,低于对照组(P<0.05);实验组大鼠治疗后1个月、2个月及3个月CD4+CD25+Tregs细胞占CD4+T细胞的百分比,高于对照组与模型组(P<0.05)。提示:骨髓间充质干细胞的抑制有助于降低炎症反应,提高神经功能恢复。目前普遍认为,脑梗死后由浸润的免疫细胞、巨噬细胞、T淋巴细胞等触发的免疫炎性反应,而氧化应激、程序性细胞死亡等在缺血性脑梗死中均发挥重要作用。而骨髓间充质干细胞移植则能促进促炎细胞因子的释放,能减轻缺血再灌注损伤,发挥移植免疫性炎性反应作用,促进神经功能恢复。Treg细胞是T淋巴细胞的一个子集,有特殊的免疫调制机制,在免疫应答中发挥了重要的作用,能维持自身免疫稳态、防止自身免疫疾病的发生。CD4+CD25+Tregs属于是重要的CD4+细胞亚群,能表达CD25及特异性核内转录因子,有效地抑制免疫炎性反应,从而产生免疫耐受。骨髓间充质干细胞的移植则能有效地改善脑梗死引起的脑损伤,有助于调节机体免疫。
综上所述,利用改良Zea-longa线栓法阻断大脑中动脉成功构建实验性大鼠缺血性脑梗死模型,采用贴壁法能完成大鼠骨髓间充质干细胞分离制备,移植骨髓间充质干细胞有助于调节大鼠免疫,降低炎症因子水平,能为脑梗死治疗提供思路。
参考文献:
[1] 李晨光,阙嘉丽,刘可嘉,等.Netrin-1对大鼠实验性脑梗死后同侧丘脑血脑屏障保护作用[J].中国神经精神疾病杂志,2017,43(03):141-146.
Li CG,Zhai JL,Liu KJ,etal.The protective effect of Netrin-1 on thalamus cerebral blood barrier after experimental cerebral infarction in rats[J].Chin J Nervous Mental Dis,2017,43(03):141-146.
[2] 陈 佳,梁燕玲,郑 翾,等.超声介导微泡携带激肽原酶靶向治疗技术对实验性急性脑梗死后神经再生及血管新生的影响[J].中华神经科杂志,2015,48(1):55-60.
Chen J,Liang YL,Zheng Z,etal.Effects of ultrasound-mediated microbubble-targeted therapy with kallikrein on neuroregeneration and angiogenesis after experimental acute cerebral infarction[J].Chin J Neurol,2015,48 (1):55-60.
[3] Panahpour H,Golmohammadi M,Mohamadnejad S.Effects of the treatment with nigella sativa oil on brain injury and edema in experimental model of stroke in rats[J].Behavioural Pharma,2015,16(3):56-61.
[4] 孙晶晶,宋乃光,张耀龙,等.高压氧治疗促进脑梗死模型大鼠神经再生微环境及神经功能的恢复[J].中国组织工程研究,2015,19(40):6460-6464.
Sun JJ,Song NG,Zhang YL,etal.Hyperbaric oxygenation promotes the recovery of neural regeneration microenvironment and neurological function in rats with cerebral infarction[J].J Chin Organizational Engineering Res ,2015,19(40):6460-6464.
[5] 王 芳,汤永红,杨 科,等.骨髓间充质干细胞移植对大鼠脑缺血损伤和IL-10、TGF-β1表达的影响[J].中国动脉硬化杂志,2016,24(8):788-792.
Wang F,Tong YH,Yang K,etal.Effect of bone marrow mesenchymal stem cell transplantation on cerebral ischemic injury and expression of IL-10 and TGF-β1 in rats[J].Chin J Arteriosclerosis,2016,24(8): 788-792.
[6] 郭淑娟,王琮民.局灶性脑缺血再灌注大鼠脑损伤与半暗带锌离子水平的关系研究[J].重庆医学,2016,45(15):2055-2057.
Guo SJ,Wang XM.Relationship between brain injury and penumbra zinc level in focal cerebral ischemia-reperfusion rats[J].Chongqing Med J ,2016,45(15):2055-2057.
[7] Bleilevens C,Roehl AB,Zoremba N,etal.Insular infarct size but not levosimendan influenced myocardial injury triggered by cerebral ischemia in rats[J].Exp Brain Res,2015,233(1):149-156.
[8] 孙而艺,张 旋,杨 阳,等.二十二碳六烯酸诱导细胞自噬减轻缺血性脑卒中神经损伤[J].第三军医大学学报,2017,39(14):1452-1457.
Sun EY,Zhang X,Yang Y,etal.Docosahexaenoic acid-induced autophagy in reducing ischemic stroke neurological injury[J].Third Military Med Univ,2017,39(14):1452-1457.
[9] 阮名花,邹赢锌,栾 洁,等.核黄素抑制大鼠缺血性脑损伤[J].中国药理学通报,2016,32(8):1115-1121.
Ruan MH,Zou YX,Yu J,etal.Riboflavin inhibits ischemic brain injury in rats[J].Chin Pharmacologl Bulletin,2016,32(8):1115-1121.
[10] Camposmartorell M,Canosarabia M,Simats A,etal.Charge effect of a liposomal delivery system encapsulating simvastatin to treat experimental ischemic stroke in rats[J].Int J Nanomed,2016,11(default):3035-3048.
[11] 王玉凯,任 丽,黄铭娜,等.电针治疗大鼠急性缺血性脑损伤的作用机制[J].中华物理医学与康复杂志,2015,37(4):247-251.
Wang YK,Ren L,Huang MN,etal.Effects of electroacupuncture on acute ischemic brain injury in rats[J].Chin J Physical Med Rehabil,2015,37(4):247-251.
[12] 何 坚,黄紫妍,陈伟标,等.电针抑制局灶性脑缺血损伤大鼠皮质细胞自噬的实验研究[J].中国康复医学杂志,2015,30(12):1203-1207.
He J,Huang ZX,Chen WB,etal.Effects of electroacupuncture on autophagy of cortical cells in focal cerebral ischemic injury rats[J].Chin J Rehabil Med,2015,30(12):1203-1207.
[13] 赵 梅,郭振丰,李天时,等.丹参酮ⅡA对大鼠实验性心肌梗死心律失常机制研究[J].中国医院药学杂志,2016,36(17):1452-1455.
Zhao M,Guo ZF,Li TS,etal.Mechanism of arrhythmia induced by tanshinone IIA in experimental myocardial infarction in rats[J].Chin J Hospital Pharmacy,2016,36(17):1452-1455.
[14] Camposmartorell M,Canosarabia M,Simats A,etal.Charge effect of a liposomal delivery system encapsulating simvastatin to treat experimental ischemic stroke in rats[J].Int J Nanomed,2016,11(default):3035-3048.
[15] 李 丽,王林萍.鸡血藤总黄酮对大鼠急性心肌缺血的保护作用[J].中成药,2015,37(10):2303-2306.
Li L,Wang LP.Protective effects of total flavonoids from Spatholobus suberectus on acute myocardial ischemia in rats[J].Chin Tradition Patent Med,2015,37(10):2303-2306.
[16] 吴 琼,蔡智慧,王振全,等.美满霉素联合栀子苷对大鼠局灶性脑缺血再灌注损伤的保护作用[J].解剖学杂志,2017,40(3):283-285.
Wu Q,Cai ZH,Wang ZQ,etal.Protection of minocycline combined with geniposide on focal cerebral ischemia-reperfusion injury in rats[J].Chin J Anatomy,2017,40(3):283-285.
[17] Gory B,Chauveau F,Bolbos R,etal.Spatiotemporal characterization of brain infarction by sequential multimodal MR imaging following transient focal ischemia in a Rat model of intra-arterial middle cerebral artery occlusion[J].Eur Rad,2016,26(12):1-10.
[18] 包新杰,李雪元,左赋兴,等.稳定的大鼠大脑中动脉栓塞脑梗死模型的建立[J].中国实验动物学报,2016,24(4):395-398.
Bao XJ,Li XY,Zuo FX,etal.Establishment of stable cerebral infarction model for middle cerebral artery occlusion in rats[J].Chin J Lab Animals,2016,24(4):395-398.
[19] 姜 炎,连亚军.鼠神经生长因子对急性脑梗死大鼠炎性因子与神经功能的影响[J].中华实验外科杂志,2016,33(7):1819-1821.
Jiang Y,Lian JJ.Effect of murine nerve growth factor on inflammatory factors and neurological function in rats with acute cerebral infarction[J].Chin J Exp Surg,2016,33(7):1819-1821.
[20] Cao XL,Du J,Zhang Y,etal.Hyperlipidemia exacerbates cerebral injury through oxidative stress,inflammation and neuronal apoptosis in MCAO/reperfusion rats[J].Exp Brain Res,2015,233(10):2753.
[21] 刘慧影,王鹏琴,边 颖,等.眼针干预脑缺血再灌注模型大鼠神经功能及相关神经营养因子的表达[J].中国组织工程研究,2016,20(18):2634-2641.
Liu HY,Wang PQ,Bian Y,etal.Effects of ocular acupuncture on neurological function and related neurotrophic factor expression in rat model of cerebral ischemia-reperfusion[J].J Chin Organizational Engineer Res,2016,20(18):2634-2641.
[22] 石秋艳,陈 历,刘爱东,等.观察远隔肢体缺血对大鼠急性脑梗死再灌注损伤的保护效应及其机制的探讨[J].现代预防医学,2015,42(11):2042-2044.
Shi QY,Chen L,Liu AD,etal..Protective effects and mechanisms of distal limb ischemia on acute cerebral infarction reperfusion injury in rats[J].Modern Prevent Med,2015,42(11):2042-2044 .
[23] Sang H,Liu L,Wang L,etal.Opposite roles of bradykinin B1 and B2 receptors during cerebral ischaemia-reperfusion injury in experimental diabetic rats[J].Eur J Neurosci,2016,43(1):53.
[24] 王钰莹,粟 旭,刘 波,等.人羊膜间充质干细胞原位移植治疗大鼠脑梗死[J].中国组织工程研究,2017,21(09):1414-1419.
Wang YY,Su X,Liu B,etal.Treatment of cerebral infarction in rats with orthotopic transplantation of human amniotic mesenchymal stem cells[J].J Chin Organizational Engineering Res,2017,21(9):1414-1419.
[25] 林亚南,程敬亮,张 勇,等.大鼠脑梗死后交叉性小脑神经机能联系不能的DTI评价[J].中国临床医学影像杂志,2017,28(4):240-244.
Lin YN,Cheng JL,Zhang Y,etal.DTI evaluation of cross-cerebellar cerebellar neuropathia after cerebral infarction in rats[J].Chin J Clin Med Imag,2017,28(4):240-244.
[26] Sun S,Chen X,Yang G,etal.Mn-SOD upregulation by electroacupuncture attenuates ischemic oxidative damage via CB1R-Mediated STAT3 phosphorylation[J].Mol Neurobiol,2016,53(1):331.
[27] 路 芳,莫林宏,王 奕.探索学习环境对脑梗死模型大鼠神经功能改善作用的实验研究[J].中国康复医学杂志,2016,31(6):637-640.
Lu F,Mo LH,Wang Y,etal.An experimental of the effect of exploring learning enviroment on neurofunction of cerebral infarction rats[J].Chin J Rehabil Med,2016,31(6):637-640.
[28] Liu C,Dong Z,Xu L,etal.MR image features predicting hemorrhagic transformation in acute cerebral infarction:a multimodal study[J].Neuroradiology,2015,57(11):1145-1152.
[29] 杨霄鹏,闫莹莹,王一凡,等.丁苯酞对局灶性脑梗死大鼠氧化应激及内皮型一氧化氮合酶脱耦联的影响[J].中华实验外科杂志,2015,32(10):2459-2461.
Yang XP,Yan YY,Wang YF,etal.Effect of butylphthalide on oxidative stress and endothelial nitric oxide synthase decoupling of rats with focal cerebral ischemia[J].Chin J Clin Med Imag,2015,32(10):2459-2461.
[30] 陈龙华.磁共振成像观察SPIO标记脂肪干细胞在脑梗死大鼠脑内的迁徙和分布[J].中国组织工程研究,2016,20(6):793-798.
Chen LH.MRI imaging of the migration and distribution of SPIO-labeled adipose-derived stem cells in brain of rats with cerebral infarction[J].J Chin Organizational Engineer Res,2016,20(6):793-798.