GC-MS法测定甲磺酸萘莫司他中的甲磺酸甲酯与甲磺酸乙酯
2018-05-24郭彦飞黄志勇
曹 卫,郭彦飞,黄志勇
(南京海融医药科技股份有限公司,江苏 南京 211100)
甲磺酸萘莫司他(NafamostatMesilate),化学名为对-胍基苯甲酸6-脒基-2-萘酯二甲磺酸盐,适用于急性胰腺炎、慢性胰腺炎的急性恶化、手术后急性胰腺炎、胰管造影后的急性胰腺炎与外伤性胰腺炎急性炎症的改善,由日本鸟居药品株式会社研发并于1986年在日本首次上市[1]。目前该药国内未上市,尚处于仿制申报阶段。
甲磺酸萘莫司他为甲磺酸盐,合成过程中使用了甲醇和乙醇[2],甲醇和乙醇易和甲磺酸盐生成具有遗传毒性的甲磺酸甲酯(MMS)和甲磺酸乙酯(EMS)这两种杂质。一些甲磺酸酯的临床前研究发现这些甲磺酸酯可直接与生物大分子(DNAs,RNAs和蛋白质)发生烷基化反应,可能会导致DNA突变,致癌效应和致畸效应[3]。近年来,欧洲药物管理局(EMEA)和美国食品药品监督管理局(FDA)陆续发布了遗传毒性杂质控制的相关法规,提出了采用“毒理学关注阈值”(Threshold of Toxicological Concern,TTC)[4-5],具体含义为:一个“1.5μg/d”的TTC值,即相当于每天摄入1.5μg的基因毒性杂质,被认为对于大多数药品来说是可以接受的风险(一生中致癌的风险小于十万分之一),按照这个阀值,可以根据预期的每日摄入量计算出活性药物中可接受的杂质水平。
因甲磺酸酯类的杂质限度要求较低,通常的色谱分析方法会面临检测灵敏度不够、样品基质干扰以及样品中的甲磺酸与醇类流动相反应生成磺酸酯干扰测定等问题,故本次实验笔者参考《欧洲药典》EP9.0中关于甲磺酸盐中对甲磺酸甲酯、乙酯的测定方法(2.5.37.Methy,Ethyl and Isopropyl Methanesulfonate in Methanesulfonic Acid[6]),采用二氯甲烷萃取技术与GC-MS联用,对上述两种物质进行研究。
1 仪器与试药
GC-MS2010plus气质联用色谱仪,日本Shimadzu公司;BT125D分析天平,德国赛多利斯公司;HP-5毛细管柱(30 m×0.32 mm×0.25μm),美国安捷伦公司;甲磺酸甲酯(批号:LS20P45,纯度99%),甲磺酸乙酯(批号:L680O91,纯度98.5%),甲磺酸异丙酯(批号:LC30P16,纯度97%),北京百灵威科技有限公司;色谱级二氯甲烷;分析级无水硫酸钠;甲磺酸萘莫司他原料(批号:170401、170402、170403),南京海融医药科技股份有限公司。
2 方法与结果
2.1 溶液配制
内标溶液:称取甲磺酸异丙酯约12.5 mg,置50 mL量瓶中,用二氯甲烷溶解并稀释至刻度,取该溶液1.0 mL,置100 mL量瓶中,二氯甲烷稀释至刻度(2.5μg/mL),取该溶液10.0 mL,置100 mL量瓶中,二氯甲烷稀释至刻度,摇匀,即得。
供试品溶液:精密称取样品0.2 g,加2 mL水溶解后,加2 mL内标溶液提取,分离和转移有机层至约含0.2g无水硫酸钠的小瓶中,过滤,取续滤液,即得。
对照品溶液:精密称取甲磺酸甲酯、甲磺酸乙酯各约12.5 mg,分别置50 mL量瓶中,用二氯甲烷溶解并稀释至刻度(250μg/mL),取该溶液1.0 mL,分别置100 mL量瓶中,用二氯甲烷稀释至刻度(2.5μg/mL),分别取上述两溶液1.0 mL和浓度为2.5μg/mL的内标溶液1.0 mL,置同一10 mL量瓶中,用二氯甲烷稀释至刻度,摇匀,即得。
定位溶液:分别取甲磺酸甲酯、甲磺酸乙酯、甲磺酸异丙酯浓度均为2.5μg/mL的溶液各1 mL,分别置10 mL量瓶中,用二氯甲烷稀释至刻度,作为定位溶液。
2.2 色谱条件
色谱条件:载气为高纯氦气;柱流量:1.5 mL/min;分流比为2∶1;进样量1μL;采用程序升温,起始柱温45℃,保持1min,再以10℃/min,升到135℃,维持2min;进样口温度为240℃。
质谱条件:离子源温度为230℃;接口温度为260℃;溶剂延迟时间:2.5min;检测器电压:调谐电压;电子能量:70eV;扫描(检测)方式:选择性离子检测(SIM)。甲磺酸甲酯、乙酯、异丙酯m/z的为80、79和123。
2.3 系统适用性试验
分别取空白溶液(二氯甲烷)和“2.1”项下的对照品溶液各1.0μL注入气质联用色谱仪,按“2.2”项下的GC-MS条件进行检测,记录色谱图,结果各杂质峰分离均大于1.5,空白溶剂不干扰测定。对照品色谱图见图1。
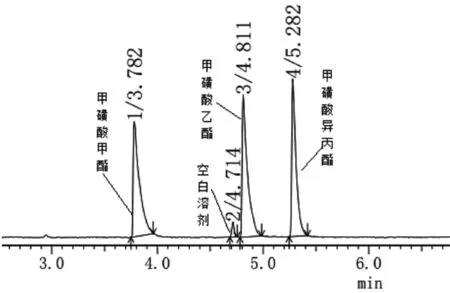
图1 对照品溶液色谱图
2.4 线性试验
精密称取甲磺酸甲酯和甲磺酸乙酯各适量,加二氯甲烷溶解并稀释制成每1mL中各约含0.5μg/mL的溶液,作为混合对照品溶液;精密量取混合对照品溶液0.2、0.5、1.0、3.0、5、8mL分别置10mL量瓶中,各加浓度为2.5μg/mL内标溶液1mL后,用二氯甲烷稀释至刻度,摇匀,制得浓度分别为0.01、0.025、0.05、0.15、0.25、0.4μg/mL的溶液,作为线性考察溶液(1)~(6);取溶液(1)~(6),按“2.2”项下的GC-MS条件进行检测,记录色谱图。以各成分的浓度为横坐标,杂质峰面积与内标峰面积比为纵坐标进行线性回归,得甲磺酸甲酯的回归方程为y=3.4022x-0.0065(r=0.9999),甲磺酸乙酯的回归方程为y=3.2865x+0.0025(r=0.9999)。结果表明,甲磺酸甲酯和甲磺酸乙酯在0.01~0.4μg/mL的浓度范围内呈良好的线性关系。
2.5 精密度试验
取“2.4”项下的线性考察溶液(5)1.0μL,照“2.2”项下的GC-MS条件,连续进样5次,记录峰面积,结果,甲磺酸甲酯峰与甲磺酸异丙酯(内标)峰面积比的RSD为1.3%,甲磺酸乙酯峰与甲磺酸异丙酯(内标)峰面积比的RSD为3.7%,表明仪器精密度良好。
2.6 检测限与定量限试验
根据标准曲线最低浓度峰的信号,取“2.1”项下各定位溶液,用二氯甲烷逐级稀释后,照“2.2”项下的GC-MS条件进样检测,测得各杂质的检测限(S/N≥3)和定量限(S/N≥10)。结果,甲磺酸甲酯与甲磺酸乙酯的检测限分别为5 ng/mL和3ng/mL,定量限分别为14.8ng/mL和7.5ng/mL。
2.7 重复性试验
取原料(批号170401)0.2g,精密称定,按“2.1”项下供试品溶液配置方法进行配制,共配制6份,照“2.2”项下的GC-MS条件进样检测,记录色谱图,结果,样品中均未检测出甲磺酸甲酯和甲磺酸乙酯。
2.8 加样回收试验
取浓度为25μg/mL的甲磺酸甲酯、甲磺酸乙酯溶液各0.8mL置同一100mL量瓶中,加入25μg/mL的内标溶液1.0mL,在室温下挥去二氯甲烷后,用水溶解并稀释至刻度,得80%回收率储备液;另同法制备100%和120%的回收率储备液。取原料(批号170401)0.2g,9份,精密称定,分别加入80%、100%、120%回收率贮备液各2 mL(各三份),超声使溶解,加2 mL二氯甲烷萃取,取下层有机相,各加入约0.2g的无水硫酸钠,过滤,取续滤液作为供试品溶液,照“2.2”项下的GC-MS条件进样检测,记录色谱图,结果,甲磺酸甲酯和甲磺酸乙酯的平均回收率(n=3)分别为90.2%和97.0%,RSD分别为1.5%和6.1%。表明该方法回收率良好。
2.9 样品测定
取3批原料各适量,精密称定,按“2.1”项下供试品溶液配置方法进行配制,照“2.2”项下的GC-MS条件进样检测,记录色谱图,结果,3批样品均未检出甲磺酸甲酯和甲磺酸乙酯。
3 讨论
3.1 限度的确定
甲磺酸萘莫司他的每日最大日使用量为600 mg,按TTC值为1.5μg/d,用1.5μg除以日最大剂量600 mg,即甲磺酸萘莫司中甲磺酸甲酯和甲磺酸乙酯不得过2.5μg/g,按此限度进行方法学验证,本试验的限度保证了甲磺酸萘莫司他的用药安全。
3.2 气相色谱条件的选择与优化
因本品配制过程中需要用到提取分离,为消除由操作条件的波动而对分析结果产生的影响,提高分析结果的准确度,固在检测过程中加入内标物质,EP9.0中关于甲磺酸盐中对甲磺酸甲酯、乙酯、异丙酯的测定方法中采用甲磺酸丁酯作为内标物质,因本品工艺过程中未使用异丙酯,固本次实验将甲磺酸异丙酯作为内标物质。
由于甲磺酸萘莫司他在水中易溶,因此采用水使样品溶解后,再用含甲磺酸异丙酯的二氯甲烷溶液将样品中存在的甲磺酸甲酯、甲磺酸乙酯提取出来。
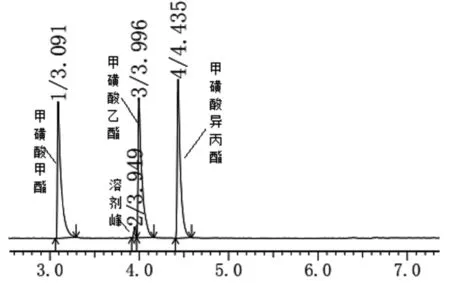
图2 二氯甲烷干扰色谱图
参照EP9.0中关于甲磺酸盐中对甲磺酸甲酯、乙酯、异丙酯的测定方法,升温程序为起始柱温55℃,保持1min,再以10℃/min,升到135℃,维持2min;进样口温度为240℃时,各杂质峰分离均较好,但二氯甲烷对甲磺酸乙酯有干扰,色谱图见图2。故在此升温程序的基础上微调升温程序,最终溶剂峰不干扰杂质检测,各峰之间分离度均大于1.5。
参考文献
[1] 陆美贞.抗胰腺炎药甲磺酸萘莫司他[J].国外药学—合成药、生化药、制剂分册,1988,9(4):234-235.
[2]陈宝泉,赵煜松,欧阳杰,等.甲磺酸萘莫司他的合成[J].中国医药工业杂志,2007,38(8):545.
[3] Benigni R,Bossa C.Chanisms of Chemical carcinogenicity and mutagenicity:a review with implications for predictive toxicology[J].Chem Rev,2011,111( 4) :2507-2536.
[4]EMEA.Guidelines on the limits of genotoxic impurities[S].London:EMEA,2006.
[5]FDA.Guidance for industry: Genotoxic and carcinogenicimpurities in drug substances and products: recommended approaches[S].US:FDA,2008.
[6]European Pharmacopoeia 9.0,2.5.37.Methyl,ethyl and isopropyl methanesulfonate in methanesulfonic acid[S].EDQM,2017:176-177.
