传染性造血器官坏死症重组腺病毒载体的构建
2018-05-24李守湖范玉锋李宝玉吴鹏程胡永浩柳纪省
李守湖,范玉锋,高 欣,李宝玉,吴鹏程,胡永浩,柳纪省
(1 甘肃农业大学 动物医学院,甘肃 兰州 730070;2 兰州威特森生物科技有限公司,甘肃 兰州 730050;3 兰州市渔业技术推广中心,甘肃 兰州 730020)
传染性造血器官坏死症(infectious hematopoietic necrosis,IHN)是一种以引起鲑鳟鱼类肾脏和脾脏造血组织坏死为主要特征的高度接触性传染病[1-4]。IHN主要危害鱼苗和种鱼,发病鱼死亡率通常在90%以上,是鱼类口岸第一类检疫对象,被我国列为二类动物疫病[5]。IHN给北美、欧洲和亚洲等各国鲑鳟鱼养殖业造成了毁灭性的打击,严重阻碍了各国水产养殖业的发展[6-10]。我国于1990年在辽宁暴发IHN,死亡率近100%[5]。近年来,我国养鳟业发展迅速,因此深入研究IHN病原对于更好地防控此病具有重要的现实意义。其病原为传染性造血器官坏死症病毒(infectious hematopoietic necrosis virus,IHNV),是一种负链RNA病毒,隶属弹状病毒科诺拉弹状病毒属。IHNV长度约为11 kb,共编码5种结构蛋白和1种非结构蛋白,分别是核衣壳蛋白、磷酸化蛋白、基质蛋白、表面糖蛋白、聚合酶蛋白和非结构蛋白,其中表面糖蛋白(G)可诱导中和抗体的产生,通常用于IHNV DNA疫苗的研究[11-14]。
重组腺病毒载体作为一种宿主广泛、易于培养、转导效率高以及繁殖滴度高的理想基因转移系统,常被用于基因工程疫苗的接种、基因的转移等。在动物机体内外,可以通过构建重组腺病毒将特异性的外源靶基因转移到哺乳动物细胞系[15-16],进而获得高效目标蛋白[17],刺激机体产生强烈的体液和细胞免疫反应,是转导目的基因的理想工具之一[18]。本试验克隆了IHNVG基因,以腺病毒作为目的基因转移载体,构建表达IHNV G蛋白的重组腺病毒载体,旨在为IHN的预防及疫苗的研制提供参考。
1 材料与方法
1.1 材 料
1.1.1 病毒与细胞系 IHN阳性病料(肾脏、脾脏),采集自甘肃省永登县某虹鳟鱼养殖场;HEK-293细胞系,由中国农业科学院兰州兽医研究所草食动物病毒病团队提供。
1.1.2 质粒与感受态细胞 Pad-Track-CMV穿梭载体、pAd-easy-1骨架载体、DH5α感受态细胞、DH10B感受态细胞和BJ5183感受态细胞,均购自武汉金开瑞生物科技有限公司。
1.1.3 试 剂 RNA提取试剂盒、DNA提取试剂盒、Quick-Fusion快速克隆试剂盒、质粒提取试剂盒、DNA聚合酶和限制性内切酶,均购自美国纽英伦生物技术(NEB);RNA反转录试剂盒,购自德国罗氏公司(Roche);脂质体2000,购自美国英杰生命技术有限公司(Invitrogen)。其他化学试剂均购自美国SIGMA 生物科技有限公司。
1.2 IHNV G基因的扩增与RT-PCR
根据GenBank上发表的IHNVG基因序列(GenBank登录号:U50401.1),应用DNA Star设计G基因特异性引物,上游引物增加了同源序列和SalⅠ酶切位点:5′-ATCTCTAGACCATGGGTCGACGCCACCATGTACACCATG-3′,下游引物增加了同源序列和XhoⅠ酶切位点: 5′-TAGATCTTCGAATCCCTCGAGTTAGGACCGGTTTGCCAG-3′,序列中下划线部分为相应的酶切位点。引物由苏州金唯智生物科技有限公司完成,预期扩增序列长度为1 533 bp。
按照RNA提取试剂盒说明书提取IHN病料总RNA,以提取的RNA为模板,采用RNA反转录试剂盒进行反转录反应,合成cDNA,反转录反应体系20 μL:1 μg总RNA,2.5 μmol/L anchored-oligo(dT)18引物,10 U反转录酶,1×反转录酶buffer,20 U蛋白酶抑制剂,1 mmol/L脱氧核苷酸混合物,加ddH2O至总体系为20 μL;反应条件:65 ℃ 10 min,55 ℃ 30 min,85 ℃ 5 min。
以反转录合成的cDNA为模板进行PCR扩增。PCR反应体系:cDNA模板2 μL,GXL DNA聚合酶(1.25 U/μL)1 μL,5×GXL DNA buffer 10 μL,dNTP Mixture(200 μmol/L)4 μL,上、下游引物(10 μmol/L)各1.5 μL,加ddH2O至50 μL。反应条件:94 ℃ 2 min;98 ℃ 10 s,64 ℃ 30 s,72 ℃ 1 min,共31个循环;72 ℃延伸10 min。PCR产物用 1.5%琼脂糖凝胶电泳检测,同时设置空体系对照。PCR产物置于-20 ℃保存备用。
1.3 G基因的快速克隆和腺病毒载体的构建
将PCR产物电泳鉴定后切下目的片段,按照DNA胶回收试剂盒说明书回收和纯化目的片段,用SalⅠ和XhoⅠ双酶切腺病毒载体Pad-Track-CMV使之线性化。按照快速克隆试剂盒说明书,G基因的快速克隆体系为:PCR产物 40 ng,Pad-Track-CMV载体20 ng,1.0 μL快速克隆酶,10×快速克隆酶2.0 μL,加ddH2O至20 μL。反应条件:37 ℃水浴锅孵育30 min。反应结束后立即将连接产物转化至DH5α感受态细胞,涂布于含50 μg/mL卡那霉素的LB平板上,37 ℃培养12~16 h。挑取白色菌落培养后进行PCR鉴定,同时设空载体对照。对阳性培养物提取质粒,用SalⅠ和XhoⅠ进行双酶切鉴定,鉴定为阳性的质粒立即送往苏州金唯智生物科技有限公司测序。将测序结果在NCBI上进行同源性比对。
1.4 Pad-Track-CMV载体与pAd-easy-1骨架载体的同源重组
将pAd-easy-1骨架载体转化到BJ5183感受态细胞中,之后将带有pAd-easy-1骨架载体的BJ5183大肠杆菌细胞做成电转化感受态细胞,置于-80 ℃保存备用。
将1.3中鉴定合适的带有目的基因的腺病毒载体Pad-Track-CMV用PmeⅠ酶切线性化后,按照胶回收试剂盒说明书回收产物,再将10 μL线性化的重组腺病毒载体(1 μg)与40 μL 含有pAd-easy-1骨架载体的BJ5183电转化感受态细胞置于直径为2.0 mm的电转杯中进行电击。电击条件为:电压2 500 V,电阻200 Ω,电容25 μF,电击时间5 ms。将电击后的腺病毒重组质粒按照100,200,300,400 μL分别涂布于含100 μg/mL卡那霉素的LB平板上,37 ℃培养16~20 h。挑取培养平板上培养的较小菌落,提取质粒并进行PCR扩增,用0.8%琼脂糖凝胶电泳对PCR产物进行鉴定,对疑似阳性的质粒再用PacⅠ酶切鉴定,酶切体系为:1 μL限制性内切酶PacⅠ、5 μL 10×buffer、1 μg重组质粒,加ddH2O至50 μL;37 ℃作用4 h并用0.8%琼脂糖凝胶电泳鉴定。
通过与上述中相同的电击条件,将阳性重组腺病毒质粒转化到感受态细胞DH10B中,以获得高表达的重组质粒,并用限制性内切酶PacⅠ酶切鉴定。然后从大肠杆菌DH10B中大量提取重组腺病毒质粒,用PacⅠ消化以切除ori和卡那霉素抗性原件。
1.5 重组质粒转染HEK-293细胞
转染前24 h将HEK-293细胞以1.0×106mL-1的密度分散于25 cm2细胞培养瓶中,置于37 ℃培养箱中培养。将4 μg线性化重组质粒DNA加入460 μL F12-DMEM中制成悬浮液A,将20 μL脂质体2000加入到480 μL F12-DMEM中混匀制成悬浮液B,再将悬浮液A与悬浮液B混匀加入到培养好(汇合度达50%~70%)的HEK-293细胞中,置于37 ℃培养箱中培养4 h,补加细胞培养液后置于培养箱中继续培养。转染8 d后,通过监测绿色荧光蛋白(GFP)来确定转染的结果,待细胞出现绿色荧光时,弃去上层5 mL细胞培养液并收集下层培养液5 mL,收集的病毒液反复冻融2次后,在HEK-293细胞中复制,复制5代后对重组病毒中的糖蛋白进行Western-blot检测。
1.6 重组腺病毒糖蛋白表达的Western-blot检测
收集上述重组病毒液样品,同时取空白HEK-293细胞,加入RIPA蛋白裂解液于冰上裂解5 min,收集到EP管后进行超声破碎(40 W 3 s,间隔3 s,重复20次),然后于4 ℃下12 000 r/min离心5 min,取上清,加入蛋白上样缓冲液, 95 ℃作用10 min,制备样品。将蛋白样品加入SDS-PAGE孔中进行电泳,电泳条件:先在60 V电压下反应60 min,再将电压调到120 V直至结束。参考蛋白分子质量标准将电泳结束后的凝胶切下,以β-actin为内参,用PVDF膜进行200 mA 120 min的转膜操作。转膜结束后用50 g/L的牛血清白蛋白封闭1 h,用PBST洗3次,每次10 min;于封闭好的膜上加入1∶2 000倍稀释好的兔抗IgG孵育1 h,用PBST洗3次,每次10 min;小心取出膜置于稀释好的羊抗兔二抗中孵育2 h,用PBST洗3次,每次10 min,之后加入配好的显色液进行化学发光反应。
1.7 重组腺病毒半数组织细胞感染量(TCID50)的测定
将复制10代后收集的病毒按照10-1~10-12连续稀释成12个梯度,然后将稀释的病毒接种在培养好HEK-293细胞的96孔板中,每个稀释度重复8孔,每孔接种100 μL。每天观察细胞病变情况并记录结果,按照Reed-Muench法[19]计算病毒TCID50。
2 结果与分析
2.1 IHNV G基因的PCR扩增
将IHNVG基因的PCR产物加入1.5%琼脂糖凝胶中进行电泳,获得了长1 533 bp的片段(图1),与预期片段长度相符。
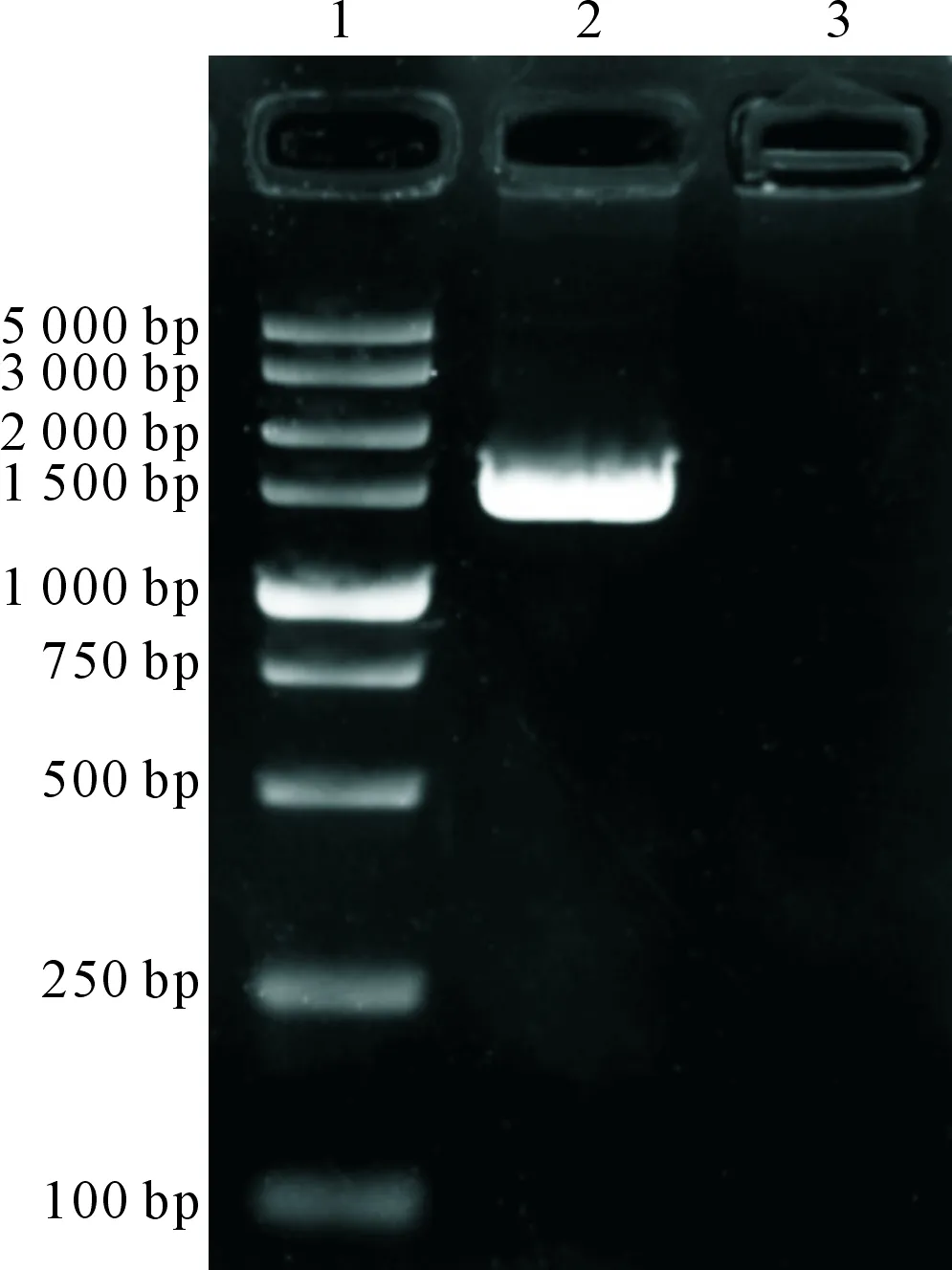
1.5 000 bp DNA Marker;2.G基因;3.空白对照1.5 000 bp DNA Marker;2.G gene;3.Blank control图1 IHNV G基因的PCR扩增Fig.1 PCR amplification product of IHNV with G gene
2.2 IHNV G基因重组载体Pad-Track-CMV的鉴定
IHNVG基因的重组腺病毒载体经PCR鉴定获得了1 533 bp的片段,经SalⅠ和XhoⅠ双酶切鉴定获得了1 533 bp和9 200 bp的片段(图2),均与预期结果一致。测序分析结果显示,本试验中G基因的开放阅读框(ORF)与IHNV ChYU78、ChAb76、KoMo71、RtNaq82和HV7601株的同源性为99%。结果表明,重组腺病毒载体Pad-Track-CMV构建成功。
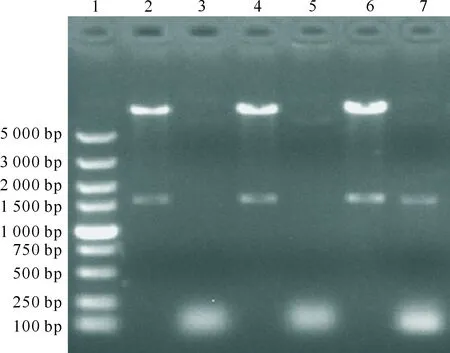
1.5 000 bp DNA Marker;2,4,6.SalⅠ和XhoⅠ双酶切产物;3,5.空载体PCR扩增产物;7.重组腺病毒载体PCR扩增产物1.5 000 bp DNA Marker;2,4,6.Products of recombinant plasmids by SalⅠand XhoⅠ;3,5.PCR amplification product of empty vector;7.PCR amplification products of recombinant plasmid 图2 IHNV G基因重组载体Pad-Track-CMV的PCR和SalⅠ/XhoⅠ双酶切鉴定Fig.2 Identification of recombinant Pad-Track-CMV vector by PCR and double digestionplasmids with Sal Ⅰ/Xho Ⅰ
2.3 IHNV G基因重组腺病毒质粒的鉴定
重组腺病毒质粒的PCR扩增和PacⅠ限制性内切酶的消化结果(图3)表明,PCR扩增获得了1 533 bp的片段,符合预期;PacⅠ内切酶消化获得了长约33和4.5 kb的2条清晰条带,与试验预期结果相符。由此得知重组腺病毒质粒构建成功。

1.G基因PCR扩增;2.内切酶PacⅠ消化结果;3.5 000 bp DNA Marker1.PCR amplification of G gene;2.Recombinant plasmids by PacⅠ;3.5 000 bp DNA Marker图3 IHNV G基因重组腺病毒质粒的鉴定Fig.3 Screening of recombinant adenovirus vector of IHNV with G gene
2.4 重组腺病毒糖蛋白表达的Western-blot
转染的重组腺病毒经HEK-293细胞复制5代后,以β-actin为内参,通过Western-blot分析糖蛋白表达情况,结果(图4)显示,相比空白HEK-293细胞,重组腺病毒在分子质量约58 ku处有蛋白条带,表明转染的重组腺病毒中糖蛋白能够表达。
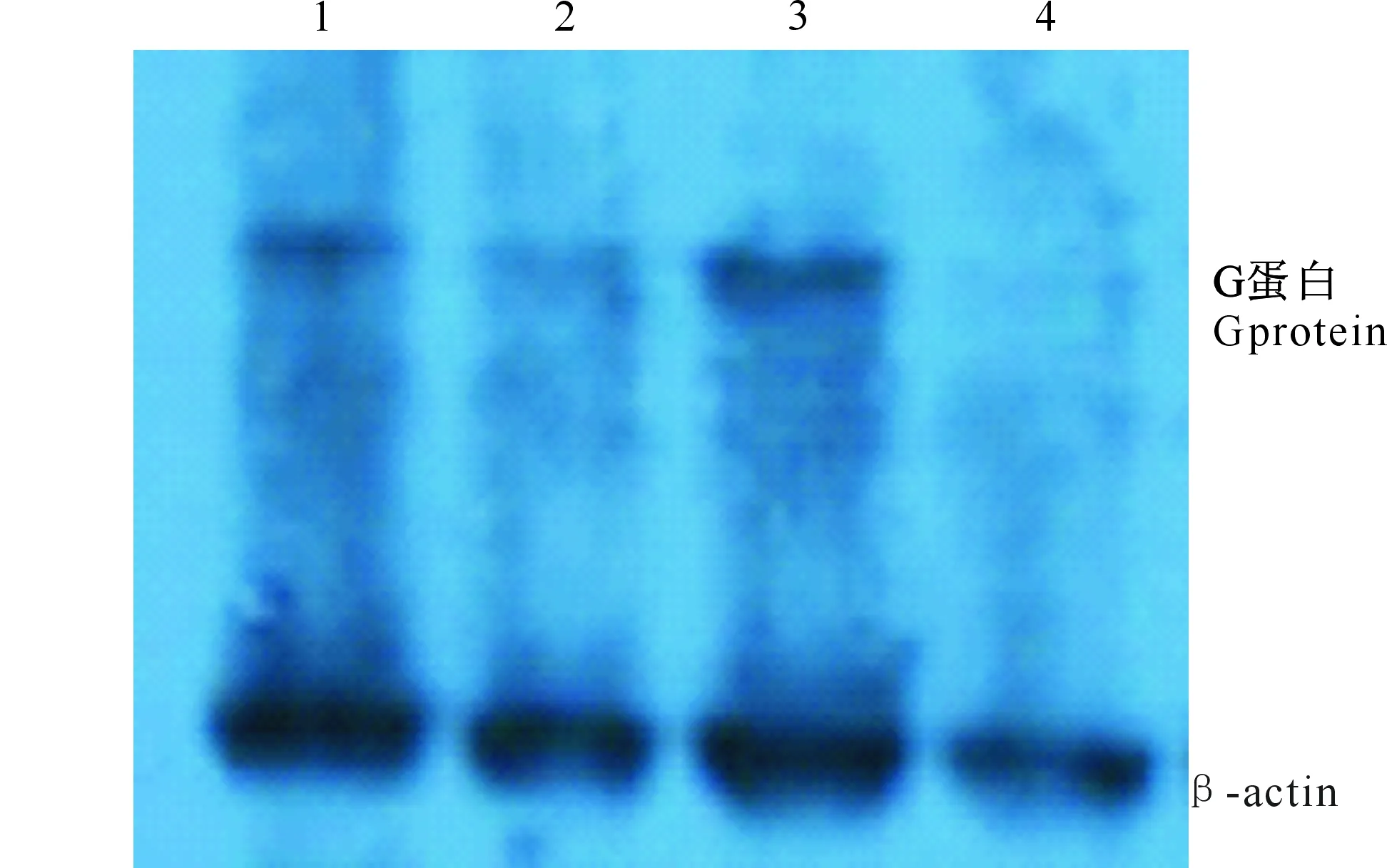
1,2,3.重组腺病毒糖蛋白;4.空白HEK-293细胞1,2,3.Expression of glycoprotein of the recombinant adenovirus;4.HEK-293 cells图4 重组腺病毒糖蛋白表达的Western-blot分析Fig.4 Western-blot analysis on expression of glycoprotein of the recombinant adenovirus
2.5 重组腺病毒的TCID50
转染重组腺病毒的HEK-293细胞第5 天时出现绿色荧光蛋白,第8天时有80%的细胞可以清楚观察到绿色荧光蛋白(图5)。根据Reed-Muench方法计算得知,重组腺病毒的TCID50为1.0×1010.4mL-1。

图5 重组腺病毒转染HEK-293细胞第8天后GFP的表达Fig.5 Expression GFP of the recombinant adenovirus 8 days after transfecting
3 讨 论
传染性造血器官坏死症(IHN)是一种主要危害鲑鳟鱼的病毒性疫病,其引发的极高死亡率给国内外冷水鱼养殖业造成了严重的经济损失[20-21]。我国自1990年辽宁发现IHN以来,该病的传播范围不断扩大。另外,我国对于IHN的研究相对落后,该病爆发基本无法控制,因此给鲑鳟鱼养殖业造成了严重的影响。疫苗免疫是目前防控该病的主要措施[22],因此研制IHN疫苗成为我国防控该病的重中之重。表面糖蛋白能够诱导中和抗体产生并刺激细胞免疫,在免疫保护机制中起着重要作用[23]。Kurath等[22]构建了IHNV pIHNw-G DNA疫苗,用其免疫虹鳟鱼苗3个月后可以检出中和抗体。本试验利用糖蛋白构建了重组腺病毒载体,通过测序分析得知,IHNV的G基因仍保留着关键抗原位点,未发生关键内氨基酸的突变。
重组腺病毒具有较高的转染效率,且不会整合到宿主基因组中,是用于动物体内和体外转染疫病靶基因的有效病毒载体之一。重组腺病毒在E3和E4中的突变,使得其与靶基因组可以通过包装病毒在HEK-293细胞中转染,由于转染高效、宿主广泛和病毒滴度较高,因此重组腺病毒载体被广泛应用于疫苗的研发[24-25]。与传统疫苗的研发相比,重组腺病毒良好的免疫原性及安全性,促使其广泛地成为建立疫苗平台的理想基因转移载体[26-27]。本研究首先运用快速克隆方法将IHNVG基因快速插入到Pad-Track-CMV载体中,代替了传统依靠T载体连接目的基因的复杂操作,提高了载体的构建效率。此外,同源重组在大肠杆菌内进行,比传统的细胞内重组效率更高,使得阳性质粒的筛选更为简便[28]。本研究首先用化学方法将pAd-easy-1骨架载体转入大肠杆菌BJ5183感受态细胞中,再将带有目的基因的腺病毒载体电转入感受态pAd easy-BJ5183中进行同源重组,相比于双质粒同时电转化至大肠杆菌BJ5183感受态细胞更为简便,显著提高了重组效率。另外,利用Pad-Track-CMV载体携带的GFP可直接观察到目的蛋白在细胞内的表达情况,使得观察转染成功与否更为简便。
综上所述,本研究利用重组腺病毒系统,通过在大肠杆菌中同源重组,成功构建了带有IHNVG基因的重组腺病毒,转染HEK-293细胞后,重组腺病毒能高效表达,且病毒滴度较高。糖蛋白在细胞中的高效表达,增加了鱼类免疫应答和体内抗体的产生可能,为研制IHN的针对性疫苗奠定了基础。
[参考文献]
[1] Kim K I,Cha S J,Lee C,et al.Genetic relatedness of infectious hematopoietic necrosis virus (IHNV) from cultured salmonids in Korea [J].Archives of Virology,2016,161(8):2305-2310.
[2] Jonstrup S P,Schuetze H,Kurath G,et al.An isolate and sequence database of infectious hematopoietic necrosis virus (IHNV) [J].Journal of Fish Disease,2010,33(6):469-471.
[3] Dixon P,Paley R,Alegria-Moran R,et al.Epidemiological characteristics of infectious hematopoietic necrosis virus (IHNV) [J].Veterinary Research,2016,47(1):63.
[4] Hattenberger A M,Danton M,Merle G,et al.Epidemiology of infectious hematopoietic necrosis (IHN) of salmonid fish in France:study of the course of natural infection by combined use of viral and seroneutralization test and eradication attempts [J].Veterinary Research,1995,26(4):256-275.
[5] Anderson E,Clouthier S,Shewmaker W,et al.Inactivated infectious hematopoietic necrosis virus (IHNV) vaccines [J].Journal of Fish Disease,2008,319(10):729-745.
[6] 吉尚雷,张培军,卢玉婷,等.传染性造血器官坏死病病毒CJ-13株糖蛋白的原核表达及免疫原性 [J].西北农林科技大学学报(自然科学版),2015,43(7):1-6.
Ji S L,Zhang P J,Lu Y T,et al.Prokaryotic expression and immunogenicity of glycoprotein gene of infectious hematopoietic necrosis virus (IHNV) CJ-13 strain [J].Journal of Northwest A&F University (Natural Science Edition),2015,43(7):1-6.
[7] Food and Agriculture Organisation.The state of world fisheries and aquaculture [M].Rome:Springer Netherlands,2012:261-294.
[8] Kurath G,Garver K A,Troyer R M,et al.Phylogeography of infectious hematopoietic necrosis virus in North America [J].The Journal of General Virology,2003,84(4):803-814.
[9] Enzmann P J,Castric J,Bovo G,et al.Evolution of infectious hematopoietic necrosis virus (IHNV),a fish rhabdovirus,in Europe over 20 years:implications for control [J].Diseases of Aquat Organ,2010,89(1):9-15.
[10] Adel M,Amiri A B,Dadar M,and et al.Phylogenetic relationships of Iranian infectious hematopoietic necrosis virus of rainbow trout (Oncorhynchusmykiss) based on the glycoprotein gene [J].Archives of Virology,2016,161(3):657-663.
[11] Nishizawa T,Kinoshita S,Kim W S,et al.Nucleotide diversity of Japanese isolates of infectious hematopoietic necrosis virus (IHNV) based on the glycoprotein gene [J].Dis Aquat Organ,2006,71(3):267-272.
[12] Morzunov S P,Winton J R,Nichol S T.The complete genome structure and phylogenetic relationship of infectious hematopoietic necrosis virus [J].Virus Res,1995,38(2):175-192.
[13] Jeon C H,Kim S R,Kim W S,et al.Monitoring of viruses in chum salmon (Oncorhynchusketa) migrating to Korea [J].Archives of Virology,2011,156(6):1025-1030.
[14] Kim W S,Nishizawa M J,Park J W,et al.Genotyping of Korean isolates of infectious hematopoietic necrosis virus (IHNV) based on the glycoprotein gene [J].Archives of Virology,2007,152(11):2119-2124.
[15] Kozarsky K F,Wilson J M.Gene therapy:adenovirus vectors [J].Curr Opin Genet Dev,1993,3:499-503.
[16] Benihoud K,Yeh P,Perricaudet M.Adenovirus vectors for gene delivery [J].Curr Opin Biotechnol,1999,10:440-447.
[17] Zou X,Xiao R,Guo X,et al.Preparation of recombinant human adenoviruses labeled with miniSOG [J].Chinese Journal of Virology,2016,32(1):32-38.
[18] Cao Y,Xu L,LaPatra S E,et al.The kinetics and protection of the antiviral state induced by recombinant IFN1a in rainbow trout against infectious hematopoietic necrosis virus [J].Molecular Immunology,2016,24:55-61.
[19] 杨海玉,马智龙.应用TCID50法比较4种细胞对呼吸道腺病毒的敏感性 [J].现代预防医学,2014,41(23):4345-4347.
Yang H Y,Ma Z L.Comparison on sensitivity of four cells to adenovirus in respiratory tract with TCID50 [J].Modern Preventive Medicine,2014,41(23):4345-4347.
[20] McKenney D G,Kurath G,Wargo A R.Characterization of infectious dose and lethal dose of two strains of infectious hematopoietic necrosis virus [J].Virus Research,2016,214:80-89.
[21] Kurath G,Garver K A,Corbeil S,et al.Protective immunity and lack of histopathological damage two years after DNA vaccination against infectious hematopoietic necrosis virus in trout [J].Vaccine,2006,24:345-354.
[22] Robison C S,Whitt M A.The membrane-proximal stem region of vesicular stomatitis virus G protein confers efficient virus assembly [J].Journal of Virology,2000,74(5):2239-2246.
[23] Lasaro M O,Ertl H C.New insights on adenovirus as vaccine vectors [J].Mol Ther,2009,17(8):1333-1339.
[24] Ammayappan A,Lapatra S E,Vakharia V N.A vaccinia-virus-free reverse genetics system for infectious hematopoietic necrosis virus [J].J Virol Methods,2010,167(2):132-139.
[25] Lorenza N,LaPatra S E.DNA vaccines for aquacultured fish [J].Rev Sci Tech,2005,24(1):201-213.
[26] Wang C,Lian G H,Zhao L L,et al.Virulence and serological studies of recombinant infectious hematopoietic necrosis virus (IHNV) in rainbow trout [J].Virus Research,2016,220:193-202.
[27] 陈邦党,马依彤,马 翔,等.人EPO基因重组腺病毒载体的构建及表达 [J].细胞与分子免疫学杂志,2010,26(3):223-226.
Chen B D,Ma Y T,Ma X,et al.Construction and expression of recombinant adenovirus vector of human EPO gene [J].Journal of Cellular and Molecular Immunology,2010,26(3):223-226.
