羽毛降解杆状链霉菌S-28遗传转化系统的建立与优化
2018-05-24张晋龙马怡茗舒伟学李晓霞贾良辉
张晋龙,马怡茗,舒伟学,李晓霞,柯 欣,颜 华,贾良辉
(西北农林科技大学 生命科学学院,陕西 杨凌 712100)
现代农业的发展促进了家禽养殖业的规模化生产,伴随而来的是家禽养殖场和屠宰场每年产生数千万吨的羽毛废弃物。羽毛废弃物的传统处理方法主要为填埋、焚烧,这不仅造成资源的巨大浪费,而且严重污染环境。禽类羽毛中蛋白含量极高,一般为75%~90%,而且氨基酸种类齐全,是具有较高营养价值的饲料蛋白资源。但由于禽类羽毛主要成分是角蛋白,性质极其稳定且含有丰富的二硫键,如未经处理,消化道常见酶类(胃蛋白酶、胰蛋白酶、木瓜蛋白酶等)很难将其降解[1-2]。近些年,利用微生物降解角蛋白废弃物引起了人们的广泛关注,是资源化利用羽毛废弃物的重要手段[3]。目前在细菌、真菌和放线菌中均已经发现了可以降解角蛋白的菌株,其中以芽胞杆菌属的细菌居多[4]。由于放线菌可以产生丰富的次级代谢产物,同时由于其生活史中营养菌丝的生长特点,使其更有利于侵入羽毛硬质角蛋白从而使角蛋白降解,所以羽毛降解放线菌的研究受到了越来越多的重视。
菌株S-28是由西北农林科技大学微生物资源研究室分离的1株能够高效降解羽毛的链霉菌,根据菌株的形态、生理生化特性及16S rDNA序列分析,确定其为杆状链霉菌(Streptomycesbacillaris)的一个菌株;除高效降解羽毛外,菌株S-28还对多种植物病原真菌有强烈的抑制效果;全基因组测序也表明,S-28含有丰富的次级代谢产物生物合成基因簇(未发表数据),具有较好的研究价值。目前,关于杆状链霉菌(Streptomycesbacillaris)的研究很少,且主要集中在其发酵条件优化及活性物质的分离方面。Hu等[5]从StreptomycesbacillarisSNB-019的发酵液中发现了新肽L-O-Lac-L-Val-D-O-Hiv-D-Val,该肽有抑制自噬作用,具有治疗肿瘤疾病的潜能。Jeng等[6]从20年普洱茶饼中分离鉴定了StreptomycesbacillarisR9菌株,发现其可以显著提高茶叶中多酚含量,减少DPPH(1,1-二苯基-2-三硝基苯肼)自由基。但关于杆状链霉菌遗传转化系统的研究尚未见报道。本研究尝试通过接合转移的方式将外源基因导入到杆状链霉菌(Streptomycesbacillaris) S-28,并对影响接合效率的培养基的种类、MgCl2浓度、热激温度、预萌发时间、供受体比例和接合转移时间等要素进行优化,为今后该菌株的遗传改造奠定基础。
1 材料与方法
1.1 供试材料
1.1.1 菌株与质粒 羽毛降解杆状链霉菌S-28菌株由西北农林科技大学微生物资源研究室分离保存;大肠杆菌(Escherichiacoli)S17-1为供体菌株;pSET152质粒为大肠杆菌-链霉菌穿梭整合型质粒,具有安普霉素抗性基因aac(3)IV及噬菌体φC31整合酶基因int的整合位点attp[7]。
1.1.2 培养基 大肠杆菌液体培养基为LB,链霉菌液体培养基为TSB[8]。链霉菌产孢培养基及接合转移培养基均为MS,孢子预萌发培养基为2×YT,具体配方参见链霉菌遗传操作手册[9]。
1.1.3 试 剂 抗生素红霉素(Ery)、卡那霉素(Kan)、安普霉素(Apr)和潮霉素(Hyg),其他生化试剂萘啶酮酸(Nal),均购自生工生物工程(上海)股份有限公司。
1.2 质粒及链霉菌基因组提取
大肠杆菌质粒提取基本操作参见文献[10]。链霉菌总DNA的提取参照链霉菌遗传操作手册[9]。
1.3 S-28菌株抗生素耐受性检测
选取安普霉素、卡那霉素、红霉素、潮霉素4种抗生素,分别加入MS培养基中,每种抗生素终质量浓度分别为0,5.0,10.0,20.0,50.0 μg/mL。划线接种野生型S-28,28 ℃黑暗培养6 d后观察结果。
1.4 大肠杆菌和杆状链霉菌S-28的接合转移
将整合型质粒pSET152用热激法转入大肠杆菌(Escherichiacoli)S17-1中,得到供体菌株S17-1/pSET152。挑取单菌落,接种于5 mL含有安普霉素50 μg/mL的LB液体培养基中,37 ℃培养过夜后,按1∶100的体积比转接到50 mL含有相同抗生素的新鲜LB液体培养基中,37 ℃培养至OD600为0.4~0.6时离心收集菌体,用等体积不含抗生素的新鲜LB培养基洗涤菌体3次,将菌体悬浮于500 μL不含抗生素的LB培养基中。
在长满杆状链霉菌S-28孢子的MS平板上,用接种环刮下孢子后接到含有玻璃珠的玻璃瓶中,手动或摇床振荡30 min,用脱脂棉过滤收集S-28孢子,然后将孢子悬浮于500 μL的2×YT培养基中,热激10 min后于37 ℃、150 r/min摇床中预萌发2.5 h。
将备用的大肠杆菌和预萌发好的链霉菌S-28孢子悬液按1∶1体积比混合,吸取100 μL涂布于接合培养基表面,28 ℃培养16~20 h后,用一定质量浓度Apr(≥10 μg/mL)和Nal(≥25 μg/mL)覆盖,28 ℃培养3~4 d后长出接合子。
1.5 接合转化子的PCR扩增反应验证
刮取S-28接合转化子的孢子接种到含有10 μg/mL安普霉素的TSB液体培养基中培养48 h,收集菌丝体,提取其总DNA作为模板。以野生型链霉菌S-28的总DNA为阴性对照,以pSET152质粒为阳性对照。根据安普霉素抗性基因设计1对引物(AprF:5′-CTTCGCATCCCGCCTCTGG-3′和AprR:5′-CAATACGAATGGCGAAAAG-3′),扩增片段大小为750 bp。PCR反应条件为:95 ℃ 5 min;95 ℃ 30 s,57 ℃ 30 s,72 ℃ 40 s,30个循环;72 ℃10 min。
1.6 接合转移体系的优化
孢子生长培养基选择高氏1号、2CMY、ISP4、GSY、YMS和MS 6种;接合转移培养基中MgCl2浓度分别设置为0,10,20,30,40,50 mmol/L;热激温度设置为25,40,45,50,55 ℃;预萌发时间设置为0,2,4,6,8 h;供受体比例设置为1∶1,10∶1,100∶1,1 000∶1;接合转移时间设置为12,14,16,18,20,22,24 h;筛选转化子的抗性培养基选择MS(含Apr 10 μg/mL和Nal 25 μg/mL)。除供受体比例优化试验中所需供体大肠杆菌数量从107~1010以10倍递增外,其他试验中链霉菌S-28菌丝体量或孢子量保持107,供体大肠杆菌细胞数量保持107,最后以肉眼可分辨的转化子为准。接合转移效率=接合子数/孢子量,取3次重复的平均值。
1.7 接合转移体系复合最优条件验证
将上述试验过程中获得的各个优化条件,包括培养基的种类、MgCl2浓度、热激温度、预萌发时间、供受体比例和接合转移时间,进行复合最优条件遗传转化体系试验验证,以肉眼可分辨的转化子为准,接合转移效率=接合子数/孢子量,取3次重复的平均值。
2 结果与分析
2.1 杆状链霉菌S-28的抗生素耐受性
为了建立一个有效的接合转移系统,必须首先测定S-28菌株的抗生素耐受性。本研究分别测试了S-28菌株对红霉素(Ery)、卡那霉素(Kan)、安普霉素(Apr)和潮霉素(Hyg) 4种抗生素的耐受水平,结果如表1所示。由表1可知,S-28对Apr和Kan比较敏感,在含Apr 10.0 μg/mL或Kan 20.0 μg/mL的平板上生长极慢;在含Apr质量浓度≥20 μg/mL或含Kan ≥50 μg/mL的培养基平板上,S-28不生长。S-28菌株对Ery和Hyg不敏感,在50.0 μg/mL Ery或Hyg的平板上生长依然旺盛,因此选择安普霉素(Apr≥10 μg/mL)或卡那霉素(Kan≥20 μg/mL)作为遗传操作的选择标记。

表1 羽毛降解杆状链霉菌S-28的抗生素耐受性测定结果Table 1 Antibiotic tolerance of the feather-degrading strain Streptomyces bacillaris S-28
注:+++.正常生长;++.生长缓慢;+.生长极慢;-.不生长。
Note:+++.Normal growth;++.Slow growth;+.Extremely slow growth;-.No growth.
2.2 杆状链霉菌S-28接合转化子的PCR鉴定及稳定性检测
pSET152属于穿梭-整合型质粒,转入到链霉菌S-28后,不会单独存在于细胞质中,而是整合到该菌株的基因组上[7]。随机挑选7个链霉菌S-28接合子,提取其基因组DNA,用安普霉素的抗性基因引物分别进行PCR扩增。PCR检测结果(图1)显示,接合转化子及阳性对照pSET152质粒均扩增出750 bp左右的条带,而野生型链霉菌S-28 DNA未扩增出目的片段,由此证实pSET152质粒已成功转入到链霉菌S-28中。
为了验证S-28遗传转化系统的稳定性,将经PCR鉴定的7个接合转化子在MS培养基(含Apr 10 μg/mL和Nal 25 μg/mL)上传5代后,在TSB培养基(含Apr 10 μg/mL)中摇菌培养,提取DNA进行PCR验证,结果与第1代接合子的验证结果一致,表明pSET152在链霉菌S-28中能够稳定遗传。

M1.质粒pSET152;M2.野生型S-28;M3.DNA Marker;1~7.链霉菌S-28接合转化子M1.Plasmid pSET152;M2.Wild type S-28;M3.DNA Marker;1-7.Exconjugants of Streptomyces bacillaris S-28图1 链霉菌S-28/pSET152阳性接合子的PCR验证Fig.1 PCR validation of positive exconjugants ofS-28/pSET152
2.3 杆状链霉菌S-28遗传转化系统的优化
2.3.1 产孢培养基的选择 作为接合转移的受体,链霉菌孢子的质量直接决定接合转移是否能够成功。为了获得足量的新鲜孢子,将链霉菌S-28接种到多种链霉菌常用的产孢培养基中,28 ℃恒温培养6~8 d,观察菌丝的生长及产孢状况,结果表明,该菌在培养3~5 d后开始长出白色的气生菌丝;培养4~8 d开始产微黄色孢子,同时伴随有棕色色素产生。由表2可知,链霉菌S-28在MS培养基上生长旺盛。收集孢子稀释计数,计算每种培养基上所产生的孢子数量,发现最佳产孢培养基为MS,因此选择MS为接合转移最适产孢培养基。
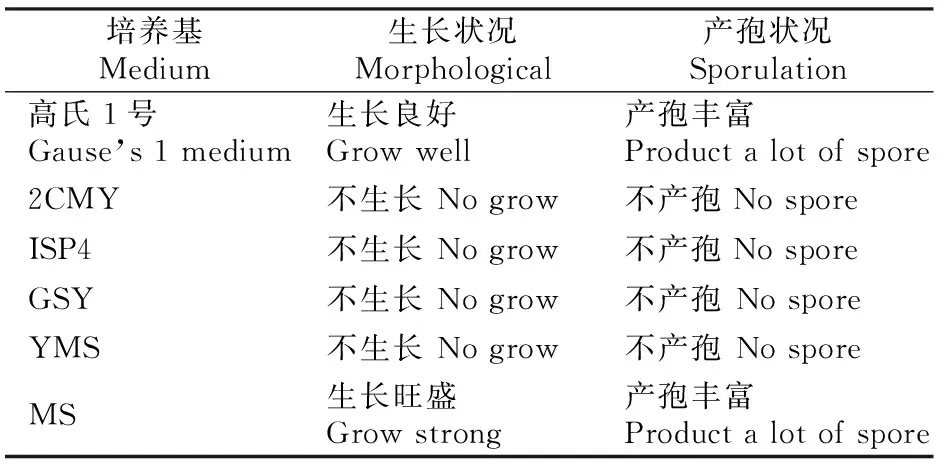
表2 链霉菌S-28在不同培养基上的生长状况Table 2 Morphological observation of S-28 cultivated indifferent media
2.3.2 培养基中MgCl2浓度对接合转移效率的影响 有研究表明,MgCl2能够提高接合转移效率[9,11],但是不同的链霉菌所需的MgCl2最适浓度不同。在本研究中,以MS为基础培养基,分别添加0,10,20,30,40,50 mmol/L MgCl2,结果见图2。如图2所示,接合转移效率随着MgCl2浓度的增加先升高后降低,且MgCl2浓度为10 mmol/L时,接合转移效率最高;MgCl2浓度继续升高,接合转移效率逐渐降低。因此在后续的优化条件试验中,均以含有10 mmol/L MgCl2的MS培养基为接合转移培养基,以不含MgCl2的MS培养基为筛选转化子的培养基。
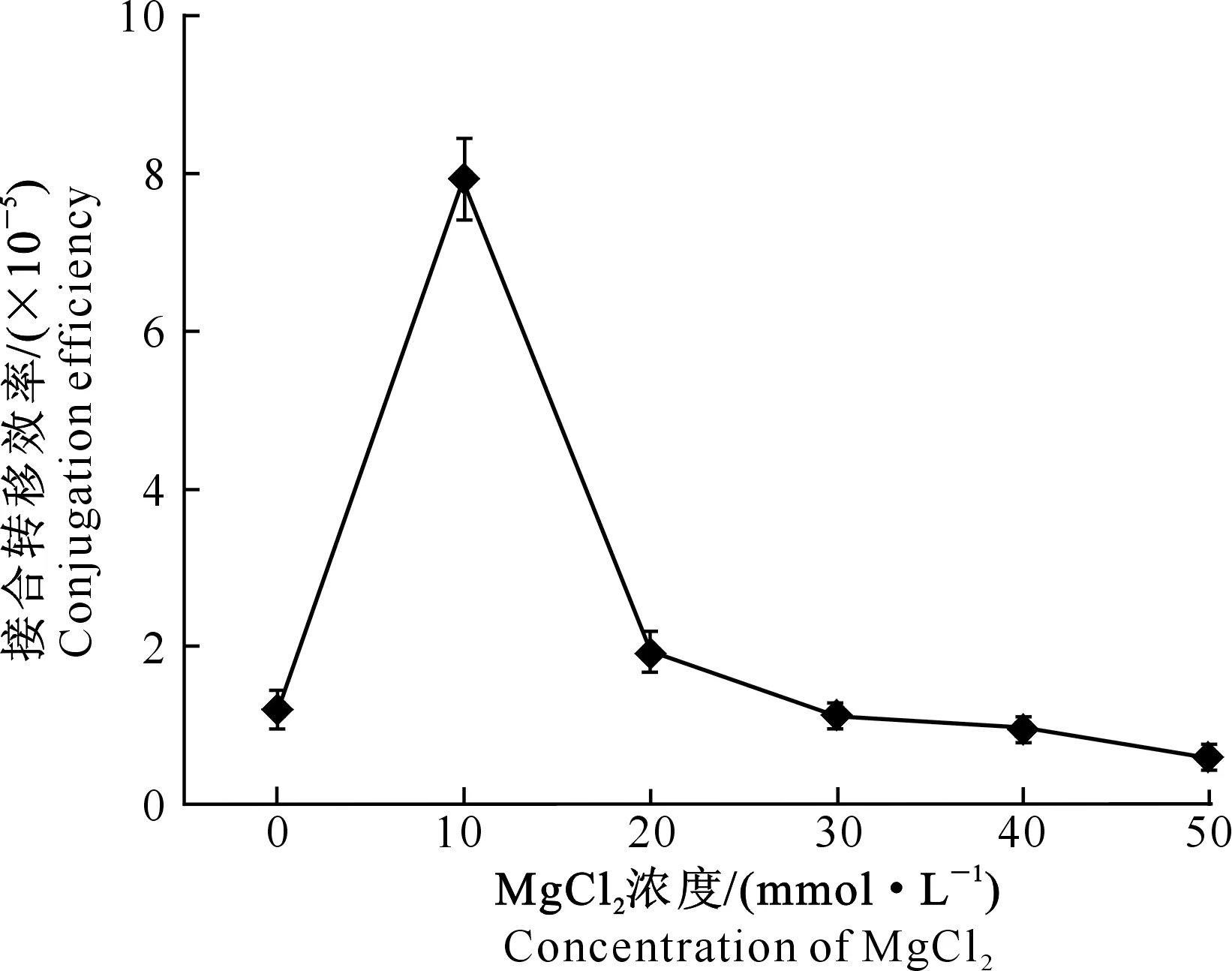
图2 MS培养基中MgCl2浓度对接合转移效率的影响Fig.2 Effect of MgCl2 concentration on conjugation efficiency
2.3.3 热激温度对接合转移效率的影响 热激处理被认为是供体与受体混合均匀前的预处理[12-13]。为了探究热激温度对接合转移效率的影响,设置25,40,45,50,55 ℃ 5个温度梯度各处理10 min,结果如表3所示。由表3可知,接合转移效率随着热激温度的增加先升高后降低,且热激温度为40 ℃时接合转移效率最高,达到(4.32±0.31)×10-5,之后随着热激温度的升高接合转移效率逐渐降低,因此S-28孢子40 ℃热激10 min时接合转移效率最高。

表3 热激温度对S-28孢子活性和接合转移效率的影响Table 3 Effect of heat treatment of S-28 spores on spore viability and conjugation efficiency
2.3.4 热激孢子预萌发时间对接合转移效率的影响 在S17-1/pSET152与S-28接合转移之前,热激孢子预萌发时间也是影响接合转移效率的参数,因此在S-28孢子40 ℃热激10 min后对预萌发时间也进行了优化,结果如图3所示。由图3可知,预萌发时间越长,接合转移效率越低。故确定40 ℃热激10 min且不进行预萌发处理时进行接合转移。

图3 热激孢子预萌发时间对接合转移效率的影响Fig.3 Effect of incubation time of heat-treated spores onconjugation efficiency
2.3.5 供受体比例对接合转移效率的影响 供受体比例在链霉菌接合转移过程中是一个很重要的参数。在本试验中,以S-28孢子数量为107保持不变,然后与数量为107~1010的S-17/pSET152供体按比例混合,检测接合转移效率,结果见表4。从表4可以看出,当供体菌的数量为107,能获得相对较少的接合子,当供体菌的数量为108,接合转移效率最高,达到(5.63±0.31)×10-5,比供体菌为107时提高了10倍,而随着供体菌数量的增加,接合转移效率又随之降低。说明当供受体比例为10∶1时,S17-1/pSET152和S-28接合转移效率最高。

表4 供受体比例对接合转移效率的影响Table 4 Effect of donor-to-recipient on conjugation efficiency
2.3.6 接合转移时间对接合转移效率的影响 供体到受体的接合需要一定的时间,供受体混匀涂布到接合转移培养基MS,经过一定的时间后覆盖抗生素筛选接合子。如果接合时间过短,接合转移不能完成,导致接合转移效率较低,但如果接合转移时间过长,会出现过多的假阳性。如图4所示,供体到受体接合12~20 h时,都可以获得较多的接合子,其中12~16 h时差异不是很明显,18~20 h时接合转移效率最高;接合22~24 h时链霉菌S-28生长过于旺盛,导致阳性接合子难以挑选。因此选择18~20 h为筛选接合子的最佳时期。
2.3.7 综合最优条件对接合转移效率的影响 综合最优接合转移单因素条件进行链霉菌S-28和E.coliS17-1/pSET152接合转移试验验证,发现接合转移效率达到10-4。
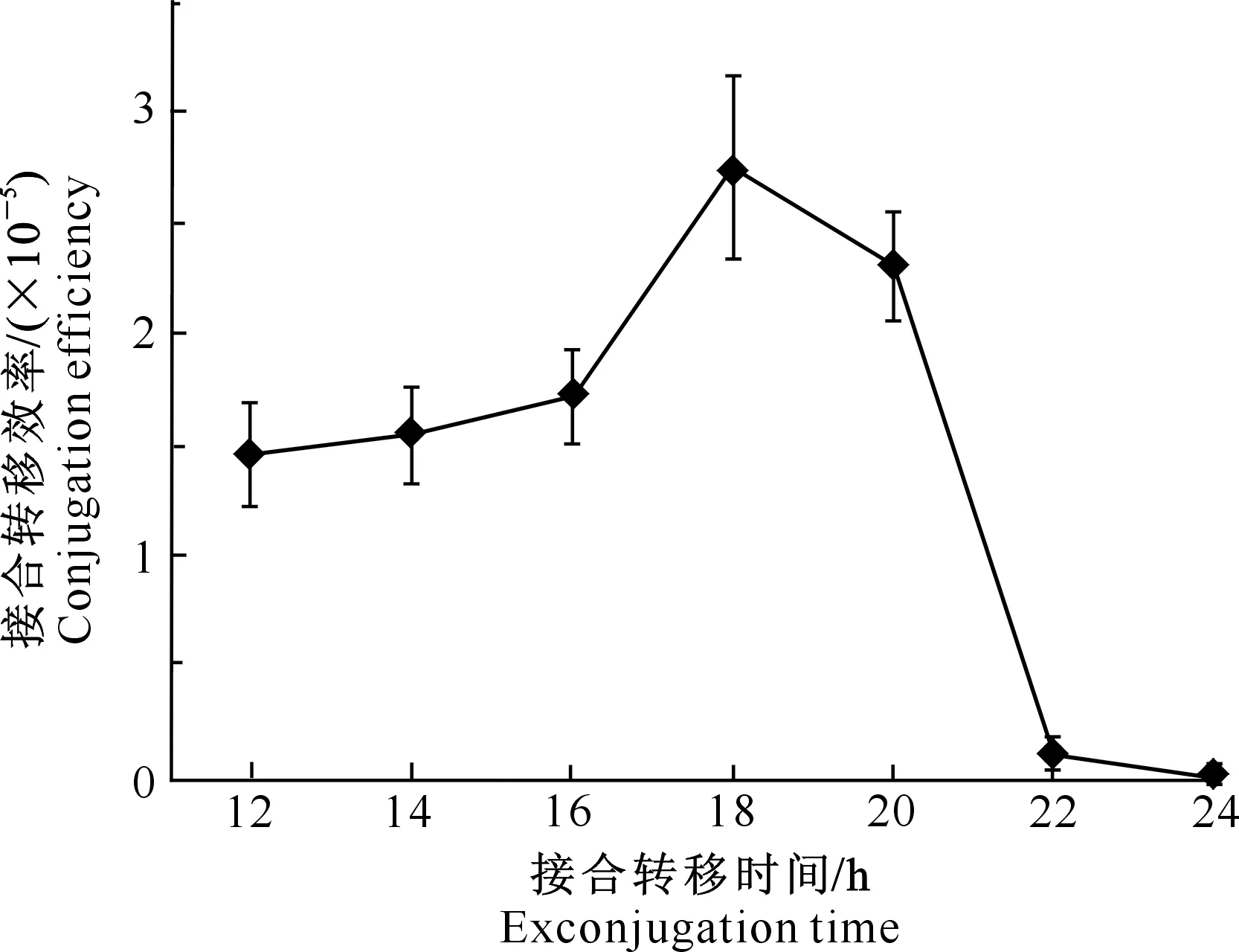
图4 接合转移时间对接合转移效率的影响Fig.4 Effect of exconjugation time on conjugation efficiency
3 讨论与结论
链霉菌是一类高G+C含量的革兰氏阳性菌,能产生丰富的次级代谢产物,目前发现的12 000余种天然抗生素中约60%由链霉菌产生[14-15],许多已在人类医药、农业和畜牧业中体现出重要的应用价值。杆状链霉菌S-28除可以高效降解羽毛外,还含有丰富的次级代谢产物生物合成基因簇,有一定的研究价值。建立可靠且高效的遗传转化体系是开展后续工作的必要前提。
链霉菌是一个高度分化的菌属,不同菌种之间有很大差异,适用于一种链霉菌的转化方法不一定适用于其他链霉菌[9,16-17]。链霉菌常见的遗传操作方法有电转化、原生质体转化和接合转移3种[18]。在建立S-28遗传转化系统的过程中,也尝试过电转化和原生质体转化,但未获得成功。本研究在S-28菌株抗生素耐受性测试、产孢培养基和供体菌株选择的基础上,通过接合转移的方法,成功建立了S-28的遗传转化系统。
本研究结果表明,培养基中随着MgCl2浓度的增高,接合转移效率先升高后降低,当接合转移培养基MS中MgCl2浓度为10 mmol/L时,接合转移效率是不含MgCl2的7~8倍,说明一定浓度的MgCl2可以提高接合转移效率。研究表明Mg2+与膜结构及功能的完整性有关,在培养基中加入一定量的Mg2+能够提高接合转移的效率[19]。热激温度对接合转移效率也有显著影响,随着热激温度的升高,接合转移效率先升高后降低,在热激温度40 ℃时接合转移效率最高,当热激温度达到55 ℃并处理10 min后,接合转移效率最低。有研究表明,适度的高温热激处理可降低细胞内限制酶活性,使得接合转移效率变高[20-21];而55 ℃的热激处理使得部分孢子丧失活性,从而降低了接合转移效率。本研究发现,供受体比例对接合转移效率也有影响,供受体比例不同,接合转移效率也不同,且供受体比例为10∶1时接合转移效率最高。有研究表明,天蓝色链霉菌(Streptomycescoelicolor)[13]和结节链霉菌(Streptomycesnodosus)[22]供受体比例不会影响接合转移效率,但北里孢刚毛菌(Kitasatosporasetae)[23]、林可链霉菌(Streptomyceslincolnensis)[24-25]和淀粉酶产色链霉菌(Streptomycesdiastatochromogenes1628)[26]却受供受体比例的影响。
综合各种因素,本研究建立并优化了S-28的遗传转化系统:以MS为接合转移最适培养基,MgCl2浓度为10 mmol/L,孢子在40 ℃热激10 min且不进行预萌发处理,供受体比例为10∶1,接合转移时间18~20 h,此条件下转化效率最高达到10-4。
[参考文献]
[1] Kornillowicz-Kowalska T,Bohacz J.Biodegradation of keratin waste:theory and practical aspects [J].Waste Manage,2011,31(8):1689-1701.
[2] Coulombe P A,Omary M B.“Hard” and “soft” principles defining the structure,function and regulation of keratin intermediate filaments [J].Current Opinion in Cell Biology,2002,14(1):110-122.
[3] 张 琪,吴光宇,赵永超,等.角蛋白酶菌株的筛选及其菌株X6的鉴定 [J].北京农业,2014,34(12):6-7.
Zhang Q,Wu G Y,Zhao Y C,et al.Screening of the keratin stains and identification of the X6 stains [J].Beijing Agriculture,2014,34(12):6-7.
[4] Verma A,Singh H,Anwar S,et al.Microbial keratinases:industrial enzymes with waste management potential [J].Critical Reviews in Biotechnology,2017,37(4):476-491.
[5] Hu Y,MacMillan J B.A new peptide isolated from a marine derivedStreptomycesbacillaris[J].Natural Product Communications,2012,7(2):211-214.
[6] Jeng K C,Chen C S,Fang Y P,et al.Effect of microbial fermentation on content of statin,GABA,and polyphenols in Pu-Erh tea [J].Journal of Agricultural and Food Chemistry,2007,55(21):87-92.
[7] Bierman M,Logan R,O’brien K,et al.Plasmid cloning vevtors for the conjugal transfer of DNA fromEscherichiacolitoStreptomycesspp. [J].Gene,1992,116(1):43-49.
[8] 咸洪泉.微生物学实验教程 [M].北京:高等教育出版社,2010:2-6.
Xian H Q.Microbiology experiment course [M].Beijing:Higher Education Press,2010:2-6.
[9] Kieser T,Bibb M J,Buttner M J,et al.PracticalStreptomycesgenetics[M].Norwich:The John In-nes Foundation,2000.
[10] 奥斯伯F M,布伦特R,金斯顿R E,等.精编分子生物学实验指南 [M].5版.北京:科学出版社,2002:26-27.
Ausubel F M,Brent R,Kinston R E,et al.Short protocols in molecular biology [M].5th ed.Beijing:Science Press,2002:26-27.
[11] Gust B,Challis G L,Fowler K,et al.PCR-targetedStreptomycesgene replacement identifies a protein domain needed for biosynthesis of the sesquiterpene soil odor geosmin [J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(4):1541-1546.
[12] Mazodier P,Petter R,Thompson C.Intergeneric conjugation betweenEscherichiacoliandStreptomycesspecies [J].Journal of Bacteriology,1989,171(6):3583-3585.
[13] Flett F,Mersinias V,Smith C P.High efficiency intergeneric conjugal transfer of plasmid DNA fromEscherichiacolito methyl DNA-restrictingStreptomycetes[J].FEMS Microbiology Letters,1997,155(2):223-229.
[14] Strohl W R.Biotechnology of antibiotics [M].2nd ed.New York:Marcel Dekker,1997:4-8.
[15] Bibb M J.The regulation of antibiotic production inStreptomycescoelicolorA3(2) [J].Microbiology,1996,142(6):1335-1344.
[16] Mamoru K,Takuma U,Satoshi O,et al.Genome-minimizedStreptomyceshost for the heterologous expression of secondary metabolism [J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(6):2646-2651.
[17] Pigac J,Schrempf H.A simple and rapid method of transformation ofStreptomycesrimosusR6 and otherStreptomycetesby electroporation [J].Applied and Environmental Microbiology,1995,61(1):352-356.
[18] 吴 胜,夏焕章.链霉菌基因转移的方法 [J].生物工程进展,2002,22(1):91-94.
Wu S,Xia H Z.The current state in research of chemically inducible expression system of plant genetic engineering [J].China Biotechnology,2002,22(1):91-94.
[19] 余姣姣,陶美凤.无机盐对阿维链霉菌接合转移及异源表达放线紫红素的影响 [J].微生物学报,2010,50(11):1556-1561.
Yu J J,Tao M F.Effect of inorganic salts on the conjugation and heterologous expression of actinorhodin inStreptomycesavermitilis[J].Acta Microbiologica Sinica,2010,50(11):1556-1561.
[20] Bailey C R,Winstanley D J.Inhibition of restriction inStreptomycesclavuligerusby heat treatment [J].The Journal of General and Applied Microbiology,1986,132(10):2945-2947.
[21] Engel P.Plasmid transformation ofStreptomycestendae after heat attenuation of restriction [J].Applied and Environmental Microbiology,1987,53(1):1-3.
[22] Nikodinovic J,Barrow K D,Chuck J A.High frequency transformation of the amphotericin-producing bacteriumStreptomycesnodosus[J].Journal of Microbiological Methods,2003,55(1):273-277.
[23] Choi S U,Lee C K,Hwang,et al.Intergeneric conjugal transfer of plasmid DNA fromEscherichiacolitoKitasatosporasetae,a bafilomycin B1 producer [J].Archives of Microbiology,2004,181(4):294-298.
[24] 张惠展,姚 峰,叶 江.林可链霉菌转化系统的建立 [J].微生物学报,1999,39(1):82-85.
Zhang H Z,Yao F,Ye J.Establishment of transformation system ofStreptomyceslincolnensis[J].Acta Microbiologica Sinica,1999,39(1):82-85.
[25] Du L,Liu R H,Ying L,et al.An efficient intergeneric conjugation of DNA fromEscherichiacolito mycelia of the lincomycin-producerStreptomyceslincolnensis[J].International Journal of Molecular Sciences,2012,13(4):4797-4806.
[26] Ma Z,Liu J,Bechthold A,et al.Development of intergeneric conjugal gene transfer system inStreptomycesdiastatochromogenes1628 and its application for improvement of toyocamycin production [J].Current Microbiology,2013,68(2):180-185.
