绞股蓝籽油食品安全毒理学评价及抗衰老研究
2018-05-24张明星肖娅萍王筱冰刘全宏1
杜 楠,王 璐,白 鸽,张明星,肖娅萍,张 坤,王 攀,王筱冰,刘全宏1,
(1药用植物资源与天然药物化学教育部重点实验室,陕西 西安 710062;2西北濒危药材资源开发国家工程实验室,陕西 西安 710062;3陕西师范大学 生命科学院,陕西 西安 710062)
绞股蓝(Gynostemmapentaphyllum(Thunb.)Makino)为葫芦科(Cucurbitaceae)绞股蓝属多年生草质藤本植物,又名五叶参、七叶参等。绞股蓝是除五加科人参属植物以外唯一含有人参皂苷的植物,且较人参更易栽培,优良品种中人参皂苷的含量甚至高于人参,因此获得了“南方人参”的美誉[1]。绞股蓝属于雌雄异株,自然条件下结种量较小,在农业生产中,绞股蓝主要依靠根状茎来繁殖。而对于绞股蓝种子,一方面尚未引起人们的充分重视而研究甚少;另一方面其通常只用于有性繁殖,或废弃而未得到充分利用。绞股蓝籽油是从药用植物绞股蓝种子中提取获得的天然植物油脂,其中含有超过80%的多不饱和脂肪酸及多种植物甾醇,具有作为食品添加剂、保健食品及药品原料的开发潜力[2]。Wang等[2-3]通过超临界CO2法萃取绞股蓝籽油,并对绞股蓝籽油的油脂成分进行了分析和抗氧化研究,但绞股蓝籽油要开发为一种新的食品资源,尚必须进行食品安全毒理学评价,而相关研究尚未见报道。
衰老又称老化,是机体退化时期生理紊乱及功能下降的一个不可逆的过程,也是一种自然而复杂的生物学过程。进入21世纪后,全球开始跨入一个人口老龄化社会。随着2025年人口老龄化高峰期的到来,研究衰老及抗衰老已刻不容缓。D-半乳糖致小鼠衰老模型,主要原理是通过在一定时间内连续注射D-半乳糖,增高机体细胞的半乳糖浓度,并在醛糖还原酶催化作用下将D-半乳糖还原成半乳糖醇,由于机体不能正常代谢该物质,于是这一物质便堆积在细胞中使细胞的正常渗透压受到影响,导致细胞肿胀、代谢紊乱和功能障碍,最终导致机体衰老[4-10]。
本研究以急性经口毒性试验、小鼠骨髓嗜多染红细胞微核试验、小鼠精子畸形试验来评价绞股蓝籽油的食品安全性,并通过颈背部皮下注射D-半乳糖建立小鼠衰老模型,检测血清和组织中的生理生化指标,观察小鼠肝组织切片,研究绞股蓝籽油的抗衰老作用,以期为绞股蓝籽油的生物学功能研究及其新资源的开发提供科学依据。
1 材料与方法
1.1 试验材料
绞股蓝籽油经超临界CO2萃取制备。试验动物为健康昆明种小鼠,购买于安徽医科大学动物实验中心。
1.2 试剂与仪器
主要试剂有:注射用环磷酰胺,江苏恒瑞医药股份有限公司;Giemsa染色液,北京雷根生物技术有限公司;D-半乳糖,美国Sigma公司;无水乙醇、石蜡、二甲苯、氯化钠、盐酸、苏木精、伊红、多聚甲醛、中性树胶、抗坏血酸(VC),均购自天津市天力化学试剂有限公司;超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒、总抗氧化能力(T-AOC)试剂盒、过氧化氢酶(CAT)试剂盒,均购自南京建成生物工程研究所;总胆固醇(TC)试剂盒、甘油三酯(TG)试剂盒、低密度脂蛋白(LDL)试剂盒、高密度脂蛋白(HDL)试剂盒,均购自吉林长春汇力生物技术有限公司。
主要仪器设备有:可拍照光学显微镜(P95-C MOTIC2506),德国Zeiss公司;HH-6B型数显恒温水浴锅,江苏常州国华电器有限公司;SL202型药物电子天平,上海明桥精密科学仪器有限公司;H-1型漩涡混匀器,上海康禾光电仪器有限公司;JB-3型磁力搅拌器,杭州仪表机电有限公司;TGL-20bR型高速冷冻离心机,上海安亭科学仪器厂;KD-1508A型轮转式切片机,浙江金华仪器有限公司;Nikon E2000型光学显微镜,Nikon公司;Epoch超微量微孔板分光光度计,美国BioTek公司;动物手术器械,广东医疗器械厂。
1.3 试验方法
1.3.1 小鼠急性经口毒性试验 选用健康昆明种小鼠40只,体质量18~22 g,适应性喂养2~3 d后随机分为空白对照组和高、中、低剂量组,每组10只,雌雄各半,在相同条件下分笼饲养。灌胃绞股蓝籽油前禁食16 h左右,空白对照组灌胃生理盐水,剂量为10.0 g/kg;绞股蓝籽油高(GPSO-H)、中(GPSO-M)、低(GPSO-L)剂量组灌胃剂量分别设置为4.6,10.0及21.5 g/kg,经口进行一次性灌胃后,连续观察14 d,记录小鼠的饮食、运动、排泄、中毒表现及死亡情况。测定经口半数致死剂量(LD50),若剂量超过10.0 g/kg仍不能引起动物死亡,初步认定受试样品无毒或低毒。
1.3.2 小鼠骨髓嗜多染红细胞微核试验 选用健康昆明种小鼠50只,体质量18~22 g,随机分为空白对照组、阳性对照组和高、中、低剂量组,每组10只,雌雄各半。空白对照组灌胃生理盐水,剂量为10.0 g/kg;阳性对照组用环磷酰胺(CTX,40 mg/kg)进行腹腔注射,每天1次,连续5 d;绞股蓝籽油高(GPSO-H)、中(GPSO-M)、低(GPSO-L)剂量组以2.5,5.0及10.0 g/kg的灌胃剂量连续灌胃绞股蓝籽油5 d,每天1次,最后1次灌胃后24 h处死小鼠,取股骨骨髓,制作骨髓细胞涂片,甲醇固定15 min,Giemsa染色10~15 min,双盲法镜检,每只小鼠计数1 000个嗜多染红细胞(Polychromatic erythrocyte,PCE)中含微核的PCE数,并计数200个细胞中PCE与正染红细胞(Normochromatic erythrocyte,NCE)的比值,微核发生率以千分率(‰)表示[11-12]。
1.3.3 小鼠精子畸形试验 选用体质量30~35 g的性成熟昆明种雄性小鼠25 只,随机分为空白对照组、阳性对照组和绞股蓝籽油高、中、低剂量组,每组5只,以腹腔注射40 mg/kg的环磷酰胺为阳性对照,每天1次,连续5 d,绞股蓝籽油低、中、高组以2.5,5.0及10.0 g/kg的灌胃剂量连续灌胃绞股蓝籽油5 d,最后1次灌胃7,14,21,28,35 d后分别处死小鼠,取两侧附睾剪碎,制备精子涂片,甲醇固定,质量分数1%伊红染色10 min,油镜下观察,每只小鼠计数1000个结构完整的精子细胞,依据精子畸变分型,统计每1 000个结构完整的精子细胞中畸变精子的数量,计算精子畸形率,以千分率(‰)表示[13]。
1.3.4 抗衰老研究 将雌性昆明小鼠饲养在通风良好、湿度和温度均适宜的环境中,自由摄食和饮水,期间观察小鼠状态,适应性饲养2~3 d后进行后续试验。将每只小鼠适应性饲养后称质量,随机分成6组,即空白对照组、衰老模型组、阳性对照组和绞股蓝籽油低(GPSO-L)、中(GPSO-M)、(GPSO-H)剂量组,每组10只。其中空白对照组每天颈背部皮下注射400 mg/kg生理盐水,其余各组每天颈背部皮下注射D-半乳糖400 mg/kg。衰老模型组和空白对照组每天灌胃4 mL/kg的生理盐水,阳性对照组每天灌胃100 mg/kg的抗坏血酸(VC),绞股蓝籽油低、中、高剂量组分别按2.0,3.0和4.0 mL/kg剂量每天灌胃绞股蓝籽油,连续给药60 d。在试验过程中小鼠正常饲养,每7 d称量记录体质量1次,并观察小鼠状态。在末次给药后,所有小鼠禁食不禁水12 h后颈椎脱臼法处死,试剂盒测定血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)浓度及肝、脑组织超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)、过氧化氢酶(CAT)活性及丙二醛(MDA)含量等各项生理生化指标[9]。
1.3.5 脏器指数 将所有小鼠称质量后处死,取出胸腺、肝脏、脾脏、肾脏以及脑组织分别称质量,计算各脏器指数。计算公式如下:
脏器指数=脏器质量/体质量。
1.3.6 测试样品的制备 (1)血清。各组小鼠末次给药禁食12 h后,眼眶取血,将采集的血液在3 000 r/min下低温离心10 min,取上层血清保存于-20 ℃冰箱中待测。(2)组织匀浆的制备。取出各组小鼠脑和肝组织后,冰浴生理盐水冲洗干净,滤纸吸干,称取1.0 g组织置于研钵中,在低温条件下加入冰浴生理盐水9 mL研磨成体积分数10%的组织匀浆液,在3 000 r/min下低温离心10 min,取上清液保存于-20 ℃冰箱中待测。
1.3.7 肝脏组织病理学石蜡切片的制作 每组随机取3块肝脏,在肝小叶部分剪取5 mm×5 mm的方块,用于石蜡切片的制作。制作流程如下:固定(体积分数10%福尔马林)→脱水(体积分数50%~100%乙醇梯度脱水)→透明(二甲苯)→包埋(软蜡,硬蜡)→切片→脱蜡(二甲苯)→染色(H&E)→封片(中性树脂)→镜检。
(1)透明。取出在福尔林固定液中固定24 h的小鼠肝脏组织块,流水冲洗,用体积分数50%~100%的乙醇梯度洗脱,逐渐脱去组织中的水分,然后用二甲苯逐步透明。以上每步均进行30 min。
(2)石蜡包埋。将已透明的肝脏组织块,按组别分别转置于盛有已熬好软蜡的蜡杯中,放入60 ℃保温箱内,待石蜡完全浸入组织块后,用硬蜡进行包埋。
(3)切片。将包埋好组织的蜡块修好后,用切片机连续切片,其厚度为6 μm,附于用固定液处理好的载玻片上进行贴片,40 ℃恒温烘干。
(4)H&E染色。二甲苯脱去切片中的石蜡,体积分数100%~50%乙醇梯度脱水,蒸馏水水洗,以上每步均进行5 min。然后苏木精染色4 min,自来水冲洗至泛蓝色,盐酸酒精分色2~5 s,体积分数50%~90%乙醇梯度脱水,伊红染色4 min,二甲苯透明,中性树脂封片成永久切片。
(5)镜检。在光学显微镜下观察各组小鼠肝脏组织病理学变化,拍摄并保存照片。
1.3.8 血清及脑、肝组织生理生化指标的检测 按照试剂盒使用说明书测定血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)浓度及肝、脑组织超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)、过氧化氢酶(CAT)活性及丙二醛(MDA)含量等指标。每个样品均重复3次,以降低误差确保试验结果的准确性。
1.4 数据分析
采用SPAA20.0分析软件对数据进行t检验方差分析及多重比较,差异显著性用P<0.05或P<0.01表示。
2 结果与分析
2.1 小鼠急性经口毒性试验
急性经口毒性试验结果表明,在空腹灌胃4.6,10 .0和21.5 g/kg绞股蓝籽油4 h后,各剂量组小鼠均未见明显的中毒症状,常规饲养14 d内小鼠生长发育正常,毛色光泽良好,饮食、运动、排泄均未见异常现象,无小鼠死亡。试验期间受试动物均未见明显中毒反应且无动物死亡,表明绞股蓝籽油对雌雄小鼠急性经口LD50值均大于10.0 g/kg,依据急性毒性剂量分级标准属于实际无毒物质,可进入下一阶段毒理学试验。
2.2 小鼠骨髓嗜多染红细胞微核试验
空白对照组、阳性对照组及绞股蓝籽油低、中、高剂量组小鼠骨髓嗜多染红细胞的统计结果如表1所示。
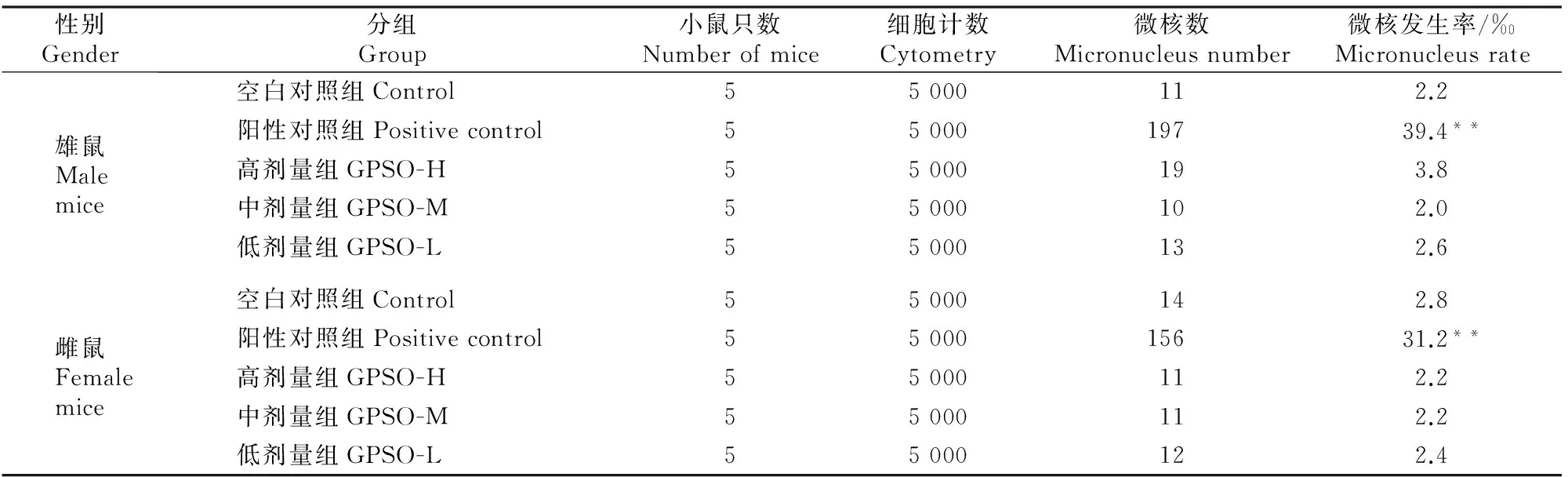
表1 小鼠骨髓嗜多染红细胞微核试验结果Table 1 Effect of GPSO on microkernel rate of polychromatic erythrocytes in mice
注:**表示与空白对照组相比差异极显著(P<0.01)。表2同。
Note:** means highly significant difference compared with control group(P<0.01).The same for Table 2.
表1结果表明,绞股蓝籽油低、中、高3个剂量组雌雄小鼠骨髓嗜多染红细胞微核发生率为2.0‰~3.8‰,与空白对照组相比均无显著性差异(P>0.05),亦无剂量依赖效应;但阳性对照组雌、雄小鼠骨髓嗜多染细胞的微核发生率达到31.2‰和39.4‰,与其他组相比均有极显著差异(P<0.01)。说明在本试验剂量范围内,绞股蓝籽油不会对小鼠骨髓嗜多染红细胞微核数造成显著影响,即受试样品的微核试验结果为阴性。
2.3 精子畸形试验
绞股蓝籽油对小鼠精子畸形率的影响如表2所示。与骨髓细胞微核试验结果相似,阳性药物处理后,小鼠精子的畸形率为6.52‰,极显著高于空白对照组及其他各剂量组(P<0.01),而绞股蓝籽油低、中、高剂量组小鼠精子畸形率分别为2.24‰,1.82‰和2.02‰,与空白对照组相比无显著差异(P>0.05),表明绞股蓝籽油对小鼠精子无致畸变作用,试验结果为阴性。

表2 小鼠精子畸形试验结果Table 2 Effect of GPSO on sperm abnormality rate in mice
2.4 绞股蓝籽油对D-半乳糖致衰老小鼠体质量的影响
绞股蓝籽油对各试验组小鼠体质量的影响如表3所示。由表3可知,在试验开始后的49 d内,各试验组小鼠体质量总体上呈持续增长趋势,但增长幅度整体较小。总体上看,衰老模型组小鼠体质量增长最为缓慢,在42 d后其体质量一直呈下降趋势,试验结束时该组小鼠体质量最低。在56 d时,所有小鼠体质量都有所下降,可能是处死之前断食所致。
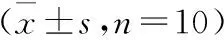
表3 绞股蓝籽油对D-半乳糖致衰老小鼠体质量的影响Table 3 Effect of GPSO on body weight of aging g
注:与空白组相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);与衰老模型组相比, #表示差异显著(P<0.05),##表示差异极显著(P<0.01)。下表同。
Note:*means significant difference compared with control group (P<0.05),**means highly significant difference compared with control group(P<0.01);#means significant difference compared with aging model group(P<0.05),##means highly significant difference compared with aging model group(P<0.01).The same below.
与空白对照组相比,衰老模型组小鼠在试验第42天时体质量显著降低(P<0.05),在第21,49,56天时体质量极显著降低(P<0.01)。而绞股蓝籽油低、中、高剂量组中,除绞股蓝籽油中剂量组在21和49 d表现出显著性差异外,其余各组均无明显差异(P>0.05)。绞股蓝籽油低、中、高剂量组与衰老模型组相比,除高剂量组在56 d时无显著差异外,低、中剂量组在49,56 d均表现出极显著差异(P<0.01),并且绞股蓝籽油低剂量组在14~28 d时有显著差异,高剂量组在第21天有显著差异。与衰老模型组相比,阳性对照组在第35天开始呈现显著性差异,在最后1周时呈现极显著差异。
表3结果说明,D-半乳糖对小鼠食欲及吸食能力有一定影响,使其体质量增加缓慢,而绞股蓝籽油低、中、高剂量组缓解了这一症状,即绞股蓝籽油可以改善D-半乳糖致衰老小鼠食欲及吸食能力的不断下降,具有一定的抗衰老活性。
2.5 绞股蓝籽油对D-半乳糖致衰老小鼠脏器指数的影响
D-半乳糖致衰老小鼠处死后,其肝脏指数、脾脏指数、胸腺指数、肾脏指数的计算结果见表4。
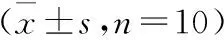
表4 绞股蓝籽油对D-半乳糖致衰老小鼠脏器指数的影响Table 4 Effect of GPSO on spleen index of aging
由表4可知,与空白对照组相比,衰老模型组小鼠肝脏指数极显著减低(P<0.01),脾脏指数和胸腺指数均显著降低(P<0.05);与衰老模型组相比,阳性对照组小鼠肝脏指数和脾脏指数有显著差异(P<0.05),绞股蓝籽油低、中、高剂量组小鼠的肝脏指数均有显著差异(P<0.05),中剂量组脾脏指数和胸腺指数也有显著差异(P<0.05)。
脏器指数可反映动物的健康状况。对于脾脏指数而言,绞股蓝籽油低、中、高剂量组小鼠与衰老模型组小鼠相比均呈升高趋势,说明灌胃绞股蓝籽油可使小鼠脾脏趋于正常,增强小鼠免疫功能。对于胸腺指数而言,绞股蓝籽油低、中、高剂量组小鼠与衰老模型组小鼠相比均呈现升高趋势,说明灌胃不同剂量绞股蓝籽油均能提高小鼠胸腺的生理机能,从而达到增强小鼠免疫功能的目的。对于肾脏指数而言,各组小鼠均无明显差异(P>0.05),说明阳性对照组和灌胃绞股蓝籽油对小鼠肾脏无明显影响。
2.6 绞股蓝籽油对D-半乳糖致衰老小鼠血清生化指标的影响
对D-半乳糖致衰老小鼠血清中总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)浓度进行测定,其结果见表5。
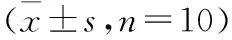
表5 绞股蓝籽油对D-半乳糖致衰老小鼠血清生化指标的影响Table 5 Effect of GPSO on biochemical indexes in serum of aging mmol/mL
由表5所知,与空白对照组相比,衰老模型组小鼠血清TC、TG和LDL浓度显著升高,HDL浓度显著降低(P<0.05)。与衰老模型组相比,绞股蓝籽油低、中、高剂量组小鼠TC浓度极显著降低(P<0.01),但灌胃绞股蓝籽油各剂量组之间差异不明显;与衰老模型组相比,灌胃绞股蓝籽油中剂量组小鼠的TG浓度极显著降低(P<0.01),低、高剂量组小鼠TG浓度也有所降低,且差异达显著水平(P<0.05)。与衰老模型组相比,绞股蓝籽油低、中、高剂量组小鼠LDL浓度显著降低,HDL浓度显著上升,但3个剂量组间并无明显差异。
2.7 绞股蓝籽油对D-半乳糖致衰老小鼠肝脏组织生化指标的影响
对D-半乳糖致衰老小鼠肝脏组织中超氧化物歧化酶(SOD)、丙二醛(MDA)、总抗氧化能力(T-AOC)、过氧化氢酶(CAT)等指标进行检测,其结果见表6。
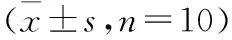
表6 绞股蓝籽油对D-半乳糖致衰老小鼠肝脏组织生化指标的影响Table 6 Effect of GPSO on biochemical indexes in liver of aging
由表6可知,与空白对照组相比,衰老模型组小鼠肝脏组织中的SOD活性和总抗氧化能力(T-AOC)极显著降低,MDA含量和CAT活性极显著升高,说明衰老模型组小鼠肝脏总抗氧化能力下降,清除自由基的能力减弱,脂质过氧化程度加深,进而导致细胞损伤、机体衰老,说明长期注射D-半乳糖致小鼠衰老造模成功。
表6显示,与衰老模型组相比,阳性对照组和灌胃绞股蓝籽油各剂量组小鼠的SOD活性均有所提高,其中阳性对照组小鼠肝脏SOD水平的提高具有显著性差异(P<0.05),低剂量组和中剂量组小鼠SOD水平的提高具有极显著差异(P<0.01)。说明灌胃绞股蓝籽油能在一定程度上增加小鼠肝脏的SOD活性。针对MDA而言,与衰老模型组相比,灌胃绞股蓝籽油的各剂量小鼠的MDA含量均呈显著下降趋势,说明灌胃绞股蓝籽油能降低小鼠肝脏的MDA含量。针对总抗氧化能力(T-AOC)而言,与衰老模型组相比,灌胃绞股蓝籽油的各剂量组小鼠的T-AOC活性显著或极显著提高,说明灌胃绞股蓝籽油可提高小鼠的总抗氧化能力。就CAT而言,与衰老模型组相比,灌胃绞股蓝籽油低、中剂量小鼠的CAT活性均极显著降低,高剂量组和阳性对照组显著降低,说明灌胃绞股蓝籽油可降低小鼠的过氧化程度,但是灌胃绞股蓝籽油各剂量组小鼠的抗衰老能力并不会随着剂量的增加而增大,因此绞股蓝籽油对D-半乳糖致衰老小鼠抗衰老能力的提高不构成剂量依赖关系。
2.8 绞股蓝籽油对D-半乳糖致衰老小鼠脑组织生化指标的影响
对D-半乳糖致衰老小鼠脑组织中超氧化物歧化酶(SOD)、丙二醛(MDA)、总抗氧化能力(T-AOC)指标进行测定,其结果见表7。由表7可知,与空白对照组相比,衰老模型组小鼠脑组织中的SOD活性和总抗氧化能力(T-AOC)降低,MDA含量升高,且均达极显著差异水平(P<0.01),说明衰老模型组小鼠脑组织总抗氧化能力下降,清除自由基能力降低,脂质过氧化程度加深,亦证实了长期注射D-半乳糖致小鼠衰老造模成功。
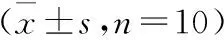
表7绞股蓝籽油对D-半乳糖致衰老小鼠脑组织生化指标的影响Table 7 Effect of GPSO on biochemical indexes in cerebrum of aging
与衰老模型组相比,除阳性对照组小鼠T-AOC活性显著升高外(P<0.05),其余各组SOD、T-AOC活性和MDA含量均极显著升高或降低(P<0.01)。说明灌胃绞股蓝籽油可降低小鼠脑组织脂质过氧化程度,提高总抗氧化能力,提高自由基清除能力,但是不同剂量组氧化能力并不会随着剂量的增加而增大,因此绞股蓝籽油对D-半乳糖致衰老小鼠不构成剂量依赖关系。
以上结果表明,绞股蓝籽油抗衰老机理之一可能与其具有的抗氧化能力有关,其可以通过增强机体的总抗氧化能力并有效清除自由基,降低机体细胞损伤程度,间接保护正常细胞,从而起到抗衰老的作用。
2.9 绞股蓝籽油对D-半乳糖致衰老小鼠肝脏组织病理变化的影响
对空白对照组、衰老模型组及绞股蓝籽油低、中、高剂量组小鼠肝脏组织进行病理学镜检,结果如图1所示。
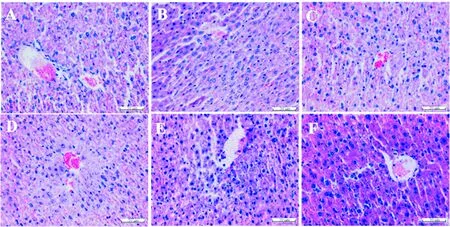
A.空白对照组;B.衰老模型组;C.阳性对照组;D.绞股蓝籽油低剂量组;E.绞股蓝籽油中剂量组;F.绞股蓝籽油高剂量组A.Control group;B.Aging-model group;C.Positive control group;D.GPSO-L;E.GPSO-M;F.GPSO-H图1 各组小鼠肝脏组织HE染色病理切片的显微镜检(×40)Fig.1 HE staining of mice liver tissues in experimental groups (×40)
由图1可知,空白对照组小鼠肝颜色红润富有弹性,表面光滑有光泽度,光学显微镜检结果显示,肝细胞间连接紧密,核质比大,胞浆丰富,以中央静脉腔为中心呈辐射状,细胞完整且很规则,细胞结构与间隙清晰,细胞核圆形位于中央,核质分布均匀(图1-A);衰老模型组小鼠肝脏明显肿大,颜色黄白有点状灰白色,表面粗糙且质地稍脆无光泽,光学显微镜镜检结果显示细胞间隙扩大,排列紊乱,坏死细胞较多,细胞轮廓模糊,细胞核多皱缩且胞浆疏松、淡染,出现裂解现象,胞质内出现脂滴空泡,并伴随胞质丢失现象(图1-B);阳性对照组小鼠肝细胞排列较紊乱且间隙大,腔静脉周围都有少部分坏死细胞,细胞界限模糊但病变有所缓解(图1-C);绞股蓝籽油低剂量组小鼠肝胞排列较整齐而间隙较大,胞质内有脂滴空泡,胞浆疏松、淡染呈轻度脂肪变性(图1-D);绞股蓝籽油中剂量组小鼠肝细胞边缘清晰结构完整,少数胞质内有脂滴空泡,病变较小(图1-E);绞股蓝籽油高剂量组小鼠肝细胞呈辐射状排列且细胞间隙小,核圆清晰完整,几乎无坏死细胞,损伤较轻(图1-F),说明绞股蓝籽油可以有效缓解衰老小鼠的肝损伤情况。
3 讨 论
在绞股蓝籽油的相关报道中,刘世彪等[14]对石油醚提取的绞股蓝籽油进行了小鼠急性毒性试验的初步评价,该试验中选用的最大剂量为一次性经口灌胃65 mL/kg,试验结果表明,14 d内小鼠活动正常,体质量增加均衡,无明显中毒症状,亦无死亡现象发生;同时对小鼠进行解剖镜检,各主要脏器也未发现可见的异常变化,故按照保健食品检验与评价技术规范的急性毒性分级标准,初步认定绞股蓝籽油为无毒级,且富含多不饱和脂肪酸[2],可作为营养保健植物食用油使用。本试验采用超临界CO2萃取绞股蓝籽油,避免了溶剂残留的影响,并通过急性经口毒性试验及2项遗传毒性试验结合的方法,进一步验证了绞股蓝籽油的食用安全性。但考虑到绞股蓝籽油含有大量α-桐酸,且油脂的脂肪酸组成结构与桐油极为相似,α-桐酸的含量也几乎相当,而误食桐油发生中毒的事件时有报道[15-17],普遍的观点认为桐油的毒性来源于α-桐酸,因此,仅通过急性经口毒性试验及遗传毒性试验检测评价绞股蓝籽油的食用安全性,尚是远远不够的,还需要经过慢性毒性试验等大量检测进行进一步考察。此外,也有文献报道,同样含有大量α-桐酸的苦瓜籽油和栝楼籽油均可作为食用油脂用于日常饮食,平均寿命最长的日本人也有长期食用苦瓜的习惯[18-20],这些事例似乎又证明,这些含有大量α-桐酸的植物油甚至α-桐酸本身可能都是无毒的。推测桐油的毒性来源一方面是桐油籽中含有的有毒皂素等物质,一方面是以α-桐酸为主构成的甘油三酯因组成或结构不同而产生有毒或无毒的植物油脂[21-22]。此外,桐油的急性中毒也可能与摄入量密切相关,而α-桐酸具有的抗癌、减肥、降血脂等有益的生理功效,也不会因为桐油的毒性而被掩盖[23]。因此,在充分验证绞股蓝籽油无毒的基础上,有望将其开发成富含α-桐酸的可食用天然植物油,以取代桐油成为更加安全的α-桐酸的天然来源。
本试验以绞股蓝籽油为对象,采用皮下注射D-半乳糖的方法构建小鼠衰老模型,初步研究其抗衰老作用。随着灌胃和注射时间的延长,小鼠出现饮食量下降,皮毛光泽度变差,行动缓慢,体质量增加缓慢甚至下降的症状,说明长期注射D-半乳糖会导致小鼠食欲及吸食能力不断下降,而绞股蓝籽油可以缓解这一症状。肝脏指数分析表明,绞股蓝籽油对小鼠肝脏可以起到保护作用。脾脏和胸腺指数是评价机体免疫功能的主要生化指标,灌胃绞股蓝籽油各剂量组小鼠脾脏指数和胸腺指数均较衰老模型线小鼠有所提高,说明绞股蓝籽油可通过提高小鼠脾脏和胸腺的生理机能从而达到增强小鼠免疫功能的目的。本研究显示,供试小鼠的肾脏指数未出现异常,说明绞股蓝籽油对小鼠肾脏功能影响不大。血清生化指标测定结果表明,长期食用绞股蓝籽油不会增加血清中的TC和TG浓度,反而可明显降低衰老小鼠血清的LDL浓度,增加HDL浓度,说明绞股蓝籽油可能通过调节血清血脂TC、TG、LDL、HDL浓度,改善血脂代谢进而起到抗衰老作用[24]。肝脏组织和脑组织生化指标的测定结果说明,绞股蓝籽油在一定程度上能显著辅助和增强SOD活性,降低MDA含量,提高总抗氧化能力,表明绞股蓝籽油抗衰老机理之一可能与其抗氧化能力有关,其可能通过增强机体的总抗氧化能力并有效清除自由基,降低机体细胞损伤程度,间接保护正常细胞,从而起到抗衰老作用[25-26]。小鼠肝脏组织石蜡切片显示,灌胃不同剂量绞股蓝籽油均可有效缓解衰老小鼠肝脏内脂质过氧化和自由基攻击等造成的氧化损伤,降低肝细胞肿胀甚至坏死的程度,调节细胞恢复生理功能和正常代谢,表明绞股蓝籽油有一定的抗衰老活性。
4 结 论
绞股蓝籽油食品安全性毒理学评价初步认定,绞股蓝籽油属实际无毒物质,小鼠骨髓嗜多染红细胞微核试验和精子畸形试验也表明,绞股蓝籽油不会对小鼠骨髓嗜多染红细胞微核数造成显著影响,对小鼠精子无致畸变作用。另外,绞股蓝籽油有一定的抗衰老作用,且其抗衰老机理可能与其所具有的抗氧化能力有关。
[参考文献]
[1] 南京中医药大学.中药大辞典 [M].上海:上海科学技术出版社,2007.
Nanjing University of Chinese Medicine.The dictionary of medicinal plant [M].Shanghai:Shanghai Science and Technology Publishing House,2007.
[2] Wang L,Wang X B,Wang P,et al.Optimization of supercritical carbon dioxide extraction,physicochemical and cytotoxicity properties ofGynostemmapentaphyllumseed oil:a potential source of conjugated linolenic acids [J].Separation Purification Technology,2016,159:147-156.
[3] Wang L,Pang M,Wang X B,et al.Characteristics,composition,and antioxidant activitiesinvitroandinvivoofGynostemmapentaphyllum(Thunb.) Makino seed oil [J].Journal ofthe Science of Food and Agriculture,2017,97:2084-2093.
[4] 曹峻岭,李祖伦,陈建武,等.火麻仁油对D-半乳糖致亚急性衰老模型小鼠血清NO、SOD、GSH-Px、MDA的影响 [J].四川中医,2005,23(3):29-30.
Cao J L,Li Z L,Chen J W,et al.The effect of Hemp seed oil on subacute aging model mice serum NO,SOD,GSH-Px,MDA induced by D-galactose [J].Journal of Sichuan Traditional Chinese Medicine,2005,23(3):29-30.
[5] 雷 鸣,朱祖健.D-半乳糖致衰老模型小鼠的保护作用 [J].解剖科学进展,2011,17(1):83-85.
Lei M, Zhu Z J.The research progress of D-galactose-induced aging [J].Progress of Anatomical Science,2011,17(1):83-85.
[6] 关 萍, 郭 搏, 王 蕙, 等.D-半乳糖促小鼠衰老模型的衰老程度与自然生长鼠龄的比较 [J].动物医学进展,2013,34(1):71-74.
Guan P,Guo B,Wang H,et al. Analysis on relativity of Aging degree between aging model mice caused by D-galactose and natural growth mice [J].Progress in Veterinary Medicine,2013,34(1):71-74.
[7] 黄玲玲,魏道智,吴亚妮,等.复方精油对D-半乳糖致衰老模型小鼠的保护作用 [J].上海交通大学学报(农业科学版),2012,30(6):32-35.
Huang L L,Wei D Z,Wu Y N,et al.The anti-aging effect of Compound essential oil on aging mice induced by D-galactose [J].Journal of Shanghai Jiaotong University (Agriculture Science Edition),2012,30(6):32-35.
[8] 莫艳秀,于美娟,莫永亮.林蛙油对D-半乳糖衰老模型小鼠的保护作用 [J].中国老年学杂志,2011,31(9):1603-1604.
Mo Y X,Yu M J,Mo Y L.The protection effect of oviductusranae on aging model induced by D-galactose [J].Chinese Journal of Gerontol,2011,31(9):1603-1604.
[9] 秦红兵,杨朝晔,范忆江,等.D-半乳糖诱导衰老小鼠模型的建立与评价 [J].中国组织工程研究与临床康复,2009,13(7):1275-1278.
Qin H B,Yang Z Y,Fan Y J,et al.Establishment and evaluation of aging model induced by D-galactoose in mice [J].Journal of Clinical Rehabilitative Tissue Engineering Research,2009,13(7):1275-1278.
[10] Chen J M,Li Y F,Zhu Q Q,et al.Anti-skin-aging effect ofEpigallocatechingallateby regulating epidermal growth factor receptor pathway on aging mouse model induced by D-galactose [J].Mechanisms of Ageing and Development,2017,164:1-7.
[11] 付少华,夏 莹,田 洁.环磷酰胺给予剂量及方式对小鼠骨髓微核率的影响 [J].卫生研究,2016,45(6):1018-1019.
Fu S H,Xia Y,Tian J.Effects of dose and model of cyclophosphamide on micronucleus rate of bone marrow in mice [J].Journal of Hygiene Research,2016,45(6):1018-1019.
[12] Jiang P Z,Ni Z Z,Wang B,et al.Acute toxicity, twenty-eight days repeated dose toxicity and genotoxicity of vanadyl tregalose in Kunming mice [J].Regulatory Toxicology and Pharmacology,2017,85:86-97.
[13] 张希桥,杨志华.关于精子畸变分型的参考意见 [J].卫生毒理学杂志,1995,9(1):46.
Zhang X Q,Yang Z H.Guidance on sperm aberration typing [J].Journal of Health Toxicology,1995,9(1):46.
[14] 刘世彪,谭秀梅,彭小列,等.绞股蓝种子油的提取、成分分析和急性毒性实验 [J].广西植物,2014,34(1):130-134.
Liu S B,Tan X M,Peng X L,et al.Extraction,composition and acute toxicity test of seed oil ofGynostemmapentaphyllum[J].Guihaia,2014,34(1):130-134.
[15] 虞精明,李志芳,方胜宇,等.一起误食桐油引起食物中毒事件的调查 [J].中国卫生检验杂志,2013,23(9):2201-2202.
Yu J M,Li Z F,Fang S Y,et al.An investigation case of eating with tung oil cause food poisoning [J].Chinese Journal of Health Laboratory Technology,2013,23(9):2201-2202.
[16] 冯银矿.急性桐油中毒17例临床分析 [J].中国社区医师,2015,31(7):109.
Feng Y K.Clinical analysis of 17 cases acute tung oil poisoning [J].Chinese Community Doctors,2015,31(7):109.
[17] 狄 明,张春玲,尹江宁,等.一起误食桐油引起食物中毒事件的调查 [J].中国卫生检验杂志,2014,24(24):3636-3637.
Di M,Zhang C L,Yi J N,et al.Analysis of ingestion of tung oil cause food poisoning [J].Chinese Journal of Health Laboratory Technology,2014,24(24):3636-3637.
[18] Tsuzuki T,Tokuyama Y,Igarashi M,et al.Tumor growth suppression by alpha-eleostearic acid, a linolenic acid isomer with a conjugated triene system,via lipid peroxidation [J].Carcinogenesis,2004,25(8):1417-1425.
[19] Kohno H,Yasui Y,Suzuki R,et al.Dietary seed oil rich in conjugated linolenic acid from bitter melon inhibits azoxymethane induced rat colon carcinogenesis through elevation of colonic PPARgamma expression and alteration of lipid composition [J].International Journal of Cancer,2004,110(6): 896-901.
[20] Dhar P,Ghosh S,Bhattacharyya D K.Dietary effects of conjugated octadecatrienoic fatty acid (9cis,11trans,13trans) levels on blood lipids and nonenzymaticinvitrolipid peroxidation in rats [J].Lipids,1999,34(2):109-114.
[21] Cahoon E B,Carison T J,Ripp K G,et al.Biosynthetic origin of conjugated double bonds:production of fatty acid components of high-vallue drying oils in transgenic soybean embryos [J].Proceedings of the Natioal Academy of Sciences of the United States of America,1999,96(22):12935-12940.
[22] Van Erp H,Shockey J,Zhang M,et al.Reducing isozyme competition increases target fatty acid accumulation in seed triacylglycerols of transgenicArabidopsis[J].Plant Physiology,2015,168(1):36-46.
[23] Yuan G F,Chen X E,Li D.Conjugated linolenic acids and their bioactivities:a review [J].Food&Function,2014,5:1360-1368.
[24] 殷 越,赵雪莹,李胜志.二至丸对D-半乳糖致衰老模型大鼠血脂含量影响的实验研究 [J].中医药信息,2009,26(1):75-77.
Yin Y,Zhao X Y,Li S Z. Experimental study on the effect of Erzhi Pill on blood lipid content in D-galactose-induced senile rat model [J].Information on Traditional Chinese Medicine,2009,26(1):75-77.
[25] 栾增强,曹文富,黄和贤,等.延衰合剂对D-半乳糖衰老小鼠血清SOD,MDA,IL-2和睾酮的影响 [J].中国药房,2011,22(7):589-591.
Luan Z Q,Cao W F,Huang H X,et al.Effects of Yanshuai mixture on serum SOD,MDA,IL-2 and testosterone of aging mice induced by D-galactose [J].China Pharmacy,2011,22(7):589-591.
[26] Zhen Y Z,Lin Y J,Li K J,et al.effects of rhein lysinate on D-galactose-induced aging mice [J].Exoerimnetal and Therapeutic Medicine,2016,11:303-308.
