大豆异黄酮对健康大鼠肝脏
2018-05-241、、1
1、、1
大豆异黄酮(soy isoflavone,SIF),又称植物雌激素,可对动物机体产生广泛影响,如影响激素分泌、代谢生物学活性、蛋白质合成、生长因子活性等。大量研究证明,SIF具有抑制脂肪沉积及降低血脂、血糖的作用[1-3]。肥胖及其相关疾病在亚洲发病率普遍较低,这与亚洲国家饮食中含有较多的大豆食品相关[4-5]。Chen等[6]研究表明,内源性大麻素及其相关蛋白与血糖、肥胖紧密相关,大麻素1型受体(CB1R)缺乏可使瘦素水平降低,导致血糖升高。内源性大麻素由CB1R转运至细胞,通过脂肪酰胺水解酶(FAAH)降解。二脂酰甘油酰基转移酶(DGAT1)是甘油三酯和脂滴合成的关键酶,在内源性大麻素AEA、2AG等脂质分子的合成中起重要作用。之前的研究表明,DGAT1的活性与肥胖、胰岛素抵抗等代谢性疾病有关[7]。CB1R、FAAH和DGAT1与脂质代谢密切相关,对脂肪的合成和分解平衡发挥着重要的作用[8]。虽SIF现已大量应用,但关于其对肝脏CB1R、FAAH和DGAT1表达的影响尚未见报道。为此,本试验主要检测SIF对大鼠肝脏CB1R、FAAH和DGAT1表达的影响,探讨其作用机制,以丰富SIF活性研究资料。
1 材料与方法
1.1 材 料
1.1.1 试验动物 试验动物为6周龄SD雄性大鼠,40只,体质量(228.44±11.06) g/只,购自成都达硕实验动物有限公司,使用许可证SCXK(川)2015-030。试验中对动物的处置符合中华人民共和国科学技术部《关于善待实验动物的指导性意见》。
1.1.2 主要试剂和仪器 主要试剂有:兔源CB1R抗体,武汉博士德生物工程有限公司;兔源FAAH抗体,美国GeneTex;兔源DGAT1抗体、山羊抗兔IgG,武汉博士德生物工程有限公司。RNAiso-Plus、Prime Script TMRT reagent Kit with gDNA eraser、SYBR®Premix ExTaqTMⅡ (Tli RNaseH Plus,购自大连宝生物工程有限公司。
主要仪器有:手动轮转式切片机(Leica RM2235),光学显微镜(Olympus BX41),生物数码显微镜(Nikon DS-Ril),大容量高速台式冷冻离心机(ST16)(Thermo Scientific),荧光定量PCR仪(Bio-Rad CFX96 touch)。
1.2 大鼠处理
将试验大鼠随机分为4组,每组10只,在自然光下饲养,自由饮水进食,第5天开始SIF干预。将大豆异黄酮溶于5 g/L羧甲基纤维素钠中,配制成质量浓度分别为0,25,125,250 mg/mL的溶液,按照2 mL/(kg·d)灌胃各组大鼠,实际SIF剂量分别为0 mg/kg(对照组)、50 mg/kg(SIF低剂量组) 、250 mg/kg(SIF中剂量组)、500 mg/kg (SIF高剂量组)),连续灌胃4周。所有大鼠按0.4 mL/hg腹腔注射 100 g/L水合氯醛麻醉,眼球采血2 mL/只后解剖,取肝脏组织于40 g/L多聚甲醛固定。
1.3 血液生化指标的测定
将采集的血样放入2 mL离心管,于4 ℃、4 000 r/min离心8 min,取血清。利用TBA-120FR 全自动生化仪检测血清中甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白 (LDL)和高密度脂蛋白(HDL)浓度。
1.4 大鼠肝脏石蜡及冰冻切片制备
取经40 g/L多聚甲醛液处理的大鼠肝脏组织,经流水冲洗24 h,体积分数75%,85%,95%和100%乙醇梯度脱水,甲苯透明2 h,58 ℃烘箱浸蜡2 h,石蜡包埋,制成5 μm厚的切片,载玻片用体积分数10%的多聚赖氨酸处理,置于烘箱4 h后于4 ℃保存备用。另取肝脏组织用300 g/L蔗糖溶液脱水过夜,冰冻切片(20 μm)备用。
1.5 鼠肝脏组织学结构的检测
每只大鼠各取5张肝脏切片,HE染色,中性树胶封片,镜检,观察肝组织病理学变化。
1.6 大鼠肝脏脂滴沉积量的测定
采用油红O染色法检测肝脏脂滴含量。将新鲜配制的油红O滴于大鼠肝脏冰冻切片上,室温静置20 min,用体积分数60%的异丙醇脱色,PBS润洗后甘油明胶封片,在光学显微镜下观察肝脏脂滴并记录拍照(20×)。每只大鼠肝脏组织切片选择15个视野统计脂滴面积(μm2),以之代表脂滴沉积量。
1.7 大鼠肝脏CB1R、FAAH和DGAT1蛋白表达量的测定
每只大鼠取5张肝脏切片,用SABC免疫组织化学法检测CB1R、FAAH、DGAT1蛋白的表达。切片按照常规步骤脱蜡至复水,在体积分数3% H2O2中浸泡20 min,蒸馏水清洗3次,每次5 min(下同),柠檬酸盐缓冲液高压修复2~3 min,PBS清洗3次,山羊血清37 ℃封闭30~40 min,PBS稀释的一抗(阴性对照用PBS代替一抗)4 ℃过夜,PBS洗3次,生物素化山羊抗鼠IgG 37 ℃ 60 min,PBS洗3次,SABC 37 ℃ 30 min,PBS洗3次,DAB显色,蒸馏水终止反应,脱水、透明封片,镜检拍照(40×)。每个蛋白在每只大鼠肝脏组织切片选择6个视野,用江苏捷达形态分析软件统计积分光密度值,以之代表蛋白表达量。
1.8 大鼠肝脏CB1R、FAAH和DGAT1 mRNA表达量的检测
采用实时荧光定量PCR法(qPCR)测定大鼠肝脏CB1R、FAAH和DGAT1 mRNA的表达量,以β-actin基因为内参,各基因上下游引物(由大连宝生物有限公司合成)见表1。提取大鼠肝组织总RNA并检测其质量后进行反转录,获取cDNA。qPCR反应体系为25 μL: cDNA模板1 μL,上、下游引物各1 μL,无菌水9.5 μL, SYBR荧光染料12.5 μL。反应程序为:95 ℃预变性5 min;95 ℃ 10 s,58 ℃ 30 s,72 ℃ 10 s, 40个循环。

表1 实时荧光定量PCR引物序列Table 1 Sequences of real-time fluorescence quantitative PCR primers
cDNA样品设置3个重复, 反应结束后采集目标基因和内参基因的循环阈值(Ct)平均值,利用2-ΔΔCt相对定量法计算相对表达量,结果取平均值为最终测定结果。荧光定量PCR采用B10-RAD CFX96序列检测系统检测。
1.9 统计学分析
试验所得数据均利用SPSS 20.0统计软件进行单因素方差分析(one-way ANOVA),数据以“平均值(Means)±标准差(SD)”表示。
2 结果与分析
2.1 大豆异黄酮对大鼠血清生化指标的影响
大豆异黄酮对大鼠血液生化指标的影响如表2所示。

表2 大豆异黄酮(SIF)对大鼠血液生化指标的影响Table 2 Effects of SIF on biochemical indicators of rats mmol/L
注:同列数据后标不同小写字母表示差异显著(P<0.05);标不同大写字母表示差异极显著(P<0.01)。
Note:Different lowercase letters in each column indicate significant different (P<0.05),and different capital letters indicate extremely significant difference (P<0.01).
由表2可知,在SIF干预4周后,与对照组相比,SIF低剂量组大鼠总胆固醇浓度显著下降(P<0.05);低密度脂蛋白浓度有所下降,但差异不显著(P>0.05)。中剂量组总胆固醇、甘油三酯和低密度脂蛋白浓度显著下降(P<0.05)。高剂量组总胆固醇浓度显著下降(P<0.05),低密度脂蛋白浓度极显著下降(P<0.01)。高密度脂蛋白浓度各组间差异均不显著(P>0.05)。
2.2 SIF对大鼠肝脏组织学结构的影响
肝脏组织学观察(图1)发现,与对照组相比,SIF各剂量组大鼠肝脏肝小叶结构完整,未见异常病理变化。

A、B、C、D分别为对照组及大豆异黄酮低、中、高剂量组。图2同A,B,C and D are control group,low,medium and high dose groups,respectively.The same for Fig.2图1 大豆异黄酮对大鼠肝脏组织学结构的影响(HE染色,20×)Fig.1 Effects of SIF on histological structure of liver of rats (HE staining,20×)
2.3 SIF对大鼠肝脏脂滴沉积量的影响
大鼠肝脏脂滴含量检测结果(图2,3)显示,随SIF剂量的增大,大鼠肝脏脂滴含量下降;与对照组相比,低、中、高SIF剂量组大鼠肝脏脂滴沉积量均极显著降低(P<0.01);且SIF低剂量组脂滴沉积量极显著高于SIF中、高剂量组(P<0.01)。
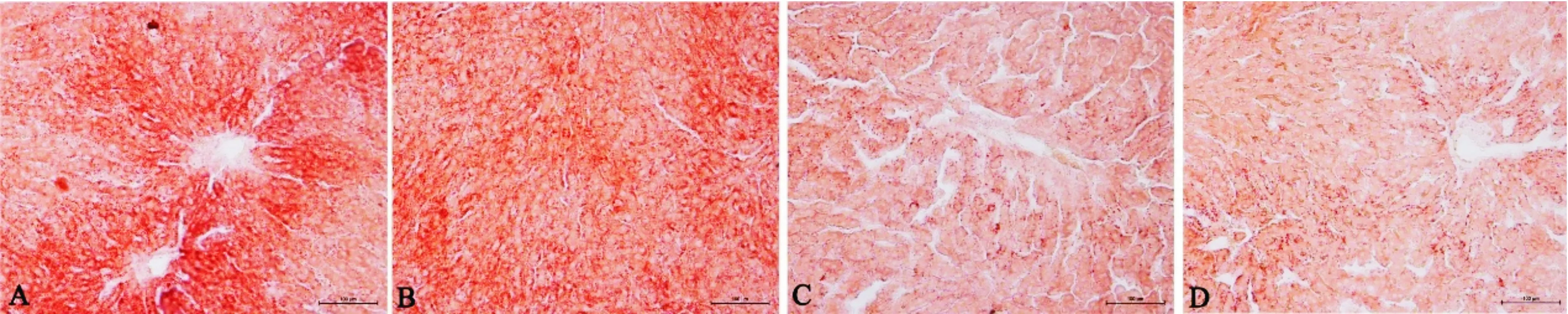
图2 大豆异黄酮对大鼠肝脏脂滴含量的影响(油红O染色,20×)Fig.2 Effects of SIF on lipid content in liver of rats (Oil red O staining,20×)
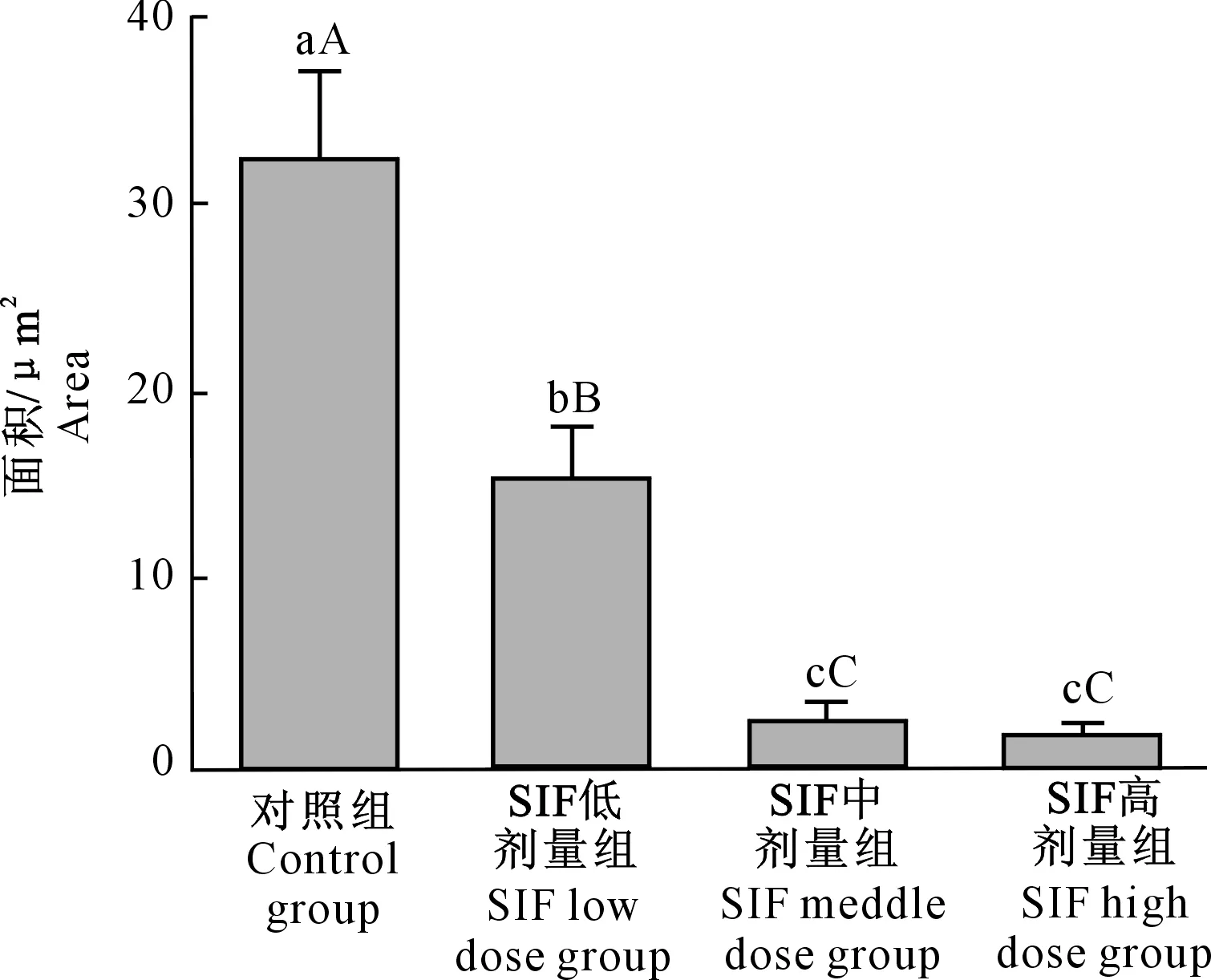
图柱上标不同小写字母表示差异显著(P<0.05),标不同大写字母表示差异极显著(P<0.01)Different lowercase letters indicate significant different among treatments(P<0.05),and different capital letters indicate extremely significant difference (P<0.01)图3 大豆异黄酮(SIF)对大鼠肝脏脂滴沉积的影响Fig.3 Effects of SIF on lipid deposition in liver of rats
2.4 SIF对大鼠肝脏CB1R、FAAH和DGAT1蛋白表达的影响
SIF对大鼠肝脏CB1R、FAAH和DGAT1蛋白表达的影响结果如图4、5所示。由图5-A可知,与对照组相比,低剂量组大鼠肝脏中DGAT1和CB1R表达量显著降低(P<0.05),FAAH 表达量显著增多(P<0.05),中、高剂量组CB1R、FAAH和DGAT1表达量均极显著增多(P<0.01);3个SIF处理组间CB1R、FAAH和DGAT1表达量均随SIF剂量的增加而增大。
2.5 SIF对大鼠肝脏CB1R、FAAH和DGAT1 mRNA表达的影响
SIF对大鼠肝脏中CB1R、FAAH和DGAT1 mRNA表达量的影响结果见图5。由图5-B可知,与对照组相比,低剂量组大鼠肝脏CB1RmRNA表达量显著降低,FAAH、DGAT1 mRNA表达量均极显著降低(P<0.01);中剂量组CB1RmRNA显著增多(P<0.05),FAAHmRNA表达量差异不显著,DGAT1 mRNA表达量极显著降低(P<0.01);高剂量组中,CB1R和FAAHmRNA表达量极显著增多(P<0.01),而DGAT1 mRNA表达量无显著变化。3个SIF处理组之间,CB1R、FAAH和DGAT1 mRNA表达量均呈现出随SIF剂量增加而增多的趋势。
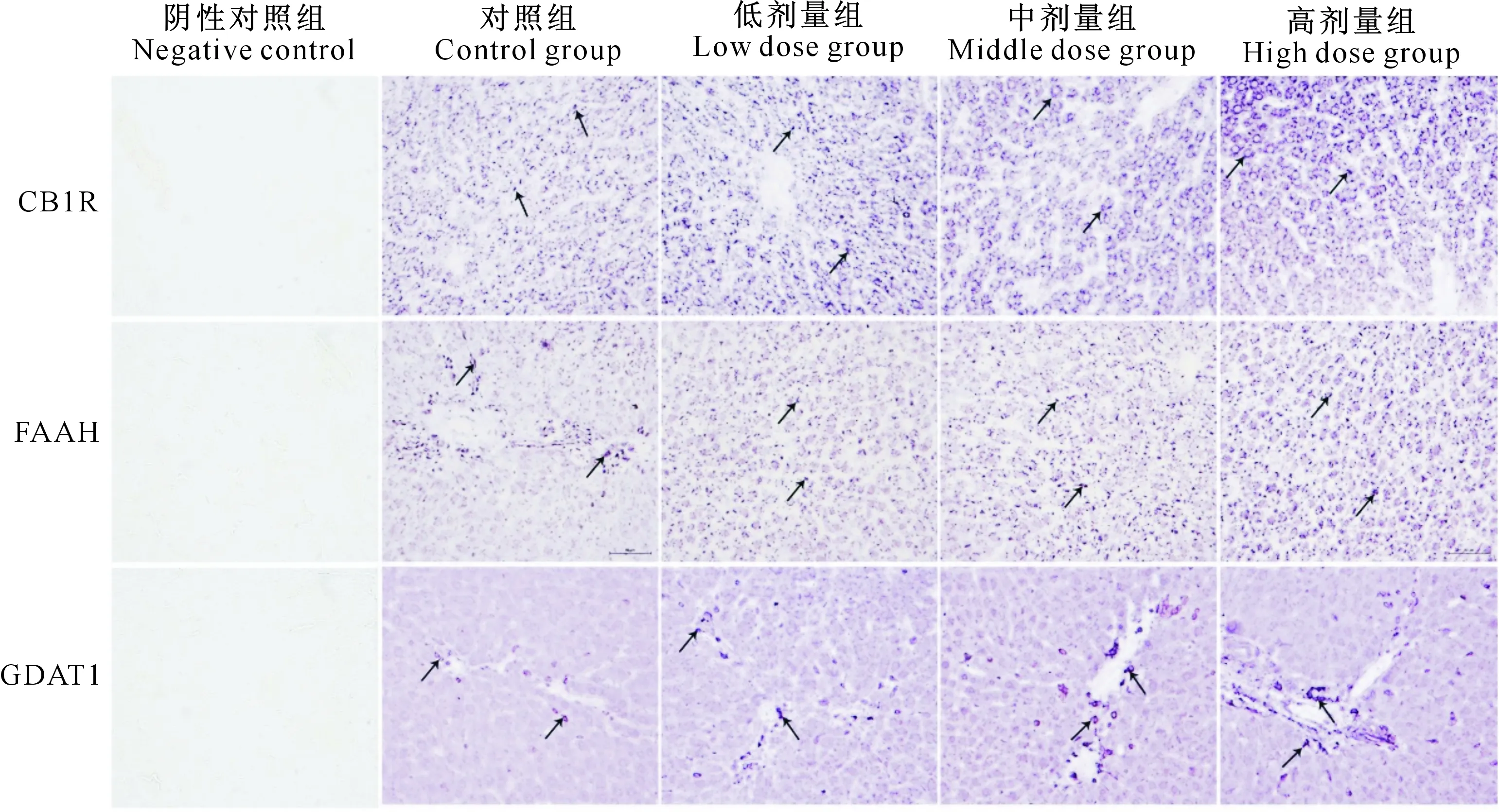
图中箭头指示阳性细胞Arrows indicate positive cells图4 大豆异黄酮(SIF)对大鼠肝脏CB1R、FAAH、DGAT1蛋白表达的SABC免疫组织化学染色检测 (40×)Fig.4 Effects of SIF on expression of CB1R,FAAH and DGAT1 in rat liver by SABC immunohistochemical staining (40×)

同一指标不同处理相比,图柱上标不同小写字母表示差异显著(P<0.05),标不同大写字母表示差异极显著(P<0.01)Among the treaments,different lowercase letters indicate significant difference (P<0.05),and different capital letters indicate extremely significant difference (P<0.01).对照组;.SIF低剂量组;.SIF中剂量组;.SIF高剂量组.Control group;.SIF low dose group;.SIF meddle dose group;.SIF high dose group
3 讨 论
肥胖是糖尿病、冠状动脉疾病、动脉粥样硬化[9]、呼吸道疾病和一系列癌症[10]的诱发因素。Kelly等[11]预测,2030年全球肥胖患者将超过11.2亿。调查发现,2011-2012年美国20岁以上的成年人中肥胖者占34.9%[12]。在我国,2002年的调查显示,成年人肥胖发生率已上升到29.9%[13]。SIF又称植物雌激素,其与雌激素结构和功能相似,通过调节一些参与脂质代谢蛋白的表达改善血脂异常和肝脏脂质积累[14-15],进而减轻肥胖症状。有研究报道,SIF有益于脂肪性肝病、肥胖及其相关性代谢性并发症,例如氧化应激、胰岛素抵抗、炎症和脂质异常[1],有降低体质量、改善血脂的作用[16]。Crespillo等[17]、Potter等[18]研究表明,大豆异黄酮能降低动物体内脂肪。然而不同剂量的SIF对健康大鼠肝脏CB1R、FAAH和DGAT1表达的影响仍不明确。本试验油红O染色结果显示,SIF低、中、高剂量组大鼠肝脏中脂滴含量显著减少,表明SIF可抑制肝脏脂滴的合成,促进脂滴水解,并且可能还与过多食用大豆异黄酮对其肝脏造成损伤有关。
有关试验表明,CB1R、FAAH和DGAT1与脂质代谢密切相关[8]。脂酰辅酶A与甘油二脂合成为甘油三脂的关键酶是DGAT1,DGAT1也是形成脂滴的关键酶[19]。大麻素花生四烯酰乙醇胺和花生四烯酰甘油是抑制肿瘤增殖的2种脂质,其经CB1R转运至细胞,通过FAAH灭活[20]。研究发现,在慢性丙型肝炎患者的肝组织中,内源性大麻素及 CB1R 表达量升高,而FAAH 降低[21]。CB1R活化可使体质量增加[6],CB1R受体拮抗剂能减少食物摄入、腹部肥胖,调节新陈代谢紊乱[22]。本试验结果显示,低剂量SIF可以显著抑制大鼠肝脏CB1R、DGAT1的表达,而促进FAAH的表达;中、高剂量的SIF可以极显著促进肝脏CB1R、FAAH、DGAT1的表达,这与Crespillo等[17]及Chen等[23]的研究结果基本一致;SIF中、高剂量组肝脏CB1R表达量未减反增,结合Yang等[24]报道的SIF具有雌激素活性和抗雌激素活性双重作用的结果,笔者推测高剂量的SIF可能产生了抗雌激素的作用。
综上所述,低剂量SIF能显著或极显著降低肝脏CB1R、FAAH、DGAT1的表达,高剂量的SIF则可以显著增高CB1R、FAAH、DGAT1的表达,因此大豆异黄酮可以通过大麻素相关蛋白调控肝脏脂质代谢,且具有较明显的剂量关系。
[参考文献]
[1] Orsolya M,William J B,Richard W S,et al.Soy isoflavones exert antidiabetic and hypolipidemic effects through the PPAR pathways in obese zucker rats and murine RAW 264.7 cells [J].The Journal of Nutrition,2003,133(5):1238-1243.
[2] Cederroth C R,Vinciguerra M,Gjinovci A,et al.Dietary phytoestrogens activate AMP-activated protein kinase with improvement in lipid and glucose metabolism [J].Diabetes,2008,57(5):1176-1185.
[3] 陈晓林,罗启慧,唐秀莹,等.SIF干预肥胖大鼠下丘脑瘦素介导JAK/STAT信号通路的研究 [J].浙江农业学报,2016,28(3):420-427.
Chen X L,Luo Q H,Tang X Y,et al.Study of leptin-dependent signaling JAK/STAT in hypothalamus after treated by SIF on obese rats [J].Acta Agriculturae Zhejiangensis,2016,28(3):420-427.
[4] Llaneza P,González C,Fernandez I J,et al.Soy isoflavones,diet and physical exercise modify serum cytokines in healthy obese postmenopausal women [J].Phytomedicine,2011,18(4):245-250.
[5] 李立科,罗启慧,唐秀莹,等.大豆异黄酮对肥胖大鼠肠道瘦素介导 Janus激酶/信号转导及转录激活因子信号转导通路的影响 [J].动物营养学报,2016,28(8):2448-2457.
Li L K,Luo Q H,Tang X Y,et al.Effects of soybean isoflavone on signaling transduction path of Leptin-dependent janus kinase/signal transduction and activator of transcription in intestine of obese rats [J].Chinese Journal of Animal Nutrition,2016,28(8):2448-2457.
[6] Chen L,Peter M J,Shanta J P.Role of the endocannabinoid system in food intake,energy homeostasis and regulation of the endocrine pancreas [J].Pharmacology and Therapeutics,2011,129(3):307-320.
[7] Daisuke T,Chihiro O,Yukihito I,et al.JTT-553,a novel Acyl CoA:diacylglycerol acyltransferase (DGAT) 1 inhibitor,improves glucose metabolism in diet-induced obesity and genetic T2DM mice [J].J Pharmacol Sci,2015,129(1):51-58.
[8] 邓 佳.二脂酰甘油酰基转移酶及脂肪酰胺水解酶在结直肠癌中的表达及临床意义 [D].重庆:第三军医大学,2012.
Deng J.The expression of DGATl and FAAH and their clinical significances in colorectal cancer [D].Chongqing:Third Military Medical University,2012.
[9] Wooton A K,Melchior L M.Obesity and type 2 diabetes in our youth:a recipe for cardiovascular disease [J].The Journal for Nurse Practitioners,2017,13(3):222-227.
[10] Flegal K M,Graubard B I,Williamson D F,et al.Cause-specific excess deaths associated with underweight,overweight,and obesity [J].Journal of the American Medical Association,2007,298(17):2028-2037.
[11] Kelly T,Yang W,Chen C S,et al.Global burden of obesity in 2005 and projections to 2030 [J].International Journal of Obesity,2008,32(9):1431-1437.
[12] Ogden C L,Carroll M D,Kit B K,et al.Prevalence of childhood and adult obesity in the United States,2011-2012 [J].Journal of the American Medical Association,2014,311(8):806-814.
[13] 武阳丰,马冠生,胡永华,等.中国居民的超重和肥胖流行现状 [J].中华预防医学杂志,2005,39(5):316-320.
Wu Y F,Ma G S,Hu Y H,et al.The current prevalence status of body overweight and obesity in China [J].Chinese Journal of Preventive Medicine,2005,39(5):316-320.
[14] Ivan T V,Armando R T,Victoria E,et al.Soy protein ameliorates metabolic abnormalities in liver and adipose tissue of rats fed a high fat diet [J].Nutrition,2008,138(3):462-468.
[15] Badger T M,Ronis M J J,Wolff G,et al.Soy protein isolate reduces hepatosteatosis in yellow Avy/a mice without altering coat color phenotype [J].Experimental Biology and Medicine,2008,233(10):1242-1254.
[16] Deborah G G,Donna K S.Usual dietary isoflavone intake is associated with cardiovascular disease risk factors in postmenopausal women [J].The Journal of Nutrition,2001,131(4):1202-1206.
[17] Crespillo A,Alonso M,Vida M,et al.Reduction of body weight, liver steatosis and expression of stearoyl-CoA desaturase 1 by the isoflavone daidzein in diet-induced obesity [J].British Journal of Pharmacology,2011,164(7):1899-1915.
[18] Potter S M,Baum J A,Teng H,et al.Soy protein and isoflavones:their effects on blood lipids and bone density in postmenopausal women [J].The American Journal of Clinical Nutrition,1998,68(6):1375-1379.
[19] Charles A H,Joel T H,Ryan S S,et al.DGAT enzymes are required for triacylglycerol synthesis and lipid droplets in adipocytes [J].The Journal of Lipid Research,2011,52(4):657-667.
[20] Pushkarev V M,Kovzun O I,Tronko M D.Antineoplastic and apoptotic effects of cannabinoids.N-acylethanolamines:protectors or killers? [J].Experimental Oncolgy,2008,30(1):6-21.
[21] 孙丽杰,万 琳,张晓宇,等.胰岛素抵抗的慢性丙型肝炎患者外周血及肝组织内源性大麻素系统的变化 [J].肝脏,2014(2):87-90.
Sun L J,Wan L,Zhang X Y,et al.The change of endocannabinoid system in the peripheral circulation and liver in patients with chronic hepatitis C and insulin resistance [J].Chinese Hepatology,2014(2):87-90.
[22] Isabel M,Vincenzo D M.Endocannabinoids and the control of energy balance [J].Trends in Endocrinology and Metabolism,2007,18(1):27-37.
[23] Chen N,Liu L,Zhang Y,et al.Whole-body insulin resistance in the absence of obesity in FVB mice with overexpression of Dgat1 in adipose tissue [J].Diabetes,2005,54(12):3379-3386.
[24] Yang J,Nakagawa H,Tsuta K,et al.Influence of perinatal genistein exposure on the development of MNU-induced mammary carcinoma in female Sprague-Dawley rats [J].Cancer Letters,2000,149(1):171-179.
