肿瘤源性血管内皮细胞的培养及靶向CD105能力测定*
2018-05-24杨华龚明福徐建众邹利光张松
杨华 龚明福 徐建众 邹利光 张松
(1.重庆市中医院放射科,重庆400021;2. 第三军医大学新桥医院放射科,重庆400037)
肿瘤的发生、发展呈血管依赖性,肿瘤血管的生成在肿瘤生长、侵袭和转移过程中起着重要作用,抗肿瘤血管生成一直是肿瘤治疗的研究热点。体外肿瘤血管内皮细胞(vascular endothelial cells,VECs)试验是目前研究肿瘤血管生成及抗肿瘤血管生成治疗主要的研究手段。由于肿瘤血管的内皮细胞(tumor-derived vascular endothelial cells,Td-VECs)与正常血管的内皮细胞在结构、分子表达和功能上有质的不同[1],因而研究肿瘤血管生成不能以正常VECs替代。然而,直接分离、培养肿瘤Td-VECs技术要求高,尤其是肿瘤新生血管的内皮细胞更是难以获得。研究表明[2,3]:通过模拟肿瘤环境,可以通过肿瘤因子诱导正常VECs向Td-VECs分化,然而,目前国内相关文献报道较少,尤其是针对细胞标记简单有效的Td-VECs培养方法更是鲜有报道。因而,本研究描述了一种简易、方便、可靠的Td-VECs培养方法,并对Td-VECs的分子表达及靶向结合能力进行分析,以期为靶向抗肿瘤血管生成提供细胞基础。
1 材料与方法
1.1 主要的细胞、试剂与仪器 MDA-MB-231乳腺癌细胞由第三军医大学生物化学及分子生物学教研室惠赠;内皮细胞培养及染色试剂均购自美国sigma公司、Hyclone公司及Abcam公司;M199细胞培养液购自Hyclone公司;DAPI染色液购自美国Roche公司;内皮细胞培养支持物(ECGS)购自美国Sciencecell公司;Millicell小室购自美国Millipore公司;总RNA提取试剂、TriZOL试剂及DEPC水购自上海碧云天生物技术有限公司。超净台为苏州洁净化设备公司,核算仪为美国Bio-Rad公司生产,倒置显微镜和TCSSP5激光共聚焦显微镜为德国徕卡公司。
1.2 方法
1.2.1 人脐静脉内皮细胞(HUVECs)的分离、培养 超净台常规消毒、灭菌。原代内皮细胞培养基由1 mL谷氨酰胺、20mL胎牛血清、1mL肝素及1mL ECGS加入到80mL M199培养基中制成。取长约20cm新鲜婴儿脐带,剪去机械损伤的部分。在脐静脉两头套上三通管,手术缝线固定,预冷的PBS液反复冲洗管腔以去除其内残留血液,气体排净PBS液。将0.1% I型胶原酶10mL注入管腔内,关闭三通管后将脐带置入广口瓶中,37℃细胞孵箱内消化。15min后取出脐带,收集消化液1000转/分离心5min,弃上清,新鲜培养液重悬细胞于50mL一次性培养瓶中培养。倒置显微镜每天观察细胞生长情况,两天更换一次培养液,细胞铺满瓶底约90%时进行1:2传代。
1.2.2 HUVECs的鉴定 取第3代HUVECs以1×105/孔的密度接种于铺有多聚赖氨酸(PLL)溶液包被的盖玻片的6孔板中培养,待细胞爬片后以预冷的丙酮酸溶液固定,3%牛血清蛋白(BSA)封闭。将抗CD34抗体按梯度稀释为1:50、1:100、1:150和1:200四个浓度,分别滴加到盖玻片上,以PBS为对照,置于载玻片上4 ℃孵育过夜。将带有FITC标记的2抗稀释1500倍,滴加到盖玻片上,37℃避光湿盒中孵育1h。DAPI显色15min,防淬灭封片液封片,激光共聚焦显微镜下观察。
1.2.3 MDA-MB-231乳腺癌细胞与HUVECs共培养 将人HUVECs按细胞密度5×104/孔接种于六孔板,在培养箱中孵育12h使细胞贴壁,然后将接种有5×104/孔密度人乳腺癌细胞MDA-MB-231的Millicell小室放入六孔板中,继续培养3d后收获六孔板内的目标细胞。
1.2.4 Td-VECs的鉴定 ①PCR引物的设计,美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)检索人肿瘤血管内皮标志物Tem1、Tem8和人actin蛋白的基因序列,设计PCR引物如下:Tem1: LEFT PRIMER:983 21 61.11 52.38 4.00 1.00 actacgttggtggcttcgagt,RIGHT PRIMER:1271 23 59.79 52.17 2.00 1.00 tagggtatctgtggctctctgtc;Tem8: LEFT PRIMER:1183 21 62.20 52.38 3.00 0.00 gaggttcgttggggagaaaag,RIGHT PRIMER:950 21 61.70 52.38 4.00 2.00 atctccttctgcatcctgtcg;actin: LEFT PRIMER:357 22 60.76 50.00 4.00 2.00 gacccagatcatgtttgagacc,RIGHT PRIMER:950 21 61.70 52.38 4.00 2.00 atctccttctgcatcctgtcg。交由Takara(大连)生物工程有限公司合成。②Td-VECs总RNA提取,取六孔板中生长良好的细胞,加入1 mL Trizol溶液,机械吹打,充分裂解,离心管内室温放置5min。加入0.2 mL氯仿,剧烈摇动15s,室温放置3min。4℃下,12000转/分离心15min,吸取上层无色水相至新的离心管中,加入0.5 mL异丙醇,混匀后室温沉淀10min。4℃下,12000转/分离心10min,弃上清。加入1 mL DEPC水配制的75%乙醇,颠倒混匀,4℃下,7500转/分离心5min,弃上清。加入20uL DEPC水溶解后取少许在核酸仪上测量核酸的含量。③Td-VECs的聚合酶链反应,双蒸水溶解合成的Tem1、Tem8和actin引物,根据逆转录聚合酶链反应(Reverse Transcription-Polymerase Chain Reaction,RT-PCR)试剂盒的操作说明配制成25uL的反应体系。设置程序,将Tem1、Tem8和actin的退火温度分别设为53 ℃、51 ℃和52 ℃,循环数定为30个。将合成的DNA产物置于1%琼脂糖凝胶加样孔中电泳,1h后置于紫外灯下看结果。
1.2.5 Td-VECs免疫荧光染色 诱导后的VECs经预冷丙酮溶液固定15min后BSA封闭30min,将抗CD105抗体按梯度稀释为1:50、1:100、1:150和1:200四个浓度,分别滴加到盖玻片上,以PBS为对照,4℃湿盒内孵育过夜。将带FITC标记的二抗稀释1500倍滴加到盖玻片上,避光湿盒中37℃孵育1h,DAPI显色15min, PBS清洗后防淬灭封片液封片,激光共聚焦显微镜下观察,以未诱导的VECs对比,了解CD105表达的程度是否有差异。
1.2.6 靶向CD105纳米粒细胞标记 取经MDA-MB-231细胞诱导后处于对数生长期的VECs。以1x105/孔的密度接种于铺有PLL溶液包被的盖玻片的6孔板中,常规培养待细胞爬片。分别以铁浓度为0、0.5、1、2、5 、10ug/mL向诱导后的VECs内加入靶向CD105的CL-PEG-MnFe2O4纳米粒(为靶向CD105结合肽的磁性纳米粒,已在另文中详述[4]),每个浓度设3个复孔。孵育24h后固定,常规普鲁士蓝染色,倒置显微镜下观察、摄片,任意取30个视野行阳性细胞计数,计算细胞标记阳性率:标记阳性率=视野内阳性细胞数/视野内细胞总数 ×100%。以未诱导VECs为对照。实验中注意避光操作。
2 结果
2.1 HUVECs的分离、培养和鉴定 从脐带取材到完成细胞分离整个过程大致需要2h。原代细胞培养12h后可见细胞贴壁;48h细胞铺满瓶底约30%,呈梭形或小圆形,细胞浆、细胞核显示清晰;4d后观察,细胞呈梭形,贴壁生长,铺满瓶底约60~70%,呈“铺路石”样改变;6d后,细胞铺满瓶底约90%,部分区域呈簇状生长,出现细胞重叠,进行第一次传代(见图1)。此后3d进行一次细胞传代。细胞CD34免疫荧光染色(见图2),可见细胞呈CD34阳性,胞膜呈绿色荧光,胞核呈蓝色荧光,而PBS对照只见蓝色胞核,未见绿色荧光的细胞膜。

图1 不同时段分离细胞的培养(×200)Figure 1 Culture of isolated cells at different time periods

图2 分离细胞的CD34免疫荧光染色Figure 2 CD34 immunofluorescence staining of isolated cells注: a、b. 为CD34标记细胞; c. 为PBS对照
2.2 Td-VECs的培养和CD105靶向能力鉴定 诱导后VECs总RNA的RT-PCR反应显示,所获得的DNA产物大小分别为594 bp、289 bp和321 bp,符合actin、Tem1和Tem8的DNA链长,电泳结果显示诱导细胞的Tem1和Tem8表达量明显增高(见图3),具有Td-VECs的特性。Td-VECs的CD105免疫荧光染色(见图4),呈CD105阳性,细胞膜见红色荧光,胞核呈蓝色荧光,而PBS对照组只见胞核蓝色荧光,未见红色荧光的细胞膜,且诱导后的VECs荧光强度强于未诱导的内皮细胞。在铁浓度为0、0.5、1、2、5 、10ug/mL时,共同孵育24h后,诱导后和未诱导的VECs的标记率分别为0%、(25.35±4.23)%、(58.07±4.12)%、(86.68±3.42)%、100%、100%和0%、(10.58±2.62)%、(16.31±4.32)%、(46.33±3.42)%、(77.62±4.13)%、100%,诱导后细胞与靶向CD105纳米粒的结合力明显强于未诱导细胞,见图5。
3 讨论
血管内皮细胞为内衬在血管腔面的单层细胞。除在肺部帮助进行气体交换外,血管内皮细胞更多的是在受体的存在下调节血细胞及多种生物活性分子(如:凝血蛋白、生长因子、脂蛋白和激素等)的量。此外,内皮细胞在很多生理过程中也起着重要作用:通过促血栓形成因子和抗血栓形成因子的表达调节止血;与内皮下细胞外基质和平滑肌的协同来调节血管紧张素酶-I的转化、血管活性胺的代谢及缓激肽的降解;内皮细胞还借助表面抗原、细胞因子和粘附分子的合成参与炎症及免疫应答的过程[5,6]。
尽管脐静脉内皮细胞并不能确切代表人体各个器官、不同类型内皮细胞的生理、代谢及毒性反应过程,但由于取材方便,分离、培养方法简单,且一次性获取细胞量大,依然是目前应用最广泛的内皮细胞模型。参考Jaffe等[7]的内皮细胞分离方法,我们将取材到内皮细胞分离完成的整个过程缩短到2h,不仅提高效率,同时也最大限度的保护内皮细胞不受损伤。诸如CD31、CD34、CD54、CD106、血管紧张素、细胞内粘附分子-1(ICAM-1)、血管粘附分子-1(VCAM-1)、Ⅷ因子等均为内皮细胞标志物,其中,CD31、CD34的是目前最常用的内皮细胞标志物[8]。我们的结果显示:第3代细胞CD34免疫荧光染色呈CD34阳性,说明所获得的细胞为HUVECs。

图3 诱导后VECs的PCRFigure 3 PCR after induction of VECs
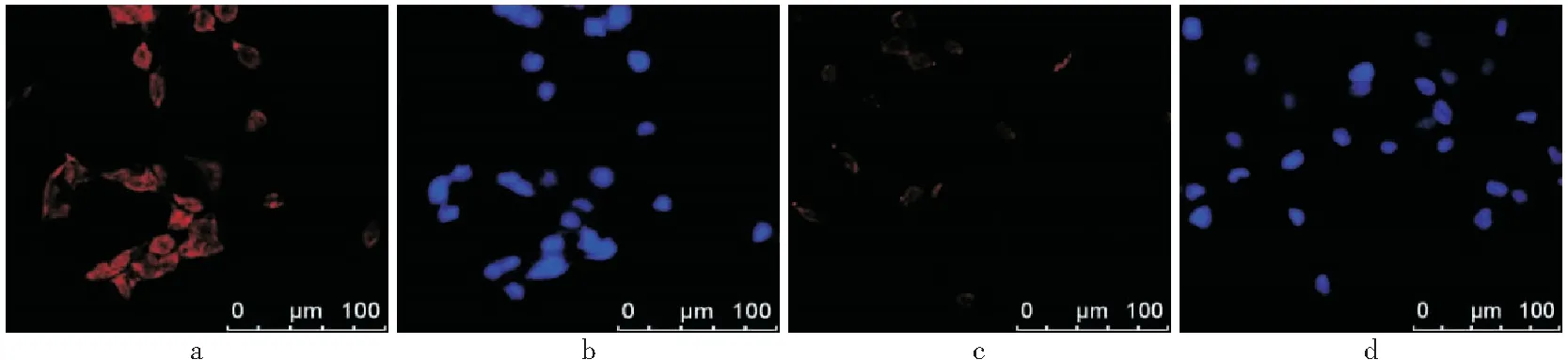
图4 血管内皮细胞的免疫荧光染色Figure 4 Immunofluorescence staining of vascular endothelial cells 注:a、b. 诱导后VECs的CD105染色; c. 未诱导的VECs的CD105染色; d.诱导后VECs的PBS对照
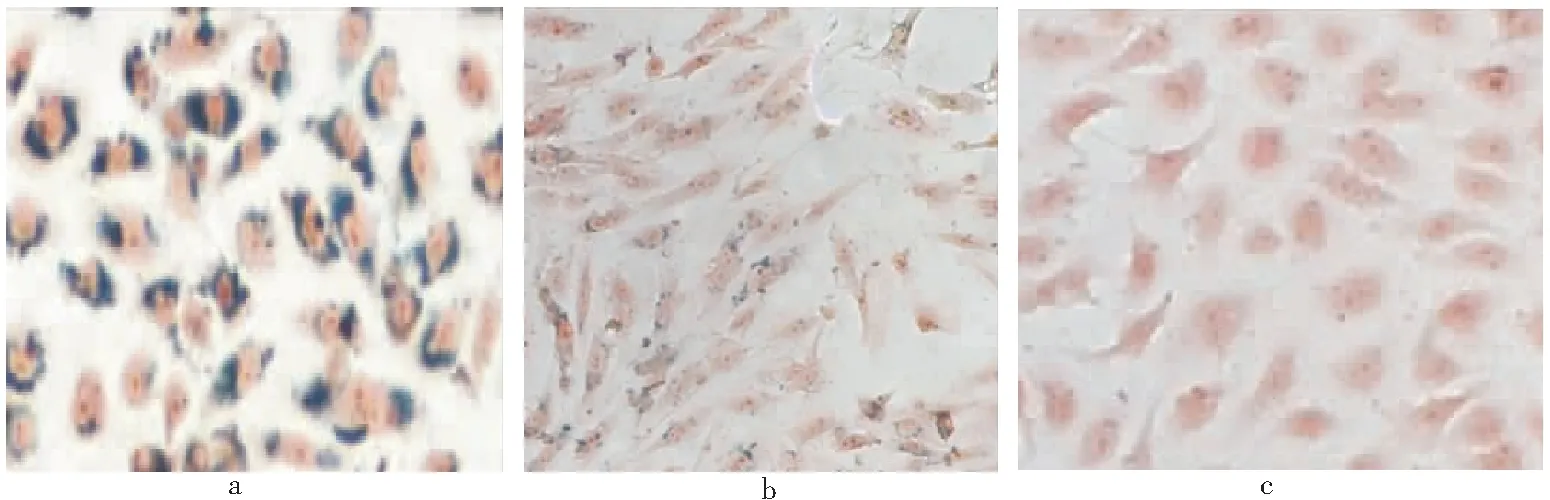
图5 铁浓度为5ug/mL的CL-PEG-MnFe2O4标记细胞的普鲁士蓝染色(×200)Figure 5 Prussian blue staining of CL PEG MnFe 2O4 labeled cells with iron concentration of 5ug/mL注: a、b. 分别为诱导后及未诱导VECs; c.为诱导后VECs的PBS对照
细胞数量的扩增可以通过传代培养来实现,但细胞会随着传代次数的增加而加速衰老和自发性的凋亡,从而使很多蛋白(如:前列环素和血管紧张素I等)的表达逐渐减少,通常,应选择第3-4代细胞进行下一步实验[9]。同时,在细胞培养的过程中所添加的外源性生长因子及其代谢产物也可能会改变细胞蛋白的合成和转运[10]。因而,为最大限度的模拟内皮细胞特性,在细胞培养过程中,应尽可能选用内皮细胞专用培养基,且在培养过程中尽量避免添加任何促细胞生长因子。
由于从肿瘤组织中分离Td-VECs操作难度大,且分离细胞数量少、培养困难,因而学者们多采用HUVECs替代以解决Td-VECs难以获得的问题。研究表明[11]:由肿瘤细胞自分泌和(或)旁分泌的血管因子,可刺激血管内皮细胞向Td-VECs分化,诱导内皮细胞增殖、迁移和管腔生成。Khodarev[12]利用transwell小室将HUVECs和U87MG人神经胶质瘤细胞进行共培养,结果显示:HUVECs在形态、表型及功能变化等方面具有了Td-VECs的特性。同样,Mikhaylova等采用millicell小室成功诱导人真皮淋巴管内皮细胞(HDLECs)向乳腺癌淋巴管内皮细胞分化[13]。因而,为了模拟Td-VECs生长的内环境,我们采用了膜孔径为0.4微米的millicell小室建立了内皮细胞与肿瘤细胞共培养模型,小室内的内皮细胞不能透过微孔膜,而下室肿瘤细胞分泌的细胞因子能够通过微孔膜进入上层Millicell小室内,从而模拟形成肿瘤内皮细胞生长环境。经诱导后内皮细胞总RNA的RT-PCR反应及DNA电泳结果显示:诱导后内皮细胞的Tem1和Tem8表达量明显增高,由于Tem1和Tem8仅在肿瘤血管内皮细胞上表达,说明诱导后的血管内皮细胞具有Td-VECs的特性。
CD105是内皮细胞膜上的一种糖蛋白,在处于增殖状态的肿瘤新生血管内皮细胞过表达,且CD105的表达水平与内皮细胞的增殖程度密切相关,基于CD105染色的肿瘤微血管密度与肿瘤的预后高度相关[14]。因而,可以将CD105作为分子靶标用于检测所诱导血管内皮细胞的Td-VECs特性。结果显示诱导后的VECs荧光强度强于未诱导的内皮细胞。并且靶向CD105纳米粒与诱导后细胞标记率也明显高于未诱导细胞,表明所获得的细胞不仅具有Td-VECs的分子特性,并且具有很好的CD105靶向结合力。
4 结论
肿瘤细胞共培养法可诱导VECs向Td-VECs分化,是获取基于CD105分子靶向研究的Td-VECs可靠方法,可为进一步靶向抗肿瘤血管生成治疗研究提供可靠的细胞基础。
【参考文献】
[1]Zhang WJ, Wu LQ, Ye LY,etal. Immunologic characteristics of tumor-derived vascular endothelial cells [J]. Ai Zheng, 2005, 24(5):634-638.
[2]Rape A, Ananthanarayanan B, Kumar S. Engineering strategies to mimic the glioblastoma microenvironment [J]. Adv Drug Deliv Rev, 2014, 79(80):172-183.
[3]Avci NG, Fan Y, Dragomir A,etal. Investigating the Influence of HUVECs in the Formation of Glioblastoma Spheroids in High-Throughput Three-Dimensional Microwells [J]. IEEE Trans Nanobioscience, 2015, 14(7):790-796.
[4]杨华,龚明福,邹利光,等.靶向Endoglin的CL-PEG-MnFe2O4探针构建及体外实验 [J].中国医学物理学杂志, 2016, 33(7):751-756.
[5]Mou Y, Yue Z, Zhang H,etal. High quality in vitro expansion of human endothelial progenitor cells of human umbilical veinorigin [J]. Int J Med Sci, 2017, 14(3):294-301.
[6]Baudin B, Bruneel A, Bosselut N,etal. A protocol for isolation and culture of human umbilical vein endothelial cells [J]. Nature protocols, 2007, 2(3): 481-485.
[7]Jaffe EA, Nachman RL, Becker CG,etal. Culture of human endothelial cells derived from umbilical veins. Identification by morphologic and immunologic criteria [J]. Journal of Clinical Investigation, 1973, 52(11): 2745.
[8]Liu X, Wang J, Dong F,etal. Human gingival fibroblasts induced and differentiated into vascular endothelial-like cells [J]. Dev Growth Differ, 2016, 58(9):702-713.
[9]Johnson A, Dipietro LA. Apoptosis and angiogenesis: an evolving mechanism for fibrosis [J]. FASEB J, 2013, 27(10):3893-3901.
[10] Siow RC. Culture of human endothelial cells from umbilical veins [J]. Methods Mol Biol, 2012, 806:265-274.
[11] Morin KT, Dries-Devlin JL, Tranquillo RT. Engineered microvessels with strong alignment and high lumen density via cell-induced fibrin gel compaction and interstitial flow [J]. Tissue Eng Part A, 2014, 20(3-4):553-565.
[12] Khodarev NN, Yu J, Labay E,etal. Tumour-endothelium interactions in co-culture: coordinated changes of gene expression profiles and phenotypic properties of endothelial cells [J]. Journal of cell science, 2003, 116(6): 1013-1022.
[13] Mikhaylova M, Mori N, Wildes FB,etal. Hypoxia increases breast cancer cell-induced lymphatic endothelial cell migration [J]. Neoplasia, 2008, 10(4): 380-389.
[14] 杨华,邹利光. Endoglin (CD105) 在肿瘤新生血管靶向诊断及治疗中的应用[J]. 临床肿瘤学杂志, 2011, 16(12): 1130-1132.
