Au25/L-半胱氨酸修饰金电极上CO2的电化学还原
2018-05-24谭幸楠金葆康
谭幸楠,金葆康
(安徽大学 化学化工学院, 安徽 合肥 230601)
全球经济在不断高速发展,特别是进入社会工业化时代后,各个国家对化石燃料的需求急速增大,导致了CO2的排放量日益增长,造成温室效应等一系列生态问题.由于CO2中拥有丰富的碳资源,是一种潜在的重要化工原料.因此,如何转化固定CO2,使其成为有用的化工产品已成为研究热点[1-3].
目前主要有催化加氢[4-6]、催化重整[7-8]、电化学还原[9-10]、光电化学还原[11-12]等多种方式来实现CO2的固定转化,然而,由于CO2是碳的最高价氧化态,其性质稳定,因此采用电化学方法是目前最有效和最低能耗的方法之一.除此之外,电化学还原法具有装置简单、操作简便、环境污染小、价格经济等一系列优点[13-14].更关键的是,可以通过构建不同的电化学还原界面,采用不同的电解液,达到有效降低CO2较高还原过电位的目的.
Snuffin 等[15]发现在离子液体(EMIMBF3Cl)中Pt电极上,CO2电化学还原过程中形成了BF3-CO2,避免出现中间体CO·-,达到了高效还原CO2的目的;Kanan等[16]发现厚的金氧化物还原形成的金纳米颗粒使水溶液中CO2的还原超电势降低至少140 mV并且活性持久;Qu等[17]发现利用RuO2和TiO2纳米管复合修饰Pt电极构建还原界面可显示出良好的催化活性.
基于纳米材料的高比表面积制备的纳米材料修饰电极表现出高选择性和高灵敏度等优良的性质[18-19].已有研究报道Au25团簇在CO2电化学还原成CO过程中使CO2过电位降低,但并未研究具体的还原机制[20].笔者利用纳米金溶胶和Au25团簇构建CO2电化学还原界面,比较了GNPs/L-Cys/Au和Au25/L-Cys/Au电极在电化学上的差异,探索CO2在不同界面上电化学还原行为,以期获得催化性能良好的电化学界面,实现高效还原CO2.此外,通过现场红外光谱电化学技术、循环伏吸法对CO2还原机制进行探究,为其还原转化提供理论基础.
1 实验部分
1.1 仪器与试剂
电化学工作站CHI630C,上海辰华仪器有限公司;光电化学综合测试仪CIMPS,德国Zahner公司;傅里叶红外光谱仪iS50,美国Nicolet公司;电子分析天平SL202,上海精密科学仪器有限公司.
高纯二氧化碳(CO2纯度不低于99.99%)和高纯氮气(N2纯度不低于99.99%)均购自南京特种气体有限公司;氯金酸、柠檬酸三钠、苯乙硫醇、四辛基溴化铵购自阿拉丁试剂有限公司;硼氢化钠、L-半胱氨酸购自上海国药集团;将6 nm纳米金溶胶与Au25团簇按文献[21-22]进行合成,透射电镜和紫外可见光谱结果证实是否成功合成;支持电解质四正丁基高氯酸铵(TBAP)为实验室合成,使用前烘干30 min.
1.2 GNPs/L-Cys/Au和Au25/L-Cys/Au修饰电极的制备
电极分别用0.3 μm和0.05 μm Al2O3粉打磨、超声清洗.然后电极表面滴加10 μL Piranha溶液(98% H2SO4∶30% H2O2为3∶1),二次水清洗,重复3次,N2吹干后得干净的Au电极.将其浸置在5mol·L-1L-半胱氨酸水溶液中20 h,取出二次水冲洗,室温下干燥,得自组装修饰的L-半胱氨酸修饰电极(L-Cys/Au).将L-Cys/Au电极浸置在6 nm纳米金溶胶中10 h,取出二次水冲洗,室温下干燥后即可得GNPs/L-Cys/Au电极.将制备的Au25团簇溶于甲苯中,分别取10 μL滴加至L-Cys/Au和Au电极表面,室温下干燥,乙腈冲洗除去未吸附的Au25团簇,干燥后得Au25/L-Cys/Au和Au25团簇修饰电极(Au25/Au).将所有修饰电极放置在4 ℃下储存待用.
1.3 电化学实验
采用三电极体系开展线性扫描伏安实验,以不同的修饰电极为工作电极,Pt丝为对电极,Ag/AgCl为参比电极,自制薄层电化学池[23-24].实验前配制0.15 mol·L-1的TBAP-乙腈溶液,先通10 min高纯N2后得空白溶液,然后通30 min CO2得CO2的电解液.
1.4 现场红外光谱电化学实验
现场红外光谱电化学实验中选用了现场红外差谱技术和快速扫描红外光谱电化学技术,均在Nicolet iS50 红外光谱仪上进行,配有镜面反射附件和用液氮冷却的HgCdTe/A型检测器.
现场红外差谱技术是分别在参比电位和电解电位下采集红外光谱,以参比电位下红外光谱为背景进行处理,分辨率为8 cm-1,为100张干涉谱图的叠加.快速扫描红外光谱电化学技术是在线性扫描伏安的同时,利用快速扫描技术同步采集红外谱图,分辨率为16 cm-1,为32张干涉谱图的叠加.
2 结果与讨论
2.1 6 nm金溶胶和Au25团簇的表征
使用透射电镜和紫外-可见光谱对合成的6 nm金溶胶以及Au25团簇进行表征,结果如图1所示.
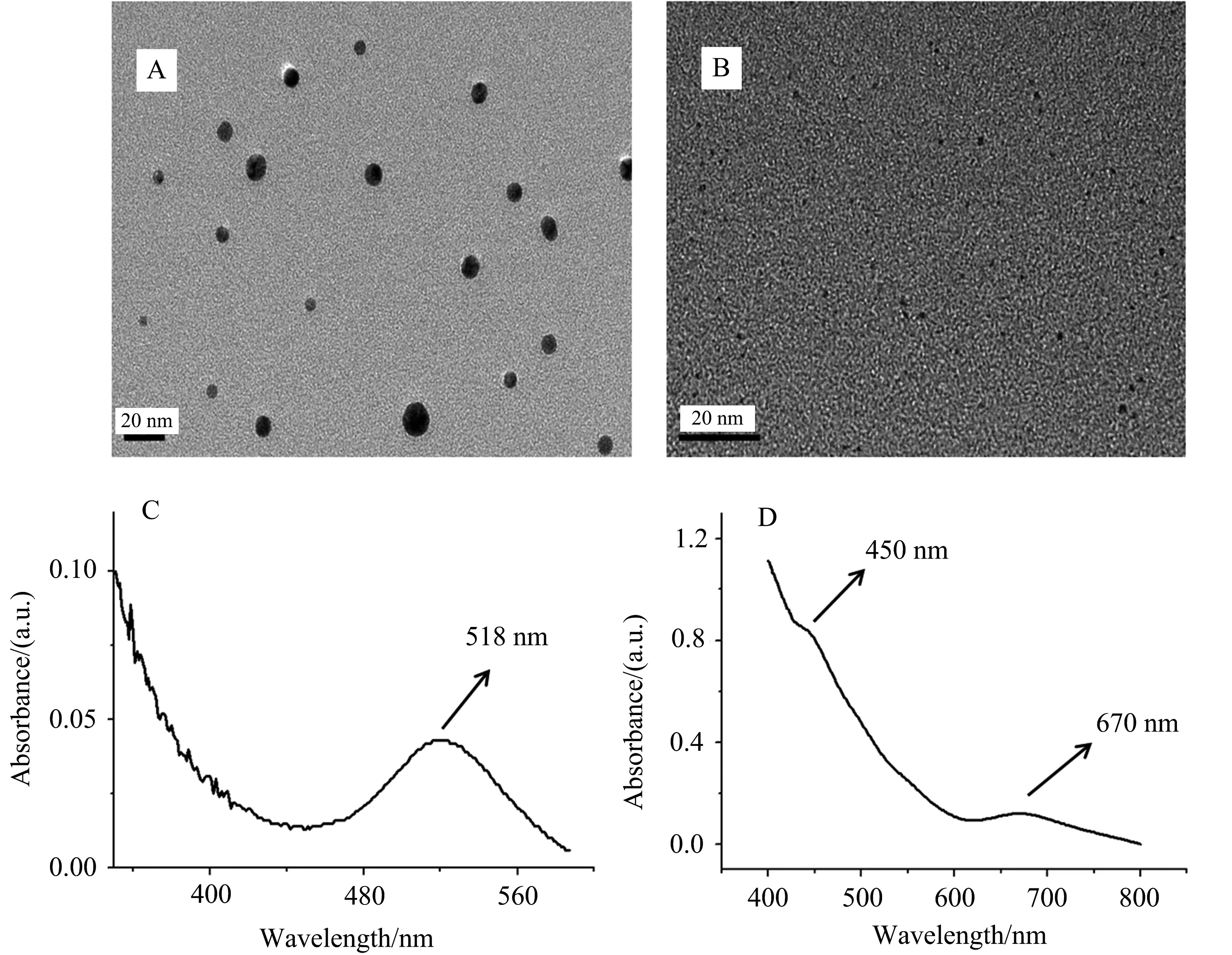
图1 6 nm金溶胶(A)和Au25团簇(B)的透射电镜照片以及6 nm金溶胶(C)和 Au25团簇的(D)的紫外-可见光谱图
通过透射电镜图1A可观察到纳米金颗粒大小均匀,大约为6 nm,并且分散性较好.紫外-可见光谱图1C显示位于518 nm处有1个紫外吸收峰,与文献报道相符[25].通过透射电镜图1B可观察到团簇颗粒小于1 nm,并且在图1D中可明显观察到2个紫外吸收峰,分别位于450 nm与670 nm.同样与文献报道吻合[22].结合透射电镜和紫外-可见光谱结果表明,成功制备了6 nm金溶胶和Au25团簇.
2.2 GNPs/L-Cys/Au和Au25/L-Cys/Au修饰电极的表征
采用电化学阻抗实验对制备的不同的修饰电极进行表征.图2为不同电极在2 mmol·L-1K3[Fe(CN)6]/ K4[Fe(CN)6]溶液中的阻抗谱图.
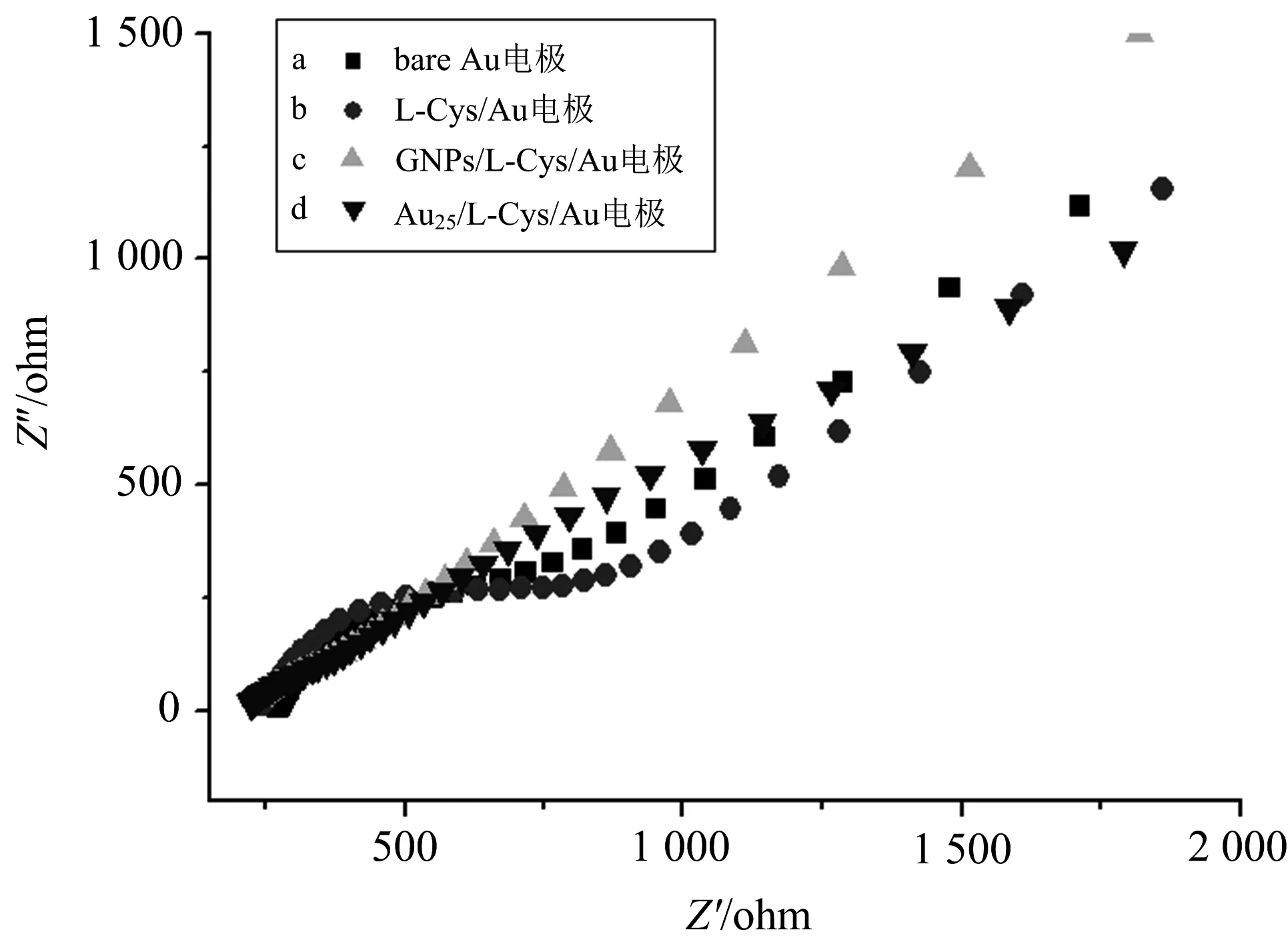
图2 不同电极的电化学阻抗图
电化学阻抗图(electrochemical impedance spectroscopy,简称EIS)中的曲线包括动力学控制的半圆部分和扩散控制的直线部分.高频区的半圆部分代表了电子传递限制过程,半圆的直径相当于电荷转移电阻Rct[26].从图2曲线a中可以看出,Au电极的半圆形直径很小,当电极自组装上L-半胱氨酸为L-Cys/Au电极后,曲线b的直径增大.这可能是L-半胱氨酸阻碍了溶液之间与电极表面的电子传递,使电阻变大.当继续修饰纳米金溶胶或者Au25团簇后,其阻抗谱图近似于一条直线(曲线c和曲线d),其电荷转移电阻变小,这是因为纳米金溶胶与Au25团簇增大了电子转移速度[27].这一系列变化表明,GNPs/L-Cys/Au和Au25/L-Cys/Au电极相比于Au和L-Cys/Au电极电荷传递速率更大.
2.3 GNPs/ L-Cys/Au电极和Au25/L-Cys/Au电极上CO2的电化学还原
图3为不同电极在TBAP的乙腈溶液中的线性扫描伏安曲线.曲线a为空白溶液,由于不同电极上空白溶液的线性扫描伏安曲线与Au25/L-Cys/Au电极上曲线(曲线a)几乎一致,故图中仅给出Au25/L-Cys/Au.b~f曲线为溶液中通入了CO2.曲线b为Au电极,c为 GNPs/L-Cys/Au电极,d为L-Cys/Au电极,e为Au25/Au电极,曲线f为Au25/L-Cys/Au电极.
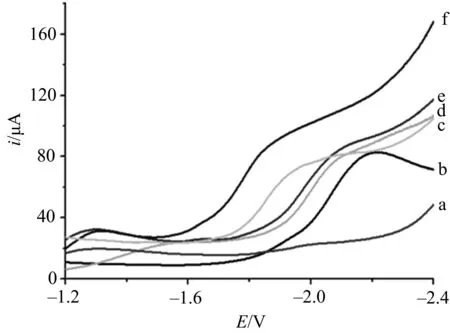
a: 未通CO2;b~f: 通CO2;扫速为100 mV·s-1.图3 不同电极上CO2在0.15 mol·L-1 TBAP的乙腈溶液中线性扫描伏安曲线对比图
从图3可观察到,溶液通CO2后,Au电极(曲线b)、L-Cys/Au电极(曲线d)、GNPs/L-Cys/Au电极(曲线c)、Au25/Au电极(曲线e)、Au25/L-Cys/Au电极(曲线f)上均能够观察到1个明显的CO2还原峰,但起峰电位等数据均有所差异,为方便对比,将不同电极上起峰电位与半峰电位数据列于表1.

表1 CO2在0.15 mol·L-1 TBAP的乙腈溶液线性扫描伏安实验中, 不同修饰电极上CO2还原峰电位
注:半峰电位E1/2为峰电流最大值的一半处对应的电位.
综合图3及表1可以看出,当电极修饰上L-半胱氨酸后,相比Au电极,起峰电位以及半峰电位正移,还原过电位降低60 mV,当继续修饰纳米金溶胶后,还原过电位降低190 mV.这表明L-Cys/Au和GNPs/L-Cys/Au电极均能催化还原CO2,比较而言GNPs/L-Cys/Au电极具有更好的催化效果.当电极修饰上Au25团簇后,相比Au电极,还原过电位降低80 mV,当修饰上Au25/L-Cys,还原过电位降低280 mV.表明相比于单独修饰L-半胱氨酸或Au25团簇,修饰Au25/L-Cys催化效果更明显.这可能是因为协同作用使GNPs/L-Cys/Au和Au25/L-Cys/Au电极表现出更好的催化效果.对比GNPs/L-Cys/Au和Au25/L-Cys/Au电极,Au25/L-Cys/Au电极上CO2的还原在更低电位下,更有效地降低了还原过电位.
2.4 Au25 / L-Cys电极上CO2的红外光谱电化学
为了考察CO2电化学还原机制,利用现场红外跟踪还原过程反应物、产物的变化.图4为Au25/L-Cys/Au电极上CO2的电化学现场红外差谱图.以—1.2V为参比电势,电位阶跃—1.3~—2.4 V,间隔0.1 V.
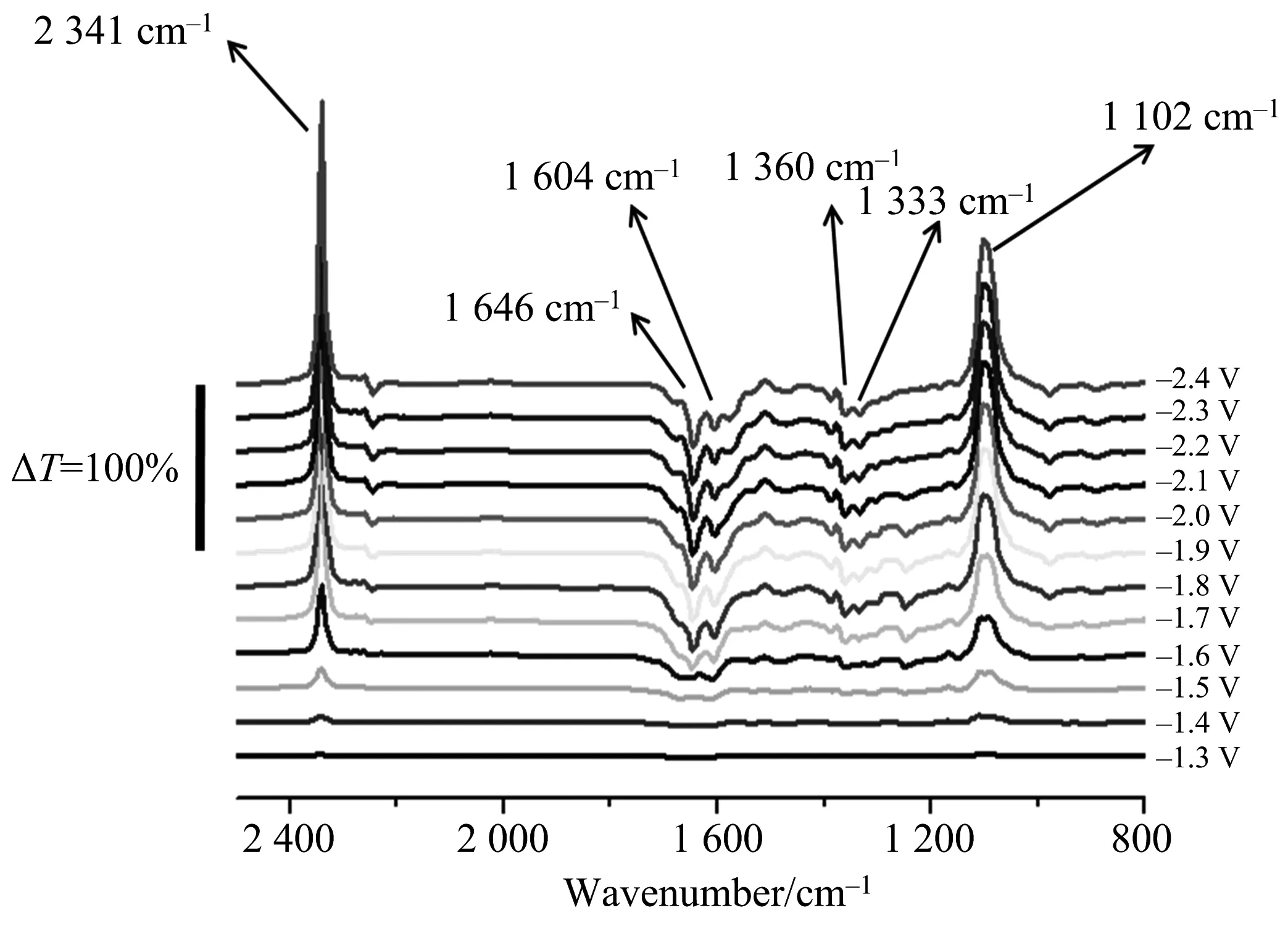
图4 Au25 / L-Cys/Au电极上CO2在乙腈溶液中的电化学红外差谱图,以-1.2 V为参比电位
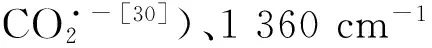
采取同样的方法开展Au和GNPs/L-Cys/Au电极上CO2的差谱实验,并与Au25/L-Cys/Au电极进行比较,发现各物质吸光度改变电位均有不同.具体数据见表2.
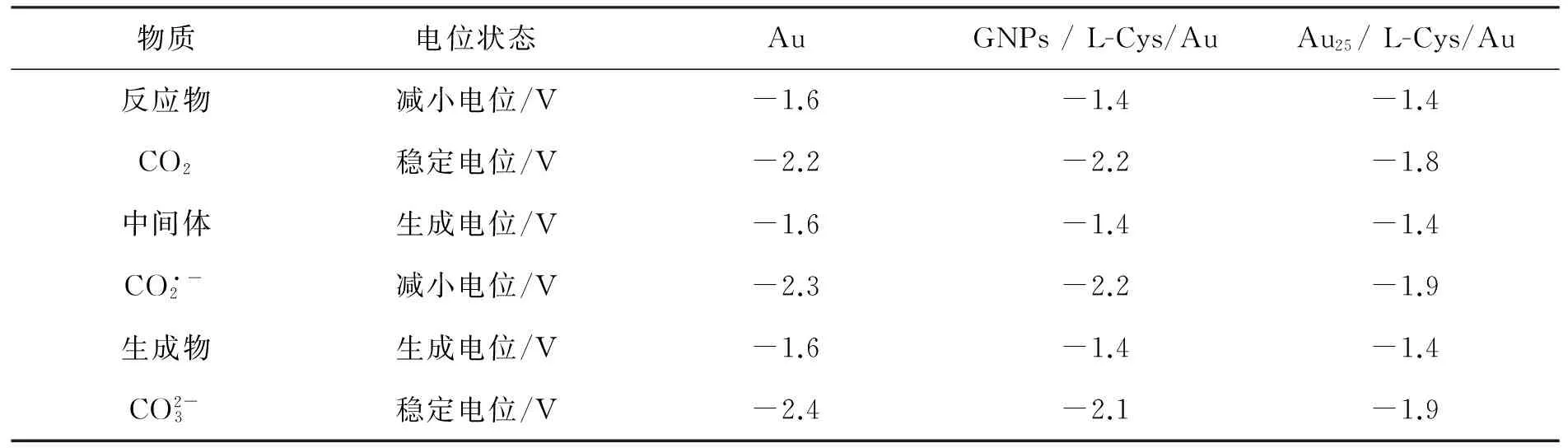
表2 不同电极上CO2的电化学现场红外差谱实验中各特征峰的变化趋势
从表2可以看出,Au25/ L-Cys/Au电极上,反应物、中间体与生成物变化电位相比Au和GNPs/L-Cys/Au电极正移.以反应物CO2的改变电位为例,GNPs / L-Cys/Au和Au25/ L-Cys/Au电极上CO2减小电位相比于Au电极均正移了将近200 mV,但Au25/ L-Cys/Au电极上CO2保持稳定即反应完全电位相比于GNPs / L-Cys/Au电极又正移了将近400 mV.该结果进一步证明了Au25/L-Cys/Au电极上能够非常有效地降低CO2还原过电位,具有良好催化性能.
2.5 Au25 / L-Cys/Au电极上快速扫描红外光谱电化学
为了进一步研究红外峰的变化趋势,并探索其还原机制,笔者进行了快速扫描红外光谱电化学实验.图5A为Au25/L-Cys/Au电极上CO2在加入乙腈溶液的薄层池中的线性扫描伏安曲线.图5B为对应—1.2~—2.4V扫描范围内所对应的900~2 500 cm-1波数范围内的快速扫描红外光谱图.
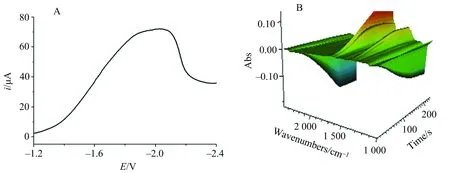
图5 Au25 / L-Cys/Au电极上CO2在TBAP的乙腈溶液中的线性扫描伏安图(A)以及相应3D红外光谱图(B)

为了更直观地探讨电化学还原中CO2在乙腈溶液中的还原机制,对图5B中不同波数的红外吸收峰数据进行处理,作循环伏吸图(CVAs),选取2 341,2 137,1 646,1 360,1 102 cm-1处的红外特征吸收峰.由于2 137 cm-1的吸收强度很小,将2 137 cm-1放大15倍,作出的循环伏吸图如图6所示.
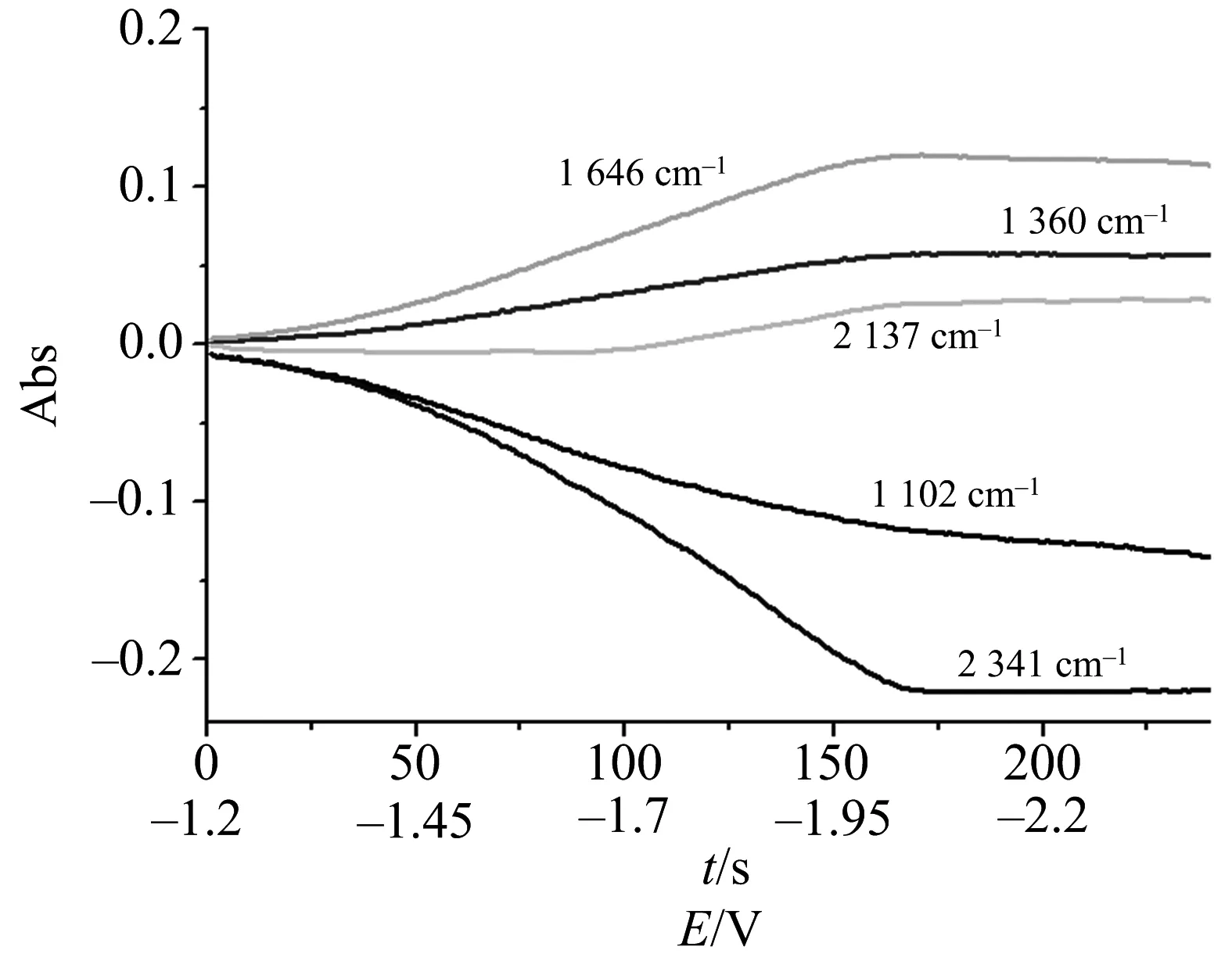
图6 Au25/L-Cys/Au电极上CO2在乙腈溶液中的电化学过程中所对应的循环伏吸图
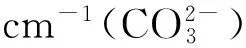
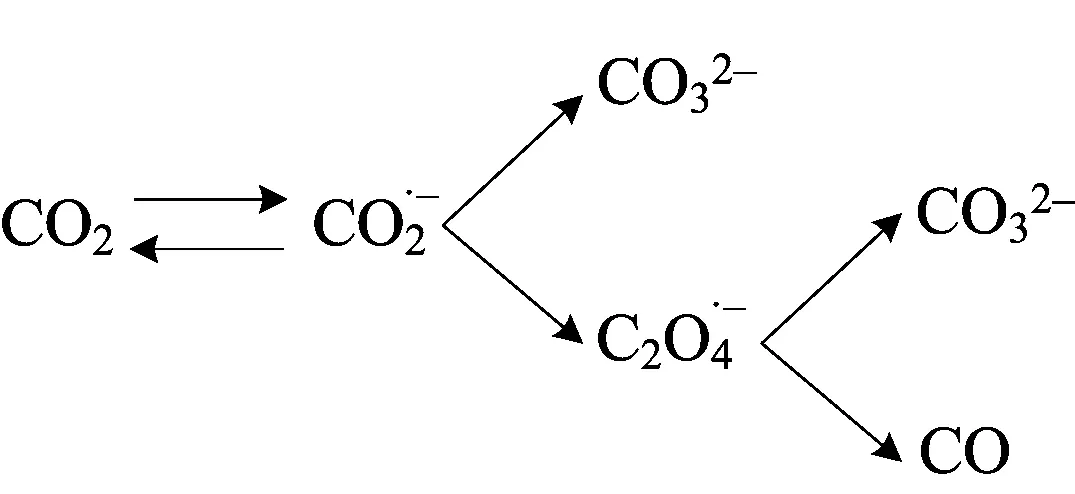
3 反应机制
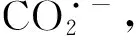
结合以上结果及讨论,推测在Au25/L-Cys/Au电极上,CO2在乙腈溶液中的还原机制可能为
4 结束语
笔者利用线性扫描伏安法和现场红外光谱技术对GNPs/L-Cys/Au和Au25/L-Cys/Au电极上CO2的电化学还原行为进行研究.结果表明,GNPs/L-Cys/Au和Au25/L-Cys/Au电极相比于Au、L-Cys/Au与Au25/Au电极表现出良好的催化性能.GNPs/L-Cys/Au电极上,CO2还原过电位相比Au电极降低了将近190 mV;而在Au25/L-Cys/Au电极上,过电位降低了将近280 mV.Au25/L-Cys/Au电极上CO2的还原过电位降低幅度较GNPs/L-Cys/Au电极更大,这表明Au25/L-Cys/Au电极具有更好的催化性能,推测这可能是由于Au25团簇具有独特的活性位点造成的[20,33].提出了CO2在Au25/L-Cys/Au电极上可能的还原机制.
参考文献:
[1] LEE S C. Stability of CO2adsorbates and mechanism of methanation reaction on MgO surfaces[J]. Journal of Physical Chemistry B, 2017, 111 (42): 12097-12102.
[2] FU Y, SUN D, CHEN Y, et al. An amine-functionalized titanium metal-organic framework photocatalyst with visible-light-induced activity for CO2reduction[J]. Angewandte Chemie, 2012, 124 (14): 3364-3367.
[3] TAKEDA H, KOIKE K, INOUE H, et al. Development of an efficient photocatalytic system for CO2reduction using rhenium (I) complexes based on mechanistic studies[J]. Journal of the American Chemical Society, 2008, 130 (6): 2023-2031.
[4] JORGE D A, BELLIDO E, ELISABETE M. Effect of the Y2O3-ZrO2support composition on nickel catalyst evaluated in dry reforming of methane[J]. Applied Catalysis A: General, 2009, 352: 179-187.
[5] TAMAURA Y, TANAB M. Complete reduction of carbon dioxide to carbon using cation-excess magnetite[J]. Nature, 1990, 346: 255-258.
[6] 王琳, 姜玄珍. 对ZrO2作为CO2氢化反应催化剂载体的研究[J]. 高校化学工程学报, 1990, 4 (3): 284-289.
[7] BRADFORD M C J, VANNICE M. CO2reforming of CH4[J]. Catalysis Reviews, 1999, 41 (1): 1-42.
[8] CHEN H, DING Y, DOU B, et al. Progress in low temperature hydrogen production with simultaneous CO2abatement[J]. Chemical Engineering Research and Design, 2011, 89: 1774-1782.
[9] WHIPPLE D T, KENIS P J A. Prospects of CO2utilization via direct heterogeneous electrochemical reduction[J]. Journal of Physical Chemistry Letters, 2010, 1 (24): 3451-3458.
[10] 张现萍, 黄海燕, 靳红利, 等. 水溶液中电化学还原CO2的研究进展[J]. 化工进展, 2015, 34 (12): 4139-4150.
[11] DIMITRIJEVIC N M, VIJAYAN B K, POLUEKTOV O G, et al. Role of water and carbonates in photocatalytic transformation of CO2to CH4on titania[J]. Journal of the American Chemical Society, 2011, 133 (11): 3964-3971.
[12] LIN W Y, FREI H. Photoactivation of ti centers in mesoporous silicate sieve under visible and UV light[J]. Studies in Surface Science & Catalysis, 2004, 153 (4): 283-288.
[13] HORI Y, WAKEBE H, TSUKAMOTO T, et al. Electrocatalytic process of CO selectivity in electrochemical reduction of CO2at metal electrodes in aqueous media[J]. Electrochimica Acta, 1994, 39: 1833-1839.
[14] JITARU M. Electrochemical CO2reduction fundamental and applied topics[J]. Journal of the University of Chemical Technology and Metallurgy, 2007, 42 (4): 333-344.
[15] SUNFLIN LL, WHALEY L W, YU L. Catalytic electrochemical reduction of CO2in ionic liquid EMIMBF3Cl[J]. Journal of the Electrochemical Society, 2011, 158 (9): F155-F158.
[16] CHEN Y H, LI C W, KANAN M W. Aqueous CO2reduction at very low overpotential on oxide-derived Au nanoparticles[J]. Journal of the American Chemical Society, 2012, 134 (49): 19969-19972.
[17] QU J P, ZHANG X G, WANG Y G, et al. Electrochemical reduction of CO2on RuO2/TiO2nanotubes compositemodified Pt electrode[J]. Electrochimica Acta, 2005, 50 (16): 3576-3580.
[18] VALENTINI F, PALLESCHI G. Nanomaterials and analytical chemistry[J]. Analytical Letters, 2008, 41 (4): 479-520.
[19] AKANDA M R, SOHAIL M, et al. Recent advances in nanomaterial-modified pencil graphite electrodes for electroanalysis[J]. Electroanalysis, 2015, 28 (3): 408-424.
[20] KAUFFMAN D R, ALFONSO D, MATRANGA C, et al. Experimental and computational investigation of Au25clusters and CO2: a unique interaction and enhanced electrocatalytic activity[J]. Journal of the American Chemical Society, 2012, 134 (24): 10237-10243.
[21] BROWN K R, FOX A P. Morphology-dependent electrochemistry of cytochromec at Au colloid-modified SnO2electrodes[J]. Journal of the American Chemical Society, 1996, 118 (5): 1154-1157.
[23] XIE Y L, LI D, JIN B K. In situ FT-IRspectroelectrochemical study of the reduction of 1, 4-dinitrobenzene in room-temperature ionic liquids[J]. Journal of Electroanalytical Chemistry, 2016, 774: 1-6.
[24] LI D, CHENG L J, JIN B K. Investigation on PCET-accompanied dimerization of 5-hydroxy-1, 4-naphthoquinone in the process of electrochemical reduction by in situ FT-IR spectroelectrochemistry and density functional calculation[J]. Electrochimica Acta, 2014, 130: 387-396.
[25] LINK S, EL-SAYED M A. Spectralproperties and relaxation dynamics of surface plasmon electronic oscillations in gold and silver nanodots and nanorods[J]. Journal of Physical Chemistry B, 1999, 103 (40): 8410-8426.
[26] FINKLEA H O, SNIDER D A, FEDYK J, et al. Characterization of octadecanethiol-coated gold electrodes as microarray electrodes by cyclic voltammetry and ac impedance spectroscopy[J]. Langmuir, 1993, 9 (12): 3660-3667.
[27] JIN B K, DING S N, KAMETANI K, et al. The preparation and electrochemical behavior of density-controlled gold nano-particle self-assembled interface[J]. Chemistry Letters, 2005, 34 (3): 302-303.
[28] PÉREZ E R, GARCIA J R, CARDOSO D R, et al. In situ FT-IR and ex situ EPR analysis for the study of the electroreduction of carbon dioxide in N, N -dimethylformamide on a gold interface[J]. Journal of Electroanalytical Chemistry, 2005, 578 (1): 87-94.
[29] LOVE J G, BROOKSBY P, MCQUILLAN A J. Infrared spectroelectrochemistry of the oxidation of absolute methanol at a platinum electrode[J]. Journal of Electroanalytical Chemistry, 1999, 464 (1): 93-100.
[30] BEWICK A, CANTRILL P R, TUXFORD A M. Studies of electrochemically generated reaction intermediates using modulated specular reflectance spectroscopy[J]. Faraday Discussions of the Chemical Society, 1973, 56: 96-107.
[31] ZHOU Z Y, TIAN N, SUN S G, et al. In situ rapid-scan time-resolved microscope FTIR spectroelectrochemistry: study of the dynamic processes of methanol oxidation on a nanostructured Pt electrode[J]. Journal of Electroanalytical Chemistry, 2004, 573 (1): 111-119.
[32] 陈晨, 金葆康. 红外光谱电化学研究金电极表面上CO2的还原[J]. 无机化学学报, 2012, 28 (3): 541-545.
[33] ZHU Y, WU Z K, JIN R C, et al. Exploring stereoselectivity of Au25nanoparticle catalyst for hydrogenation of cyclic ketone[J]. Journal of Catalysis, 2010, 271 (2): 155-160.
