miR- 200c通过靶向调节AHNAK抑制胰腺癌细胞的侵袭
2018-05-23顾兴伟周家华
顾兴伟,周家华
(东南大学附属中大医院 普外科,江苏 南京 210009)
胰腺癌是严重危害人类健康的恶性肿瘤,其发生发展过程受到多种编码基因与非编码基因的调控[1]。MicroRNA(miRNAs)是一类小片段(20~22个核苷酸)的非编码RNA,miRNA的表达失衡对胰腺癌的侵袭转移具有重要影响[2- 3]。miRNA- 200c属于miRNA- 200家族,具有调控肿瘤侵袭的作用[4- 5]。已有研究表明,miR- 200c在胰腺癌组织中表达降低[6]。并且胰腺癌干细胞中miR- 200c的表达降低,而miR- 200c过表达能够抑制胰腺癌干细胞的生长及侵袭[7]。然而关于miR- 200c是否参与调控胰腺癌细胞侵袭及机制仍然有待进一步研究。本研究以胰腺癌细胞SW1990和PANC- 1为研究对象,旨在探讨miR- 200c过表达对胰腺癌细胞侵袭的影响,为胰腺癌的防治提供新的研究思路。
1 材料与方法
1.1 主要试剂
人胰腺癌细胞SW1990、PANC- 1购自中国科学院上海细胞所,常规传代培养;DMEM培养液、胎牛血清及胰酶购自Gibco公司;脂质体转染Lipofectamine2000、Trizol及PCR扩增试剂盒购自Invitrogen公司;SYBR green PCR mix购自TaKaRa公司;miR- 200c引物、U6引物、miR- 200c类似物(miR- 200c mimics)及其阴性对照(Scramble)购自GenePharma公司;PMSF、RIPA裂解液购自碧云天公司;Matrigel购自BD公司;Super ECL Plus试剂盒、BCA试剂盒购自Pierce公司;AHNAK兔抗人多克隆抗体(sc- 98373)、β- actin兔抗人多克隆抗体(sc- 130656)购自Santa Cruz Biotechnology公司;pmirGLO载体、Dual- luciferase检测试剂盒购自Promega公司。
1.2 方法
1.2.1 细胞培养 含10%胎牛血清的DMEM培养基中加入合适体积的人胰腺癌细胞SW1990和PANC- 1,于37 ℃、5% CO2的培养箱中培养,根据细胞生长密度更换新鲜培养基或传代培养。
1.2.2 细胞转染 将以1×105对数期生长的人胰腺癌细胞SW 1990及PANC- 1接种于6孔培养板中,细胞生长密度至60%~70%时,根据脂质体转染Lipofectamine2000说明书分别转染miR- 200c mimics及其阴性对照。
1.2.3 RNA提取及RT- PCR 使用Trizol从细胞中分离提取出总RNA。使用逆转录试剂盒合成cDNA。使用SYBR green PCR mix在StepOne实时PCR系统(Applied Biosystems)上进行RT- PCR。miR- 200c和U6扩增引物购买自GenePharma公司,其中U6为内参对照,各组相对表达量采用2-ΔΔCt法计算。
1.2.4 Transwell细胞侵袭实验 按照试剂盒的说明书要求,使用8 μm孔径的室评估细胞迁移。在Transwell上室中加入100 μl Matrigel,2 h凝固后将含有105个细胞的200 μl无血清DMEM培养基加入Transwell上室中,将含10%FBS的200 μl DMEM培养基加入到下室中。细胞在37 ℃、5%CO2中孵育。培养24 h后用棉签刮去Transwell上室内的细胞,固定并用0.1%结晶紫染色迁移至膜底部的细胞,通过显微镜观察并计数。
1.2.5 生物信息学方法预测miR- 200c靶基因 采用TargetScan、PicTar和miranda数据库预测miR- 200c的靶基因,使用miranda数据库预测靶基因AHNAK的3′非翻译区(3′UTR)与miR- 200c的结合位点。
1.2.6 双荧光素酶报告基因实验 构建靶基因AHNAK的3′UTR(野生型3′UTR)与miR- 200c的结合位点突变的序列(突变型3′UTR)。AHNAK的野生型或突变型3′UTR亚克隆至pmirGLO载体中,构建pmirGLO- AHNAK- wt和pmirGLO- AHNAK- mut。实验分为4组:(1)Scramble和pmirGLO- AHNAK- wt;(2)Scramble和pmirGLO- AHNAK- mut;(3)miR- 200c mimics和pmirGLO- AHNAK- wt;(4)miR- 200c mimics和pmirGLO- AHNAK- mut。在SW1990及PANC- 1细胞中,按照上述分组进行转染实验。按照Dual- luciferase试剂盒说明书检测萤火虫和海肾荧光素酶活性,海肾萤光素酶活性作为内参对照。
1.2.7 蛋白免疫印迹检测 用含有PMSF的RIPA裂解液裂解细胞,利用BCA试剂盒测量蛋白浓度。通过十二烷基硫酸钠- 聚丙烯酰胺凝胶电泳(SDS- PAGE)后转移到聚偏二氟乙烯(PVDF)膜上,用5%的脱脂牛奶封闭。膜与AHNAK或β- actin抗体4 ℃孵育过夜,再使用辣根过氧化物酶标记的二抗与膜室温孵育1 h。使用Super ECL Plus试剂盒进行信号检测,其中β- actin为内参对照。
1.3 统计学处理
采用SPSS 17.0统计软件进行数据分析,计量数据描述用均数±标准差,两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 miRNA- 200c的表达
RT- PCR结果显示,在SW1990与PANC- 1细胞中,相比转染阴性对照组转染miR- 200c mimics 24 h后miR- 200c的表达明显增高,差异具有统计学意义(图1)。

*与对照组比较,P<0.05
图1RT-PCR检测SW1990与PANC-1细胞中miR-200c的相对表达量
Fig1RelativeexpressionofmiR-200cinSW1990andPANC-1cellswasdetectedbyRT-PCRassay
2.2 miR- 200c过表达对胰腺癌细胞侵袭的影响
Transwell细胞侵袭实验结果显示,与对照组相比人胰腺癌细胞株SW1990及PANC- 1过表达miR- 200c后SW1990与PANC- 1细胞的侵袭能力显著减弱(图2)。

图2miR-200c过表达对胰腺癌细胞SW1990及PANC-1侵袭的影响
Fig2EffectsofmiR-200coverexpressiononinvasioninSW1990andPANC-1pancreaticcancercells
2.3 AHNAK是miR- 200c的靶标
生物信息学结果显示,miR- 200c可特异结合AHNAK 3′UTR区域,结合位点如图3A所示。双荧光素酶报告基因实验结果显示,与Scramble和pmirGLO- AHNAK- wt共转染相比,miR- 200c mimics和pmirGLO- AHNAK- wt共转染至SW1990和PANC- 1细胞,荧光素酶活性显著降低。但是,与Scramble和pmirGLO- AHNAK- mut共转染相比,miR- 200c mimics和pmirGLO- AHNAK- mut共转染至SW1990和PANC- 1细胞,荧光素酶活性基本不变(图3B)。上述结果表明,miR- 200c能够与AHNAK基因的3′UTR结合。
2.4 miR- 200c过表达对AHNAK蛋白表达的影响
蛋白免疫印迹检测结果显示,在人胰腺癌细胞SW1990和PANC- 1中,与对照组相比过表达miR- 200c能够显著抑制AHNAK的蛋白表达(图4)。

*与对照组比较,P<0.05
图3miR-200c能够与AHNAK基因的3′UTR区结合
Fig3MiR-200cspecificallybindsAHNAK3′UTR
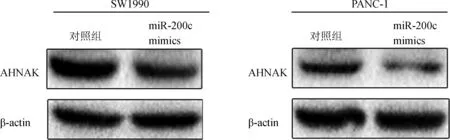
图4miR-200c过表达对胰腺癌细胞SW1990和PANC-1中AHNAK蛋白表达的影响
Fig4EffectsofmiR-200coverexpressiononAHNAKproteinexpressioninSW1990andPANC-1cells
3 讨 论
胰腺癌是美国男性和女性癌症死亡的第4大常见原因[8]。尽管临床医师和科学家在不断地努力,但胰腺癌患者5年生存率仍较低[9]。在2000年至2011年期间,中国男性胰腺癌发病率逐年上升[10]。胰腺癌恶性程度高,在发病早期极易发生局部侵袭和远处转移,使得传统手术、放疗以及化疗的疗效差[11]。近年来的研究发现,microRNA通过与其靶基因mRNA的3′非翻译区(3′UTR)相互作用调节基因的表达,在生物体内起到致癌或者抑癌作用[12]。比如,miR- 451通过靶向调节CAB39促进胰腺癌细胞增殖和转移[13],发现miR- 1271通过靶向调节ZEB1和TWIST1抑制胰腺癌细胞迁移、侵袭和上皮间质转化[14]。
钙调蛋白AHNAK亦称桥粒联结蛋白(desmoyokin),在多种细胞类型中表达[15]。最近的证据表明,AHNAK具有促进肿瘤转移的能力[16]。AHNAK能够促进伪足形成、细胞迁移和侵袭、增强肌动蛋白活性、诱导上皮间质转化从而促进细胞转移[17]。在间皮瘤细胞中,降低AHNAK的表达能显著降低细胞的迁移和侵袭能力[18]。以上研究成果均表明,AHNAK在肿瘤的迁移与侵袭中发挥着重要的作用。
miR- 200是一类抑制肿瘤的miRNA家族,其包括miR- 200a、miR- 200b、miR- 200c、miR- 141和miR- 429,并参与肿瘤的发生和发展[19]。miR- 200c作为miR- 200家族的重要成员之一,在肿瘤的发生和发展中发挥着重要的作用。miR- 200c可以通过靶向调节Bmi- 1和E2F3抑制肾癌细胞的生长和转移[20],而miR- 200c通过靶向调节FN1能够抑制胃癌细胞的增殖、迁移和侵袭[21- 22]。我们研究结果显示,在人胰腺癌SW1990和PANC- 1细胞中过表达miR- 200c显著降低胰腺癌细胞的侵袭能力,并且miR- 200c能够与AHNAK的3′UTR结合并下调AHNAK的蛋白表达水平。综上所述,miR- 200c过表达可通过靶向调节AHNAK的蛋白表达而抑制胰腺癌细胞的侵袭。
[参考文献]
[1] HERNANDEZ B Y,GREEN M D,CASSEL K D,et al.Preview of Hawaii cancer facts and figures 2010c[J].Hawaii Med J,2010,69 (9):223- 224.
[2] MORIYAMA T,OHUCHIDA K,MIZUMOTO K,et al.MicroRNA- 21 modulates biological functions of pancreatic cancer cells including their proliferation,invasion,and chemoresistance[J].Mol Cancer Ther,2009,8 (5):1067- 1074.
[3] BAI Z,SUN J,WANG X,et al.MicroRNA- 153 is a prognostic marker and inhibits cell migration and invasion by targeting SNAI1 in human pancreatic ductal adenocarcinoma[J].Oncol Rep,2015,34 (2):595- 602.
[4] SOSSEY- ALAOUI K,BIALKOWSKA K,PLOW E F.The miR200 family of microRNAs regulates WAVE3- dependent cancer cell invasion[J].J Biol Chem,2009,284 (48):33019- 33029.
[5] URBAS R,MAYR C,KLIESER E,et al.Relevance of microRNA200 family and microRNA205 for epithelial to mesenchymal transition and clinical outcome in biliary tract cancer patients[J].Int J Mol Sci,2016,17 (12):2053.
[6] YU J,OHUCHIDA K,MIZUMOTO K,et al.MicroRNA,hsa- miR- 200c,is an independent prognostic factor in pancreatic cancer and its upregulation inhibits pancreatic cancer invasion but increases cell proliferation[J].Mol Cancer,2010,9:169.
[7] MA C,HUANG T,DING Y C,et al.MicroRNA- 200c overexpression inhibits chemoresistance,invasion and colony formation of human pancreatic cancer stem cells[J].Int J Clin Exp Pathol,2015,8 (6):6533- 6539.
[8] SIEGEL R L,MILLER K D,JEMAL A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66 (1):7- 30.
[9] HIDALGO M.Pancreatic cancer[J].N Engl J Med,2010,362:1605- 1617.
[10] CHEN W,ZHENG R,BAADE P D,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66 (2):115- 132.
[11] KELEG S,BüCHLER P,LUDWIG R,et al.Invasion and metastasis in pancreatic cancer[J].Mol Cancer,2003,2:14.
[12] BARTEL D P.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136 (2):215- 233.
[13] GUO R,GU J,ZHANG Z,et al.MiR- 451 promotes cell proliferation and metastasis in pancreatic cancer through targeting CAB39[J].Biomed Res Int,2017,2017:2381482.
[14] LIU H,WANG H,LIU X,et al.miR- 1271 inhibits migration,invasion and epithelial- mesenchymal transition by targeting ZEB1 and TWIST1 in pancreatic cancer cells[J].Biochem Biophys Res Commun,2016,472 (2):346- 352.
[15] SHTIVELMAN E,COHEN F E,BISHOP J M.A human gene (AHNAK) encoding an unusually large protein with a 1.2- microns polyionic rod structure[J].Proc Natl Acad Sci USA,1992,89 (12):5472- 5476.
[16] DAVIS T A,LOOS B,ENGELBRECHT A M.AHNAK:the giant jack of all trades[J].Cell Signal,2014,26 (12):2683- 2693.
[17] SHANKAR J,MESSENBERG A,CHAN J,et al.Pseudopodial actin dynamics control epithelial- mesenchymal transition in metastatic cancer cells[J].Cancer Res,2010,70(9):3780- 3790.
[18] SUDO H,TSUJI A B,SUGYO A,et al.AHNAK is highly expressed and plays a key role in cell migration and invasion in mesothelioma[J].Int J Oncol,2014,44 (2):530- 538.
[19] FENG X,WANG Z,FILLMORE R,et al.MiR- 200,a new star miRNA in human cancer[J].Cancer Lett,2014,344 (2):166- 173.
[20] QIU M,LIANG Z,CHEN L,et al.MicroRNA- 200c suppresses cell growth and metastasis by targeting Bmi- 1 and E2F3 in renal cancer cells[J].Exp Ther Med,2017,13 (4):1329- 1336.
[21] ZHANG H,SUN Z,LI Y,et al.MicroRNA- 200c binding to FN1 suppresses the proliferation,migration and invasion of gastric cancer cells[J].Biomed Pharmacother,2017,88:285- 292.
[22] 何永亮,王琦玲,成永莲,等.胃癌STAT3、Survivin和RegⅣ的表达及其与临床病理参数间的相关性[J].现代医学,2017,45(2):224- 229.
