黑线鳕鱼皮胶原蛋白胰蛋白酶酶解多肽对UVB诱导HaCaT光损伤的抑制作用
2018-05-23董丽莎李妍妍张红燕崔晨茜韩姣姣王朝阳司开学芦晨阳苏秀榕
董丽莎,李妍妍,张红燕,崔晨茜,韩姣姣,王朝阳,司开学,周 君,芦晨阳,苏秀榕,*
(1.宁波大学海洋学院,浙江 宁波 315211;2.康奈尔大学农业与生命科学学院,美国 纽约州 伊萨卡 14853)
胶原蛋白多肽是胶原蛋白经过酶解等降解后生成的产物[1],不会受到消化酶的二次水解,能够直接吸收,可减轻消化道的负担,有利于体弱者[2]。同时,它还具有人体调节功能,提高免疫力,改善细胞代谢,以及抗衰老[3],消除体内自由基等生理功能。现已发现水解胶原蛋白中有多种活性肽:抑制血管紧张素转化酶活性肽[4]、抗氧化肽[5-6]、抗菌肽等。
我国年产鳕鱼逾50万 t,这些渔业产品在加工成冻鱼块或冻鱼排产品时,约30%鲜质量成为加工副产品,其中鱼皮占8%左右[7-8]。这些副产品通常用来干制粉碎用于制造动物蛋白饲料,经过粗加工制成的产品经济价值不高。黑线鳕鱼皮是较好的胶原蛋白来源。它的加工废弃物如果能够用于胶原的提取和加工,必定能够提高黑线鳕的附加值。本研究以黑线鳕鱼皮胶原蛋白为原料来酶解制备多肽,通过胰蛋白酶进行单因素和响应面设计试验,确定最佳酶解工艺条件后,利用基质辅助激光解吸电离飞行时间串联质谱(matrix-assisted laser desorption/ionization time of flight tandem mass spectrometry,MALDI-TOF MS/MS)测定酶解液中的优势肽序列,并通过分子对接技术预测优势肽抗氧化的作用机制。最后通过细胞实验验证黑线鳕鱼皮胶原蛋白酶解多肽对光损伤的抑制作用。
1 材料与方法
1.1 材料与试剂
人表皮角质形成细胞 北京北纳创联生物技术有限公司;黑线鳕鱼皮胶原蛋白冻干粉 日本新田有限公司。
胰蛋白酶 上海源叶生物科技有限公司;总氨基酸、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)测定试剂盒 南京建成生物工程研究所;DMEM培养基、胎牛血清、磷酸缓冲液 美国Hyclone公司;噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)粉 美国Sigma公司;二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Amresco公司;0.25%胰蛋白酶+乙二胺四乙酸 美国Gbico公司;细胞凋亡、细胞周期检测试剂盒、100 μg/mL青霉素、100 μg/mL链霉素碧云天生物技术研究所。
1.2 仪器与设备
5800 MALDI-TOF MS/MS仪 美国AB SCIEX公司;Discovery Studio 2017 美国Accelrys公司。
1.3 方法
1.3.1 胶原蛋白胰蛋白酶酶解工艺优化
以水解度为指标,pH值为7.0、底物质量分数为10%的条件下,研究胰蛋白酶质量分数、酶解时间、酶解温度对水解效果的影响。在单因素试验的基础上,采用Box-Behnken试验设计原理,以酶解温度、酶质量分数和酶解时间为自变量,设计3因素3水平的响应面分析试验[9]。水解度计算如式(1)所示:

1.3.2 胶原蛋白多肽组成分析
采用MALDI-TOF MS/MS对酶解液进行测定。离子源加速电压为20 kV,N2激光器,激光波长337 nm,能量5 800,离子延迟提取时间390 ns,质谱信号单次扫描累加2 000 次,使用标准多肽校准品(peptideII standard kit(Bruker))离子峰校正(m/z 500~3 000)质量扫描范围500~3 000 u。MALDI-TOF MS/MS串联质谱结果用本地MASOT软件查询NCBInr数据库(2367365 sequences;802797248 residues)进行检索[10]。
1.3.3 Discovery Studio的筛选与分子对接
1.3.3.1 小分子配体准备
用Discovery Studio 2017中Build and Edit Protein模块将1.3.2节获得的多肽氨基酸序列输入获得未经处理的多肽3D结构,并通过Minimize Ligands模块中的Full Minimization功能将其能量最优化,以获得最佳能量的多肽3D结构。由于配体数目较多,并考虑到对映异构体等因素,使用Protocol中的Prepare Ligands处理该体系。
1.3.3.2 蛋白质受体准备与活性位点的确定
PDB数据库是目前最主要的蛋白质分子数据库,从中检索并下载Keap1,其ID号为5DAD。将5DAD在DS中打开后,去水加氢,并用Prepare Protein对蛋白进行预处理,包括在不同pH值条件下的质子化状态、缺失loop的补充等。在Tools Explorer中的Define Receptor将处理好的5DAD蛋白分子定义为受体分子,展开Define and Edit Binding Site,将活性位点指定在受体蛋白中自带的小分子配体处。
1.3.3.3 分子对接
在Tools Explorer中,展开Receptor-Ligand Interactions模块,点击CDOCKER,打开相应参数面板。在参数面板中,将Input Receptor设置为5DAD-prep:5DAD后运行。
1.3.4 多肽抗氧化活性分析
1.3.4.1 细胞培养
HaCaT细胞用含10%胎牛血清的DMEM培养液于37 ℃、5% CO2细胞培养箱中贴壁培养。待细胞融合90%以上时传代,经0.5%胰蛋白酶消化,离心计数后备用[11]。
1.3.4.2 多肽对细胞增殖的影响
将HaCaT细胞以105个/mL、每孔100 μL接种于96 孔板中,培养24 h后,MTT法测定其吸光度,确定多肽最佳质量浓度[12]。细胞增殖率计算如式(2)所示:

胶原蛋白多肽对HaCaT细胞增殖具有一定的促进作用,且在一定范围内,随胶原蛋白多肽质量浓度的增加而增加,当多肽质量浓度为250 mg/mL时,胶原蛋白多肽对细胞增殖的促进作用达到最大值。选择150、250、350 mg/mL 3 个质量浓度进行后续实验。
1.3.4.3 细胞分组
将HaCaT细胞分为空白对照组(DMEM培养基培养细胞24 h,不用户外紫外线(ultraviolet radiation B,UVB)辐射)、UVB辐射模型组(DMEM培养基培养细胞24 h,采用UVB辐射)、MP处理组(分别用1.3.4.2节中挑选的3 个质量浓度胶原蛋白多肽DMEM培养液培养24 h,再用UVB辐射,分别记作酶解多肽低、中、高剂量组)。每组细胞都有6 个复孔,弃掉细胞培养基,加入适量磷酸缓冲液覆盖细胞,再用30 mJ/cm2剂量UVB辐射。空白对照组需要用铝箔纸覆盖。
1.3.4.4 指标测定
按照1.3.2节步骤处理各组细胞后,收集各组细胞及上清液,并根据各试剂盒说明书测定MDA含量、SOD和GSH-Px活性。利用流式细胞仪检测细胞凋亡率[13],利用Modfit LT软件进行分析[14]。
1.4 数据分析
采用SPSS 19.0软件进行单因素方差分析,同时进行最小显著差异两两比较。检验显著性水平(P<0.05)。实验结果均以 ±s表示。
2 结果与分析
2.1 单因素试验结果

图1 胰蛋白酶酶解胶原蛋白的单因素试验结果Fig. 1 Effects of variables on degree of hydrolysis
如图1所示,水解度随酶解时间、酶解温度的升高呈现先增加后减少的趋势,而胶原蛋白随着酶质量分数的增大呈现出先增大后稳定的趋势。最适酶解条件为1.0~2.0 h、45~55 ℃、0.5%~1.5%的胰蛋白酶。
2.2 响应面试验结果
响应面试验设计与结果见表1。根据Box-Behnken试验设计,采用SAS 9.0进行回归拟合,得到各因素变量间的方程式为:Y=84.356 67+0.015 000X1-0.586 25X2+0.156 25X3-0.93X1X2-1.32X1X3+2.087 50X2X3-
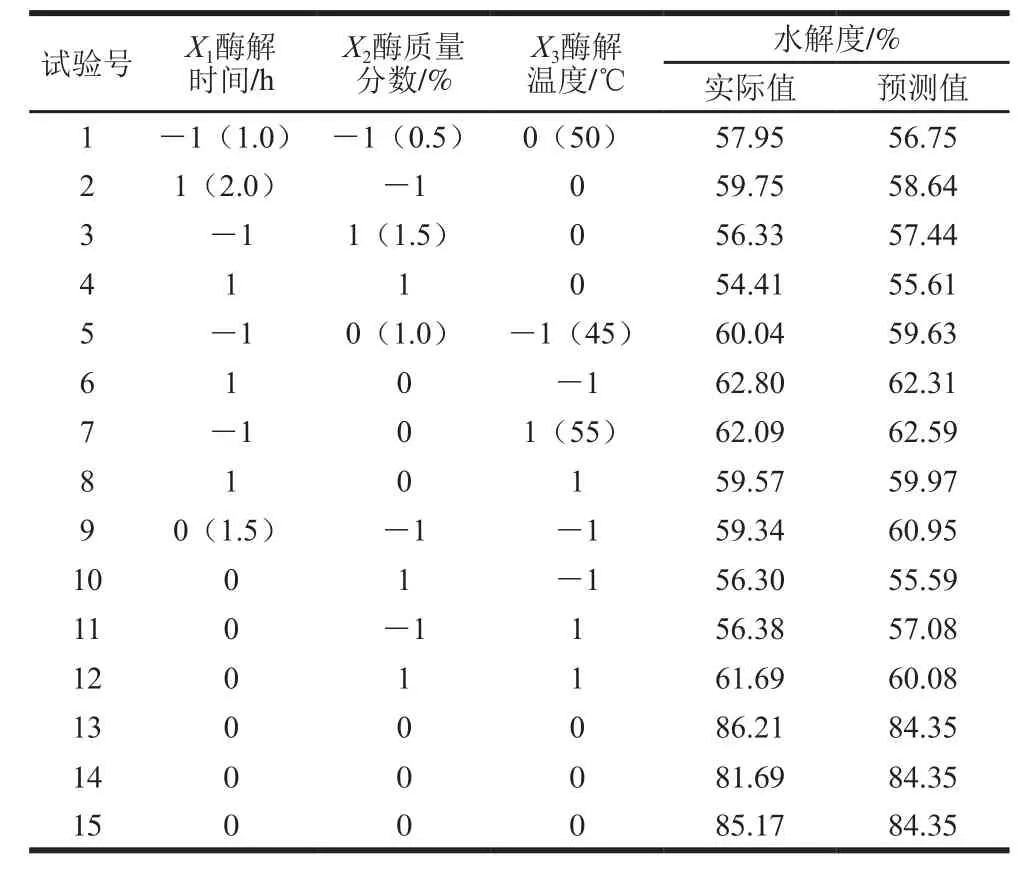
表1 响应面试验设计方案和结果Table 1 Experimental design used in response surface methodology along with measured and predicted degree of hydrolysis

表2 回归方程的方差分析Table 2 Analysis of variance of regression equation
黑线鳕鱼皮胶原蛋白水解度的回归模型极显著(P<0.01),回归方程的失拟项不显著(P>0.05),这表明酶解温度、酶解时间、酶质量分数对胶原蛋白水解度影响的显著程度高,同时3 个因素又可以与水解度进行很好的拟合。相关系数R2为94.31%,说明该回归方程的可靠性比较高。模型变异系数为3.39%,说明试验稳定性好、操作可靠,基于以上分析可知,3 个因素水平设计合理、方法可行,因此,该模型可用于分析数据。从表2可以看出,二次项X12、X22、X32对胰蛋白酶酶解胶原蛋白水解度有极显著影响,一次项X1、X2、X3和交互项X1X2、X1X3、X2X3对其影响不显著。这表明各个因素对胶原蛋白水解度影响呈二次关系,且各因素之间有较强的交互作用。

图2 胶原蛋白水解度的响应面及等高线图Fig. 2 Response surfaces and contour plots showing individual and interactive effects of variables on the degree of hydrolysis of collagen
三维响应面及等高线图见图2,3 个因素与水解度呈抛物线关系,随着各因素水平增加,在一定范围内,水解度呈不同程度的增加。但超过一定界限,水解度呈下降的趋势,各因素变化程度符合上述回归方程。3 个因素在特定范围内水解度达到最大值。综合响应面数学分析,得到最优水解条件为酶解时间1.75 h、酶质量分数1.23%、酶解温度52.95 ℃,水解度理论预测值为74.22%。采用上述优化酶解条件测得的胶原蛋白水解度为78.33%。试验值与理论预测值有较好的拟合性,表示采用响应面优化参数在实践中是可行的。
2.3 胶原蛋白多肽种类的确定

表3 黑线鳕鱼皮胶原蛋白多肽的鉴定Table 3 Identification of peptides in collagen hydrolysate from Melanogrammus aeglefinus skin
MALDI-TOF MS/MS共检测到1 026 个峰,其中仅有3 个相对较强的质谱峰,分别为m/z 1 267.512 8、m/z 783.315 0和m/z 602.241 5。选择它们作为母离子进行二级质谱处理。得到3 个优势多肽,见表3和图3。

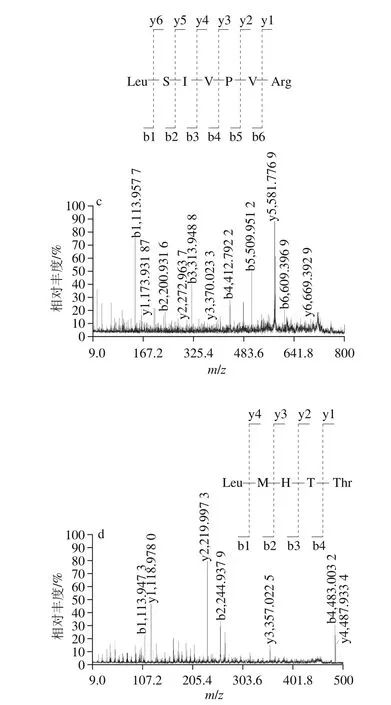
图3 胶原蛋白多肽的质谱分析图Fig. 3 Mass spectra of polypeptides derived from fish skin collagen
2.4 胶原蛋白多肽与Keap1分子对接
CDocker 分子对接方式结果主要根据受体与配体相互作用的能量(CDocker interaction energy,ECI),范德华力(Van der Waals Energy,EVDW)等信息来确定结合的程度。ECI值越低表示分子对接过程中受体与配体的相互作用越小,结合的越紧密。如表4所示,配体小分子V-IFFVTMGTP-R(1)与受体蛋白结合所需的能量最低,结合最紧密,远低于其他配体。由图4可看出,参与1号配体小分子与Keap1中的相互作用的氨基酸残基共13个,其中配体小分子与Arg135、Glu138、Glu134、Asp87形成电荷吸引力,与Lys131、Lys150形成氢键能,与Gly148形成碳氢键能,与Met147、Val155、Cys151、His154、His129、Tyr85形成烷基键能和π烷基键能,由此可以推测,1号配体能够与Keap1蛋白相互结合,并抑制其活性,从而阻断Nrf2信号通路,以达到抗氧化的作用。

表4 分子对接结果Table 4 Molecular docking

图4 分子对接结果Fig. 4 Schematic of molecular docking
2.5 细胞实验结果
2.5.1 胶原蛋白多肽对HaCaT细胞活性的影响
UVB模型组细胞活性与空白对照组对比,极显著降低(P<0.01)。而250 mg/mL中剂量组的胶原蛋白多肽处理的HaCaT细胞活性达到最大值,与模型组相比,极显著增高(P<0.01),表明胶原蛋白多肽能够有效抑制光损伤作用(图5)。

图5 各组HaCaT细胞的活性Fig. 5 Viability of HaCaT cells under different treatment conditions
2.5.2 胶原蛋白多肽对HaCaT细胞MDA含量和SOD、GSH-Px活性的影响
模型组与空白对照组相比MDA含量上升,SOD活性与GSH-Px活性极显著下降(P<0.01),表明造模成功。胶原蛋白多肽各剂量组中,中剂量组的MDA含量降低较其他两组更明显,SOD和GSH-Px活性上升也较其他两组更高,且较模型组均呈极显著变化(P<0.01),表明胶原蛋白多肽能在一定程度上抑制UVB对HaCaT细胞的氧化损伤(图6)。

图6 各处理组对HaCaT细胞MDA浓度和SOD、GSH-Px活性的影响Fig. 6 Effects of different treatments on MDA, SOD, and GSH-Px levels of HaCaT cells
2.5.3 胶原蛋白多肽对HaCaT细胞调亡和周期的影响
与空白对照组相比,模型组的正常细胞数下降了14.5%;与模型组相比,胶原蛋白多肽中剂量组的正常细胞数上升了12.3%,凋亡早期细胞下降11.1%,凋亡晚期的细胞下降了1.2%(图7),较低剂量组与高剂量组正常细胞数量更接近于空白对照组。
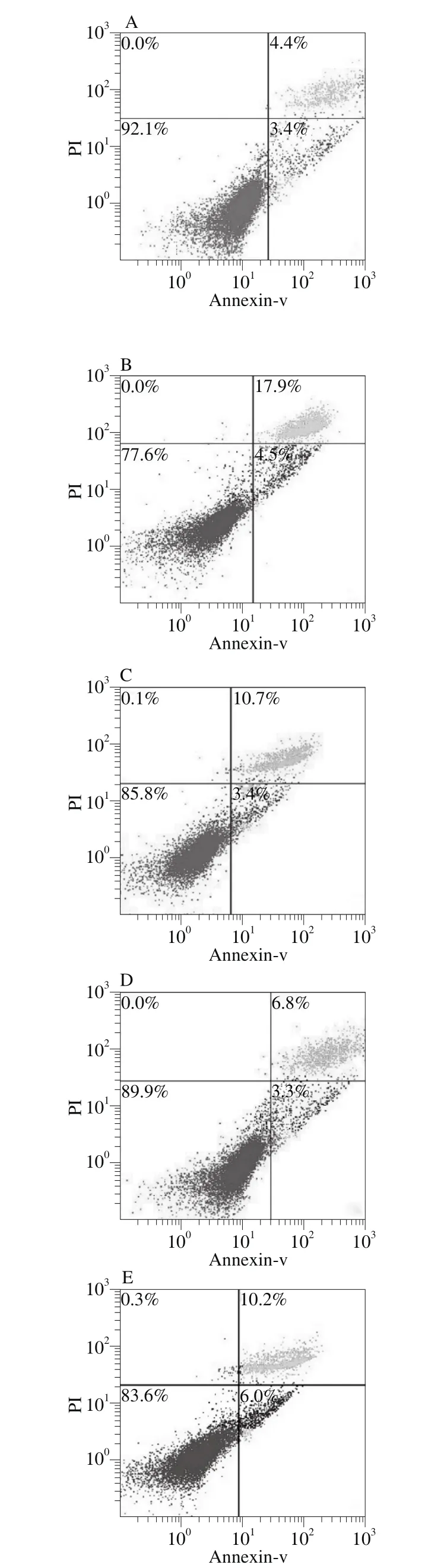
图7 胶原蛋白多肽对HaCaT细胞凋亡的作用Fig. 7 Effects of different treatments on apoptosis in HaCaT cells
3 讨 论
3.1 胶原蛋白多肽抗氧化的分子虚拟筛选
分子对接方法已成为药物设计方法中比较成熟的直接药物设计方法。它能够准确预测蛋白质受体与配体间的结合位点,指导和解释实验现象[15-17]。Discovery Studio是一款面向生命科学领域的综合模拟软件,主要用于蛋白质结构功能研究,预测蛋白质受体与配体间氨基酸相互作用的准确率高达96%。刘广斌等[18]已通过Discovery Studio模拟Hsrad51蛋白与多肽brc4的分子对接,该结果为今后研究Hsrad51蛋白与其他重复基元的分子对接以及相互作用提供了重要依据。郑春松等[19]用Discovery Studio成功预测独活寄生汤对TNF-α和IL-1β作用的活性成分,为其临床使用提供一定的研究依据。
Keap1蛋白Nrf2的胞浆抑制蛋白,正常情况下锚定于胞浆的肌动蛋白细胞骨架上。Nrf2蛋白在未受诱导的正常细胞里,Nrf2的代谢相当快,半衰期只有10~30 min。但当细胞受到活性氧刺激后,Nrf2与Keap1解偶联,活化的Nrf2转运进入细胞核,激活靶基因表达,调控2相代谢酶、抗氧化酶或药物转运体的转录活性,从而发挥抗氧化损伤的作用[20]。在本实验中,3 种MP的分子对接结果显示,与Keap1相互作用的共同氨基酸有HIS129、TYR85、LYS131、VAL155、ARG135,它们在结合过程中起着重要的作用。从而预测胶原蛋白多肽与Keap1蛋白结合后,能够刺激其与Nrf2蛋白的解偶联,发挥抗氧化作用,进而对正常细胞起到抗氧化的保护效应。
3.2 胶原蛋白多肽抗氧化活性
长期暴露于紫外辐射,尤其是UVB会导致色素沉着、老化、皮肤癌等。为了减弱UVB辐射所引起的光损伤,应用天然抗氧化剂成为人们保护皮肤的有效措施[21-23]。吕玲玲等[24]酶解法制得林蛙皮胶原蛋白多肽,并研究抗氧化性得出林蛙皮胶原蛋白具有一定的还原能力,并且在一定范围内,随着浓度的增加其抗氧化的能力逐渐增强。窦梅等[25]建立UVA氧化损伤人角质形成细胞病理模型,探讨了扇贝多肽对单次UVA氧化损伤体外培养角质形成细胞的影响及其作用机制,研究发现扇贝多肽在一定质量浓度范围内能剂量依赖性降低HaCaT细胞质MDA水平,提高SOD、GSH-Px活性。人角质形成细胞作为表皮的主要构成是UVB辐射的靶细胞。而正常细胞有正常的抗氧化体系,主要有酶促和非酶促体系[26]。酶促体系包括SOD和GSH-Px等,非酶促体系包括维生素、辅酶、抗坏血酸等。SOD能够清除超氧阴离子自由基,保护细胞免受损伤[27],MDA的量主要反映机体脂质过氧化程度,间接反映细胞受损程度。MDA常与SOD同时测定:SOD间接反映机体清除氧自由基的能力,而MDA反映了细胞受自由基攻击的严重程度。GSH-Px是机体内的一种催化过氧化氢分解的酶,起到保护细胞膜结构和功能完整的作用[28]。本研究通过体外培养HaCaT,采用30 mJ/cm2的UVB照射,使得HaCaT内SOD、GSH-Px活性显著降低(P<0.01),而MDA含量显著升高(P<0.01),说明UVB可通过抑制SOD、GSH-Px活性的防御系统,降低其清除活性氧族的能力,使机体自由基堆积,脂质过氧化物含量增多,造成细胞及组织的损伤;而加入胶原蛋白多肽的实验组却可显著抑制UVB导致的细胞内SOD、GSH-Px活性下降,降低MDA的产生。用MTT法检测到胶原蛋白多肽对UVB辐射细胞活力的影响,结果显示胶原蛋白多肽各剂量组的细胞活性百分比均显著高于模型组而较空白组低。说明UVB可以造成体外培养HaCaT细胞增殖活力下降,而胶原蛋白多肽在250 mg/mL时可提高HaCaT的增殖活力。细胞凋亡的途径最主要的是内源性凋亡途径,内源性凋亡途径可由多种因素诱发,如细胞脱离了原来的生长环境,DNA受到损伤等[29]。在线粒体内、外膜之间存在线粒体通透性转变孔,它的发生在细胞凋亡中扮演着极其重要的角色,而引起线粒体通透性转变孔开放的主要因素为细胞外源性损伤,包括氧化应激过度,Ca2+超载,药物诱导等[30]。Annexin V-FITC/PI法细胞凋亡检测显示,黑线鳕鱼皮胶原蛋白多肽250 mg/mL与模型组相比。在凋亡早期和凋亡晚期阶段,均有显著的抑制作用。说明该胶原蛋白多肽对HaCaT细胞的凋亡有抑制作用。
综上所述,分子对接结果表明黑线鳕鱼皮胶原蛋白胰蛋白酶酶解得到的3 种多肽均能与Keap1对接,该对接位点的信息对分析多肽类化合物激活Keap1活性的分子机制提供了依据,有助于多肽类物质用于抗氧化损伤相关药物的研发。UVB辐射使HaCaT细胞活性下降了21.04%,而经胶原蛋白多肽处理,尤其是250 mg/mL处理的HaCaT细胞的损伤程度明显减轻,活性上升了39.29%,细胞内的MDA含量显著下降(P<0.01),SOD和GSH-Px活性显著提高(P<0.01),表明该胶原蛋白多肽对UVB辐射损伤具有显著的光损伤保护作用。
参考文献:
[1]成晓瑜, 张顺亮, 戚彪, 等. 胶原与胶原蛋白多肽的结构功能及其应用研究现状[J]. 肉类研究, 2011, 25(12): 33-39.
[2]WATANABE-KAMIYAMA M, SHIMIZU M, KAMIYAMA S, et al.Absorption and effectiveness of orally administered low molecular weight collagen hydrolysate in rats[J]. Journal of Agricultural and Food Chemistry, 2010, 58(2): 835-841. DOI:10.1021/jf9031487.
[3]OESSER S, SEIFERT J. Stimulation of type II collagen biosynthesis and secretion in bovine chondrocytes cultured with degraded collagen[J]. Cell Tissue Research, 2003, 311(3): 393-399.
[4]曾名勇, 陈胜军, 李来好, 等. 红非鲫鱼皮胶原蛋白酶解产物中血管紧张素转换酶抑制肽的分离及其部分特性[J]. 中国组织工程研究与临床康复, 2007, 11(2): 397-400. DOI:10.3321/j.issn:1673-8225.2007.02.028.
[5]MENDIS E, RAJAPAKSE N, KI S K. Antioxidant properties of a radical-seavenging peptide purified from enzymatically prepared fish skin gelatin hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2005, 53(3): 581-587. DOI:10.1021/jf048877v.
[6]朱夕波, 周培根, 李燕, 等. 猪皮胶原蛋白水解产物中的抗氧化活性肽的分离及其氨基酸组分[J]. 天然产物研究与开发, 2009, 21(1):122-124; 182. DOI:10.3969/j.issn.1001-6880.2009.01.028.
[7]KOCHANEK K S, WIASCHEK M, SCHAUEN M, et al. UV-induced reactive oxygen species in photocarcinogenesis and photoaging[J].Biological Chemistry, 2007, 78(3): 1247-1257.
[8]RYOO Y W, SUH S I, MUN K C, et al. The effects of the melatonin on ultraviolet-B irradiated cultured dermal fibroblasts[J]. Journal of Dermatological Science, 2001, 27(3): 162-169. DOI:10.1016/S0923-1811(01)00133-5.
[9]侯付景, 金春华, 董明敏, 等. 响应面分析法优化海地瓜酶解工艺及其抗氧化活性的研究[J]. 营养学报, 2010, 32(3): 276-280.
[10]杨帆, 敬海明, 张拓, 等. MALDI-TOF/TOF和LC-MS/MS液质联用分析大鼠脑脉络丛的多肽组[J]. 中国生物化学与分子生物学报, 2010,26(7): 659-671.
[11]蔡江佳, 李晔, 苏秀榕, 等. 鱿鱼皮胶原蛋白对H2O2诱导MC3T3-E1损伤的修复作用[J]. 中国食品学报, 2015, 15(1): 6-12.DOI:10.16429/j.1009-7848.2015.01.002.
[12]王鸿飞, 飞刘, 超徐, 等. 费菜总黄酮调节血脂及对肝癌细胞增殖的作用[J]. 中国食品学报, 2013, 13(4): 23-26.
[13]童茜茜, 徐嘉杰, 苏秀榕, 等. 小球藻精油对人结肠癌细胞增殖和凋亡的作用[J]. 中国食品学报, 2016, 16(5): 25-31. DOI:10.16429/j.1009-7848.2016.05.004.
[14]李晔, 陈蕾, 李振, 等. 浙江枝吻纽虫凝溶胶蛋白基因的原核表达产物抗肿瘤活性的研究[J]. 海洋与湖沼, 2012, 43(4): 756-760.
[15]段爱霞, 陈晶, 刘宏德, 等. 分子对接方法的应用与发展[J]. 分析科学学报, 2009, 4(6): 473-477.
[16]ULRIKE G, TERESA K, FLORIAN P, et al. Accessing biological actions of Ganoderma secondary metabolites by in silico profiling[J].Phytochemistry, 2015, 114(4): 114-126.
[17]WU Q, JIA J, YAN H, et al. A novel angiotensin-I converting enzyme(ACE) inhibitory peptide from gastrointestinal protease hydrolysate of silkworm pupa (Bombyx mori) protein: biochemical characterization and molecular docking study[J]. Peptides, 2015, 68(2): 17-24.
[18]刘广斌, 赵东欣, 马丽, 等. 计算机模拟HsRAD51蛋白与多肽BRC4分子对接[J]. 化学研究, 2016, 27(1): 97-101. DOI:10.14002/j.hxya.2016.01.017.
[19]郑春松, 叶蕻芝, 许惠凤, 等. 分子对接法预测独活寄生汤对TNF-α和IL-1β作用的活性成分[J]. 福建中医药大学学报, 2012, 22(4): 28-30. DOI:10.3969/j.issn.1004-5627.2012.04.009.
[20]胡流芳, 王迎, 任汝静, 等. Keap1-Nrf2/ARE信号通路的抗氧化应激作用及其调控机制[J]. 国际药学研究杂志, 2016, 43(1): 146-152.DOI:10.3969/j.issn.1004-5627.2012.04.009.
[21]OUYANG H, STANFIELD J, COLE C, et al. High-SPF sunscreens may provide ultraviolet protection above minimal recommended levels by adequately compensating for lower sunscreen user application amounts[J]. American Academy Dermatology, 2012, 67(2): 1220-1227. DOI:10.1016/j.jaad.2012.02.029.
[22]SENARATNE L S, PARK P J, KIM S K. Isolation and characterization of collagen from brown backed toadfish (Lagocephalus gloveri)skin[J]. Bioresource Technology, 2006, 97(2): 191-197.
[23]张达江, 王亮. I型胶原蛋白的结构、功能及其应用研究的现状与前景[J]. 生物技术通讯, 2006, 17(2): 265-269.
[24]吕玲玲, 金香淑, 施溯筠. 林蛙皮胶原蛋白的提取及抗氧化性[J]. 食品研究与开发, 2013, 34(10): 20-22. DOI:10.3969/j.issn.1005-6521.2013.10.006.
[25]窦梅, 初晓, 张杰, 等. 扇贝多肽保护单次UVA氧化损伤HaCaT细胞[J]. 中国药理学通报, 2006, 22(4): 416-420. DOI:10.3321/j.issn:1001-1978.2006.04.008.
[26]程若城, 李澄, 王清, 等. 雌二醇拮抗紫外线所致大鼠表皮角质形成细胞损伤作用的研究[J]. 中国老年学杂志, 2009, 29(14): 1773-1775.DOI:10.3969/j.issn.1005-9202.2009.14.021.
[27]MILLER A F. Superoxide dismutase: active sites that save, but a protein that kills[J]. Current Opinion Chemistry Biology, 2004, 8(2):162-168. DOI:10.1016/j.cbpa.2004.02.011.
[28]王咏梅. 自由基与谷胱甘肽过氧化物酶[J]. 解放军药学学报, 2005,21(5): 369-371. DOI:10.3969/j.issn.1008-9926.2005.05.017.
[29]刘娜, 刘俊田. 失巢凋亡在As斑块破裂中的作用及机制[J]. 中国药理学通报, 2007, 23(3): 298-301. DOI:10.3321/j.issn:1001-1978.2007.03.006.
[30]吴伟, 徐蔚. 线粒体通透性转换孔结构和功能的研究进展[J]. 医学信息, 2011, 24(3): 1753-1754. DOI:10.3321/j.issn:1001-1978.2007.03.006.
