干旱及复水对桑树叶片光合能力的影响
2018-05-23滕志远张栩涵张会慧张秀丽孙广玉
滕志远,张栩涵,张会慧,马 瑶,张秀丽,孙广玉
(1.东北林业大学生命科学学院,黑龙江 哈尔滨 150040; 2.东北农业大学资源与环境学院,黑龙江 哈尔滨 150030)
桑树(Morusalba)是桑科(Moraceae)桑属植物,在亚洲、欧洲及美洲的50多个国家均有种植[1],是自古以来集多种用途于一体的经济树种[2]。近年来饲料桑的开发利用越来越引起人们的重视。研究发现,在蛋白质和糖代谢过程中起重要作用的谷氨酸、赖氨酸和蛋氨酸在桑枝叶含量丰富,这对动物体内蛋白质合成具有特别重要的意义[3]。且桑枝叶中粗蛋白和碳水化合物含量较优质饲料苜蓿(Medicagosativa)分别高10.6%和32.1%,而纤维素含量和粗脂肪较苜蓿分别低50.0%和12.5%;饲喂桑枝叶的奶牛产奶量较饲喂苜蓿的奶牛高46.6%,饲喂桑枝叶的鸡消化能较饲喂苜蓿的鸡高15.8%[4]。桑树作为新型畜禽饲料源,既可弥补夏季缺少青绿饲料的不足,又可缓解人畜争粮矛盾。桑枝叶中富含多种可提高畜禽抗逆力和改善畜禽产品风味的活性物质[4]。此外,桑树具有较强的抗逆性和适应性,使得饲料桑在退耕还林、治理荒地和城市绿化等工程中被广泛应用[5]。
自我国实施 “东桑西移,南蚕北移”工程[6]后,桑树的栽植逐渐由湿润区域向内陆干旱和半干旱地区扩展。东北干旱地区种植的桑树,其幼苗生长经常遭遇春旱,而有关桑树叶片光合能力对于干旱响应的相关研究越来越多。陈志成等[7]发现最有利于桑树光合作用的土壤含水量(SWC)为45%~78%。而Guha等[8]报道,水分亏缺对耐旱型的桑树品种V1(M.indica‘V1’)的叶片光合气体交换参数影响较小,同时可保持较高的蒸腾速率及气孔导度。在不致死的干旱胁迫下(根系周围SWC:22%~28%),尽管桑树叶片光合气体交换受到抑制,但PSⅡ的结构和功能保持正常;干旱时可能会伴随着强光或高温[9-10],且当干旱程度继续增强时,植物体内活性氧增加,保护酶活性升高[11-12];当超过植物可承受的干旱胁迫时,活性氧的产生与清除失衡[13],生长受到抑制。而关于桑树光合特性对旱后复水响应情况的报道为数不多,在持续10 d干旱胁迫(SWC 25%)下,桑树叶片光合气体交换参数值明显下降,但复水48 h后,主要相关参数值可恢复到无干旱胁迫水平[14]。有研究发现,植物是否受干旱胁迫,与植物品种、干旱程度和发生频率直接相关[15]。而近年来,黑龙江省春旱频发,但推广种植的桑苗成活率并未受其影响,其对干旱响应及复水恢复的相关机制尚不明确。为此,研究干旱及旱后复水对黑龙江省桑树主要栽培品种“秋雨桑”(M.alba‘Qiuyu’)幼苗叶片光合生理特性的影响,以期从理论上认识苗期干旱后复水后桑树生长和光合作用动态过程,以便在干旱地区桑树栽培过程中,利用其自身的调节和补偿机制最终达到节水增产的目的。
1 试验设计
1.1 植物材料
供试品种为一年生“秋雨桑”扦插苗,由黑龙江省蚕业研究所提供。桑树的培养方法与滕志远等[16]的相同。
1.2 试验处理
根据黑龙江省气象局资料表明,2014年5月苗木生长期间,哈尔滨日温为(14±3) ℃,夜温为(5±3) ℃,太阳辐射最高值为1 689 μmol·(m2·s)-1。5月30日至6月4日,气温迅速升高,6月3至5日分批开始控水试验,干旱胁迫及复水后的试验于6月19日至22日测定。日最高气温(33±2) ℃,夜温(21±2) ℃,太阳辐射最高值为1 879 μmol·(m2·s)-1,干旱胁迫及复水期间,气温变化比较平稳,日温(28±4) ℃,夜温(18±2) ℃,太阳辐射最高值为1 809 μmol·(m2·s)-1。随机选取4盆(4次重复)检测桑树根系周围土壤含水量(SWC)=(土鲜重-土干重)/土鲜重×100%,分别在处理后5、8、11、14、17、20 d的傍晚测定供试桑苗的根系周围SWC,相应结果分别为66.5%、53.9%、36.4%、26.7%、18.6%、11.2%,同时保证平行试验的对照(CK)植株正常生长,SWC在55%左右。
预试验发现,当SWC≤26.7%时(处理后14 d),桑树叶片已完全萎蔫,净光合速率接近0。分别对SWC为26.7%(处理后14 d)、18.6%(处理后17 d)和11.2%(处理后20 d)的桑苗进行复水试验,结果表明,根际土SWC为11.2%(处理后20 d),桑苗因缺水致死,复水也未能复活。根际土SWC为18.6%(处理后17 d)的桑苗叶片萎蔫枯落,但供水若干天后能够长出新叶,而根际土SWC为26.7%的桑苗叶片的生长和光合特性,可在数小时内恢复。本研究中所涉及到的干旱胁迫均指根际土壤的SWC为26.7%(相当于处理后14 d处理组的SWC)。
1.3 测定项目
1.3.1光合气体交换参数的测定 2014年6月19至22日,天气晴朗,日平均温度(26±1) ℃,风力小于3级。为保证测定叶片经过充分的光合诱导,于09:00-11:00进行光合气体交换参数的测定,利用Li-6400型光合仪器自带光源设定光强(PPFD)为1 200 μmol·(m2·s)-1[小于桑树叶片饱和光强1 280 μmol·(m2·s)-1]。干旱胁迫处理后14 d, SWC为26.7%(0 h),分别于复水后1、2、3、4、5、6 h测定各指标。分别测定从上往下数第3~4片完全展开功能叶片的主要光合气体交换参数:叶片蒸汽压亏缺(Vpdl)、气孔导度(Gs)、净光合速率(Pn)、胞间CO2浓度(Ci)和蒸腾速率(Tr),并利用以上测得参数计算气孔限制值[Ls=1-(Ci/Ca)]和水分利用效率(WUE=Pn/Tr)。为保证复水后4、5、6 h测定的时间是在09:00-11:00,采取分批提前复水等措施。
1.3.2叶绿素荧光参数的测定 测定光合气体交换参数的同时,同样采用分批错时的方法,用暗适应夹对供试桑苗从上往下数第3~4片完全展开功能叶片进行暗适应30 min,利用便携调制式荧光仪(FMS-2,Hansatech,英国),参照Hu等[17]方法测定主要荧光参数:PSⅡ最大光化学效率(Fv/Fm)、最大荧光(Fm)、初始荧光(Fo)和电子传递速率(ETR);根据文献[18-19]计算出PSⅡ反应中心吸收光能的去向(图1),即:用于光化学反应的量子产额(ФPSⅡ)=[1-(Fs/Fm')][(Fv/Fm)/(Fv/FmM)];依赖于类囊体膜两侧质子梯度和叶黄素循环的量子产额(ФNPQ)=[(Fs/Fm')-(Fs/Fm)][(Fv/Fm)/(Fv/FmM)];基本的荧光量子产额和热耗散的量子产额(Фf,D)=[(Fs/Fm)][(Fv/Fm)/(Fv/FmM)]以及失活PSⅡ反应中心的热耗散量子产额(ФNF)=1-(Fs/Fm)/[(Fv/Fm)/(Fv/FmM)];ФNF+ФPSⅡ+ФNPQ+Фf,D=1(图1)。
1.3.3叶片形态指标的测定 待光合气体交换参数及荧光参数检测完毕,测相应叶片的叶基角和卷曲度[20]。取叶片进行相对含水量的测定。叶基角利用量角器测定茎杆和叶片平直部分的夹角;叶片含水量(LWC)=(鲜重-干重)/干重×100%。
1.4 数据处理和统计方法
利用DPS 7.05软件中的单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)对不同处理间试验数据进行差异比较。利用Excel 2010软件绘制图表,数据均为4次重复的平均值±标准差。
2 结果与分析
2.1 干旱及旱后复水对桑树叶片形态及叶片蒸汽压亏缺的影响
自然蒸发式干旱对桑树幼苗生长的影响,取决于根际土的SWC,在干旱处理后17 d(SWC 18.6%)时,桑苗叶片萎蔫枯落,此时恢复供水若干天后,桑苗可长出新叶,而在干旱处理后20 d时(SWC 11.2%),桑苗因缺水致死,复水也不能复活。与叶片翠绿、上举的对照组桑树幼苗相比(图2),当干旱处理后14 d时(SWC 26.7%)的桑苗其叶片萎蔫、卷曲并下垂,叶片饱和蒸汽压亏缺(Vpdl)为2.05(图3),较对照组的高出38.4%,差异极显著(P<0.01)。随着复水时间的推移,萎蔫的叶片逐渐舒展,叶片Vpdl在复水后5 h接近对照组,在6 h时叶片的Vpdl略高于对照组。幼苗叶片的含水量在干旱处理后14 d时为43.7%(表1),较对照组的71.7%低39.1%,差异极显著(P<0.01)。随着复水时间的延长,叶片的含水量逐渐增加,复水后4 h桑树叶片含水量已接近对照组。而叶基角在复水后的2 h略有增加,但与干旱处理14 d的差异不显著(P>0.05),直到复水后6 h,叶基角下降到41.2°,仍极显著低于对照(P<0.01)。同时叶片的卷曲度在复水后1 h显著下降,直到复水6 h叶片的卷曲度与对照组的差异不显著(P>0.05)。
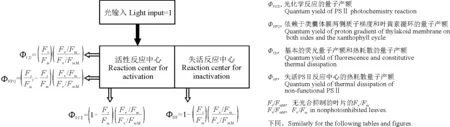
图1 PSⅡ吸收全部光能的分配情况Fig. 1 Allocation of absorption energy in PSⅡ

图2 桑树幼苗叶片状态的变化Fig. 2 Changes in status in mulberry leaves
CK表示对照,RW表示复水处理。下同。
CK, control treatment;RW,rewatering treatmen; similarly for the following tables and figures.

图3 桑树幼苗叶片蒸汽压亏缺的变化Fig. 3 Changes in the saturation vapor pressure in mulberry leaves
桑树幼苗叶片状态标注(0 h)为干旱处理后14 d,SWC为26.7%;不同大写字母和小写字母分别表示差异极显著(P<0.01)和显著(P<0.05)。下同。
Photo marked with (0 h) means the status of leaves under 26.7% soil water content (SWC); Different capital and lowercase letters indicate significant difference at 0.01 and 0.05 levels, respectively. similarly for the following tables and figures.

表1 干旱及旱后复水对桑树叶片形态的影响Table 1 Effects of drought and rewatering on morphology in mulberry leaves
同列不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05)。
Different capital and lowercase letters within the same column indicate significant difference at 0.01 and 0.05 level.
2.2 干旱及旱后复水对桑树叶片光合气体交换参数的影响
干旱胁迫导致桑树叶片的净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)值接近于0(图4),分别较对照组低92.5%、89.2%和75.3%,与对照组间差异极显著(P<0.01);复水后,随着时间的推移,以上参数值迅速升高,在复水后5 h,叶片的Pn和Gs已分别达到11.011 μmol·(m2·s)-1和0.22 mmol·(m2·s)-1,均与对照组差异不显著(P>0.05)。干旱胁迫(0 h)处理的胞间CO2浓度(Ci)较对照组高60.5%,与对照组间差异显著(P<0.05);复水后Ci值在各检测时段均与对照组差异不显著(P>0.05)。桑树叶片的水分利用效率(WUE),在复水3、4 h后,分别较对照组高42.9%、59.1%,差异极显著(P<0.01)。气孔限制值(Ls)与对照组的变化趋势一致,差异不显著(P>0.05)。
2.3 干旱及旱后复水对桑树叶片主要荧光参数的影响
干旱胁迫(0 h)的初始荧光(Fo)较对照组高出9.9%,差异显著(P<0.05),最大荧光(Fm)较对照组低17.2%,差异极显著(P<0.01),复水后,差异逐渐不显著(P>0.05);复水1 h后,Fo与对照组差异不显著(P>0.05),而Fm与对照组的差异仍处于显著水平(P<0.05);复水4 h后,Fm与对照组的差异不显著(P>0.05)。桑树叶片的最大光化学效率(Fv/Fm)在干旱胁迫下(0 h)以及复水后低于对照组,其值在复水后逐渐上升,但各检测时段与对照组差异不显著(P>0.05)。电子传递速率(ETR)在干旱胁迫下较对照组低51.0%,差异极显著(P<0.01),复水后其值迅速上升,在复水5 h后,ETR值接近对照组,差异不显著(P>0.05)(图5)。
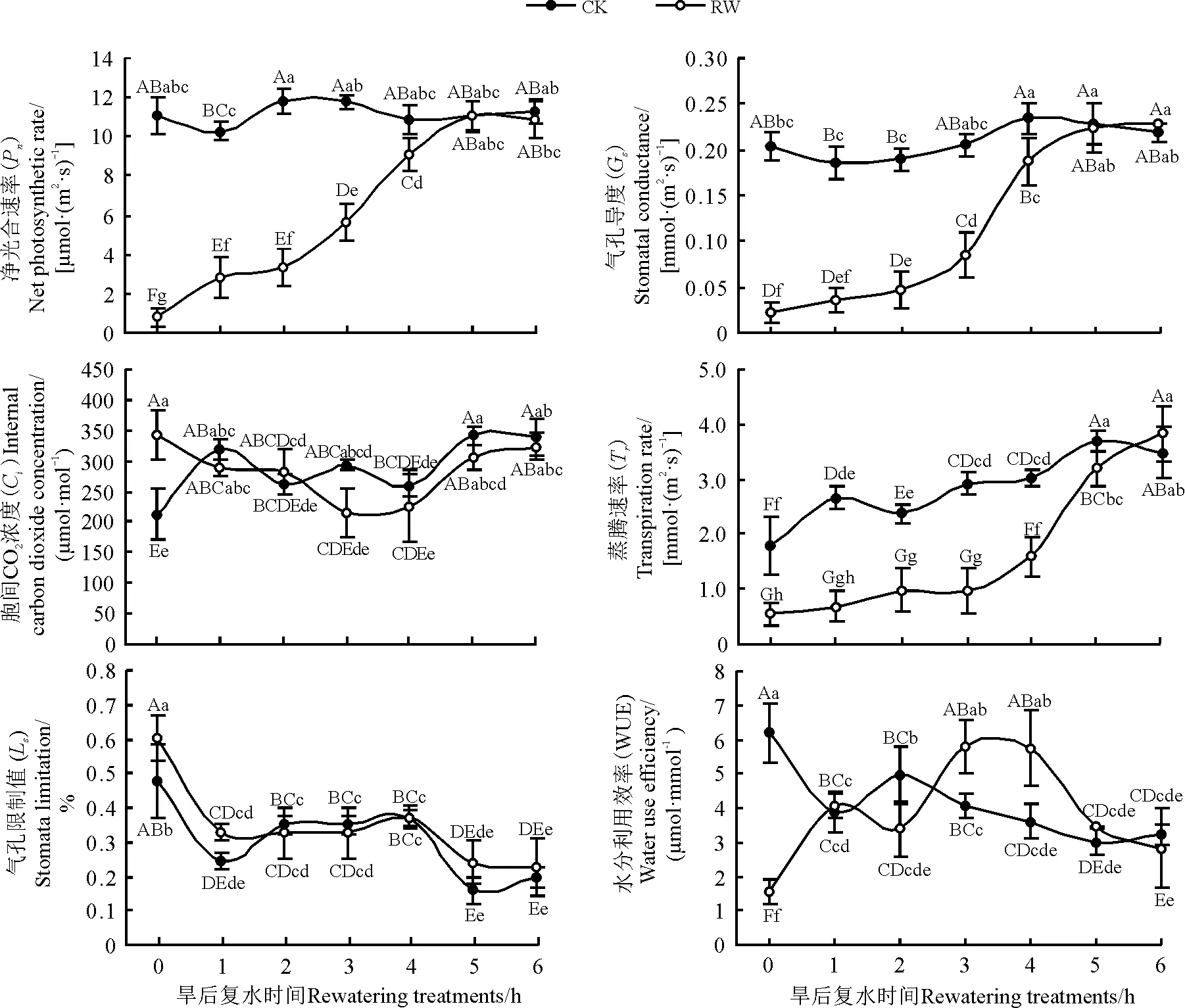
图4 干旱及旱后复水对桑树叶片光合气体交换参数的影响Fig. 4 Effects of drought and rewatering on photosynthetic gas exchange parameters in mulberry leaves
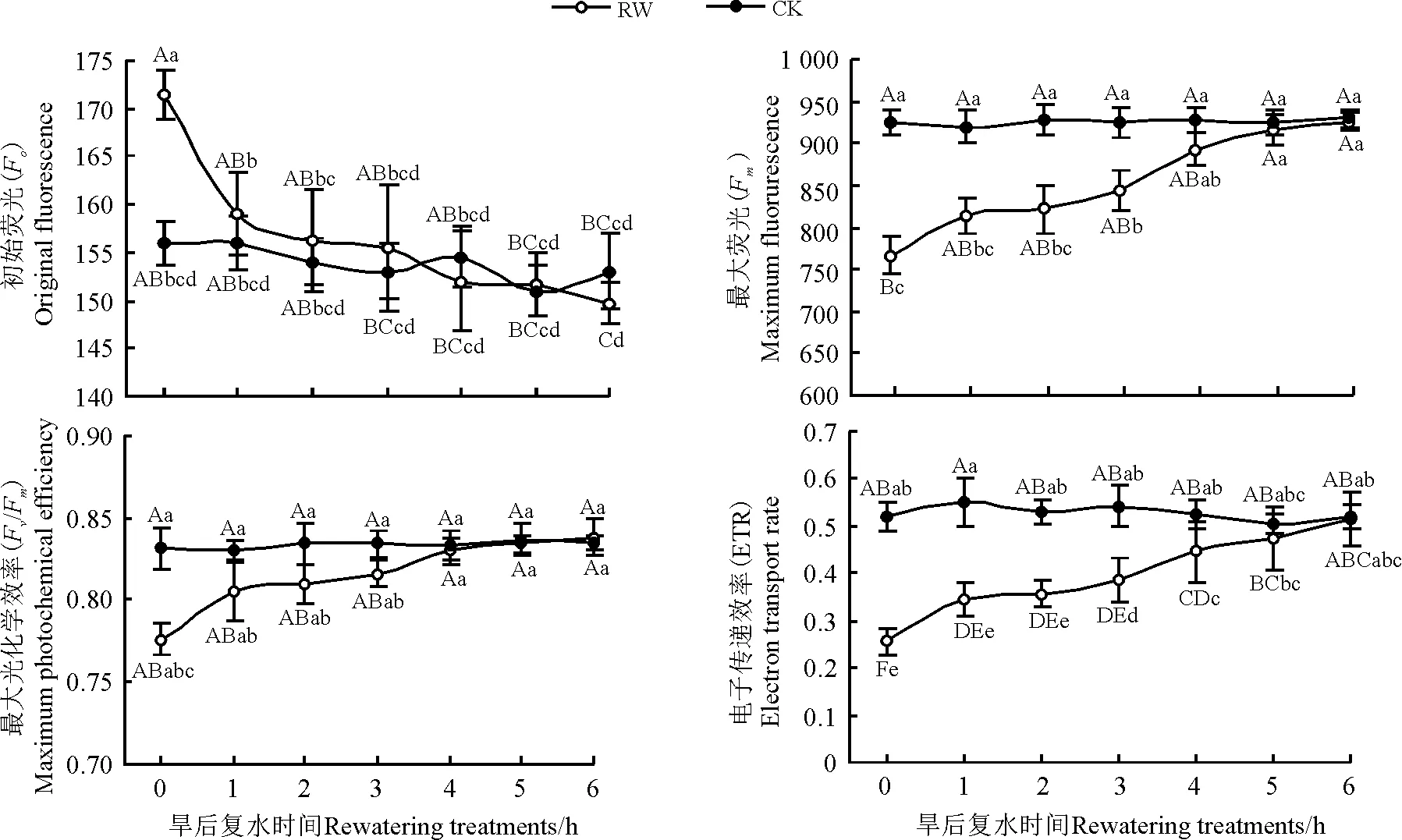
图5 桑树叶片部分荧光参数对干旱及旱后复水的响应Fig. 5 Responses of the chlorophyll fluorescence parameters of mulberry leaves to drought and rewatering
2.4 干旱及旱后复水对桑树叶片PSⅡ反应中心吸收光能分配的影响
在干旱及复水后各处理间,桑树叶片过剩光能(1-qP)/NPQ与对照组差异不显著(P>0.05),且在5 h后逐渐低于对照组(图6)。干旱处理组叶片PSⅡ反应中心吸收的光能用于光化学反应量子产额(ФPSⅡ)所占的比例为44.9%,较对照组的67.3%下降33.2%,差异极显著(P<0.01),而依赖于类囊体膜两侧质子梯度和叶黄素循环的量子产额(ФNPQ)比例为22.3%,较对照组的9.4%高出136.0%,差异极显著(P<0.01);基本的荧光量子产额和热耗散的量子产额(Фf,D)所占的比例为27.6%,较对照组的21.7%高出27.2%,差异极显著(P<0.01);失活PSⅡ反应中心的热耗散量子产额(ФNF)所占的比例为5.2%,较对照组的1.6%高出231.3%,差异极显著(P<0.01)。复水后,ФPSⅡ所占的比例不断地上升,在复水6 h后已增加到60.7%。而ФNPQ随着复水时间不断地下降,复水6 h下降到12.6%。复水后1 h,ФNF所占的比例由5.2%下降为3.1%,此后试验检测时段内,其值一直处于3%左右。复水后4 h,Фf,D逐渐下降到24.1%,此后检测时段内其值均维持在24%左右。

图6 干旱及旱后复水对桑树叶片PSⅡ反应中心吸收光能分配的影响Fig. 6 Effects of drought and rewatering on the energy allocation pathways in mulberry leaves
3 讨论与结论
干旱胁迫是限制植物生理和生长发育的关键因子之一,对植物生长的影响取决于干旱程度和持续时间。刘译锴等[21]发现黑麦草(Loliumperenne)对干旱响应的土壤相对含水量的阈值下限为40%,Guha等[8]发现SWC在22%~28%时,印度桑树可存活不致死;Ramanjulu等[14]将桑苗置于25%的SWC下持续10 d,其净光合速率虽有下降,但可在复水48 h后得以恢复。而本研究的结果与前人研究结果相似,通过停止浇水,处理后20 d,SWC降至11.2%,桑苗致死;SWC降至18.6%时,复水后枯叶掉落,但可绽出新叶;SWC降至26.7%时,降低、萎蔫下垂、叶基角增大、卷曲度增加,Pn和Gs值接近0,而Ci值不降而升,在此干旱胁迫程度下,复水后桑树光合气体交换的相关参数可在6 h内恢复。在水分供应不足时,植物受到的光强可能会超出其相应碳同化能力所需的光强,造成光化学转换和电子传递与能量消耗之间的矛盾,进而会降低PSⅡ的光化学效率,导致光抑制[22]。通常情况下,干旱胁迫导致植物光合能力下降与气孔因素和非气孔因素有关,当Ci减少而Ls升高时,Pn下降主要因气孔因素引起,当Pn值下降而Ci值上升或者不变,Ls值不变或者下降则表明是由非气孔因素引起[23]。在本研究中,SWC为26.7%的干旱胁迫下,桑树叶片的Pn值和Gs值接近0,而Ci值和Ls值均上升,表明桑树叶片Pn下降是由气孔和非气孔因素共同引起的,其中非气孔因素包括光能捕获效率、光合电子传递效率和碳同化过程等内在特性[24]。
反映光合作用“内秉性”特点的叶绿素荧光参数,可用于深入了解在不同环境下植物光合器官的结构和功能等相关信息。Fo是PSⅡ反应中心完全开放时的荧光产量,其值的大小取决于PSⅡ天线色素内的最初激发态电子密度、激发能传递速率和光合色素浓度;Fm是PSⅡ反应中心完全关闭时的荧光产量,其大小可反映PSⅡ中电子传递情况[25]。本研究中,干旱复水前和复水后各检测时段内Fv/Fm与对照组差异不显著,相关研究发现,大麦(Hordeumvulgare)[26]和葡萄(Vitisvinifera)[27]叶片的Fv/Fm对干旱胁迫同样不敏感。本研究中,干旱胁迫下桑树叶片的Fo升高,Fm降低,ETR降低,说明桑树叶片PSⅡ反应中心活性以及其接受光量子的能力降低,同时PSⅡ的电子传递速率显著下降。而在复水期间,Fo和Fm快速恢复,分别于复水1、4 h后与对照组差异不显著,桑树叶片受到抑制的光合功能在数小时内得以迅速恢复。姚春霞等[28]研究发现拔节期玉米(Zeamays)叶片光合气体交换参数和荧光参数在重度干旱胁迫下,复水5 d可基本恢复;蒙祖庆等[29]发现旱后复水的1~2周是油菜(Brassicanapus)叶片气体交换参数得到光合补偿的关键期,植物叶片光合性能在干旱后复水过程中自我修复或恢复的程度存在个体上差异,桑树在此方面具有完善的修复机制,能够在相对较短时间内得以恢复。
桑树幼苗不但可通过增加形态可塑性来适应干旱胁迫,还可以通过非辐射热耗散来维持正常的光合功能[16]。通过定量分析PSⅡ反应中心吸收光能的分配,可以进一步明确逆境对光合机构的抑制或破坏程度,同时还可以映射植物叶片中自我保护功能对逆境的响应情况[30-31]。干旱胁迫明显改变了桑树叶片PSⅡ反应中心吸收光能的分配,与对照组相比,ФPSⅡ所占的比例下降,复水6 h后,其值与对照组差异不显著,说明桑树幼苗在干旱胁迫后复水,光合电子传递速率得以迅速恢复,进而形成碳同化所需的同化力;根据Öquist等[32]理论:PSⅡ的失活反应中心具有非辐射能量耗散的能力,可以将部分光能转换中心转变为过剩光能的耗散中心。本研究中ФNF值增加,表明PSⅡ反应中心得以重建并能够维持剩余有活性反应中心的功能[33]。同时,干旱胁迫下桑树叶片过剩光能ФNPQ和Фf,D的比例显著高于对照组,由此说明,在干旱胁迫下,桑树叶片可通过增加ФNPQ和Фf,D的比例来消耗过剩光能。
黑龙江省春季干旱频发,桑树幼苗生长处于干旱和旱后复水不断变化的环境中,形成了从“伤害”到“适应”的机制。近年来,植物对干旱胁迫响应的研究,由原来伤害程度逐渐转到旱后复水恢复及补偿机制[34],着重从环境的动态变化角度考虑植物某一形态或功能的足量或超额恢复的作用机制[35],有关桑树幼苗旱后复水光合特性的补偿情况及生理机制是下一步研究的主要内容。
参考文献References:
[1] Vijayan K,Chatterjee S N.ISSR profiling of Indian cultivars of mulberry (Morusspp.) and its relevance to breeding programs.Euphytica,2003,131(1):53-63.
[2] 胡月,张倩,孙东彬,孙雨薇,张秀丽,孙广玉.模拟酸雨对桑树叶片光合日变化的影响.草业科学,2015,32(11):1862-1870.
Hu Y,Zhang Q,Sun D B,Sun Y W,Zhang X L,Sun G Y.Effects of simulated acid rain on diurnal changes of mulberry (Morusalba) photosynthesis.Pratacultural Science,2015,32(11):1862-1870.(in Chinese)
[3] 严冰,华卫东.桑叶作为草食动物饲料的营养价值.饲料博览,1999(1):28-30.
Yan B,Hua W D.Nutritive value of mulberry leaves as herbivorous animal feed.Seed Review,1999(1):28-30.(in Chinese)
[4] 杜周和,左艳春,严旭,周晓康,寇晶,刘彬斌,陈义安,刘俊凤.饲料桑草本化栽培及其在畜禽养殖中的应用.中国人口·资源与环境,2015,183(25):413-416.
Du Z H,Zou Y C,Yan X,Zhou X K,Kou J,Liu B B,Chen Y A,Liu J F.Herbal-cultivating of mulberry forage and utilization in livestock breeding.China Population,Resources and Environment,2015,183(25):413-416.(in Chinese)
[5] 王宏恩,孟宝奎,韩红发.对桑树作为造林绿化树种的探讨.北方蚕业,2010,31(1):45-47.
Wang H E,Meng B K,Han H F.The discussion of mulberry as afforestation tree species.The North Sericulture,2010,31(1):45-47.(in Chinese)
[6] 许楠.黑龙江省桑树氮肥运筹及光合调控机理的研究.哈尔滨:东北林业大学博士学位论文,2013.
Xu N.Mulberry nitrogen application and photosynthetic mechanism of regulation in the Heilongjiang Province.PhD Thesis.Harbin:Northeast Forestry University,2013.(in Chinese)
[7] 陈志成,王志伟,王荣荣,耿兵,张永涛.桑树叶片光合生理性状对土壤水分含量和光照强度的响应.蚕业科学,2012(3):375-380.
Chen Z C,Wang Z W,Wang R R,Geng B,Zhang Y T.Responses of photosythesis physiological characteristics of mulberry leaf to soil moisture and light intensity.Science of Sericulture,2012(3):375-380.(in Chinese)
[8] Guha A,Sengupta D,Reddy A R.Physiological optimality,allocation trade-offs and antioxidant protection linked to better leaf yield performance in drought exposed mulberry.Journal of the Science of Food & Agriculture,2010,90(15):2649-2659.
[9] Dorcus D,Vivekanandan M.Exploitation of mulberry genotypes for drought resistance potential.Journal of Insect Biotechnology & Sericology,1997,66:71-80.
[10] Guha A,Reddy A R.Leaf gas exchange,water relations and photosystem.Ⅱ Functionality depict anisohydric behavior of drought-stressed mulberry (Morusindica‘V1’) in the hot semi-arid steppe agroclimate of Southern India.Flora-Morphology,Distribution,Functional Ecology of Plants,2014,209(2):142-152.
[11] Guha A,Sengupta D,Reddy A R.Polyphasic chlorophyll a fluorescence kinetics and leaf protein analyses to track dynamics of photosynthetic performance in mulberry during progressive drought.Journal of Photochemistry & Photobiology B Biology,2013,119:71-83.
[12] 马建平,牟志美.桑树抗逆性研究进展.北方蚕业,2006,27(2):5-7.
Ma J P,Mu Z M.Research progress of mulberry resistance.The North Sericulture,2006,27(2):5-7.(in Chinese)
[13] 崔婷茹,于慧敏,李会彬,边秀举,王丽宏.干旱胁迫及复水对狼尾草幼苗生理特性的影响.草业科学,2017,34(4):788-793.
Cui T R,Yu H M,Li H B,Bian X J,Wang L H.Effect of drought stress and rewatering on physiological characteristics ofPennisetumalopecuroides seedlings.Pratacultural Science,2017,34(4):788-793.(in Chinese)
[14] Ramanjulu S,Sreenivasalu N,Kumar S G.Photosynthetic characteristics in mulberry during water stress and rewatering.Photosynthetica,1998,11(2):S746-S746.
[15] 聂希安.干旱和低温与农业技术对策.黑龙江农业科学,1991(3):33-35.
Nie X A.The agricultural technology countermeasure for drought and low temperature.Heilongjiang Agricultural Sciences,1991(3):33-35.(in Chinese)
[16] 滕志远,张会慧,代欣,胡举伟,张秀丽,孙广玉.干旱对桑树叶片光系统Ⅱ活性的影响.浙江农业学报,2016,28(1):1-8.
Teng Z Y,Zhang H H,Dai X,Hu J W,Zhang X L,Sun G Y.Effects of drought stress on PSⅡ photochemical activity in leaves ofMorasalba.Acta Agriculture Zhejiangensis,2016,28(1):1-8.(in Chinese)
[17] Hu Y B,Sun G Y,Wang X C.Induction characteristics and response of photosynthetic quantum conversion to changes in irradiance in mulberry plants.Journal of Plant Physiology,2007,164(8):959-968.
[18] Hendrickson L,Furbank R T,Chow W S.A simple alternative approach to assessing the fate of absorbed light energy using chlorophyll fluorescence.Photosynthesis Research,2004,82(1):73-81.
[19] Zhou Y,Lam H M,Zhang J.Inhibition of photosynthesis and energy dissipation induced by water and high light stresses in rice.Journal of Experimental Botany,2007,58(5):1207-1217.
[20] 张会慧.北方桑树叶片光化学机构对盐碱的响应机理及其肥料效应研究.哈尔滨:东北林业大学博士学位论文,2014.
Zhang H H.Responses of photosynthetic apparatus in leaves of northern mulberry to salt and slkali stress and fertilizer effect research.PhD Thesis.Harbin:Northeast Forestry University,2014.(in Chinese)
[21] 刘译锴,郑明珠,马莉,刘铁军,杨有俊,刘金荣.调亏灌溉对多年生黑麦草光合特性的影响及阈值的确定.草业科学,2015,32(4):570-580.
Liu Y K,Zheng M Z,Ma L,Liu T J,Yang Y J,Liu J R.Effects of regulated deficit irrigation on photosynthetic characteristics in perennial rye grass and the determination for irrigation threshold.Pratacultural Science,2015,32(4):570-580.(in Chinese)
[22] Flexas J,Escalona J M,Medrano H.Water stress induces different levels of photosynthesis and electron transport rate regulation in grapevines.Plant Cell & Environment,1999,22(1):39-48.
[23] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis.Annual Reviews of Plant Physiology,2003,33:317-345.
[25] Ettwig K F,Butler M K,Le Paslier D.Nitrite-driven anaerobic methane oxidation by oxygenic bacteria.Nature,2010,464:543-548.
[26] Oukarroum A,Madidi S E,Schansker G.Probing the responses of barley cultivars (HordeumvulgareL.) by chlorophyll a fluorescence OLKJIP under drought stress and re-watering.Environmental & Experimental Botany,2007,60(3):438-446.
[27] Christen D,Schönmann S,Jermini M.Characterization and early detection of grapevine (Vitisvinifera) stress responses to esca disease by in situ chlorophyll fluorescence and comparison with drought stress.Environmental & Experimental Botany,2007,60(3):504-514.
[28] 姚春霞,张岁岐,燕晓娟.干旱及复水对玉米叶片光合特性的影响.水土保持研究,2012,19(3):278-283.
Yao C X,Zhang S Q,Yan X J.Effects of drought and rewatering on photosythetic characteristics of maize leaf.Research of Soils and Water Conservation,2012,19(3):278-283.(in Chinese)
[29] 蒙祖庆,宋丰萍,刘振兴,张方凯.干旱及复水对油菜苗期光合及叶绿素荧光特性的影响.中国油料作物学报,2012,34(1):40-47.
Meng Z Q,Song F P,Liu Z X,Zhang F K.Effects of drought and rewatering seedling stage on photosythesis and cholrophyll flurescence characteristics rapeseed.Chinese Journal of Oil Crop Science,2012,34(1):40-47.(in Chinese)
[30] Papaevangelou G J,Roumeliotou-Karayannis A.Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation.Physiologia Plantarum,1996,98(2):253-264.
[31] Kramer D M,Johnson G,Kiirats O.New fluorescence parameters for the determination ofQAredox state and excitation energy fluxes.Photosynthesis Research,2004,79(2):209-218.
[32] Öquist G,Chow W S,Anderson J M.Photoinhibition of photosynthesis represents a mechanism for the long-term regulation of photosystem Ⅱ.Planta,1992,186(3):450-460.
[33] Lee H Y,Hong Y N,Chow W S.Photoinactivation of photosystem Ⅱ complexes and photoprotection by non-functional neighbours inCapsicumannuumL. leaves.Planta,2001,212(3):332-342.
[34] 卜令铎,张仁和,韩苗苗,薛吉全,常宇.干旱复水激发玉米叶片补偿效应的生理机制.西北农业学报,2009,18(2):88-92.
Pu L D,Zhang R H,Han M M,Xue J Q,Chang Y.The physiological mechanism of compensation effects in maize leaf by re-watering after drought stress.Acta Agriculturae Boreali-occidentalis Sinica,2009,18(2):88-92.(in Chinese)
[35] 胡田田,康绍忠.植物抗旱性中的补偿效应及其在农业节水中的应用.生态学报,2005,25(4):885-891.
Hu T T,Kang S Z.The compensatory effect in drought resisitance of plant and its application in under saving agriculture.Acta Ecologica Sinica,2005,25(4):885-891.(in Chinese)
