复制缺陷型痘苗病毒天坛株复制缺陷机制初步探究
2018-05-23黄盼盼赵莉任皎赵颖阮力谭文杰田厚文
黄盼盼 赵莉 任皎 赵颖 阮力 谭文杰 田厚文
102206 北京,中国疾病预防控制中心病毒病预防控制所
痘苗病毒(vaccinia virus, VACV)属于痘病毒科正痘病毒属,是研究痘病毒基础生物学、毒力、宿主范围以及病毒与宿主细胞相互作用和宿主免疫反应的模式病毒[1]。痘苗病毒早期作为天花疫苗在人类消灭天花的战役中起到关键的作用,自1980年世界卫生组织宣布人类成功消灭天花后,痘苗病毒被引入实验室中作为基因表达载体广泛被用于多种感染性疾病以及癌症的预防和治疗。由于人类免疫缺陷病毒(HIV)感染、癌症治疗和器官移植等医疗过程中需要进行免疫抑制,研究人员为了提高痘苗病毒载体的安全性,对其进行改造,获得了在多数人源细胞中无法有效复制的毒株,即复制缺陷型痘苗病毒[2]。
目前国外复制缺陷型痘苗病毒有:修饰的痘苗病毒安卡拉株(modified vaccinia Ankara, MVA)和NYVAC;国内是痘苗病毒天坛株(vaccinia virus Tiantan, VTT)的衍生株:复制缺陷型痘苗病毒天坛株(NTV)。MVA 是安卡拉株在鸡胚成纤维细胞(chicken embryo fibroblasts, CEF)中自然传代570次,丢失了15%的基因[3];NYVAC为痘苗病毒哥本哈根株(vaccinia virus Copenhagen, VACV-Cop)用基因重组技术人为删除了18个开放阅读框(open reading frame, ORF)[4];NTV则是阮力等[5]通过基因工程技术缺失位于基因组C到K区的26个基因。这些基因的缺失影响了3株病毒的宿主范围、免疫逃逸和毒力等特性,导致它们在多数人源细胞中无法有效复制,这些细胞被称为病毒的非允许细胞,包括 Hela(人宫颈癌细胞)、2BS(人胚肺二倍体成纤维细胞)、143TK-(人骨髓瘤细胞)、Hep-2(人喉癌细胞)、HEL(人新生儿肾细胞)以及JT-1(人类淋巴母细胞)等[4-5,7]。其中 Hela 是痘苗病毒非复制机制的研究中的模式细胞。
1 材料与方法
1.1材料VTT、NTV由本科室保存。痘苗病毒兔源多抗血清和痘苗病毒A27蛋白鼠多抗血清由本科室保存,分别命名为anti-VTT polyclonal antisera、anti-A27 polyclonal antisera。Anti-his tag antibody购自康为世纪生物科技公司;Anti-β-actin antibody 购自cell Signaling公司;山羊抗兔IgG/辣根酶标记、山羊抗鼠IgG/辣根酶标购自北京中杉金桥生物技术公司;DyLight700山羊抗兔/800山羊抗鼠红外二抗购自Li-COR公司。
1.2VTT和NTV病毒扩增、纯化及滴度测定
1.2.1 VTT、NTV的扩增:常规方法制备鸡胚成纤维细胞(CEF),将VTT或NTV 以0.01 MOI感染CEF细胞,其中VTT于37 ℃扩增培养,NTV于33 ℃扩增培养,培养至完全病变,收集细胞。
1.2.2 VTT、NTV的纯化:将上述细胞病毒液超声破碎与胰酶按体积比4∶1混合,37 ℃水浴30 min,期间震荡2次;离心RCF741 g,rad10.6 cm,10 min,上清移至新的离心管,10 mmol/L Tris-HCl, pH 10洗沉淀3次,离心所得上清混合;向超速离心管中加入冷的36%蔗糖18 ml,将病毒液上清缓慢加入到离心管上相,用10 mmol/L Tris-HCl 调节平衡;离心RCF21 900 g,rad10.7 cm,90 min;弃上清,沉淀用适量的PBS重悬,移至冻存管-80 ℃保存。
1.2.3 免疫染色法测定病毒滴度:6孔板过夜培养BHK-21细胞至单层;用含2% FBS的DMEM维持培养基将病毒10倍梯度稀释感染细胞,每个稀释梯度2复孔,培养箱中吸附培养2 h换成维持培养基培养;24 h后移除培养基,细胞用PBS洗2遍,每孔加入1 ml的丙酮/甲醇(1∶1)固定2 min;PBS洗3次;兔抗痘苗病毒抗体用含3%FBS的PBS稀释,37 ℃混合孵育1 h;PBS洗5次,羊抗兔IgG二抗用上述稀释液按1∶500稀释,37 ℃混合孵育45 min;PBS洗5次,用DAB作为HRP的底物显色;观察并记录病毒斑个数,计算病毒滴度。
1.3痘苗病毒早期蛋白E3、晚期蛋白F17鼠多抗血清制备
1.3.1 基因合成和原核表达载体构建:通过PCR从痘苗病毒基因组上获取f17r、e3l基因序列,测序并优化密码子基因合成,在基因尾部加6个组氨酸编码序列,编码框两端分别插入酶切位点BamHI和NdeI。将整个编码框序列克隆到pET9a原核表达载体上,命名为pET9a-F17R、pET9a-E3L,对两个质粒作酶切及测序鉴定。
1.3.2 蛋白的表达及鉴定:将鉴定阳性重组质粒转化大肠埃希菌BL21(DE3),挑选单克隆优化表达离心收获菌体制备样品,作SDS-PAGE电泳分析。以Anti-his tag antibody作为一抗作Western blot鉴定。
1.3.3 蛋白的纯化及鉴定:E3蛋白的菌种1:50接种于含50 mg/L 卡那霉素的LB 培养基中,培养至OD600=0.8 时加入终浓度为1 mmol/L 的IPTG 于37 ℃诱导表达2 h。菌体用pH7.0含 20 mmol/L 磷酸盐、300 mmol/L NaCl缓冲液重悬,冰水浴超声破碎菌体,功率为300 W,超声4 s,间隔8 s,共60次,4 ℃离心RCF17 300 g,rad10.7 cm,20 min。上清和沉淀分别经SDS-PAGE电泳分析蛋白在上述缓冲液中的水溶性。菌液上清经His-Bind亲和层析纯化,用不同浓度的咪唑洗脱液洗脱蛋白。
F17蛋白为25 ℃过夜诱导表达,收获菌体方法同E3。用pH=5.8含20 mmol/L 磷酸盐、300 mmol/L NaCl、0.1%Triton缓冲液洗包涵体1次。再用pH=8.0 含20 mmol/L 磷酸盐300 mmol/L NaCl、2 mol/L尿素的缓冲液悬起冰水浴超声,功率200 w,超声4 s,间隔8 s,共25次,4 ℃离心RCF17 300 g,rad10.7 cm,20 min,上清纯化同E3蛋白。
1.3.4 免疫小鼠及多抗血清效价测定:纯化蛋白的浓度测定,方法参照BCA蛋白浓度测定试剂盒使用说明。选择6~8周龄雌性BALB/c小鼠,于第1、12和24天采用皮下多点注射免疫小鼠。首次免疫E3或F17与完全弗氏佐剂1∶1乳化,皮下多点免疫,剂量为100 μg/只。第二、三次免疫将蛋白与不完全弗氏佐剂1∶1乳化,剂量同上,同时设PBS对照。第36天取小鼠血清,ELISA 方法进行效价测定。
1.4早晚期蛋白表达水平鉴定选择NTV非允许细胞Hela进行痘苗早、晚期蛋白表达研究,同时以VTT为检测阳性对照。6孔板培养细胞生长至汇片,VTT、NTV 分别以5 MOI感染Hela 细胞,37 ℃吸附1 h,吸出病毒液,换成含2%FBS的DMEM培养,分别于感染后2 h、4 h、8 h、16 h去除细胞培养液,用冰冷的PBS洗细胞面2遍;加入细胞裂解液裂解并收集细胞,离心RCF2 152 g,rad7.7 cm,2 min。上清转移至新的洁净的EP管,加入20 μl 5×SDS Loading Buffer,沸水浴5 min,保存于-80 ℃备用。感染的细胞样品SDS-PAGE电泳后,用Western blot方法对病毒的E3、A27和F17蛋白表达情况进行鉴定,并以β-Actin作为内参指数。
2 结果
2.1病毒两株病毒得到成功的扩增和纯化,经蔗糖垫层纯化的VTT滴度为5×108PFU/ml,NTV滴度为2×108PFU/ml。
2.2E3L、F17R蛋白表达质粒酶切鉴定重组载体pET9a-E3L和pET9a-F17R分别用BamHI和NdeI酶切并送测序,结果显示E3L和F17R基因正确插入载体pET9a中。
2.3蛋白的诱导表达及鉴定将重组质粒转化大肠杆菌BL21 菌株进行蛋白表达,经SDS-PAGE分析,结果如图1所示。Anti-his tag antibody作Western blot对目的蛋白进行特异性鉴定,在预期位置有特异性反应条带。说明E3、F17蛋白在大肠杆菌中均获得了高效表达,占菌体蛋白总量10%以上。
2.4蛋白的纯化E3蛋白表达菌体在pH7.0缓冲液中超声离心后,菌体上清SDS-PAGE胶分析,结果如图2A-1所示,蛋白表现出较高的水溶性。F17在上述pH7.0缓冲液中形成包涵体,而在pH=5.8含2 mol/L尿素缓冲液中溶解量极高,如图2B-1。
将上述E3蛋白菌体上清和F17包涵体上清经His-Bind亲和层析纯化。依次用100 mmol/L、300 mmol/L、500 mmol/L咪唑洗脱液洗脱蛋白。经SDS-PAGE电泳分析,如图2所示,100 mmol/L咪唑能洗脱杂蛋白,E3和F17蛋白皆是300 mmol/L咪唑洗脱。目的蛋白用Millipore超滤离心管浓缩,用Image Lab 软件对浓缩蛋白纯度分析,纯度均达90%。
2.5E3和F17蛋白多抗血清的制备及抗体效价测定选择弗氏佐剂与蛋白抗原乳化后,免疫小鼠制备多抗血清。经ELISA检测E3和F17的鼠多抗血清滴度均大于1:12 800,在Western blot 检测中E3和F17的鼠多抗血清使用稀释度分别为1∶500、1∶1 000。
2.6NTV在非允许细胞Hela中晚期蛋白表达水平鉴定结果如图3所示,在VTT感染Hela细胞中,早期蛋白E3和晚期蛋白A27、F17分别在感染后2 h和4 h即可检出,与早期研究结果相符[8]。 从图上可看出NTV早期蛋白E3的反应强度与VTT相近,说明NTV E3蛋白可正常表达。与VTT比,晚期蛋白A27在NTV中的表达也是正常的;而F17在预期位置仅可检测到微弱的表达,说明F17蛋白表达量较低。
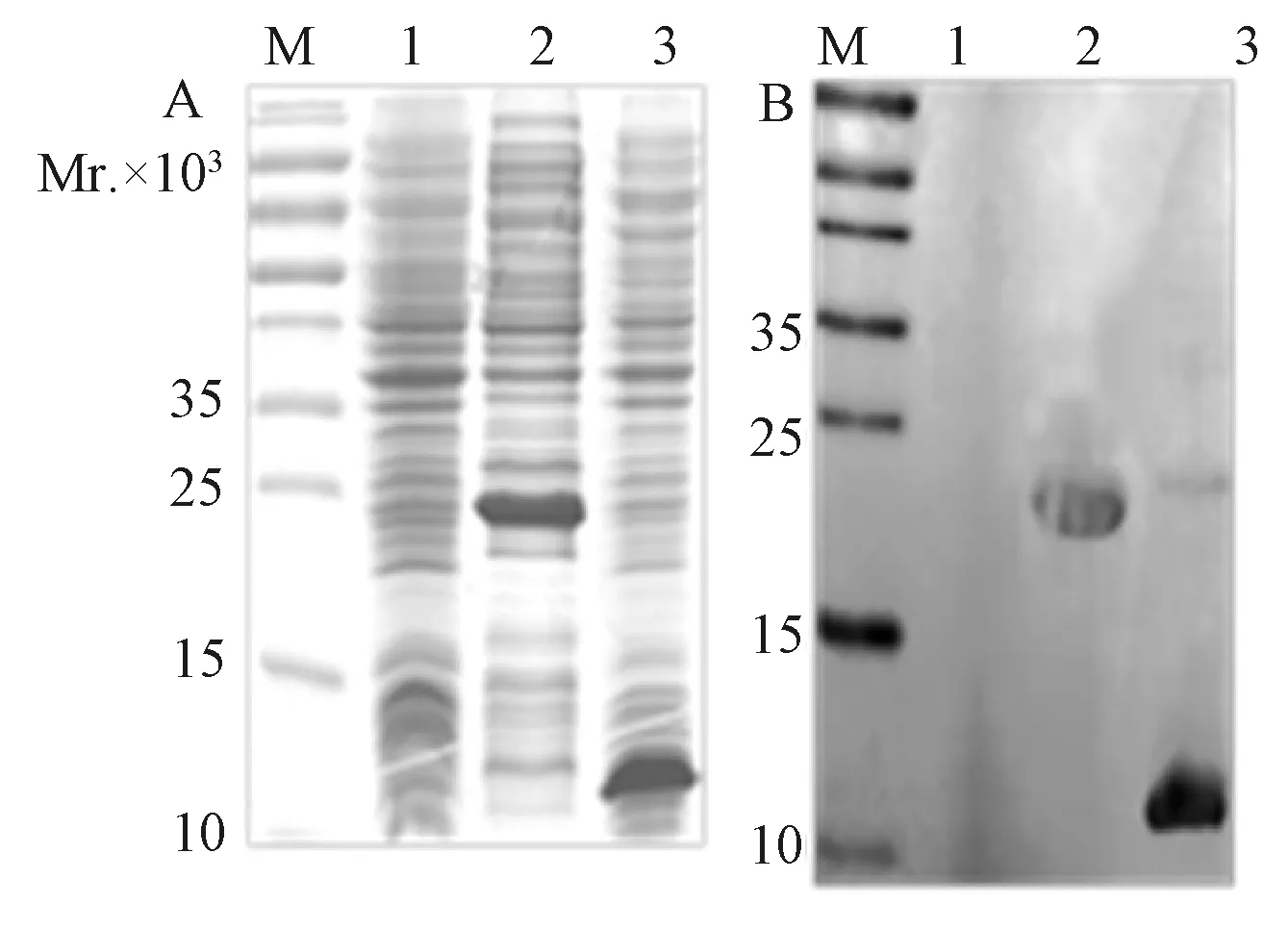
M:marker;1:空载体;2:E3L蛋白全菌裂解液;3:F17R蛋白全菌裂解液图1 E3L和F17R蛋白原核表达的SDS-PAGE分析(A)及Western blot 鉴定(B)M:marker; 1:E. coli lysate of empty plasmid vector;2:E. coli lysate of E3L;3:E. coli lysate of F17R Fig.1 SDS-PAGE(A) and Western blot(B) analysis of protein E3L and F17R prokaryotic expression

M:marker;A-1:E3蛋白菌体上清;B-1:F17蛋白包涵体; 2∶100 mmol/L咪唑洗脱液;3∶300 mmol/L咪唑洗脱液;4∶500 mmol/L咪唑洗脱液图2 E3(A)和F17(B)蛋白纯化的SDS-PAGE分析M:marker; A-1:supernatant of E3-protein E. coli lysate;B-1:supernatant of F17-protein inclusion body lysate;2∶100 mmol/L imidazole eluent;3∶300 mmol/L imidazole eluent;4∶500 mmol/L imidazole eluentFig.2 SDS-PAGE analysis of protein E3(A) and F17(B) purification
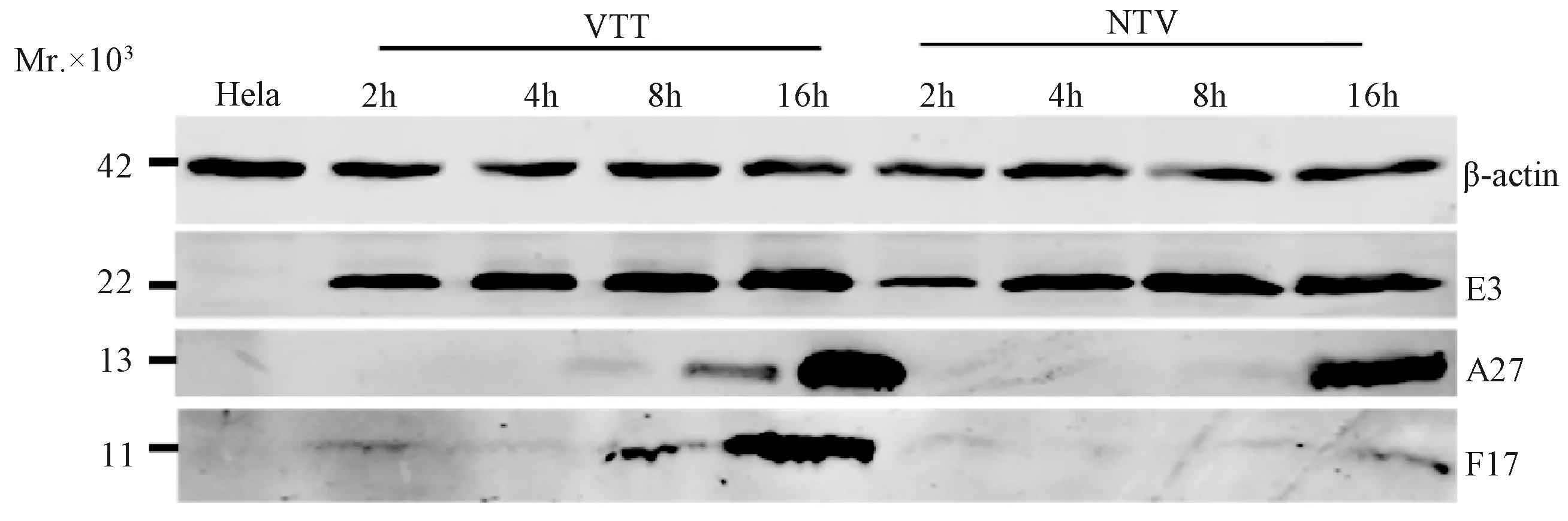
图3 NTV 在Hela细胞中早晚期蛋白表达的Western blot鉴定Fig.3 Western blot analysis of early and late protein expression in NTV infected Hela cells
3 讨论
痘苗病毒形态发生过程产生5种不同类型的病毒粒子:未成熟病毒粒子(immature virion, IV),具有感染性的胞内成熟病毒粒子(intracellular mature virion, MV),胞内包膜病毒粒子(intracellular enveloped virion, WV),结合型包膜病毒粒子(cell-associated enveloped virion, CEV)和胞外包膜病毒粒子(extracellular enveloped virion, EV)。痘苗病毒基因组的表达与复制存在着严格的时序性,不同的基因在病毒生命周期的不同阶段表达,调节着病毒的形态发生和与宿主之间的相互作用。由于3株复制缺陷病毒MVA、NYVAC和NTV自然或人为缺失基因不尽相同,病毒基本的生物学特征和复制缺陷机制也存在差异。目前国际上针对MVA和NYVAC的体外生物学特征及非复制机制已经研究得非常清楚:MVA是由于病毒粒子包装受阻[6-7],而NYVAC是由于晚期蛋白翻译水平被抑制所致[8]。但NTV具体在复制周期的哪一步被阻断尚不清楚。本研究将3株病毒对比,发现NTV病毒基因改造方式和缺失的基因序列与NYVAC更加接近,因此推测NTV的复制缺陷机制可能与NYVAC类似。而目前报导的常用在痘苗病毒非复制机制研究中的蛋白有早期蛋白K3、E3[4,7-10]和晚期蛋白A17、A27、A14、F17[11-13]。本研究选择了与痘苗病毒复制和形态发生密切相关的早期蛋白E3、晚期蛋白A27和F17制备了鼠多抗血清对NTV在Hela细胞中蛋白表达水平进行鉴定。
E3蛋白是痘苗病毒基因编码相对分子质量为22×103蛋白,在C末端和N末端各有一个高度保守的结构域可以与zDNA结合域和N末端为双链RNA结合域(dsRBM)结合。E3L通过与zDNA和dsRBM结合,具有抵御宿主细胞干扰素及抑制PKR活性的作用,影响病毒的宿主范围和细胞凋亡相关特性[14]。A27是病毒的晚期蛋白,存在于IMV表面,是病毒颗粒的运输和包装必需的,抑制A27 L基因表达会阻断IMV运输,抑制IEV颗粒的形成。A27 L蛋白还与另外两种IMV蛋白A17 L和A14 L形成复合物,促进细胞间的融合[13]。F17是p11启动子下的蛋白,相对分子质量约为11×103,在早期的文献中又被称作F18蛋白或也p11,是一种重要的结构蛋白,据估计占了病毒粒子质量的11%。F17可以与A27、A14形成复合物对病毒粒子的形态发生和成熟具有至关重要的作用,抑制F17的表达会破坏病毒粒子的形态形成,导致空的、异常的IV及异常的球形IMV的积累[12,15]。
本研究通过大肠杆菌表达系统获得了痘苗病毒天坛株的功能相关蛋白E3和F17R,并制备了相应鼠多抗血清,为初步探索NTV的复制缺陷机制提供了一定的物质基础。在人源细胞Hela中NTV早期蛋白E3和晚期蛋白A27均能正常表达,而晚期蛋白F17仅可检测到微弱的表达,表明F17蛋白表达受到抑制。由于F17对病毒颗粒的结构组成和形态发生均起着重要作用,此蛋白表达受限会阻断感染性病毒粒子的形成,是NTV复制缺陷的机制之一。而NYVAC的复制缺陷是晚期蛋白A27表达受阻,NTV和NYVAC的复制缺陷机制都与晚期蛋白表达受阻有关,但相应的晚期蛋白有所不同。我们将对其他的复制相关晚期蛋白,如A14、A17的表达水平以及NTV细胞凋亡抑制基因进行研究,进一步探究NTV的复制缺陷机制。
利益冲突:无
参考文献
[1] Smith GL. Genus Orthopoxvirus: Vaccinia virus[P]. Birkhäuser Basel, 2007:1-45.
[2] Ober BT, Brühl P, Schmidt M, et al. Immunogenicity and safety of defective vaccinia virus lister: comparison with modified vaccinia virus Ankara[J]. J Virol, 2002,76(15):7713-7723.
[3] Sutter G, Staib C. Vaccinia vectors as candidate vaccines: the development of modified vaccinia virus Ankara for antigen delivery[J]. Curr Drug Targets Infect Disord, 2003,3(3):263-271.
[4] Tartaglia J, Perkus ME, Taylor J, et al. NYVAC: a highly attenuated strain of vaccinia virus[J]. Virology, 1992,188(1):217-232.
[5] 阮力,朱既明,娄元梅,等.复制缺陷型天坛株痘苗病毒.[P]. 中国专利,200610056800.0, 2008-06-11.
[6] Sancho MC, Schleich S, Griffiths G, et al. The block in assembly of modified vaccinia virus Ankara in HeLa cells reveals new insights into vaccinia virus morphogenesis[J]. J Virol, 2002,76(16):8318-8334.
[7] Carroll MW, Moss B. Host range and cytopathogenicity of the highly attenuated MVA strain of vaccinia virus: propagation and generation of recombinant viruses in a nonhuman mammalian cell line[J]. Virology, 1997,238(2):198-211. DOI: 10.1006/viro.1997.8845.
[8] Backes S, Sperling KM, Zwilling J, et al.Viral host-range factor C7 or K1 is essential for modified vaccinia virus Ankara late gene expression in human and murine cells, irrespective of their capacity to inhibit protein kinase R-mediated phosphorylation of eukaryotic translation initiation factor 2alpha[J]. J Gen Virol. 2010,91(Pt 2):470-482. DOI: 10.1099/vir.0.015347-0
[9] Liu Z, Wang S, Zhang Q, et al. Deletion of C7L and K1L genes leads to significantly decreased virulence of recombinant vaccinia virus TianTan[J]. PLoS One, 2013,8(7):e68115. DOI: 10.1371/journal.pone.0068115.
[10] Hand ES, Haller SL, Peng C, et al. Ectopic expression of vaccinia virus E3 and K3 cannot rescue ectromelia virus replication in rabbit RK13 cells[J]. PLoS One, 2015, 10(3):e0119189. DOI: 10.1371/journal.pone.0119189
[11] Unger B, Mercer J, Boyle KA, et al. Biogenesis of the vaccinia virus membrane: genetic and ultrastructural analysis of the contributions of the A14 and A17 proteins[J]. J Virol, 2013,87(2):1083-1097. DOI: 10.1128/JVI.02529-12.
[12] Zhang YF, Moss B. Vaccinia virus morphogenesis is interrupted when expression of the gene encoding an 11-kilodalton phosphorylated protein is prevented by the Escherichia coli lac repressor[J]. J Virol, 1991,65(11):6101-6110.
[13] Smith GL, Vanderplasschen A, Law M. The formation and function of extracellular enveloped vaccinia virus[J]. J Gen Virol, 2002,83(Pt 12):2915-2931. DOI: 10.1099/0022-1317-83-12-2915.
[14] Haller SL, Peng C, McFadden G, et al.Poxviruses and the evolution of host range and virulence[J]. Infect Genet Evol, 2014,21:15-40. DOI: 10.1016/j.meegid.2013.10.014
[15] Wickramasekera NT, Traktman P. Structure/Function analysis of the vaccinia virus F18 phosphoprotein, an abundant core component required for virion maturation and infectivity[J]. J Virol, 2010,84(13):6846-6860. DOI: 10.1128/JVI.00399-10.
