红三叶AFLP体系的建立及优化
2018-05-22蒲小剑田久胜田新会杜文华甘肃农业大学草业学院草业生态系统教育部重点实验室甘肃省草业工程实验室美草地畜牧业可持续发展研究中心甘肃兰州730070甘肃农业大学植物保护学院甘肃兰州730070
蒲小剑,田久胜,田新会,杜文华(.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; .甘肃农业大学植物保护学院,甘肃 兰州 730070)
扩增片段长度多态性(AFLP)是由RFLP与RAPD结合而成的一种新的分子标记技术,具有RFLP标记和RAPD标记的优点,有“最有力的分子标记”或“下一代分子标记”的称号[7]。因其高多态性,可靠,高效[8],DNA用量少,检测率高[9],重复性高,加上选择为中性[10]等许多优点,AFLP技术普遍应用于生物研究领域。近年来,AFLP技术在牧草种质鉴定方面的应用发展迅速,在紫花苜蓿(Medicagosativa)[11],燕麦(Avenasativa)[12],狗牙根(Cynodondactylon)[13],老芒麦(Elymussibiricus)[14-15],扁蓿豆(Medicagosativa)[16],鸭茅(Dactylisglomerata)[17]等牧草的鉴定中均有报道。孟丽娟[18]通过对来自美国、加拿大和俄罗斯的31份红三叶材料运用ISSR分子标记建立并优化了适宜红三叶ISSR分析的最佳反应体系,扩增出58条多态性条带,后通过UPGMA聚类分析将试验材料分为5类。Mamta Gupta等[19]使用36对简单序列重复(SSR)引物分析全球收集红三叶材料的遗传多样性,其扩增片段1~6个,多态性值0.301~0.719,贝叶斯聚类模型分析将研究材料分为3类。Herrmann等[20]利用优化AFLP体系探索了野生和栽培红三叶群体的遗传特性和亲缘关系。Muntean等[21]用AFLP分子标记对红三叶品种遗传多样性进行了评价。虽然AFLP技术的原理简便,但步骤繁多,从酶切反应到银染成像的优化,若一个步骤或条件不合适,就出现带型不稳定、条带不清晰和多态性偏低等问题。所以,以岷山红三叶和红三叶新品系为试验材料,筛选AFLP优化条件,旨在建立适宜红三叶的AFLP反应体系,为红三叶分子遗传研究奠定基础。
1 材料和方法
1.1 试验地概况
田间试验在甘肃省临洮县临洮农校农场进行,地理位置E 103°87′,N 35°37′,海拔1 892 m,降水量562 mm,无霜期80~190 d,年平均气温7.0℃(最高气温34.6℃,最低气温-29.5℃)。土壤为黑麻土,肥力均匀,有灌溉条件,前茬作物为玉米。
1.2 试验材料
试验材料为以岷山红三叶为父本(Male parent,M)、抗白粉病红三叶新品系(甘农PR1)为母本(Female parent,F)杂交形成的F1代群体,以及2亲本。2015年3月下旬将杂交F1代种子点播,株距20 cm,行距30 cm,播种深度1(2 cm,得到F1代群体。于生长期间采摘幼嫩叶片1~2 g,放入液氮保存,带回实验室-80℃超低温冰箱保存备用。
1.3 试验试剂与仪器
MseI,EcoRI和T4DNA连接酶购自Thermo Scientific,2×PCR Master Mix与DNA Marker购于BBI Life Sciences。引物及接头(表1)上海生工生物工程有限公司人工合成,其他试剂均为国产分析纯。
试验所用仪器见表2。
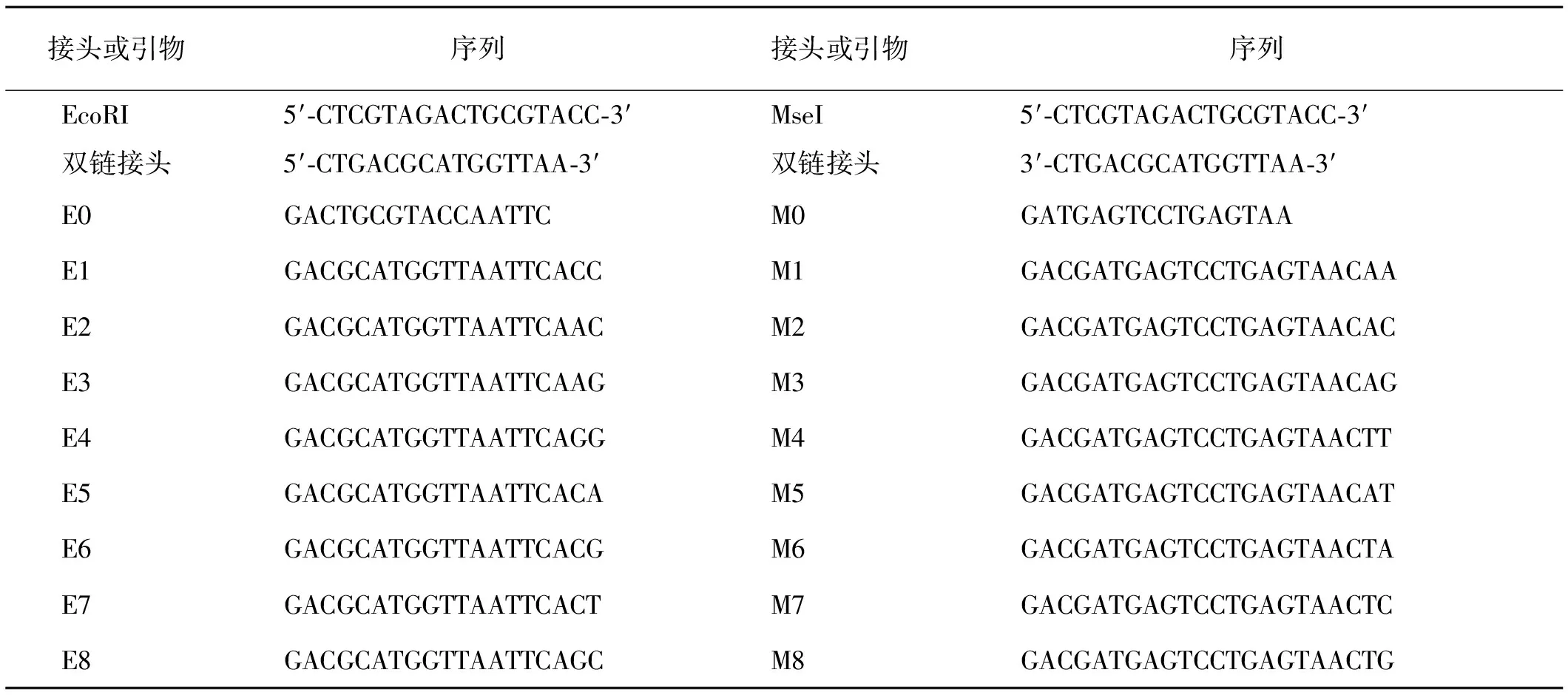
表1 接头和引物序列Table 1 Sequence of the adapter and primer
表2 试验仪器Table 2 Experimental instrument
1.4 基因组DNA制备及检测
采用改进CTAB法[22-23]提取红三叶基因组DNA。1 %琼脂糖凝胶电泳检测DNA的质量,TE稀释后用超微量紫外分光光度计检测D260nm/D280nm,D260nm/D230nm,以确定DNA的纯度与浓度。
1.5 体系优化筛选条件
体系优化筛选条件:酶切时间,DNA浓度,EcoRI、MseI浓度见表3;预扩增体系见表4,选择性扩增体系进行优化设计见表5。

表3 优化体系筛选条件设计及筛选结果Table 3 Optimization system screening conditions design and screening results
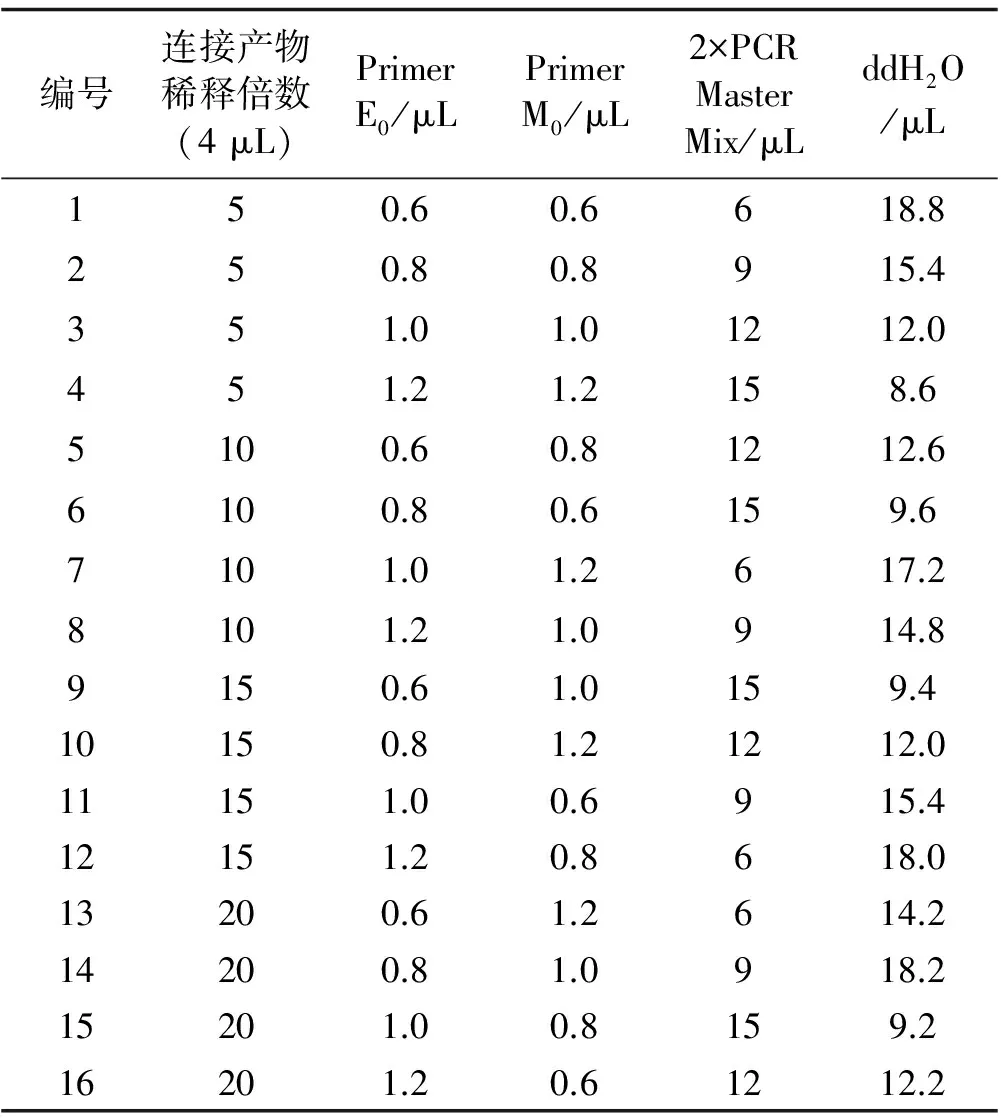
表4 预扩增正交体系设计Table 4 Orthogonal design for pre-amplification
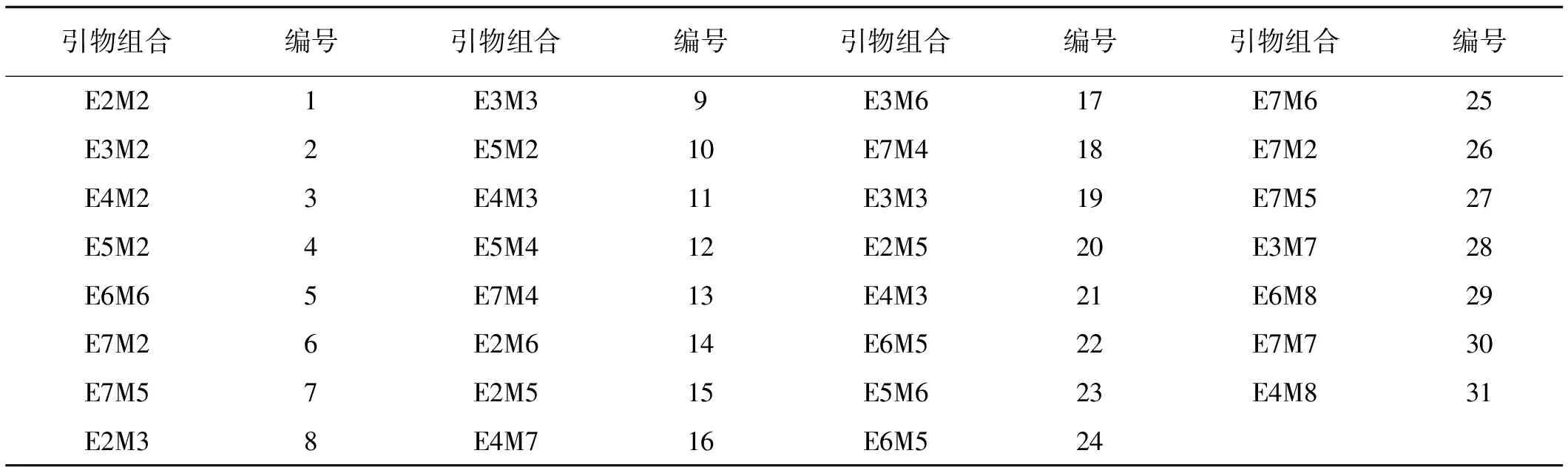
表5 选择性扩增引物组合编号Table 5 Primer numbers
注:E代表EcoRI,M代表MseI。
1.6 AFLP反应体系
1.6.1 基因组DNA双酶切 选取2种限制性内切酶EcoRI/MseI,反应体系共20 μL。包含,10×Tang buffer 3 μL,模板DNA(200~300 ng/μL)9 μL,8 UEcoRI,6 UMseI,ddH2O补平。双酶切时间,37℃水浴5 h、65℃水溶15 min。-20℃保存酶切产物。
1.6.2 接头连接 合成的单链人工接头稀释至50 μmol/L,经PCR反应合成双链,加入3 U T4DNA连接酶,于22℃下连接过夜。
1.6.3 AFLP预扩增反应 反应总体系30 μL,包括4 μL连接产物模板DNA,0.8 μLEcoRI,0.6 μLMseI预扩增引物,15 μL 2×PCR Master Mix,ddH2O补平,离心混匀进行PCR反应。
1.6.4 AFLP选择性扩增反应 反应总体系20 μL,包括2 μL稀释10、20、25、30、40、50倍的预扩增产物(稀释30倍);0.8 μL Primer E,1.0 μL Peimer M,2×PCR Master Mix6、7、8、9、10和11 μL;ddH2O补平后进行PCR反应。
1.6.5 扩增产物检测 制备4%变性聚丙烯酰胺凝胶,待胶聚合后预电泳30 min。选择扩增产物(2 μL)与上样Buffer混匀,经90℃变性3 min,置于4℃保存等待点样。点样后1 500 V恒功率电泳1.5 h左右,停止电泳。采用Carlos银染方法[22-23],胶版微干后拍照、统计数据。
2 结果与分析
2.1 DNA提取质量和检测
AFLP反应对DNA质量要求较高。高质量的DNA是获得重复性好、条带清晰AFLP扩增结果的关键因素。采取改良CTAB法提取红三叶基因组DNA。经1%琼脂糖凝胶电泳检测显示所提取的红三叶基因组DNA条带清晰、整齐、无拖尾(图1)。经超微量紫外分光光度计检测,D260nm/D280nm在1.7~1.9,D260nm/D230nm约为2,浓度在200 ng/μL。说明所提取DNA纯度高,浓度适中,能够达到下一步试验要求。

图1 红三叶基因组DNA电泳检测Fig.1 Agarose gel-electrophporesis of redclover genomic DNA注:1,2分别为红三叶DNA在1 %琼脂糖凝胶检测结果
2.2 酶切、连接体系优化
2.2.1 酶切时间优化 采用EcoRI和MseI进行基因组DNA酶切,识别序列分别为GAATTC和AATT。用1.5%琼脂糖凝胶电泳检测酶切产物。其DNA片段均在100~1 500 bp,表明酶切充分,符合试验要求(图2)。1~5条带亮度逐渐增加,6稍暗于5。因此酶切时间选用37℃ 5 h,65℃ 20 min。
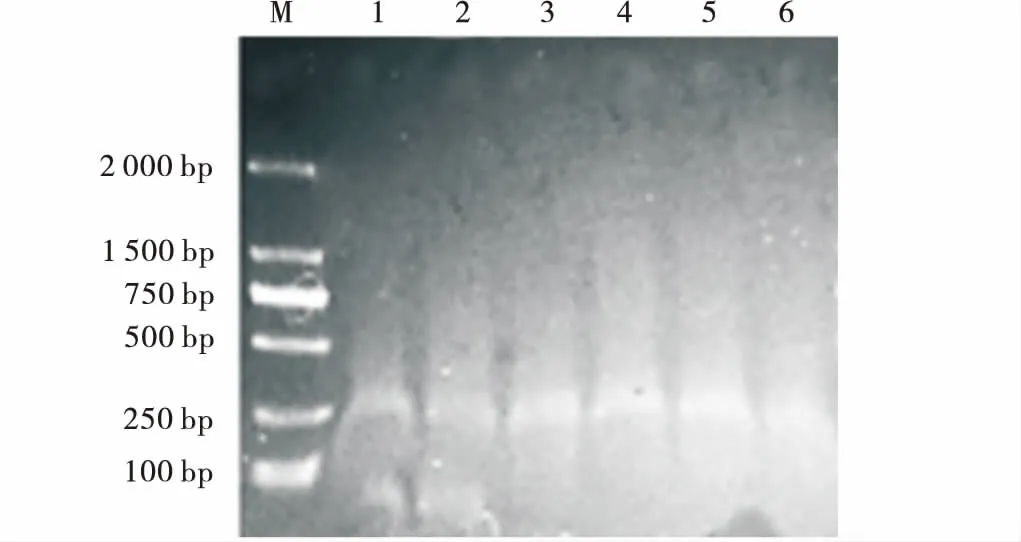
图2 酶切时间优化电泳图Fig.2 Agarose gel-electrophporesis of gradientextracted enzyme digestion time注:1~6分别为3,3.5,4.0,4.5,5.0,5.5 h酶切连接琼脂糖电泳带型,M为D2000分子量标记
2.2.2 DNA浓度筛选 40~90 ng/μL电泳条带亮度逐渐变大,100 ng/μL条带亮度暗于90 ng/μL。90 ng/μL DNA进行酶切反应(图3)。

图3 DNA浓度筛选电泳图Fig.3 Agarose gel-electrophoresis of different DNA concentrations注:1~7的DNA浓度分别为40、50、60、70、80、90、100 ng/μL,M为D2000分子量标记
2.2.3EcoRI浓度筛选 电泳结果(图4)表明,1~4条带亮度随内切酶EcoRI浓度增加变大,而5、6条带亮度暗于4。EcoRI浓度筛选结果为8 U。
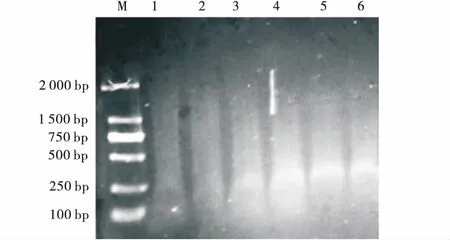
图4 EcoRI浓度筛选电泳图Fig.4 Agarose gel-electrophoresis of different EcoRI concentrations注:1~6的EcoRI浓度分别为2、4、6、8、10、12 U,M为D2000分子量标记
2.2.4MseI浓度筛选 电泳结果(图5)表明1、3条带明显亮于其他条带,3的条带亮度最大。MseI浓度筛选结果为6 U。
2.3 预扩增体系的优化
根据表2设计的16个PCR扩增结果图。整体效果不理想,仅第4与第6有条带。第6条带的亮度明显优于第4条带。因此,预扩增体系为,连接产物,4 μL(稀释10倍);Primer E0,0.8 μL;Peimer M0,0.6 μL;2×PCR Master Mix,15 μL;ddH2O,9.6 μL(图6)。
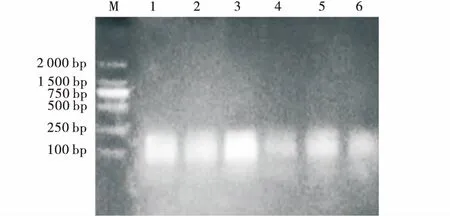
图5 MseI(Trμ9I)浓度筛选电泳图Fig.5 Agarose gel-electrophporesis of different MseI (Trμ9I) concentration注:1~6的MseI(Trμ9I)浓度分别为2、4、6、8、10、12 U,M为D2000分子量标记
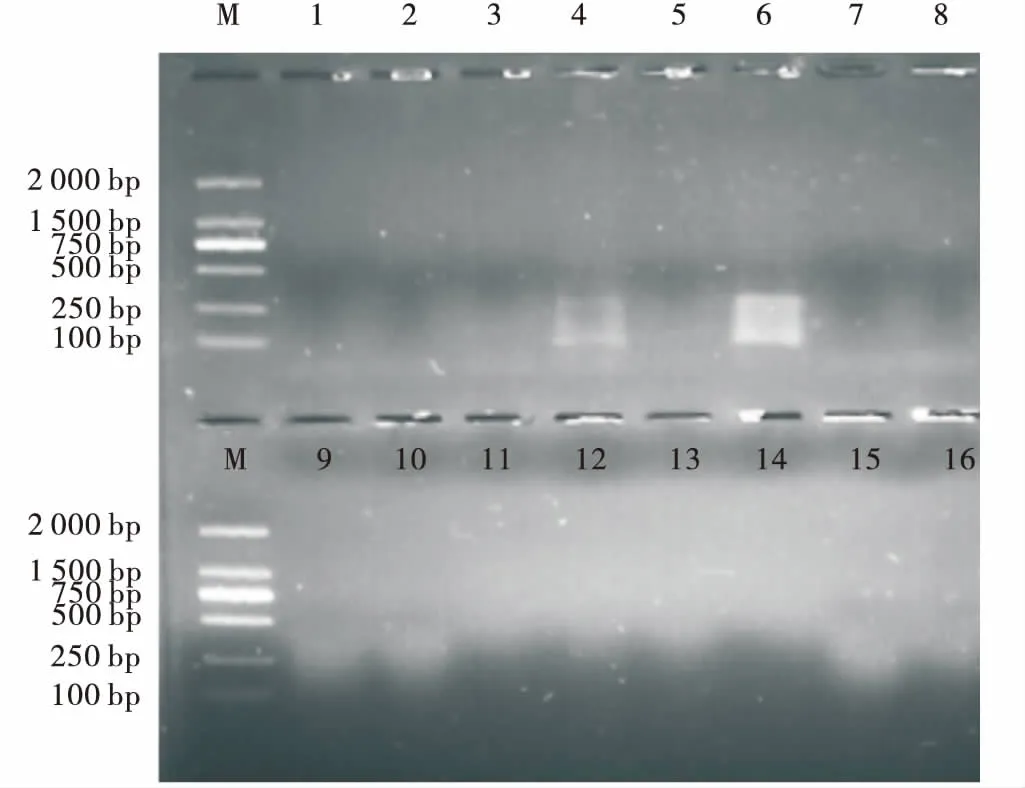
图6 预扩增正交设计电泳图Fig.6 Agarose gel-electrophporesis on orthogonal design of pre-amplification注:1~16代表正交体系编号,同表4
2.4 选择性扩增体系优化
2.4.1 预扩增产物稀释倍数筛选 在众多因素中,预扩增产物稀释的倍数对选择性扩增效果的影响最大。为使条带清晰、稳定,预扩增产物被稀释不同倍作比对试验,结果显示,最适宜的扩增效果是稀释30倍(图7)。
2.4.2 2×PCR Master Mix用量筛选 2×PCR Master Mix是即用型的常规PCR预混合溶液,含有TaqDNA Polymerase,dNTP混合物,MgCl2以及优化的缓冲体系,只需加入引物和模板即可进行扩增(图8),其用量大小会直接影响PCR结果。琼脂糖凝胶电泳表明,10 μL PCR产物电泳条带最亮,7 μL PCR产物次之,6 μL PCR产物最暗。
选择性扩增体系:预扩增产物,2 μL(稀释30倍);Primer E,0.8 μL;Primer M,1.0 μL;2×PCR Master Mix,10 μL;ddH2O,6.2 μL。
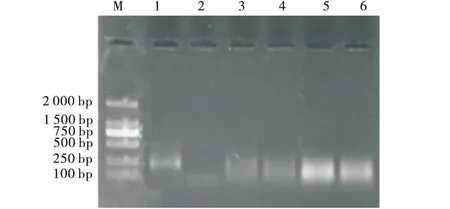
图7 预扩增产物稀释倍数处理下选择性扩增Fig.7 Effects of pre-amplification product diluted multiples on selective amplification注:1~6分别为5、10、15、20、25、30、40倍Mix用量,M为D2000分子量标记

图8 2×PCR Master Mix用量处理下选择性扩增Fig.8 Effects of concentration of 2×PCRMasterMix on selective amplification注:1~6分别为6、7、8、9、10、11 μL 2×PCR Master稀释,M为D2000分子量标记
2.4.3 引物对的筛选 从8条EcoRI酶切位点接头选择性引物和8条MseI酶切位点接头选择性引物组合共计64对选择性引物中筛选。只有1对引物组合没有扩增出条带,2对引物扩增结果与其他引物组合扩增条带重复,其余引物组合均能获得较清晰条带。其中31对引物的扩增图谱(图9)。选取16对条带清晰且条带数较多的引物组合进行后续分析。
3 讨论
AFLP被认为是十分理想、高效的分子标记技术,己经被广泛应用到水稻等作物的遗传多样性分析、种质鉴定、基因定位和连锁图谱构建等方面[24]。AFLP试验分析中,DNA模板限制性内切酶酶切是否充分、酶切片段T4DNA连接酶的连接是否成功是影响AFLP试验成功与否的关键,限制性内切酶及 T4DNA连接酶的用量根据模板 DNA量而定[25]。AFLP可采取单酶切、双酶切,据报道TE-AFLP用3种酶进行酶切反应[26]。双酶切具有DNA片段长度较小,易于分离扩增产物等优点,因此得以大量应用于试验研究。高品质基因组DNA的提取,是AFLP反应体系成功建立的关键[27],若含有质量较差的DNA时,试验结果的稳定性将会受到很大影响[28-29]。试验用于酶切的DNA经检测D260 nm/D280 nm的比值在1.7~1.9,纯度较高。琼脂糖凝胶电泳检测显示,不含RNA和其他杂质,完全达到了AFLP技术的要求。双酶切反应中,限制性内切酶对DNA的酶切必须完全彻底,否则扩增后变性聚丙烯电泳会出现多而密、中下部扩增带稀少的现象,EcoRI较MseI敏感,更容易受DNA质量和体系中各成分的影响,因此在酶切反应中,采用EcoRI酶切缓冲液作为双酶切的缓冲液。

图9 引物筛选电泳图Fig.9 Agarose gel-electrophporesis of primer screening注:M为DNA Marker(BBI Life Sciences)
AFLP反应中,不同材料的酶切时间、预扩增产物的稀释倍数和选择性扩增引物浓度这3个关键反应条件有所不同[30-31]。蔡丽艳等[11]构建苜蓿cDNA-AFLP反应体系的酶切时间为37℃ 6 h,65℃ 20 min。刘欢等[12]构建燕麦AFLP体系酶切的时间为37℃ 4 h,65℃ 15 min。引物浓度是反应体系的重要组成部分,对试验结果影响比较大[32]。如果引物浓度偏低,PCR效率也会降低,扩增产物产量也相应减少;如果引物浓度偏高,可能会发生异位引导,导致非特异性意外扩增,影响试验结果的准确性[33]。试验为2种引物分别设置了6个引物浓度梯度,并筛选出了最优浓度。
AFLP操作时,由于胶板点样口限制,同一对引物所扩增出的所有样需分批进行点样、跑胶,这就造成了不同玻璃板之间显影的差别,人工统计条带时,人为因素造成的误差会降低AFLP技术的有效性。因此,为了提高试验的精确性,试验对引物初步筛选后,选出16对引物(点样板最多点样32个)对红三叶新品系和岷山红三叶进行多样性分析,筛选出11对清晰的扩增条带且多样性丰富的引物组合进行下一步实验。
4 结论
通过对决定AFLP体系的DNA浓度,酶切时间,两酶EcoRI和MseI浓度,预扩增产物稀释倍数,2×PCR Master Mix用量,引物组合等7个要素进行筛选,逐一筛选出对应上述要素的最优化量。分别为90 ng/μL,5 h,8 U,6 U,30倍,10 μL,构建了AFLP优化体系。按照筛选结果得到31条清晰条带。并选出11条进行后续分析。
参考文献:
[1] 何玮,蒋安,王琳,等.PEG干旱胁迫对红三叶抗性生理生化指标的影响研究[J].中国农学通报,2013,29(5):5-10.
[2] 孟丽娟,赵桂琴.红三叶ISSR-PCR反应体系的建立与优化[J].草原与草坪,2015,35(2):21-26.
[3] 高雪芹,伏兵哲,王俊杰,等.红三叶的研究现状及利用前景[J].农业科学研究,2013,34(3):52-55.
[4] 姜义宝,王成章,崔国文.红车轴草异黄酮对肉鸡免疫器官、免疫球蛋白及抗氧化性能的影响[J].草地学报,2011,19(3):520-524.
[5] 杜文华.三叶草[M].兰州:甘肃科学技术出版社,2006:7-8.
[6] 刘晓玲,杜文华,宋超.氮磷肥施用量对红三叶中异黄酮含量的影响[J].西北农业学报,2010,19(7):159-163.
[7] 王真.丹参雄性不育基因的AFLP标记[D].杨凌:西北农林科技大学,2012.
[8] 李鸿雁,李志勇,辛霞,等.49份野生扁蓿豆种质资源的AFLP遗传多样性分析[J].中国草地学报,2016,38(4):20-26.
[9] 程小毛,李响,姜永雷,等.基于AFLP的滇西北玉龙雪山不同海拔川滇高山栎遗传多样性分析[J].华中农业大学学报,2017,36(1):22-27.
[10] 王晓英,张林,李承秀,等.51个春兰(Cymbidiumgoeringii)品种的AFLP遗传多样性分析[J].植物遗传资源学报,2015,16(3):653-658.
[11] 蔡丽艳,石凤翎,李志勇,等.苜蓿cDNA-AFLP反应体系的建立和优化[J].种子,2011,30(8):1-4,8.
[12] 王茅雁,齐秀丽.利用RAPD标记研究燕麦属不同种的遗传差异[J].华北农学报,2004,19(4):24-28.
[13] 凌瑶,杨树萍,张新全,等.西南地区野生狗牙根种质资源的SSR与AFLP联合分析[J].广西植物,2014,(6):734-741,815.
[14] 付艺峰.老化老芒麦种质遗传完整性研究[D].呼和浩特:内蒙古农业大学,2015.
[15] 陈云.两种牧草遗传多样性及逆境条件下甲基化水平分析[D].曲阜,曲阜师范大学,2015.
[16] 李鸿雁,李志勇,辛霞,等.野生扁蓿豆种质资源AFLP遗传多样性的分析[J].植物遗传资源学报,2016(1):78-83.
[17] 王少青,牟琼,欧钟明,等.鸭茅种质资源分子遗传多样性研究进展[J].草业与畜牧,2015(5):1-6.
[18] 孟丽娟.引进红三叶种质资源的表型和遗传多样性研究[D].兰州:甘肃农业大学,2015.
[19] M Gupta,V Sharma,S K Chahota,etal.Analysis of genetic diversity and structure in a genebank collection of red clover (TrifoliumpratenseL.) using SSR markers[J].Plant Genetic Resources,2016,1-4.
[20] D Herrmann,B Boller,F Widmer,etal.Optimization of bulked AFLP analysis and its application for exploring diversity of natural and cultivated populations of red clover[J].Genome,2005,48:474-486.
[21] L Muntean,C Botez,S Muntean.AFLP-based assessment of genetic diversity among red clover (TrifoliumpratenseL.) cultivars[C].42nd CROATIAN & 2nd INTERNATIONAL SYMPOSIUM ON AGRICULTURE,236-240.
[22] 刘世新.实用生物组织学技术[M].北京:科学出版社,2003:222-224.
[23] S Porebski,L G Bailey,B R Baum.Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components[J].Plant molecular biology reporter,1997,15(1):8-15.
[24] 张凤仙,毕玉芬,王晓云.云南野生苜蓿与引进苜蓿的核型分析[J].云南农业大学学报,2008(4):431-435.
[25] 饶龙兵,杨汉波,郭洪英,等.陈益泰.桤木属植物AFLP反应体系的建立与优化[J].分子植物育种,2014,12(3):547-553.
[26] A V Wurff,Y L Chan,N M Straalen.TE-AFLP:combining rapidity and robustness in DNA fingerprinting.Nucleic Acids Research,2000,28(24):1-5.
[27] 王大玮,李煜,周玮,等.杜仲AFLP反应体系的建立及优化[J].西北农林科技大学学报(自然科学版),2010,38(6):88-94.
[28] 雷家军,于海涛,王志刚,等.卷丹百合AFLP反应体系的建立与优化[J].东北农业大学学报,2013,44(10):122-127.
[29] 琚茜茜,黄如葵,黄玉辉,等.苦瓜AFLP和SRAP的PCR反应体系优化及应用比较[J].南方农业学报,2013,44(2):195-199.
[30] M A Rodrigues,C A Santos,J R Santana.Mapping of AFLP loci linked to tolerance to cowpea golden mosaic virus[J].Genetics and Molecular Research,2012,11(4):3789-3797.
[31] A K Shukla,A K Shasany,S P Khanuja.cDNA-AFLP-Based numerical comparison of leaf and root organ cDNAs in Catharanthus roseus[J].OMICS A Journal of Integrative Biology,2012,16(7/8):397-401.
[32] 李芳弟,王舰,王芳,等.马铃薯种质遗传多样性分析的AFLP反应体系优化与引物筛选[J].分子植物育种,2010,8(1):179-185.
[33] 曹亚.实用分子生物学操作指南[M].北京:人民卫生出版社,2003:132-134.
