黑果枸杞根际促生菌筛选与特性研究
2018-05-22马骢毓甘肃农业大学草业学院草业生态系统教育部重点实验室甘肃省草业工程实验室美草地畜牧业可持续发展研究中心甘肃兰州730070
马骢毓,姚 拓(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
植物根际生存着一类有益菌类[1],不仅可以固定空气中的氮气,还可溶解土壤中不能被植物直接利用的磷元素,或分泌植物生长调节物质,从而促进植物对矿物质的吸收和生长发育[2]。这类细菌被称为植物根际促生菌(plant growth promoting rhizobacteria,简称 PGPR)。通过利用具有固氮、溶磷、活钾、分泌生长素等功能的植物根际促生菌研制生物菌肥,对改善土壤结构、提高土壤有机质含量、改良盐碱地及环境保护具有积极作用[3-4]。生物菌肥相比传统化肥具有成本低、使用安全、持续效果好、增产稳定、非再生能源消耗少、经济效益高、无环境和食品污染等优点。国内外有关微生物肥料已有规模化的生产,但在不同环境、不同植物根际的菌株不同,且不同菌株对环境的适应性也不同。因此,借鉴已有研究经验,根据特定地区的气候、植物及环境,分离筛选高效菌株,从而研究具有地区针对性的生物菌肥具有重要意义[5-7]。
黑果枸杞(Lyciumruthenicum)为茄科(Solanceae)枸杞属(Lycium)多年生灌木,是一种稀盐盐生植物,广泛分布于我国陕西北部黄土高原、宁夏、甘肃、青海、内蒙古、新疆和西藏等地区[8],在甘肃境内主要分布在瓜州、敦煌、金塔和民勤的盐化荒漠地带[9]。由于特殊的外部形态、内部结构特征及抗盐机理,黑果枸杞具有适应能力强、抗旱、耐盐的特点[10],是待开发利用的干旱、半干旱地区植被恢复重建的生态与经济树种[11]。近年来,研究多集中在盐胁迫下黑果枸杞的生理生态机制和种子萌发[12-13],或干旱条件下黑果枸杞的生理防御机制[14],以及黑果枸杞的药用价值和保健作用[15],目前,对干旱地区黑果枸杞根际微生物的相关研究报道较少。
因此,筛选黑果枸杞根际PGPR菌,获得具有促生特性的优良菌株,并将其运用于黑果枸杞专用生物肥料的研制和生产,不仅对促进黑果枸杞的种植业发展具有积极意义,而且对改良土壤结构、修复土壤生态系统具有重要作用,并为生物肥料下一步开发利用打下了基础。
1 材料和方法
1.1 材料
采样地位于甘肃省民勤县退耕区次生草地,试验于2015年8月在采样地利用五点法获取黑果枸杞根际(根系和土壤)样品,存贮于无菌采样袋中低温运输至实验室立即进行PGPR菌株分离(4℃保存不超过24 h)。
1.2 培养基
LB培养基用于分离和保存根际细菌[16];NFM培养基用于固氮菌的分离纯化[17];PKO培养基用于溶解无机磷菌株的分离与纯化[18];蒙金娜有机磷培养基用于溶解有机磷菌株的分离与纯化[16,19]。
1.3 方法
1.3.1 根际促生菌的分离与纯化 根据文献[18]的方法,将根际分为3个部分,即根表土壤(soil adhering to roots,RS)、根系表面(rhizoplan or surface of roots,RP)、根内(histoplan or interior of roots,HP)。
称取样品2 g,置于50 mL离心管中,注入18 mL 0.85%无菌生理盐水,振荡2 min并静置后即为10-1根表土壤稀释液,然后依次制备成浓度为10-3,10-4和10-5的稀释液,备用。用微量移液器分别吸取50 μL已制备好的3个根系区域的10-3,10-4和10-5稀释液,接种于灭菌的NFM、PKO和蒙金娜固体培养基上,立即用无菌玻璃涂布器涂抹均匀,根际3个区域每个浓度均重复3次,倒置20 min。接种后的培养基置于28℃培养箱中培养7 d,用接种针从NFM培养基上挑取生长良好且形状不同的单个菌落,从PKO和蒙金娜培养基上挑取具有溶磷透明圈的菌落,利用划线法纯化后接种于LB斜面培养基,4℃保存。
NFM培养基中呈黄绿色的菌落,挑取其中单个菌落,并分别接种在新的PKO无机磷、蒙金娜有机磷固体培养基,从而获得可溶磷的目标菌落。
1.3.2 固氮菌固氮酶活性测定 色谱条件:玻璃柱长2 m,内径0.4 cm,担体GDX-502,柱温170℃,检测器温度150℃,进样器温度140℃,气体流量为H20.08 kg/cm,空气0.15 kg/cm,N20.3 kg/cm,检测器氢火焰离子化检测器(FID)。
将纯的标准C2H4气体(纯度为99.999%)配置为浓度10、25、50、75、100、200、500、1 000 μL/10 mL的C2H4标准混合气体,用50 μL微量进样器从C2H4标准混合气体抽取50 μL注入气象色谱仪(GC 7890F)进样柱中,观察 C2H4峰的峰面积。最后以C2H4浓度为横坐标,峰面积值为纵坐标作图,即得到C2H4标准曲线。
酶活计算采用乙炔还原活性参照中国科学院上海植物生理研究所方法进行计算[20]。
1.3.3 溶磷菌溶磷能力测定 (1)定性测定 将活化后的菌株点接种于PKO和蒙金娜固体培养基上,于28℃恒温培养,在7~10 d时观察每菌株是否出现溶磷透明圈,并测量每菌株溶磷圈直径(D)和菌落直径(d)的比值(D/d),由比值大小初步判定菌株的溶磷能力;(2)定量测定 在已灭菌的PKO或蒙金娜液体培养基中接种0.5 mL各菌株菌悬液(OD值为0.5)。每菌株3次重复,不接种为对照。28℃、140 r/min振荡培养12 d后,用酸度计测定各个培养液pH值,后将培养液在10 000 r/min、4℃离心15 min后,取其上清液5 mL于150 mL锥形瓶中并加入45 mL 0.5 mol/L NaHCO3和约1.5 g无磷活性炭,封口振荡 30 min,无磷滤纸过滤。在50 mL容量瓶中加入滤液1 mL、0.5 mol/L NaHCO35 mL以及蒸馏水约30 mL,最后加入5 mL钼锑抗显色剂,定容摇匀。显色30 min后,进行比色,测定D700nm,计算磷浓度(μg/mL)。
1.3.4 PGPR菌株鉴定 (1)生理生化特性测定 将各菌进行接触酶反应、V-P测定、D-葡萄糖产酸、D-木糖产酸、D-木聚糖产酸、葡萄糖产气、明胶水解、酪朊水解、淀粉水解、柠檬酸盐利用、吲哚产生、氧化酶测定等试验,准确观察并记录试验结果;(2)16S rDNA分子生物学鉴定 用细菌基因组DNA试剂盒(OMEGA,美国)提取各菌DNA;用琼脂糖凝胶电泳法和紫外分光光度法检测DNA浓度的测定;扩增引物为细菌16S rDNA扩增的通用引物27F-1492R(27F:5-AGAGTTTGATCCTGGCTCAG-3,1492R:5-GGTTACCTTGTTACGACTT-3),由上海派森诺生物有限公司合成。
扩增体系(25 μL):10×buffer缓冲液(2.5 mmol/L)2.5 μL,Mg2+(10 mmol/L)1.5 μL ,dNTP(25 mmol/L)0.5 μL ,27F(10 μmol/L)0.5 μL ,1492R(10 μmol/L)0.5 μL ,TaqDNA聚合酶(5 U/μL)0.25 μL,模板DNA(25 ng/μL)2.0 μL,稀释至25 μL。PCR反应程序:93 ℃预变性3~5 min,94℃变形30 s,55退火60 s,72℃延伸30 s,循环30~35次,72℃保温10 min,4℃保存。DNA Marker为DL200(上海派森诺生物有限公司),采用琼脂糖凝胶电泳法检测扩增产物并交公司完成。
将测得的序列在NCBI数据库(http://www.ncbi.nlm.nih.gov/BLAST/)中用 megablast进行相似性搜索,并与已报道细菌菌株的16SrDNA序列进行同源性比较,并利用MEGA 5.0生物学软件构建进化距离树图,用 Neighbor-Joining进行系统发育分析。
1.4 数据处理
数据整理及制图采用 Excel 2013,数据分析采用 SPSS 17.0。
2 结果与分析
2.1 根际促生菌的分离纯化
利用NFM、PKO和蒙金娜选择培养基分离出生长较快、菌落较大,且具有明显溶磷圈的菌株。纯化后获得菌株71株,其中固氮菌21株,溶解无机磷菌株30株,溶解有机磷菌株20株。均表现出根表(RP)>根表土(RS)>根内(HP)的数量分布规律,即表现出很强的根际效应(表1)。
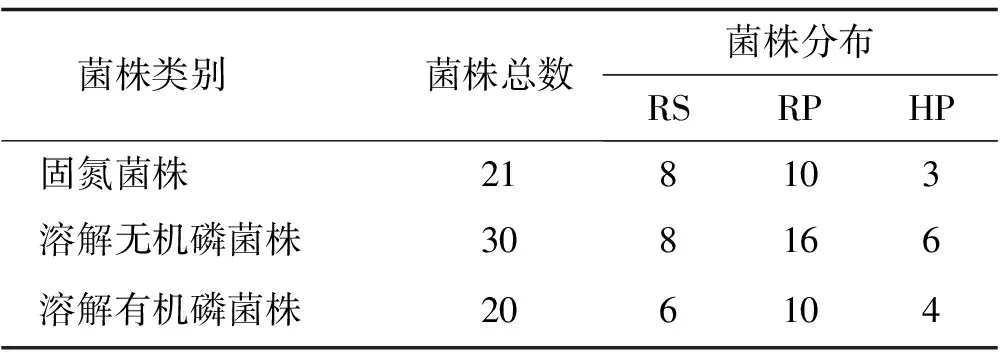
表1 黑果枸杞根际促生菌株来源及分布Table 1 Source and distribution of Lycium ruthenicum Murr rhizosphere strains
2.2 PGPR菌株的固氮酶活性
2.2.1 标准曲线 用不同浓度的乙烯混合气体作为横坐标,峰面积值作为纵坐标作图,得到乙烯标准曲线(图1)。
2.2.2 固氮酶活性测定 经乙炔还原法所测定的21株固氮菌株中,有10株菌株的固氮酶活性较为良好(表2),固氮酶活性在56.48~365.12 nmol C2H4h/mL,且各菌株之间的固氮酶活性差异较大,其中菌株NDRP5的固氮酶活性最高,菌株NDRP3的固氮酶活性最低,共有7个菌株的固氮酶活性大于200 nmol C2H4/(h·mL)。在10株菌株中,7株菌株产酸,1株菌株为中性,2株菌株产碱。
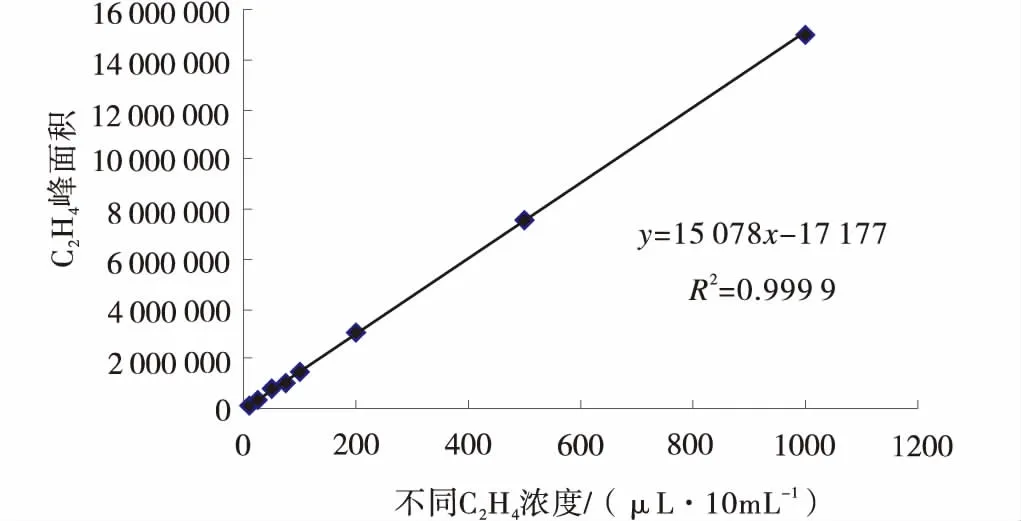
图1 乙烯标准曲线Fig.1 Standard curve of C2H4
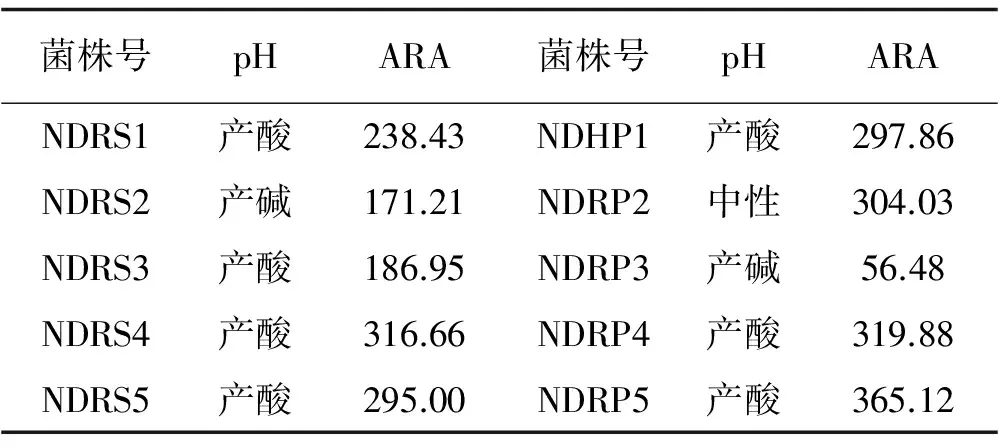
表2 固氮菌株的固氮酶活性Table 2 Nitrogenase activity of nitrogen fixing bacteria nmol C2H4/(h·mL)
2.3 PGPR菌株的溶磷能力
2.3.1 磷标准曲线 分别准确吸取5 μg/mL磷标准梯度溶液,采用钼锑抗比色法进行显示、比色,以梯度磷溶液的吸光值(D700nm)为纵坐标,梯度磷溶液的浓度为横坐标绘制标准曲线(图2)。
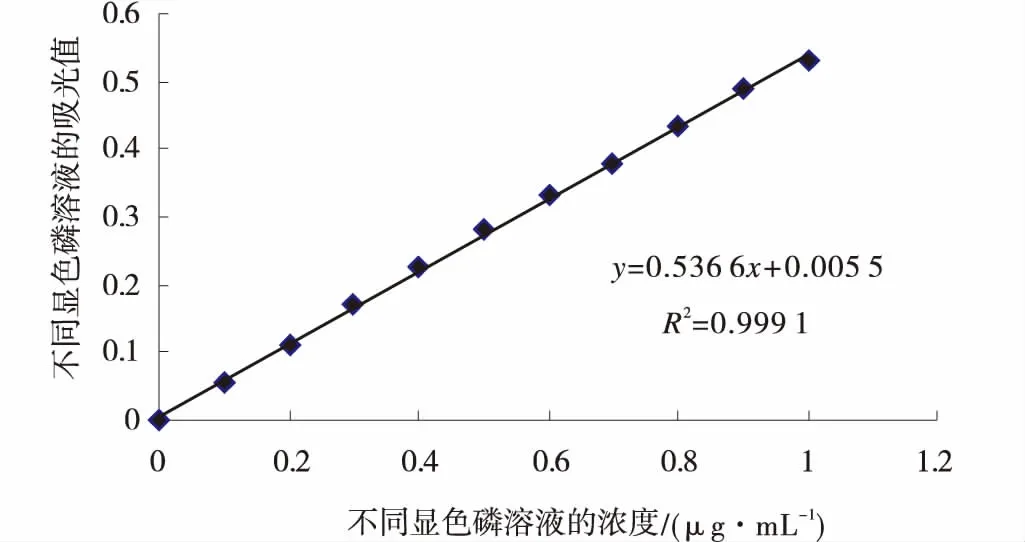
图2 磷标准曲线Fig.2 Standard curve of phosphorus
2.3.2 菌株溶解无机磷能力 供试的30株菌株中有15株菌株溶磷圈较大,生长速度较快,具有良好的溶解无机磷的能力,有7株菌株为NFM固氮培养基上筛选出的产酸菌株(表3)。通过溶磷圈法定性测定菌株的溶磷圈大小发现,各菌株D/d值在1.59~3.39,D/d值最大的菌株为NDRS5,D/d值最小的菌株为PDRS1。溶磷量在30.80~574.40 μg/mL,菌株PDRS1溶磷量最高,菌株PDRP1溶磷量低,溶磷量高于300 μg/mL的菌株共9株,各菌株在PKO培养基上pH在5.06~6.43,均偏碱性。
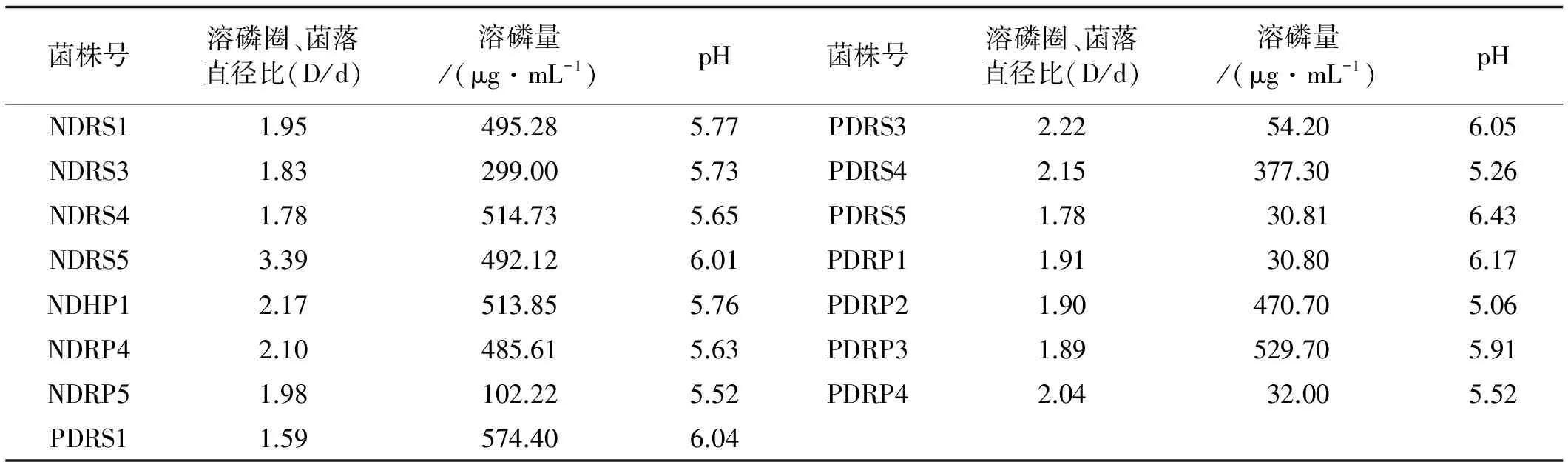
表3 菌株溶解无机磷能力测定Table 3 Capacity of strains on inorganic culture medium
2.3.3 菌株溶解有机磷能力 供试的20株菌株中选取溶磷圈较大,生长速度较快的15株进行进一步的试验,其中,有8株为NFM固氮培养基上筛选出的产酸和中性菌株(表4)。通过溶磷圈法定性测定菌株的溶磷圈大小发现,各菌株D/d在1.78~3.11,D/d值最大的菌株为MDRS1,最小的菌株是NDRS4。定量测定的结果也发现供试的15株菌株溶解有机磷量分别为64.88~429.38 μg/mL,溶磷量最大的菌株为MDRP3,最小的菌株是MDRS1,溶磷量高于300 μg/mL的菌株共4株。各菌株在蒙金娜培养基上pH4.74~6.20,多数菌株偏碱性。

表4 菌株溶解有机磷能力测定Table 4 Capacity of strains on organic culture medium
2.4 优良菌株鉴定
2.4.1 生理生化鉴定 试验结果表明,选取性能较好的6株菌株PDRS1、PDRP3、NDRS4、NDRP5、NDHP1及MDRP5进行鉴定(表5)。查阅《伯杰细菌鉴定手册》以及《常见细菌系统鉴定手册》后,初步鉴定各菌株为芽孢杆菌属[21-22]。
注:“+”代表该反应为阳性,“-”代表该反应为阴性
2.4.2 分子生物学鉴定 综合生化试验结果和分子鉴定结果,发现研究中所分离的菌株生化鉴定结果和分子鉴定结果能很好的吻合,说明鉴定结果准确可靠(表6,图3)。6株菌株分别属于芽孢杆菌属的3个种,其中,PDRS1、PDRP3、NDRP5和NDHP1为枯草芽孢杆菌(Bacillussubtilis),NDRS4为短小芽孢杆菌(Bacilluspumilus),MDRP3为蜡样芽孢杆菌(Bacilluscereus)。

表6 优良PGPR菌株鉴定结果Table 6 Identification of PGPR

图3 分离出的溶磷菌株分子系统进化树Fig.3 Phylogenetic tree of the isolated phosphate solubilizing bacteria strains
3 讨论
大自然中微生物的种类很多,仅有极少数的微生物种类得到了鉴定[23],能在试验室培养的微生物种类就更少,仅为1%[24]。在传统方法中对植物根际细菌鉴定分类主要采用微生物培养的方法,即通过观察细菌培养时的形态和生理生化指标来完成鉴定[25]。随着分子生物学的快速发展和进步,菌株鉴定和分离有了更为可靠快速的方法和手段。目前,最常用的微生物菌种鉴定技术就是16SrDNA序列分析技术,能够较好完成菌株遗传特性筛选和分子差异比对,现已将鉴定出的细菌的16SrDNA基因信息建立数据库,全部收录到GenBank等基因数据库。此次研究将生理生化特性与分子生物学方法相结合后对菌株进行鉴定,结果更为准确。
在分离、纯化具有固氮能力、溶解无机磷和溶解有机磷能力菌株时,发现各菌株数量均表现出根表>根表土>远根土>根内的根际分布趋势,此研究结果与姚拓等[26-27]、张英及赵小蓉等[28-30]的研究结果相一致。由此说明PGPR菌株在土壤中的数量除了受土壤理化性质、有机质含量、土壤类型、耕作措施等因素影响外,PGPR菌株的分布同时也受植物强烈的根际效应的影响。有研究表明接近根表的菌株更容易获取植物分泌的某些物质,从而聚集更多的微生物[31];同时,由于土壤表层积累的枯叶和根系分泌物较多,使得土壤表层和植物根系表层土壤的细菌生长可以获得丰富的营养物质[32]。另外,不同植物的根际促生菌组成必然不同,因此,要开发促生效果良好的促生菌产品,就需从不同地区不同植物的根际分离,从而选育出具有地区针对性的优良菌株。
获得的固氮、溶磷菌株经鉴定均为芽孢杆菌属(Bacillus),该属除了具有良好的解磷能力[33],还具有良好的固氮作用和生防作用[34]。大量存在于植物根际,繁殖快速、能分泌高活性的分解酵素,并合成多种有机酸、酶、生理活性等物质,成为植物位点和空间微环境的有力竞争者。孙广正等[35]分离出的一株枯草芽孢杆菌对油菜菌核病病原菌的抑制率达到了85%。王玉琴等[36]从针茅中分离获得菌株265ZY4,鉴定为枯草芽孢杆菌,具有溶磷、产IAA等生物学功能,具有较好的开发潜力。除枯草芽孢杆菌(B.subtilis),研究还获得芽孢杆菌属的其他一些常见的PGPR菌种,如短小芽胞杆菌(B.pumilus)、蜡样芽胞杆菌(B.cereus)[37-38]。研究分离出菌株,参考前人文献推测其有拮抗病原菌的潜力,对抑制有害微生物的繁殖,降解土壤中的营养成分,改善生态环境具有积极作用。
4 结论
黑果枸杞根际有大量PGPR菌,分布特征表现出根表(RP)>根表土(RS)>根内(HP)的根际效应;最终获得71株PGPR菌,其中固氮菌21株,溶解无机磷30株,有机磷20株;通过对促生特性研究,7株固氮菌株的固氮酶活性大于200 nmol C2H4/(h·mL),13株溶磷菌株的溶磷量高于300 μg/mL;筛选出综合性能良好、有进一步开发利用价值的PGPR菌株6株,经鉴定均为芽孢杆菌属(Bacillus),其中Bacillussubtilis有4株,Bacilluspumilus和Bacilluscereus各1株。
参考文献:
[1] 刘淑琮,冯炘,于洁.植物根际促生菌的研究进展及其环境作用[J].湖北农业科学,2009,48(11):2882-2887.
[2] 姚拓.促进植物生长菌的研究进展[J].草原与草坪,2002(4):1-5.
[3] 荣良燕,姚拓,冯今,等.PGPR微生物肥代替部分化肥对豌豆生长的影响[J].草原与草坪,2014(1):7-12.
[4] 陈龙,姚拓,柴强,等.微生物肥料替代部分化学肥料对玉米生长及品质的影响[J].草原与草坪,2016,36(1):20-25.
[5] Kumar N,Sowmyamala B V,Kumar S.Effect of plant growth promoting rhizobacteria (PGPR) on growth and yield of bitter gourd[J].International Journal of Applied Biology and Pharmaceutical Technology,2012,3(1):1-7.
[6] 姚拓.高寒地区燕麦根际联合固氮菌研究Ⅱ固氮菌的溶磷性和分泌植物生长素特性测定[J].草业学报,2004,13(3):85-90.
[7] 胡江春,薛德林,马成新,等.植物根际促生菌(PGPR)的研究与应用前景[J].应用生态学报,2004,15 (10):1963-1966.
[8] 匡可任,路安民.中国植物志[M].北京:科学出版社,1978:10.
[9] 冯建森,刘志虎.酒泉市野生黑果枸杞资源及利用[J].林业科技通讯,2013(2):62-64.
[10] 章英才,张晋宁.两种盐浓度环境中的黑果枸杞叶的形态结构特征研究[J].宁夏大学学报(自然科学版),2004,25(4):365-367.
[11] 张绘芳,李霞,王建刚,等.塔里木河下游植物群落结构特征分析[J].生态环境,2007,16(4):1219-1224.
[12] 王龙强,米永伟,蔺海明.盐胁迫对枸杞属两种植物幼苗离子吸收和分配的影响[J].草业学报,2011,20(4):129-136.
[13] 彭飞,黄翠华,尤全刚,等.种植黑果枸杞(Lyciumruthenicum)对盐渍土盐分分布的影响[J].中国沙漠,2013,33(5):1406-1412.
[14] 李永洁,李进,徐萍,等.黑果枸杞幼苗对干旱胁迫的生理响应[J].干旱区研究,2014,31(4):756-762.
[15] 许志诚.黑果枸杞特色产品开发现状与前景展望[J].农业与技术,2017,37(12):244.
[16] 李凤霞,张德罡,姚拓.高寒地区燕麦根际高效PGPR菌培养条件研究[J].甘肃农业大学学报,2004,39(3):316-320.
[17] 许光辉,郑洪元,主编.土壤微生物分析方法手册[M].北京:农业出版社,1986.
[18] Hafeez F Y,Yasmin S,Ariani D,etal.Plant growth-promoting bacteria as biofertilizer[J].Agronomy for Sustainable Development,2006,26(2):143-150.
[19] 陈俊,陆俊馄,康丽华,等.红树林溶磷菌的初步鉴定、溶磷能力测定及其优化培养[J].微生物学通报,2009,36(81):1183-1188.
[20] 窦新田.生物固氮[M].北京:农业出版社,1989.
[21] Buchanan R E,Gibbons N E.伯杰细菌鉴定手册.中国农科院微生物研究所《伯杰细菌鉴定手册》翻译组译(第八版).北京:科学出版社,1984.
[22] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[23] Hawksworth D L.Frontiers in mycology[M].Oxford: Oxford University Press( 1st ed),1991.
[24] Amann R I,Ludwig W,Schleifer K.Phylogenetic identification and situ detecting of individual microbial cells without cultivation[J].Microbiological Revirmentation,1995,59(1):143-169.
[25] 王祝健,马海乐,崔恒林.醋醅中细菌菌株的分离鉴定及系统学分析[J].中国食品学报,2011,11(6):170-176.
[26] 姚拓.高寒地区燕麦根际联合固氮菌研究Ⅱ固氮菌的溶磷性和分泌植物生长素特性测定[J].草业学报,2004,13(3):85-90.
[27] 卢虎,姚拓,李建宏,等.高寒地区不同退化草地植被和土壤微生物特性及其相关性研究[J].草业学报,2015,24(5):34-43.
[28] 张英.西藏阿里高寒草原四种牧草根际促生菌资源筛选及促生机理研究[D].兰州:甘肃农业大学,2013.
[29] 赵小蓉,林启美,李保国.微生物溶解磷矿粉能力与pH及分泌有机酸的关系[J].微生物学杂志,2003,23(3):5-7.
[30] 赵小蓉,林启美,李保国.溶磷菌对4种难溶性磷酸盐溶解能力的初步研究[J].微生物学报,2002,42(2):236-241.
[31] 张崇邦.东北草原土壤微生物分布特征[J].草地学报,2001,9(2):117-120.
[32] 郭春秀,姚拓,马俊梅,等.石羊河下游不同类型荒漠草地黑果枸杞群落结构及物种多样性特征[J].草地学报,2017,25(3):529-537.
[33] Paul N B,Rao W V B S.Phosphate-dissolving bacteria in the rhizosphere of some cultivated legumes[J].Plant and Soil,1971,35(1):127-132.
[34] 张艳群,来航线,韦小敏,等.生物肥料多功能芽孢杆菌的筛选及其作用机理研究[J].植物营养与肥料学报,2013,19(2):489-497.
[35] 孙广正.微生物接种剂对油菜和西葫芦病害防治及其促生作用研究[D].兰州:甘肃农业大学,2015.
[36] 王玉琴,杨成德,王颖,等.针茅内生细菌菌株265ZY4的鉴定及其生物学功能[J].微生物学通报,2015,42(1):101-109.
[37] 孙仲平,王占斌,徐香玲,等.利用杀配子染色体2C诱导中国春-黑麦二体附加系染色体畸变的研究[J].遗传学报,2004,31(11):1268-1274.
[38] Malviya J,Singh K.Biogeography and Polyphasic Approach of Pseudomonas strains from Agriculture land of Madhya Pradesh[J].Advances in Life Science & Technology,2012.
