放牧及AM真菌对垂穗披碱草生长和白粉病抗性的影响
2018-05-22郭艳娥段廷玉兰州大学草地农业生态系统国家重点实验室农业部草牧业创新重点实验室甘肃兰州730000
郭艳娥,张 峰,李 芳,段廷玉(兰州大学 草地农业生态系统国家重点实验室/农业部草牧业创新重点实验室, 甘肃 兰州 730000)
丛枝菌根(Arbuscular mycorrhizae, AM)真菌,作为土壤微生物的重要组成部分,在草地农业生态系统中广泛存在,可与80%以上陆生维管植物根系建立共生关系[1]。菌根共生体的形成能够改善宿主植物的营养状况,促进其对土壤中N、P 等矿质元素的吸收[2],提高植物的生物量[1]。此外,AM真菌作为生防因子,表面大量延伸着由根内与根外菌丝组成的庞大菌丝网,构成对病原菌的机械屏障[3-5],能够有效控制病害的发生。当植物受到病原菌侵染时,其正常的生长代谢功能受到影响,而这些不利影响所造成的损失可通过建成完善的AM共生体得到部分补偿[6]。Cordier等[7]采用分根法首次证实AM共生体的形成可诱导寄主产生系统抗性。菌根化番茄(Lycopersiconeseulentum)在受到寄生疫霉(Phytophthoraparasitica)攻击产生抗性反应时,被AM真菌侵染的根系细胞对病原菌表现出明显的抗性,而非菌根化处理并未观察到类似反应。放牧是天然草地的主要利用方式,在放牧条件下,家畜的采食、践踏和排泄等行为会对植物的生长、多样性及土壤的理化性质等产生影响,而这些又是影响AM真菌的直接因素,因此放牧势必会影响AM真菌的生长和多样性[8-9],进而影响牧草的养分吸收和生长发育效应。如Su等[10]对不同放牧强度下AM真菌的研究中发现,AM真菌的孢子密度、侵染率和种类等,随放牧强度增加显著降低。曹路等[11]认为放牧强度能影响AM真菌泡囊结构,轻度和中度放牧可促进AM真菌泡囊的形成,重度放牧则显著抑制。李芳等[12]的研究发现AM真菌侵染率随着放牧强度的增加而增加,以重度放牧最高,中度放牧次之,轻度放牧最低。然而Lugo等[13]的调查显示放牧并未影响阿根廷天然草地的AM真菌侵染率。放牧对AM真菌的影响与土壤养分状况密切有关,养分含量过高或过低都会降低菌根的侵染率及其在土壤中的侵染数量。在一定范围内AM真菌的数量随有机质含量的升高而增加,但当超过这个范围时,数量下降[14]。此外,放牧对AM真菌的影响因AM真菌种类不同而异,如地表球囊霉(Glomusversiforme)和根内球囊霉(Rhizophagusintraradices)对长期过度放牧反应敏感,但另外一些种,如摩西球囊霉(G.mosseae),则不被影响[10]。因此,开展放牧对AM真菌的研究,可为利用放牧防控草地病害提供理论依据。
病害已成为限制草牧业生产的主要因素之一,可降低牧草产量和品质,使家畜生产力减弱,影响草地生态系统的持续性和稳定性,并造成重大经济损失[15-17]。刘日出[18]对甘南藏族自治州内不同围封年限天然草地的调查共发现11科16属19种植物的27种病害,主要是锈病和叶斑类病害。张蓉[19]对该地的11个科包括30个属的植物病原菌调查后,共鉴定出黑粉病2科4属11种,占鉴定总数的25%;锈病1科11属11种,占鉴定总数的25%;麦角病1科3属3种,占鉴定病害总数的6.82%;白锈病1科1属和2种,占鉴定总数的4.55%;白粉病1科5属5种,占鉴定总数的11.36%;霜霉病1科3属3种,占鉴定总数的6.82%;叶斑类病害9种,占分离总数的20.1%。刘勇[20]研究了不同放牧强度下甘南草地3年的植物病害发生规律,发现垂穗披碱草(Elymusnutans)的锈病(Pucciniarecondita)和离蠕孢叶斑病(Bipolarissorokiniana)为常见病害。陈仕勇等[21]发现麦角病(Clavicepsspp.)也是垂穗披碱草的一种常见病害。
垂穗披碱草(Elymusnutans)是青藏高原重要的优良牧草,亦是优势植物种群,可与AM真菌形成共生体。由专性寄生真菌Blumeriagraminis引起的白粉病,是一种典型的气传性病害,也是青藏高原高寒草地的主要病害之一。主要侵害植物叶片,最初叶片两面形成白色粉状物,严重时全叶布满白粉状霉层。白粉病菌对寄主的危害比较严重,不仅造成鲜草产量的损失,还会影响牧草品质。目前,AM真菌与白粉菌等气传病害互作关系的报道尚不多见[22],有必要加强此方面的研究,进一步探究AM真菌在病害防控方面的作用。此次在不同放牧强度区采集土壤,在温室条件下建立不同土壤微生物及AM真菌处理,探讨放牧及AM真菌对垂穗披碱草生长和白粉病的影响,以期为通过放牧调控微生物,提高植物抗病性提供理论依据。
1 材料和方法
1.1 取样地概况及放牧样地设置
试验样地位于青藏高原东缘的甘肃省甘南玛曲草原站,海拔3 500 m左右。主体土壤类型为亚高山草甸土,植被类型有垂穗披碱草(Elymusnutans)、老芒麦(E.sibiricus)、早熟禾(Poaannua)、翦股颖(Agrostisstolonifera)、羊茅(Festucaovina)等,线叶嵩草(Kobresiacapillifolia)为优势种。除线叶嵩草不能和AM真菌形成共生体外,其他主要禾本科建群种均可与AM真菌形成共生体[12]。放牧地设计分为轻度放牧(LG)、中度放牧(MG)和重度放牧(HG)3个放牧强度。放牧率以当地现行载畜量为基础确定,放牧小区的面积为200 m×200 m。轻度放牧为8羊/轮牧小区,中度放牧为16羊/轮牧小区,各设6个轮牧小区,周期皆为45 d,放牧期7 d左右(根据气候和牧草生长阶段适度调整);重度放牧为8羊/轮牧小区,放牧期间持续放牧,不轮牧。6~9月是放牧季节,轮牧周期为45 d,至试验开始取样时,已连续放牧4年。
1.2 试验材料
1.2.1 供试土壤 9月底,在每个轮牧小区沿对角线选取20个植被盖度和群落相对一致的点,挖取5~15 cm土层土壤装入自封袋,每个点150 g。轮牧强度相同小区共采集约50 kg土样,用于温室试验。将玛曲放牧地采集的土壤,挑拣其他杂物并混合均匀后过0.25 mm筛。
1.2.2 供试植物 垂穗披碱草(Elymusnutans)种子于2013年9月初从玛曲放牧地采集获得。挑选大小一致且籽粒饱满的种子,用10% H2O2对其表面消毒10 min,然后用无菌水冲洗干净,置于25℃恒温培养箱催芽48 h。
1.2.3 供试AM真菌 根内球囊霉(Rhizophagusintraradices)和幼套球囊霉(Claroideoglomusetunicatum),购买于北京市农林科学院植物营养与资源研究所“丛枝菌根真菌种质资源库BGC”,宿主为三叶草(Trifoliumrepens),以扩繁所得的孢子、根外菌丝、菌根根段及培养基质(沙∶土= 9∶1)作为接种物。
1.2.4 试验设计 将放牧地采集的土壤过筛后进行处理。
自然土(NS):过筛土壤不经任何处理,保留原有的AM真菌和根部入侵真菌。
无菌土(SS):采用高温湿热灭菌法,将土壤放入铁桶,在高温高压灭菌锅中,121℃灭菌1 h,隔日再灭菌1 h,消除土壤中的AM真菌和根部入侵真菌。
接种AM真菌土(AM):将灭菌后的土壤装入花盆至3/5处,各称取15 g扩繁的混合菌剂平铺在上面,然后再覆盖无菌土至4/5处。
去除AM真菌土(NM):将野外所采集土壤,用无菌水稀释后,过滤(Whatman42号滤纸)2次,获得不含AM真菌的滤液,然后将该滤液按10 mL/kg的比例加入上述灭菌土,获得去除AM真菌土。
1.2.5 种植管理 种植盆数:放牧强度(3个)×土壤处理(4种)×重复(4次)=48盆。
将上述土壤,每盆装入700 g,覆膜保湿。选取长势、大小基本一致的萌发种子,移栽至塑料花盆中,每盆移栽5株,出苗1周后,定苗至3株。收获前测定发病率,收获时选取不同处理植株相同部位的新鲜叶片,用于生理生化指标测定。
1.3 指标测定
发病率统计:植株生长7周后,自然发生白粉病,每盆随机选取20个叶片,记录发病叶片数。
发病率=发病叶片数/20×100%。
染色镜检法测定AM菌根的侵染率[23];全P含量采用钼锑抗吸光光度法[24]测定;采用丙酮浸提法测定叶绿素含量[25];采用氮蓝四唑法和愈创木酚法测定超氧化物歧化(SOD)酶和过氧化物(POD)酶活性[26],多酚氧化酶(PPO)含量采用王学奎的方法测定[25]。
1.4 数据统计与分析
采用JMP IN 4对各指标进行交互效应和方差分析,结果用Microsoft Excel 2010作图。
2 结果与分析
2.1 AM真菌侵染率
以灭菌土(SS)和去除AM真菌土(NM)为基质的垂穗披碱草根系均未检测到菌根结构。放牧强度对AM真菌侵染率产生显著影响,AM处理不同放牧强度间的差异均显著(P<0.05)。轻度、中度和重度放牧AM处理的侵染率分别较自然土(NS)高9.71%,18.4%和40.12%。NS和AM处理的侵染率都表现为重度放牧最高,比轻度和中度放牧分别高32.48%,2.39%和69.2%、21.17%(表1)。NS处理下中度和重度放牧的侵染率差异不显著,但与轻度放牧差异显著(P<0.05)(表1)。
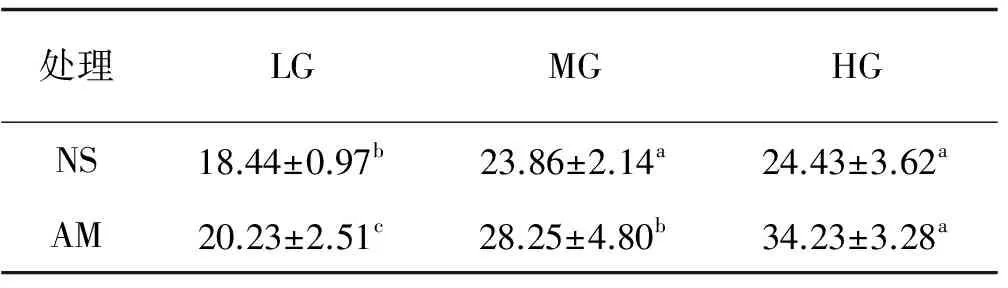
表1 不同处理下的垂穗披碱草AM真菌侵染率Table 1 AM colonization of Elymus nutans under different treatments %
注:不同小写字母表示同一土壤处理不同放牧强度间差异显著(P<0.05)
2.2 白粉病发病率
放牧强度与土壤处理间存在交互效应,中度放牧除NS处理外的发病率最高。轻度放牧的AM,NM和NS处理的白粉病发病率比SS分别低22.1%,73.37%和36.65%,中度放牧低57.26%,25.46%和81.82%,重度放牧低20.46%,13.19%和65.05%。说明不同放牧强度下各接种真菌处理皆不同程度抑制垂穗披碱草白粉病的发生,降低了发病率(图1)。此外,随放牧强度的增加,AM真菌对白粉病发病率的降低无显著差异,NM在低放牧强度下的抗病效果最为显著,NS处理在中度放牧条件下显著降低白粉病的发病率(P<0.05)(图1)。

图1 不同处理下的垂穗披碱草白粉病发病率Fig.1 Powdery mildew incidences of Elymus nutans under different treatments注:不同小写字母表示不同处理间差异显著(P<0.05),下同
2.3 总生物量和根冠比
接种AM真菌和SS处理未对垂穗披碱草总生物量产生显著影响,NS处理总生物量较无菌土和单接菌土壤均有不同程度的降低(图2a)。
不同放牧强度的土壤及AM真菌处理对根冠比的影响与总生物量相似。此外,重度放牧土壤各处理间的差异更为显著,SS处理比AM,NM和NS的根冠比分别高23.96%,45.12%和38.37%;重度放牧土壤NS处理的根冠比分别较轻度和中度放牧高126.32%和145.71%(图2b)。

图2 不同处理下的垂穗披碱草总生物量和根冠比Fig.2 Total biomass and root/shoot ratio of Elymus nutans under different treatments
2.4 全磷含量
不同放牧强度皆以接种AM真菌处理的地上全磷含量最高,但与SS和NM处理间的差异均不显著(P>0.05),自然土NS表现为最低,轻度、中度、重度放牧条件下NS处理分别较AM处理低41.78%,34.84%和29.30%(图3a)。
放牧强度与AM真菌都对垂穗披碱草根系全磷含量产生显著影响(P<0.05),且二者间存在交互效应,接种AM土壤根系全磷含量随放牧强度的增加先增加后降低,NM与NS土壤随放牧强度增加而增加。AM真菌并未显著增加根系全磷含量,其与SS间的差异不显著(图3b)。NM处理不同程度降低了根系全磷含量,中度放牧条件下降低24.14%。轻度、中度和重度放牧强度下,NS处理的根系全磷含量分别比SS降低53.74%,64.92%和21.95%(图3b)。

图3 不同处理下的垂穗披碱草全P含量Fig.3 Total P content of Elymus nutans under different treatments
2.5 叶绿素含量与光合速率
不同放牧强度土壤与AM真菌处理存在交互效应。轻度和中度放牧强度下,AM与NM处理皆提高垂穗披碱草的叶绿素含量,重度放牧强度下降低叶绿素含量。NS处理中度和重度放牧强度比低放牧强度高33.68%和21.00%(图4a)。
放牧强度对光合速率产生显著影响(P<0.05)。轻度、中度和重度放牧条件下SS和AM处理的光合速率都呈先降低后升高趋势,重度比轻度和中度在SS处理下分别高36.71%和113.86%,在AM处理下分别高 18.68%和130.66%。轻度和中度条件下,AM处理的光合速率比NM分别低8.08%和17.96%,重度放牧下高18.68%(图4b)。
2.6 抗病相关酶活性
不同放牧强度下的土壤及AM真菌处理对垂穗披碱草SOD酶活性的影响存在交互效应。AM真菌土壤的SOD酶活性随放牧强度的增强而增强,重度放牧条件比轻度和中度分别高8.3%和11.07%,NM处理反之,轻度放牧的SOD酶活性最高,NS土壤对SOD酶活性的影响与AM土壤一致。中度和重度放牧条件下,同一真菌处理的SOD酶活性无显著差异(图5a)。

图4 不同处理下的垂穗披碱草叶绿素含量与光合速率Fig.4 Chlorophyll content and photosynthetic rate of Elymus nutans under the different grazing treatments
中度放牧强度下,AM真菌显著提高了POD酶活性;NM处理对POD酶活性的影响随放牧强度的增加而增加,但无显著差异,NS处理则表现为相反趋势(P<0.05)(图5b)。
不同放牧强度下AM,NM和NS处理的PPO酶活性的无显著差异。AM真菌未对PPO酶活性产生积极影响,而NM处理显著提高了垂穗披碱草的PPO酶活性,轻度、中度和重度放牧分别较SS提高14.2%,10.61%和19%。NS处理轻度放牧下的PPO酶活性比SS高11.57%,中度和重度放牧下的差异不显著(图5c)。
3 讨论
放牧是典型草原生态系统中主要的土地利用方式和干扰模式,同时也是引起土壤养分含量发生变化的主要因素之一[27]。其通过动物的采食、践踏及排泄物的输入直接或间接对草地土壤产生影响,随着放牧强度的增加,家畜啃食量加大,凋落物或死亡地被物的分解减少,进而减少土壤中的养分含量。而放牧强度高的草地,家畜又会排泄更多的粪尿,能够增加土壤中的养分含量[28]。磷为贮藏性物质,受外界环境的影响较大。戎郁萍等[29]和Xie等[30]探究了不同放牧强度对草地土壤理化性质的影响,结果表明随放牧强度的增加,土壤全磷含量逐渐降低;周丽艳等[31]研究不同放牧强度对贝加尔针茅(Stipabaicalensis)草甸草原的影响结果也显示,土壤状况随着放牧强度的增加而劣由于放牧同时影响着植物的地上及地下土壤理化性质,而这些因素又是影响AM真菌生长及其多样性的直接因素,因此放牧对AM真菌的影响是一个较为复杂的过程[9,34-36],且随放牧强度不同,AM真菌的侵染能力也存在差异。有研究认为放牧对AM真菌有促进作用,如Klironomos等[37]关于食草行为对AM真菌影响的报道称,食草行为虽抑制了根内菌丝和丛枝的生长,但对泡囊和孢子的生成有促进作用。Techau等[38]以豌豆作为研究对象,进行模拟食草试验,发现高频率的食草行为可促进AM真菌的侵染,尤其在宿主植物缺乏磷营养的状况下。另外,Ba等[39]在吉林省羊草(Leymuschinensis)草原上比较研究不同放牧强度对草地的影响,结果表明轻度和中度放牧区AM真菌多样性高于重度放牧区。相反,也有一些研究认为放牧未对AM真菌产生显著影响。Duponnois等[40]比较研究不同年限休耕地上放牧区和围栏禁牧区的AM真菌,结果显示两个区域内的真菌孢子数量和对本土植物的侵染并没有显著差异,即围栏或放牧对真菌的生长和侵染能力没有影响,Medina-Roldán等[41]的研究进一步验证了这一结论。研究显示,中度和连续放牧土壤的侵染率均显著高于轻度放牧土壤,AM真菌对放牧行为的敏感性,主要归结于放牧对植物和土壤因子的影响,而这些因素的改变又影响AM真菌的产孢和侵染。
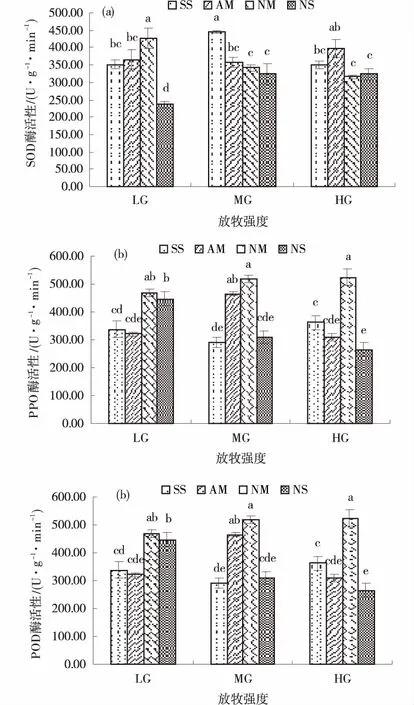
图5 不同处理下的垂穗披碱草抗病相关酶活性Fig.5 Defensive enzyme activities of Elymus nutans under different treatments
AM真菌能够改善宿主的水分代谢和养分状况,促进植物生长,改善根际微生物环境[42-43]。试验含AM真菌土壤显著增加了根系的全磷含量,这是因为菌根化植物对土壤中磷元素的摄取包括直接吸收途径(DUP)和菌根吸收途径(MUP)两条,且MUP途径对磷吸收的贡献更大[44]。中度和连续放牧条件下,含AM真菌土壤的总生物量以及根冠比显著高于其他处理,这与放牧强度和AM真菌的综合作用息息相关,放牧通过影响AM真菌特性和土壤理化性质来间接影响植物生长。
AM真菌表面分布有大量菌丝体,构成对病原物的天然屏障[45];增加了细胞壁的木质化程度和羟脯氨酸糖蛋白含量,使植物根尖表皮增厚,防止病原物的入侵[45];增加抗病成分的合成,与病原菌竞争结合部位,增强了植物的抗病性[46]。刘贵猛等[47]的研究表明,作为重要的生防种质资源,AM真菌与PGPR能够相互促进、协同抑制生姜(Zingiberofficinale)青枯病菌(Ralstoniasolanacearum)的繁殖和侵染。周修腾等[48]在AM真菌对丹参(Salviamiltiorrhiza)木质部结构及防御相关基因的影响中发现,AM真菌能够促进丹参生长,增加丹参根系木质部面积及密度,促进木质素的合成,对提高丹参抗病性有积极作用。Bruisson等[22]对葡萄藤(Vitisvinifera)白粉病(B.cinerea)的研究表明,AM真菌可诱导植物产生芪类化合物(stilbenoid),促进PAL酶相关基因的表达上调,从而提高植物对白粉病的抗性。试验含AM真菌土壤皆不同程度抑制垂穗披碱草白粉病的发生,降低发病率,且对抗病相关酶活性产生显著影响,随放牧强度的增强AM真菌处理的SOD酶和PPO酶活性升高。
病原菌的侵染会破坏植物叶片的绿色组织,从而使光合作用受到严重影响,直接导致产量下降[49]。白粉病菌(S.fuliginea)侵染的黄瓜(Cucumissativus)叶片光合膜上全链电子传递速率和光系统Ⅱ的电子传递速率都受到明显抑制。光合膜在一定范围内,随着病原菌侵染的加强,可能出于对自身的保护,会通过降低电子传递速率来尽可能减少病原菌侵染的伤害[50]。轻度和中度放牧条件下,AM真菌皆显著提高垂穗披碱草的叶绿素含量和光合速率,减轻白粉病对植物叶片的损伤,降低发病率,这与Bruisson等[13]对葡萄藤白粉病的报道相似,主要原因是AM真菌一方面促进了植物养分吸收和生长,另一方面可调节植物生理及光合作用,进而对白粉病起到防控作用。
4 结论
在玛曲高山草原地区,适当地增加放牧强度,可提高AM真菌侵染率9.71%~40.12%。AM真菌通过提高宿主根系全磷含量、叶绿素含量和光合速率,促进植物生长,调节抗病相关酶活性,可使得垂穗披碱草白粉病发病率降低20.46%~57.26%,有效抑制病害的发生。
参考文献:
[1] Smith S E,Read D J.Mycorrhizal Symbiosis[M].Longdon:Academic press,2008.
[2] Grunwld U,Guo W,Fischer K,etal.Overlapping expression patterns and differential transcript levels of phosphate transporter genes in arbuscular mycorrhizal,Pi-fertilised and phytohormone-treatedMedicagotruncatularoots[J].Planta,2009,229(5):1023-1034.
[3] Huang J,Luo S,Zeng R.Mechanisms of plant disease resistance induced by arbuscular mycorrhizal fungi[J].Chinese Journal of Applied Ecology,2003,14(5):819-822.
[4] Miransari M.Interactions between arbuscular mycorrhizal fungi and soil bacteria[J].Applied Microbiology and Biotechnology,2011,89(4):917-930.
[5] Jung S C,Martinez-Medina A,Lopez-Raez J A,etal.Mycorrhiza-Induced Resistance and Priming of Plant Defenses[J].Journal of Chemical Ecology,2012,38(6):651-664.
[6] Pfleger F L, Linderman R G. Mycorrhizae and plant health[M]. APS Press,1994.
[7] Cordier C,Pozo M J,Barea J M,etal.Cell defense responses associated with localized and systemic resistance toPhytophthoraparasiticainduced in tomato by an arbuscular mycorrhizal fungus[J].Molecular Plant-Microbe Interactions,1998,11(10):1017-1028.
[8] 仁青吉,崔现亮,赵彬彬,等.放牧对高寒草甸植物群落结构及生产力的影响[J].草业学报,2008,17(6):134-140.
[9] Eisenhauer N.Aboveground-belowground interactions as a source of complementarity effects in biodiversity experiments[J].Plant and Soil,2012,351(1):1-22.
[10] Su Y Y,Guo L D.Arbuscular mycorrhizal fungi in non-grazed,restored and over-grazed grassland in the Inner Mongolia steppe[J].Mycorrhiza,2007,17(8):689-693.
[11] 曹路,索培芬,韩冰,等.大针茅根际AM真菌的分子鉴定及不同放牧强度对AM侵染的影响[J].基因组学与应用生物学,2015,34(4):769-774.
[12] 李芳,张峰,郭艳娥,等.放牧和AM真菌对夏季青藏高原东缘老芒麦生长和白粉病的影响[J].草业科学,2017,34(12):2528-2537.
[13] Lugo M N A,Maza M E G L,Cabello M N.Arbuscular mycorrhizal fungi in a mountain grassland II:Seasonal variation of colonization studied,along with its relation to grazing and metabolic host type[J].Mycologia,2003,95(3):407-415.
[14] 李晓林,冯固.丛枝菌根生态生理[M].北京:华文出版社,2001.
[15] 南志标,李春杰.中国牧草真菌病害名录[J].草业科学,1994,11(3):30.
[16] 南志标,李春杰,白原生,等.我国草类作物病害及其防治对策[C]∥南志标,李春杰.中国草类作物病理学研究,2003.
[17] 马爽,杨成德,薛莉,等.陇东典型草原不同载畜量土壤的微生物季节变化[J].草原与草坪,2004(2):27-30.
[18] 刘日出.放牧和围封对草地植物病害的影响[D].兰州:兰州大学,2011.
[19] 张蓉.甘南高寒草地植物主要真菌病害调查与鉴定[D].兰州:甘肃农业大学,2009.
[20] 刘勇.放牧对陇东与甘南草原植物病害的影响[D].兰州:兰州大学,2016.
[21] 陈仕勇,马啸,张新全,等.青藏高原垂穗披碱草种质麦角病抗性的初步研究[J].西南农业学报,2016,29(2):302-306.
[22] Bruisson S,Maillot P,Schellenbaum P,etal.Arbuscular mycorrhizal symbiosis stimulates key genes of the phenylpropanoid biosynthesis and stilbenoid production in grapevine leaves in response to downy mildew and grey mould infection[J].Phytochemistry,2016,131:92-99.
[23] Koske R E,Gemma J N.A modified procedure for staining roots to detect VA mycorrhizas[J].Mycological Research,1989,92(4):486-488.
[24] 严昶升.土壤肥力研究方法[J].北京:农业出版社,1988.
[25] 王学奎,黄见良.植物生理生化实验原理与技术[M].北京:高等教育出版社,2015.
[26] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[27] 刘忠宽,汪诗平,陈佐忠,等.不同放牧强度草原休牧后土壤养分和植物群落变化特征[J].生态学报,2006,26(6):2048-2056.
[28] 安慧,李国旗.放牧对荒漠草原植物生物量及土壤养分的影响[J].植物营养与肥料学报,2013,19(3):705-712.
[29] 戎郁萍,韩建国,王培,等.放牧强度对草地土壤理化性质的影响[J].中国草地,2001,23(4):41-47.
[30] Xie Y Z,Wittig R.The impact of grazing intensity on soil characteristics ofStipagrandisandStipabungeanasteppe in northern China (autonomous region of Ningxia)[J].Acta Oecologica,2004,25(3):197-204.
[31] 周丽艳,王明玖,韩国栋.不同强度放牧对贝加尔针茅草原群落和土壤理化性质的影响[J].干旱区资源与环境,2005,19(z1):182-187.
[32] 李香真,陈佐忠.不同放牧率对草原植物与土壤C,N,P含量的影响[J].草地学报,1998,6(2):90-98.
[33] Steenwerth K L,Jackson L E,Calderón F J,et al.Soil microbial community composition and land use history in cultivated and grassland ecosystems of coastal California[J].Soil Biology and Biochemistry,2002,34(11):1599-1611.
[34] Eriksson A.Arbuscular Mycorrhiza in Relation to Management History,Soil Nutrients and Plant Species Diversity[J].Plant Ecology,2001,155(2):129-137.
[35] Mendoza R,Cabello M,Anchorena J,etal.Soil parameters and host plants associated with arbuscular mycorrhizae in the grazed Magellanic steppe of Tierra del Fuego[J].Agriculture Ecosystems & Environment,2011,140(3-4):411-418.
[36] Teague W R,Dowhower S L,Baker S A,etal.Grazing management impacts on vegetation,soil biota and soil chemical,physical and hydrological properties in tall grass prairie[J].Agriculture Ecosystems & Environment,2011,141(3-4):310-322.
[37] Klironomos J N,Mccune J,Moutoglis P.Species of arbuscular mycorrhizal fungi affect mycorrhizal responses to simulated herbivory[J].Applied Soil Ecology,2004,26(2):133-141.
[38] Techau M E C,Christensen S.Simulated herbivory eff ects on rhizosphere organisms in pea (Pisumsativum) depended on phosphate[J].Plant and Soil,2004,264(1):185-194.
[39] Ba L,Ning J,Wang D,etal.The relationship between the diversity of arbuscular mycorrhizal fungi and grazing in a meadow steppe[J].Plant and Soil,2012,352(1):143-156.
[40] Duponnois R,Plenchette C,Thioulouse J,etal.Mycorrhizal soil infectivity and AM fungal spore communities of different aged fallows in Senegal[J].Applied Soil Ecology,2001,17(3):239-251.
[41] Medina-Roldán E,Arredondo J T,Huber-Sannwald E,etal.Grazing effects on fungal root symbionts and carbon and nitrogen storage in a shortgrass steppe in Central Mexico[J].Journal of Arid Environments,2008,72(4):546-556.
[42] Hooker J E, Jaizme-Vega M, Atkinson D. Biocontrol of plant pathogens using arbuscular mycorrhizal fungi[M]. Impact of arbuscular mycorrhizas on sustainable agriculture and natural ecosystems,1994.
[43] Graham J H.What Do Root Pathogens See in Mycorrhizas?[J].New Phytologist,2001,149(3):357-359.
[44] Smith S E,Smith F A,Jakobsen I.Mycorrhizal fungi can dominate phosphate supply to plants irrespective of growth responses[J].Plant Physiology,2003,133(1):16-20.
[45] Affokpon A,Coyne D L,Lawouin L,etal.Effectiveness of native West African arbuscular mycorrhizal fungi in protecting vegetable crops against root-knot nematodes[J].Biology and Fertility of Soils,2011,47(2):207-217.
[46] Cameron D D,Neal A L,van Wees S C,etal.Mycorrhiza-induced resistance:more than the sum of its parts?[J].Trends in Plant Science,2013,18(10):539-545.
[47] 刘贵猛,谭树朋,孙文献,等.AMF和PGPR对生姜青枯病的影响[J].菌物研究,2017,15(1):1-7.
[48] 周修腾,王雪,陈敏,等.丛枝菌根真菌对丹参木质部结构及防御相关基因的影响[J].中国农学通报,2017,33(4):98-104.
[49] Culver J N,Lindbeck A G C,Dawson W O.Virus-Host Interactions:Induction of Chlorotic and Necrotic Responses in Plants by Tobamoviruses[J].Annual Review of Phytopathology,1991,29(4):193-217.
[50] 沈喜,李红玉,文雅,等.白粉病菌侵染对黄瓜叶片光合电子传递及其PSⅡ功能蛋白D1表达的影响[J].植物病理学报,2003,33(6):546-549.
