治疗前中性粒细胞与淋巴细胞比值对食管鳞癌患者放疗预后的价值
2018-05-22周鹏飞姚晓军李丽娜祁联芬蒋成明邓运冰王鑫和张洪伟
周鹏飞,姚晓军,李丽娜,李 密,董 娟,祁联芬,蒋成明,邓运冰,王鑫和,张洪伟
食管癌是我国常见恶性肿瘤之一,在我国的发病率和死亡率分别居第五位和第四位[1,2]。我国食管癌的病理类型以鳞癌为主,西方国家则以腺癌为主。多数患者诊断时往往由于局部分期较晚、基础疾病较多或已经发生远处转移等,失去了手术治疗的机会。对于局部晚期食管癌而言,放疗是主要的治疗手段。当前放疗对于食管癌患者生存的改善尚无有效的预测手段。最近的研究表明,全身炎症的存在与各种类型癌症的存活率低有关。中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)在肺癌[3]、宫颈癌[4]和胃癌[5]等多种肿瘤的治疗预后中的预测价值已经得到证实,但在食管癌,尤其是食管鳞癌的放疗中的研究极少。本研究回顾性分析了125例局部晚期食管鳞癌患者的临床资料,探讨治疗前NLR对食管鳞癌放疗患者预后中的预测价值。
1 材料与方法
1.1 临床资料 回顾性分析从2011年3月至2014年3月在我院胸部肿瘤科收治的125例初治行根治性放疗的局部晚期食管鳞癌患者,经根治性放疗后随访3年或随访至死亡的患者的临床病理资料。临床分期标准参照2009年第五届全国食管癌放疗研讨会通过的“非手术治疗食管癌的临床分期标准(草案)”进行。
1.1.1 纳入标准:(1)年龄18-85岁,性别不限;(2)卡氏评分>70分;(3)组织学活检确诊为食管鳞癌;(4)无远处转移;(5)预计生存期>3个月;(6)无放疗禁忌。排除标准:(1)“非手术治疗食管癌临床分期”中T1-2的病例;(2)未完成放疗前基线检查;(3)未完成根治性放疗;(4)入院时合并全身感染;(5)其他可能导致患者无法完成根治性放疗的疾病或因素;(6)治疗后30天内出现急性严重并发症或死亡;(7)接受新辅助化疗。
研究共入组患者总数125例,其中男102例,女23例;胸上段癌20例,胸中段癌67例,胸下段癌38例。KPS评分70-90分。所有患者均为经食管内镜活检,病理诊断的食管鳞癌,放疗前均行体格检查了解全身情况以及血常规、肝肾功、食管吞钡造影、胸腹部增强CT、头颅MRI/CT、腹部及锁骨上超声等检查。所有患者均进行根治性放疗。其中,43例患者接受同步化疗,25例患者接受序贯化疗(化疗方案为含氟尿嘧啶或铂为基础的单药或联合方案)。
1.1.2 放疗方法 所有患者均采用直线加速器6MV高能X线放疗。食管病灶及累计淋巴结区放疗剂量为60-66Gy,对各段食管相应的淋巴结引流区放疗剂量为50Gy。常规放疗1.8-2Gy/次,1次/d,5d/周,45-50Gy时缩野。放疗控制肺V20≤30%,V30≤20%;心脏V40≤30-40%;脊髓最大剂量<45Gy。
1.2 随访情况 治疗结束后开始随访,1年内3个月随访一次,1年后半年随访一次。主要以门诊及电话等方式随访。随访内容包括进食情况、食管内镜、胸腹部CT、超声检查等。以病理确诊为开始日期,终点为患者死亡日期。随访时间截止至2017年3月。全组患者3年总生存率为32.6%。
1.3 放疗前NLR的计算及界值 收集患者放疗前1周内抽取的外周静脉血送检,根据血常规检查结果记录外周血中性粒细胞与淋巴细胞绝对值,并计算NLR值。参照以往的研究将3作为NLR的临界值[6],将患者分为高NLR组(≥3)和低NLR组(<3)进行分析。
1.4 统计学方法 采用SPSS17.0软件进行统计分析。计数资料采用χ2检验,单因素分析采用Kaplan-Meier法计算总生存率,组间比较采用log rank检验。多因素分析采用Cox比例风险回归模型。P<0.05为差异有统计学意义。
2 结 果
2.1 放疗前NLR与食管鳞癌患者的临床病理特征的关系 患者的临床病例特征见表1。125例食管鳞癌患者中,男性102例(81.6%),女性23例(18.4%);中位年龄为64岁(范围:47~82岁)。以3为NLR截点,将患者分为高NLR组(≥3)和低NLR组(<3)。根据数据资料得到,90例(72%)患者被纳入低NLR组,35例(28%)被纳入高NLR组。如表1所示,低NLR组与高NLR组之间的年龄、肿瘤分期、吸烟史、肿瘤部位、合并化疗情况的差异均无统计学意义(P值均>0.05);而性别、饮酒史和肿瘤分化程度的差异有统计学意义(P值均<0.05)。
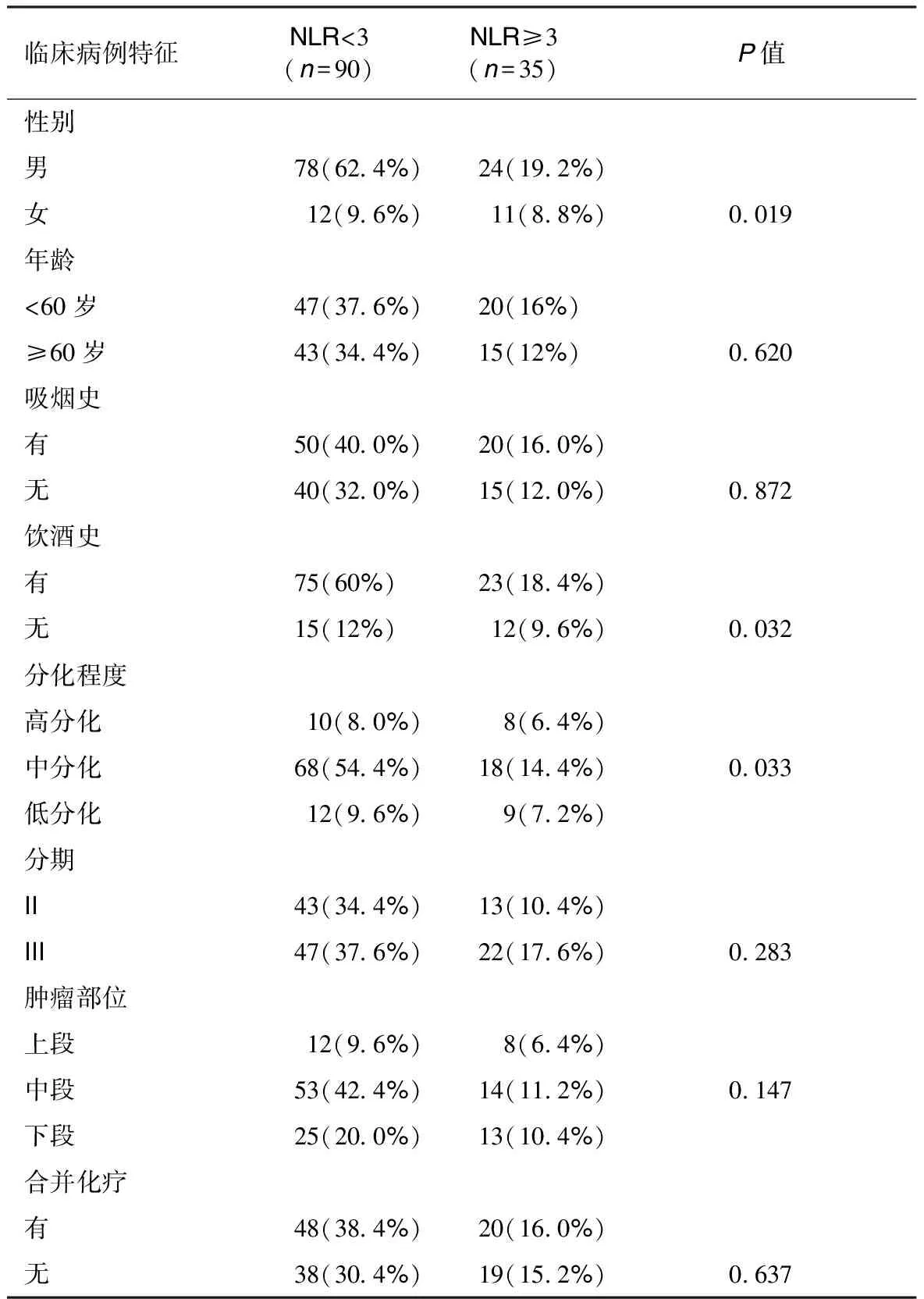
表1 高NLR组和低NLR组食管鳞癌患者的临床病理特征
2.2 治疗前NLR和其他临床病例因素预后意义的单因素分析全组患者3年生存率为32.6%,其中高NLR组患者3年生存率为31.7%,低NLR组患者为34.8%,Kaplan-Meier生存分析显示差异有统计学意义(P=0.012)。见图1。单因素分析结果显示(见表2):吸烟史、临床分期、合并化疗和NLR是决定患者预后的影响因素(均P<0.05),而性别、年龄、饮酒史、分化程度和肿瘤部位对预后无显著性影响(均P>0.05)。
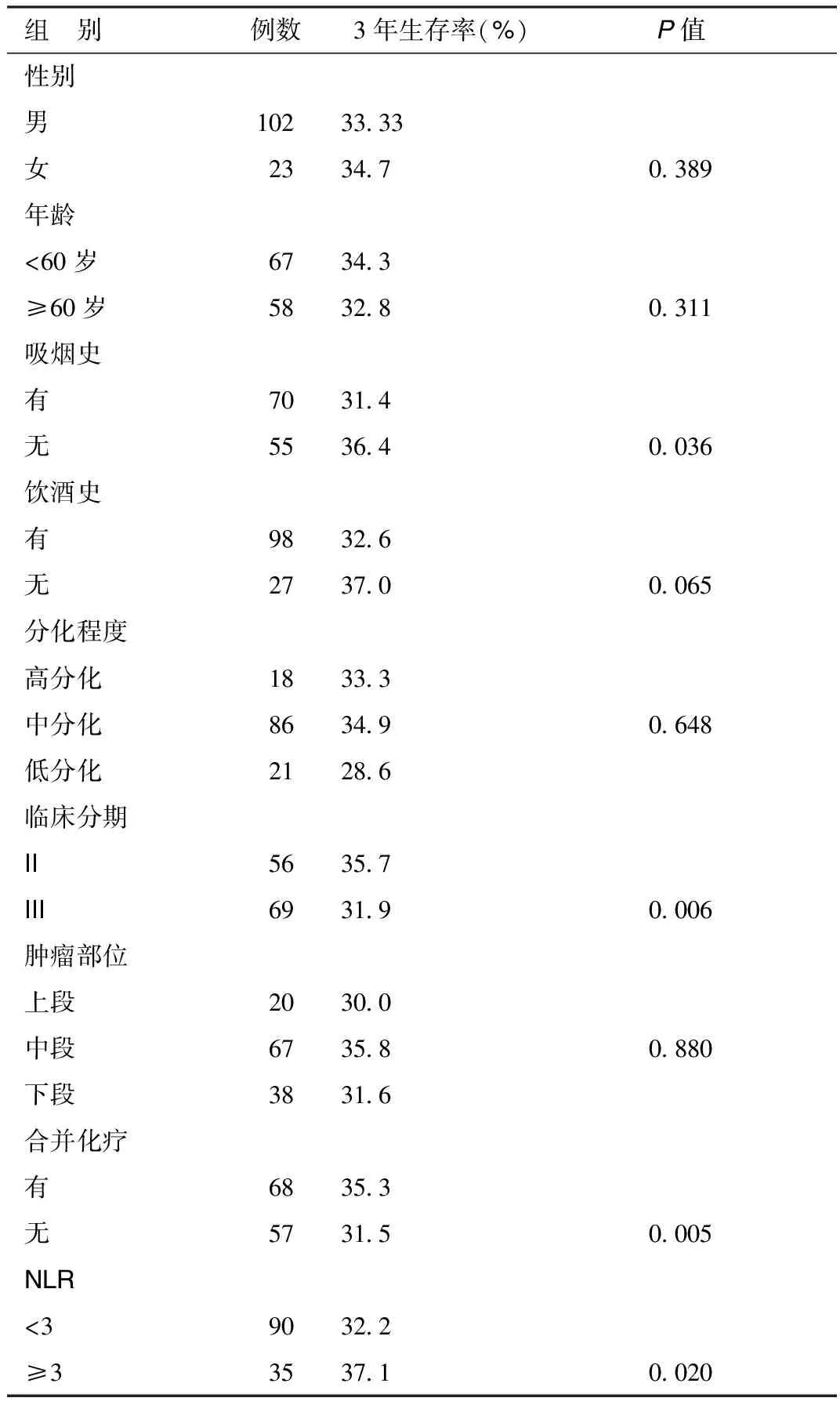
表2 食管鳞癌放疗患者预后影响因素的单因素分析结果
2.3 食管鳞癌放疗患者预后影响因素的多因素分析 将单因素分析结果有统计学意义的因素吸烟史、临床分期、合并化疗和NLR纳入多因素分析,结果如表3。Cox多因素分析结果显示合并化疗、临床分期和NLR仍是影响食管鳞癌放疗患者的独立预后因素(均P<0.05),而吸烟史不能作为预后的独立预测因素(P=0.35)。

表3 食管鳞癌放疗患者预后影响因素的多因素回归分析
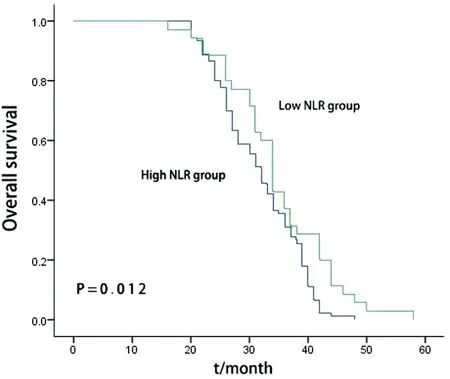
图1 治疗前高和低NLR组食管鳞癌放疗患者的总生存曲线
3 讨 论
近年来,随着人们对肿瘤发生和发展规律认识的不断深入,越来越多的证据表明,全身炎性反应与恶性肿瘤的进展、侵袭及转移相关[7,8]。淋巴细胞是宿主免疫的关键组成部分,该细胞的减少导致肿瘤免疫功能障碍[9,10]。嗜中性粒细胞增多可能为肿瘤细胞的发育和发展建立了充分的环境。外周中性粒细胞已被证明含有和分泌血管内皮生长因子、IL-18和基质金属蛋白酶[11,12],其有助于肿瘤相关的血管发生、肿瘤生长和转移。由于免疫功能取决于全身性炎症,因此在炎症反应高的患者中可以抑制识别肿瘤细胞的细胞毒性T淋巴细胞的抗肿瘤活性[13]。所以,淋巴细胞的减少和中性粒细胞的增多都会促进肿瘤的发展,从而影响患者的预后。
临床用来判断食管鳞癌患者预后的临床病理因素主要包括原发肿瘤浸润深度、长度、淋巴结转移状态、肿瘤分化程度及手术后病人术后TNM分期等,其中淋巴结转移状态是影响预后的最主要因素,在术后患者中,上述因素更容易体现。然而,对于非手术治疗晚期食管鳞癌的患者,预后因素并不明确。本研究发现吸烟史、临床分期和合并化疗是影响晚期食管鳞癌放疗患者预后的因素。生活方式特别是吸烟,是众所周知的食管癌危险因素。然而,吸烟对食管癌生存的影响知之甚少,在过去几十年中,大多数研究一直侧重于吸烟与癌症发病率之间的关系[14,15]。最近,Wang等[16]和Yaegashi等[17]的研究报道了有吸烟史的食管癌患者的预后相比无吸烟史的更差。然而,我们的研究结果显示吸烟并不是晚期食管鳞癌放疗患者预后的独立预测因素。因此,关于吸烟与食管鳞癌预后的关系,还需更大、设计更好的研究来证实。韩春等研究报道了225例非手术治疗食管癌放疗患者的临床分期对于预后的评价意义[18],同样我们的研究结果也证实了临床分期的预后价值。另外,周宓等[19]研究了68例晚期食管癌放疗患者发现合并化疗的患者生存有改善,与本研究的结果一致。以上结果显示,临床分期和合并化疗都是晚期食管癌放疗患者预后的有效预测因素。因此,临床上可以根据这些预后因素,对患者选择合适的治疗方案,以提高晚期食管癌放疗患者的预后。
NLR可以反映恶性肿瘤的炎性反应与人体抗肿瘤免疫之间的平衡状态,已被证实与多种实体肿瘤患者的预后相关,也有研究报道NLR在食管癌患者中的预后价值[20,21],但目前很少有研究探讨NLR对局部晚期食管鳞癌放疗患者预后评估中的价值。本研究发现治疗前高NLR组患者与较差的预后相关,并且NLR可以作为局部晚期食管鳞癌放疗患者预后的独立预测指标。Sato等[13]研究的260例行放化疗的日本晚期食管癌患者和Yoo等[22]研究的138例亚洲局部晚期食管癌患者都发现NLR是预后的有效指标,与本研究结果一致。我们的研究都揭示了NLR可以作为晚期食管鳞癌患者有效的预后指标,鉴于其测量的方便性与可及性,将对患者的风险分层有极大的帮助,进而有助于临床上选择个体化的治疗方案以改善预后。因此,具有低风险的患者(低NLR),尤其是伴老年或其他体质较差等因素,可尽可能的避免多种治疗模式如合并化疗等带给机体带来的不良影响。
本研究还发现,治疗前NLR与晚期食管鳞癌患者的肿瘤恶性分化程度相关。这可能是因为分化程度差的患者肿瘤细胞对宿主的侵犯能力更强,导致淋巴细胞数目相对减少。同时可能是由于副肿瘤综合症导致粒系集落刺激因子等造血因子的异常升高,从而使外周血中肿瘤相关中性粒细胞增加[3]。苏子剑等研究了345例食管癌患者也显示术前NLR与肿瘤分化程度相关[23],与本研究的结果一致。然而,Chen等人研究475例食管癌患者的临床资料,发现术前NLR与肿瘤分化程度没有相关性[24]。造成我们结果差异的主要原因可能是由于本研究的群体是非手术的食管鳞癌放疗患者,其通过食管镜取得的活检组织标本有限,对于判断肿瘤的分化程度可能存在一定的影响。另外,鉴于以往关于这类的研究甚少,而且研究的人群队列有限,NLR与肿瘤分化程度的关系尚不明确,因此仍需要规模更大和设计更好的研究来进一步验证本研究的结论。
在以往的研究中,对NLR界值的定义变异很大,也有不同的关于NLR界值选取的方法,包括中位值、受试者工作特征曲线法等。最近苏子剑等[23]研究了345例中国食管癌手术患者显示术前高NLR(NLR≥2.21)可以作为预后的独立危险因素,术前NLR较高的患者总生存率和无病生存率均较低。Sato等[13]研究了260例行放化疗的日本晚期食管癌患者发现NLR是预后的有效指标可以作为复发和死亡的独立预后指标。然而,Rashid等对294例英国食管癌手术患者的研究以3.5为NLR截点显示术前NLR对预后无有效的预测价值[25]。造成上述研究结果差异的原因可能有研究地域和人群本身存在的特异性、NLR截点选择不同、患者治疗方式不同以及样本量的限制。因此NLR与食管癌预后的关系仍未十分明确,以后需要更大且多中心的样本量和更优化的方法来确定NLR的截点值,以实现其在临床工作中的使用价值。本研究将3定为NLR的临界值将患者分组为高和低NLR组,这个截点是根据已有的大多数关于食管癌患者的研究确定的[6,13,26-27]。由于其使用的普遍性,可以排除因患者本身的特异性或研究设计的不足所带来的偏倚,使得我们的研究结果更具有实用性和可靠性。
本研究也存在一些不足。首先,虽然本研究最大限度地避免了接受新辅助化疗等影响生存的混杂因素,但这是一项单中心、小样本的回顾性研究,已知这种设计倾向于某种程度的选择偏倚。另外,本研究中的患者是非手术且行根治性放化疗的患者,难以获得完整的病理资料。本研究中的临床分期,尽管是经EUS、增强CT或PET-CT明确,但是与术后病理学分期不能完全等同[28]。因此,在这种方法可以应用于常规临床研究之前,需要开展多中心、大样本的前瞻性研究进一步验证本研究的结论。
总之,本研究结果显示,治疗前NLR可作为晚期食管鳞癌放疗患者的独立预后因素。相对于其他肿瘤标志物,NLR作为简单、方便和经济的疗前预测指标,以识别可能存在高风险的患者,在临床实践过程中,可以帮助更好的评估食管鳞癌放疗患者的预后,对于非手术食管鳞癌患者的治疗风险管控具有一定的预测价值。
【参考文献】
[1] 陈万青, 郑荣寿, 张思维, 等. 2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2016, 0(1): 1-8.
[2] 张思维, 张敏, 李光琳, 等. 2003-2007年中国食管癌发病与死亡分析[J].中国肿瘤,2012, 21(4): 241-247.
[3]TOMITAM,SHIMIZUT,AYABET,etal.PreoperativeNeutrophiltoLymphocyteRatioasaPrognosticPredictorafterCurativeResectionforNon-smallCellLungCancer[J].AnticancerResearch, 2011, 31(9):2995-2998.
[4]WUJ,CHENM,LIANGC,etal.Prognosticvalueofthepretreatmentneutrophil-to-lymphocyteratioincervicalcancer:ameta-analysisandsystematicreview[J].Oncotarget, 2017, 8(8).
[5]GUNALDIM,GOKSUS,ERDEMD,etal.Prognosticimpactofplatelet/lymphocyteandneutrophil/lymphocyteratiosinpatientswithgastriccancer:amulticenterstudy[J].InternationalJournalofClinical&ExperimentalMedicine, 2015, 8(4):5937.
[6]ARIGAMIT,OKUMURAH,MATSUMOTOM,etal.AnalysisoftheFibrinogenandNeutrophil-LymphocyteRatioinEsophagealSquamousCellCarcinoma:APromisingBloodMarkerofTumorProgressionandPrognosis[J].Medicine, 2015, 94(42):e1702.
[7]ROXBURGHCSD,MCMILLANDC.ROXBURGHCS,MCMILLANDC.Roleofsystemicinflammatoryresponseinpredictingsurvivalwithprimaryoperablecancer[J].FutureOncol, 2010, 6(1):149-163.
[8]ARGILéSJM,BUSQUETSS,TOLEDOM,etal.Theroleofcytokinesincancercachexia[J].CurrOpinSupportPalliatCare, 2009,3(4):263-268.
[9]WATANABER,TOMITAN,ITABASHIM,etal.Peripheralbloodabsolutelymphocyte/monocyteratioasausefulprognosticfactorindiffuselargeB-celllymphomaintherituximabera[J].EuropeanJournalofHaematology, 2014, 92(3):204-210.
[10]TAVARESMURTABM,MENDONAMA,DUARTENL,etal.Systemicleukocytealterationsareassociatedwithinvasiveuterinecervicalcancer[J].InternationalJournalofGynecologicalCancer, 2010, 20(7):1154-1159.
[11]JABLONSKAE,PUZEWSKAW,GRABOWSKAZ,etal.VEGF,IL-18andNOproductionbyneutrophilsandtheirserumlevelsinpatientswithoralcavitycancer[J].Cytokine, 2005,30(3): 93-99.
[12]ARDIVC,KUPRIYANOVATA,DERYUGINAEI,etal.HumanNeutrophilsUniquelyReleaseTIMP-FreeMMP-9toProvideaPotentCatalyticStimulatorofAngiogenesis[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2007, 104(51):20262-20267.
[13]SATOY,GONDAK,HARADAM,etal.Increasedneutrophil-to-lymphocyteratioisanovelmarkerfornutrition,inflammationandchemotherapyoutcomeinpatientswithlocallyadvancedandmetastaticesophagealsquamouscellcarcinoma[J].BiomedicalReports, 2017, 7(1):79.
[14]RAMUSJR,GATENBYPA,CAYGILLCP,etal.TherelationshipbetweensmokingandseveredysplasticdiseaseinpatientswithBarrett'scolumnar-linedoesophagus[J].EurJCancerPrev,2012 , 21(6):507-510.
[15]COLEMANHG,BHATS,JOHNSTONBT,etal.Tobaccosmokingincreasestheriskofhigh-gradedysplasiaandcanceramongpatientswithBarrett'sesophagus[J].Gastroenterology, 2012, 142(2):233-240.
[16]WANGN,TANB,CAOF,etal.Prognosticinfluenceofsmokingonesophagealsquamouscellcarcinoma.[J].IntJClinExpMed, 2014, 8(10):18867-18872.
[17]YAEGASHIY,ONODAT,MORIOKAS,etal.JointeffectsofsmokingandalcoholdrinkingonesophagealcancermortalityinJapanesemen:findingsfromtheJapancollaborativecohortstudy[J].AsianPacJCancerPrev, 2014, 15(2):1023-1029.
[18] 韩春, 王澜, 祝淑钗, 等. 非手术治疗食管癌临床分期标准对225例放疗患者的预后评价[J].中华放射肿瘤学杂志,2011, 20(2): 109-112.
[19] 周宓, 孙婷婷, 王宗站, 等. 调强放疗联合TP方案化疗对晚期食管癌的疗效研究[J].现代医学,2015(05): 571-574.
[20]YUTONGH,XIAOLIX,SHUMEIL,etal.IncreasedNeutrophil-LymphocyteRatioIsaPoorPrognosticFactorinPatientswithEsophagealCancerinaHighIncidenceAreainChina[J].ArchivesofMedicalResearch, 2015, 46(7):557-563.
[21]GAOGD,SUNB,WANGXB,etal.Neutrophiltolymphocyteratioasprognosticindicatorforpatientswithesophagealsquamouscellcancer.[J].InternationalJournalofBiologicalMarkers, 2017, 32(4).
[22]YOOEJ,PARKJC,KIMEH,etal.Prognosticvalueofneutrophil-to-lymphocyteratioinpatientstreatedwithconcurrentchemoradiotherapyforlocallyadvancedoesophagealcancer[J].Digestive&LiverDisease, 2014, 46(9):846-853.
[23] 苏子剑,潘群雄,王聪仁,等. 术前中性粒细胞/淋巴细胞比值预测食管癌患者预后的价值[J].肿瘤,2015(11): 1258-1264.
[24] 陈恒琦,赫捷. 术前外周血中性粒细胞与淋巴细胞比值在食管鳞状细胞癌预后评估中的价值[J].中华肿瘤杂志,2014,36(04):294-297.
[25]RASHIDF,WARAICHN,BHATTII,etal.Apre-operativeelevatedneutrophil:lymphocyteratiodoesnotpredictsurvivalfromoesophagealcancerresection[J].WorldJournalofSurgicalOncology, 2010, 8(1):1.
[26]KIJIMAT,ARIGAMIT,UCHIKADOY,etal.CombinedFibrinogenandNeutrophil-LymphocyteRatioasaPrognosticMarkerofAdvancedEsophagealSquamousCellCarcinoma[J].CancerScience, 2017, 108(2):193-199.
[27]GRENADERT,WADDELLC,PECKITTJ,etal.Prognosticvalueofneutrophil-to-lymphocyteratioinadvancedoesophago-gastriccancer:exploratoryanalysisoftheREAL-2trial[J].AnnalsofOncology, 2016,27(4): 687-692.
[28] 刘雪梅, 李明焕, 孔莉, 等. 外周血中性粒细胞与淋巴细胞比值对根治性放化疗食管鳞癌患者预后预测价值[J].中华肿瘤防治杂志,2016(21): 1431-1436.
