中药复方多糖对鸡淋巴细胞IL-6、TNF-α和NF-κB含量的影响
2018-05-21朱晓庆商云霞谷新利杨红洋
郭 晓,朱晓庆,商云霞,谷新利,杨红洋
(石河子大学动物科技学院,新疆石河子 832003)
中药作为中国传统药物,以其毒副作用较小、残留低等优势作为提高动物免疫力的免疫增强剂,被广泛研究并运用到畜禽生产中,以有效增强畜禽机体抵抗病原的能力。中药有效成分中的多糖是起免疫增强作用的主要成分之一,从1936年Shear发现多糖具有抗肿瘤活性后,人们就已经开始关注多糖对免疫系统的调节作用[1]。近年来,人们对多糖发挥免疫调节作用的研究已不再停留在测定几个免疫指标的变化上,而是深入到细胞、分子、基因等多种水平。随着Toll样受体/核因子-κB(TLRs/NF-κB)信号通路及其生物学功能的发现,学者们发现细胞表面存在多种多糖受体(如TLR2、TLR4、CR3等),多糖能与这些受体结合,激活细胞内信号传导,促进免疫细胞分化增殖,诱导细胞因子的释放,从而发挥免疫调节作用[2-3]。与此同时,鸡主要组织相容性复合体B-Lβ基因第2外显子(major histocompatibility complex B-LβⅡ,MHC B-LβⅡ)具有丰富的多态性,它使不同个体对相同抗原表现出不同的免疫反应,从而导致机体免疫功能存在个体差异。本研究采用PCR-SSCP方法对试验鸡进行MHC B-LβⅡ基因分型后,以不同MHC B-LβⅡ基因型鸡外周血淋巴细胞为研究对象,观察用TLR2抗体处理的鸡淋巴细胞中IL-6、TNF-α、NF-κB质量浓度的变化,初步探讨中药复方多糖(traditional Chinese medicine compound polysaccharides, cCHMPS)发挥免疫调节作用的受体。
1 材料与方法
1.1 材料
1.1.1 试验用药物 中药复方由当归、党参、熟地、川芎、山楂、何首乌、淫羊藿、麦冬、茯苓、补骨脂和黄芪11味中药组成,各单味药均购自石河子市医药公司。中药复方经水提-醇沉法提取得到粗中药复方多糖(cCHMPS)后,用AB-8大孔吸附树脂吸附解吸附获得一定纯度的cCHMPS,其多糖含量为77.10%。用不含血清的RPMI-1640培养液将其配制成200 μg/mL的中药复方多糖母液,经0.22 μm微孔滤膜滤过后4℃储存备用。
1.1.2 试验用动物及分组 黄麻肉鸡购自石河子市孵化场,临床检查健康,根据MHC B-LβⅡ基因第2外显子PCR-SSCP的检测结果分组,再将每种基因型鸡分成高浓度(2 μg/mL),中浓度(1 μg/mL),低浓度(0.5 μg/mL)TLR2抗体组和空白对照组。
1.1.3 主要试剂及仪器 血液基因组DNA提取试剂盒,天根生化科技(北京)有限公司产品;PCR Mixture,宝生物工程(大连)有限公司产品;鸡淋巴细胞分离液 ,天津市灏洋生物制品科技有限责任公司 产品;胎牛血清和RPMI-1640培养基,GIBCO公司产品;Hank's液,北京博奥拓科技有限公司产品;TLR2抗体,北京博奥森生物技术有限公司产品;鸡IL-6、TNF-α、NF-κB ELISA检测试剂盒,上海蓝基生物科技有限公司产品;二甲基偶氮唑蓝 (MTT),Sigma公司产品;其他试剂均为国产分析纯;酶标仪(美国热电FC型号),垂直离心机,微量移液器,恒温培养箱,倒置相差显微镜等。
1.2 方法
1.2.1 MHC B-LβⅡ基因分型 采集黄麻肉鸡外周血,按照DNA提取试剂盒说明书提取鸡全血DNA;参照GenBank收录的鸡MHC B-Lβ Ⅱ基因序列(NC-006103.2)第2外显子信息,由上海生工生物工程技术服务有限公司完成引物设计和合成,经PCR扩增得到目的条带大小为308 bp的PCR产物;用3 μL PCR产物和8 μL上样缓冲液(980 mL/L甲酰胺,0.25 g/L溴酚蓝,0.25 g/L二甲苯青,10 mmol EDTA)混匀后98 ℃水浴变性10 min,立即冰浴10 min;样品在80 g/L非变性聚丙烯酰氨凝胶中电泳后银染,用聚焦成像系统观察结果并照相。
1.2.2 鸡外周血淋巴细胞的分离与培养 采集不同MHC B-Lβ Ⅱ基因型鸡外周血2 mL,加入等体积Hank's液稀释、摇匀,将其沿离心管壁缓缓加到4 mL淋巴细胞分离液上层,20 ℃、2 500 r/min离心30 min,用移液枪吸取离心管中的白色云雾状细胞层。用无血清RPMI-1640培养液洗涤上述分离得到的细胞液2次,2 500 r/min离心10 min,将淋巴细胞液重悬于2 mL含150 mL/L胎牛血清的完全RPMI-1640培养液中,置于41.5℃、体积分数为5% CO2恒温培养箱中培养2 h后,用PBS缓冲液洗涤细胞两次,1 500 r/min离心10 min,收集淋巴细胞,用含血清的RPMI-1640培养液重悬淋巴细胞,经台盼蓝染色,细胞存活率>95%即可进行下一步试验。
1.2.3 不同浓度cCHMPS对TLR2抗体阻断的鸡外周血淋巴细胞分泌IL-6、TNF-α、NF-κB质量浓度的测定 用含血清的RPMI-1640培养液将分离得到的淋巴细胞稀释成约5×106个/mL的细胞悬液。取24孔培养板,向各孔中分别加入终浓度2、1、0.5 μg/mL的TLR2抗体共培养1 h后,加入终浓度200、100、50、25 μg/mL 的cCHMPS在41.5℃、体积分数为5% CO2培养箱中培养24 h。取细胞上清液,按 ELISA检测试剂盒说明测定IL-6、TNF-α、NF-κB的质量浓度。
1.2.4 数据统计分析 数据结果均以“平均数±标准差”表示。采用SPSS19.0对试验数据作单因素方差分析。统计分析结果以P<0.05作为差异显著性的判断标准。
2 结果
2.1 MHC B-LβⅡ基因型检测
采用PCR-SSCP方法进行MHC B-Lβ Ⅱ基因型检测,发现有5种基因型,即AA基因型、AB基因型、BB基因型、AC基因型及AD基因型。
2.2 cCHMPS对TLR2抗体阻断的不同MHC B-LβⅡ基因型鸡外周血淋巴细胞分泌IL-6的影响
在AA基因型组中,cCHMPS为25、50、100 μg/mL时,高、中、低浓度TLR2抗体组淋巴细胞中IL-6的质量浓度显著低于空白对照组(P<0.05),cCHMPS为200 μg/mL时,高浓度TLR2抗体组的IL-6质量浓度显著低于空白对照组(P<0.05)。在AB、BB基因型组中,cCHMPS为25、50、100、200 μg/mL时,高、中、低浓度TLR2抗体组的IL-6质量浓度显著低于空白对照组(P<0.05)。在AC、AD基因型组中,cCHMPS为25、50、100 μg/mL时,高、中、低浓度TLR2抗体组的IL-6质量浓度显著低于空白对照组(P<0.05),cCHMPS为200 μg/mL时,高、中浓度TLR2抗体组的IL-6质量浓度显著低于空白对照组(P<0.05)(表1)。
2.3 cCHMPS对TLR2抗体阻断的不同MHC B-LβⅡ基因型鸡外周血淋巴细胞分泌TNF-α的影响
在AA基因型组中,cCHMPS为25 μg/mL和50 μg/mL时,中,低浓度TLR2抗体组淋巴细胞中TNF-α的质量浓度显著低于空白对照组(P<0.05),cCHMPS为100 μg/mL和200 μg/mL时,高浓度TLR2抗体组的TNF-α质量浓度显著低于空白对照组(P<0.05)。在AB基因型组中,cCHMPS为25、50、200 μg/mL时,中,低浓度TLR2抗体组的TNF-α质量浓度显著低于空白对照组(P<0.05),cCHMPS为100 μg/mL时,高浓度TLR2抗体组的TNF-α质量浓度显著低于空白对照组(P<0.05)。在BB基因型组中,cCHMPS为25 μg/mL时,高浓度TLR2抗体组的TNF-α质量浓度显著低于空白对照组(P<0.05),cCHMPS为100 μg/mL时,高、中浓度TLR2抗体组的TNF-α质量浓度显著低于空白对照组(P<0.05)。在AD基因型组中,cCHMPS为25、50、100、200 μg/mL时,高、中、浓度TLR2抗体组的TNF-α质量浓度显著低于空白对照组(P<0.05)(表2)。

表1 不同MHC B-LβⅡ基因型鸡淋巴细胞培养上清液中IL-6的质量浓度
注:同一基因型组中,同列数据中肩标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。
Notes:In the same genotype and same column,data with the same letters indicate no significant difference (P>0.05),and with different letters indicate significant difference (P<0.05).
2.4 cCHMPS对TLR2抗体阻断的不同MHC B-LβⅡ基因型鸡外周血淋巴细胞分泌NF-κB的影响
在AA、AB、BB、AC和AD基因型组中,cCHMPS为25 、50、100、200 μg/mL时,高、中、低浓度TLR2抗体组的NF-κB质量浓度均显著低于空白对照组(P<0.05)(表3)。
3 讨论
Toll样受体(Toll-like recepto rs,TLRs)是近年来备受关注的一种模式识别受体(pattern recognition receptor,PRR),主要在免疫效应细胞如巨噬细胞、树突状细胞(dendritic cells,DC)和B细胞中表达,能够识别病原相关分子模式(pathogen associated molecular patterns,PAMP),从而启动天然和获得性免疫应答[4],是家畜天然免疫相关分子家族中的重要组成部分[5]。TLR2是Toll样受体家族的主要成员之一[6],也是Toll样受体家族中识别最多不同PAMP的成员之一,是癌症、败血病、自身免疫疾病等多种疾病的新靶点[7]。TLRs广泛分布于各种组织中,并具有细胞特异性。Iqpal M等[8]研究了鸡TLRs在机体不同组织和细胞中的表达情况,发现鸡TLR2的表达谱相对较窄,主要于脾脏、盲肠扁桃体法氏囊等执行免疫功能的相关组织中,在B细胞、CD4+、CD8+等免疫细胞中均有中度表达。本研究将TLR2抗体加入到鸡外周血淋巴细胞培养液中共培养1 h后,加入不同浓度的一定纯度中药复方多糖后发现,与无抗体的细胞培养液相比,TLR2抗体在不同程度上抑制了淋巴细胞分泌IL-6、TNF-α和NF-κB,这提示TLR2可能是中药复方多糖参与免疫调节作用的受体之一。
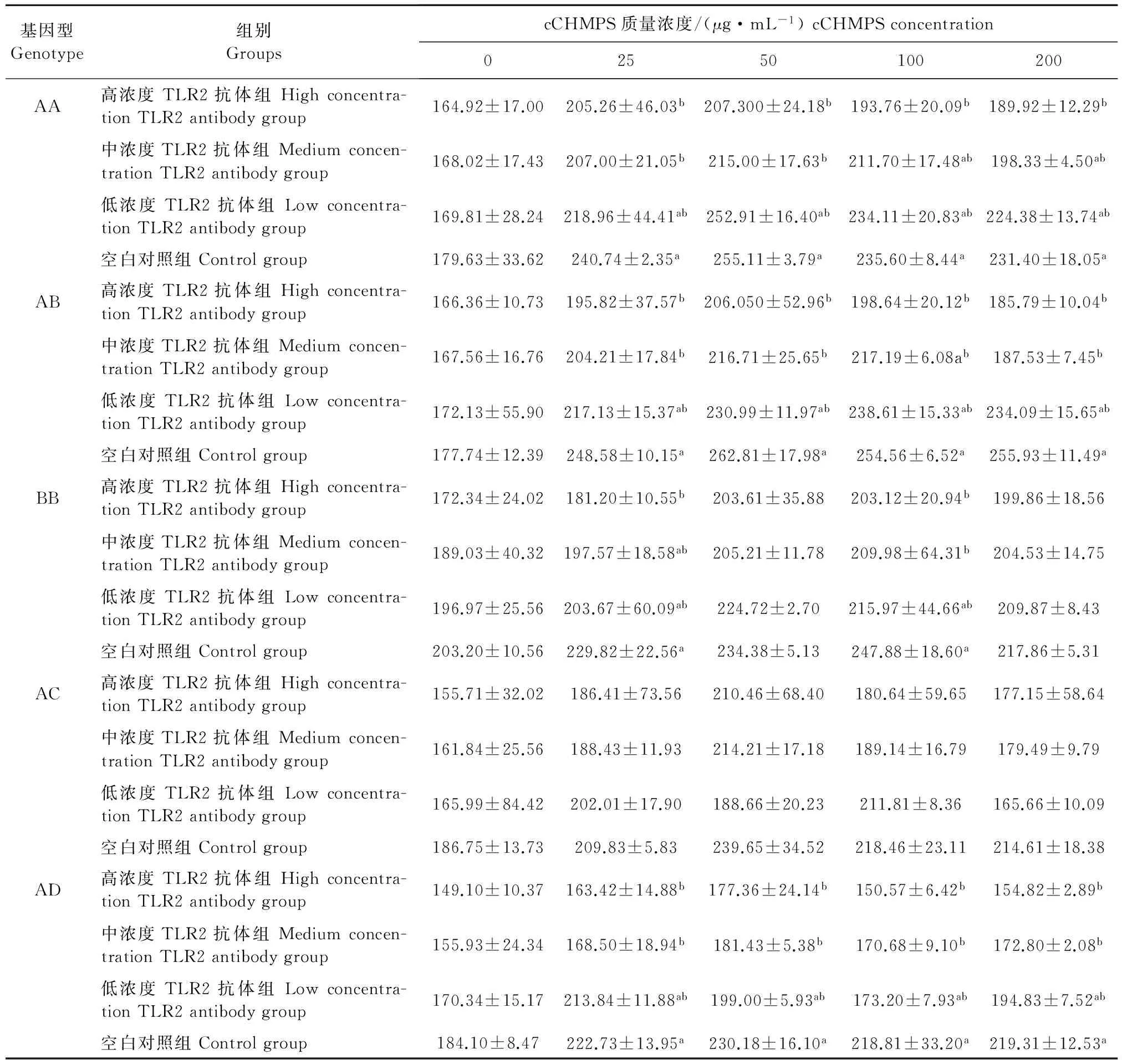
表2 不同MHC B-LβⅡ基因型鸡淋巴细胞培养上清液中TNF-α的质量浓度
注:同一基因型组中,同列数据中肩标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。
Notes:In the same genotype and same column,data with the same letters indicate no significant difference (P>0.05),and with different letters indicate significant difference (P<0.05).
NF-κB 作为一种重要的转录激活因子,能调节许多与免疫功能和炎症相关的基因,与免疫反应、炎症反应、病毒感染等多种生理病理过程均有关联。有研究表明中药多糖能够通过活化TLR2/NF-κB信号转导通路中的信号分子,诱导免疫信号的发生[9-10]。其机制可能是多糖与相应受体结合后,TLR2被活化,激活受体相关激酶,从而活化NF-κB,导致后续细胞因子如IL-6和TNF-α的转录与翻译,引发机体发生免疫反应[11]。IL-6由多种细胞合成,能够促进B细胞的增殖分化并产生抗体,刺激T细胞生成。在体外试验中发现IL-6可促进T细胞增殖,增强T细胞、单核巨噬细胞、自然杀伤性细胞等细胞活性,与机体免疫密切相关。TNF-α是一种生物学活性比较广泛的细胞因子,它能够抑制或直接杀死肿瘤细胞,并具有一定的促进细胞分化和增殖的作用[12]。武剑[13]的研究表明BPS多糖能促进巨噬细胞分泌IL-6的水平,LPS能显著提高巨噬细胞IL-6和TNF-α分泌量。本次研究中,在含有TLR2抗体的鸡外周血淋巴细胞培养液中加入cCHMPS后,cCHMPS对淋巴细胞分泌IL-6、TNF-α和NF-κB的促进作用受到抑制,且随着抗体浓度的增加,其抑制作用显著增强。
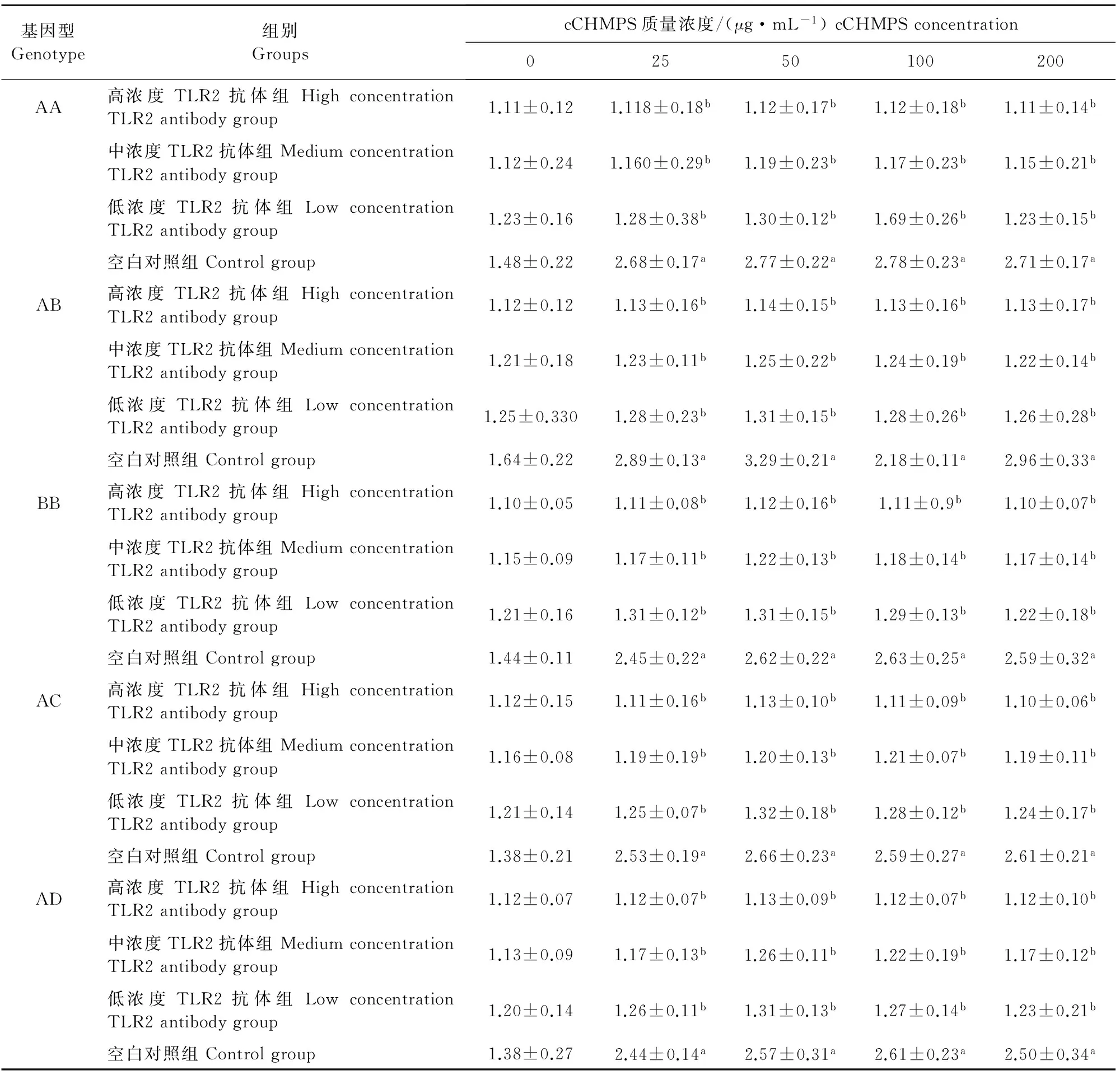
表3 不同MHC B-LβⅡ基因型鸡淋巴细胞培养上清液中NF-κB的质量浓度
注:同一基因型组中,同列数据中肩标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。
Notes:In the same genotype and same column,data with the same letters indicate no significant difference (P>0.05),and with different letters indicate significant difference (P<0.05).
在本次试验中,cCHMPS组和高、中、低浓度TLR2抗体组中,不同MHC B-LβⅡ基因型鸡淋巴细胞培养上清液中IL-6、TNF-α和NF-κB的质量浓度不同,整体而言,AA和AB基因型的各项免疫指标高于其他基因型,其原因可能是多糖被MHCⅡ类分子处理并呈递给T细胞的TCR识别,由于MHC B-LβⅡ基因多态性的存在,影响了中药多糖与TCR受体的识别和结合,阻碍了TLR2的活化,进而导致不同MHC B-LβⅡ基因型鸡淋巴细胞分泌IL-6、TNF-α和活化NF-κB的水平不同。
以上结果说明,TLR2是中药复方多糖发挥免疫调节作用的受体之一,中药复方多糖通过与淋巴细胞表面TLR2结合,经TLR2/NF-κB信号通路活化转录因子NF-κB,调控细胞因子IL-6、TNF-α的合成,促进IL-6、TNF-α的分泌。
参考文献:
[1] 王增敏.多糖对畜禽免疫的调控作用及其机制[J].中国畜牧兽医,2010,37(10):221-223.
[2] 曾 爽,何小兵,陈国华,等.Toll样受体介导的信号转导通路及其调控分子的研究进展[J].中国兽医科学,2011,41(4):433-440.
[3] 王海坤,韩代书.Toll样受体(TLRs)的信号转导与免疫调节[J].生物化学与生物物理进展,2006,33(9):820-827.
[4] 赵守中,周宏超,杨鸣琦,等.大鼠感染大肠杆菌后脑组织TLR9的动态变化[J].西北农业学报,2010,19(5):39-42.
[5] 曾 爽,景志忠,杨孝朴.家畜Toll样受体的表达及在相关疾病发生中的作用[J].动物医学进展,2015,36(4):104-108.
[6] 李丽燕.Toll样受体的研究进展[J].临床医学工程,2011,18(3):467-469.
[7] 赫天一,王 泽,陆宇燕,等.Toll样受体2的研究进展[J].沈阳师范大学学报:自然科学版,2013,31(1):124-128.
[8] Iqbal M,Philbin V J,Smith A L,et al.Expression patterns of chicken Toll-like receptor mRNA in tissues,immune cell subsets and lines[J].Vet Immunol Immunopathol,2005,104(1-2):117-127.
[9] 江 澄,林胜友.中医药调控TLR及其信号通路与肿瘤治疗[J].浙江中西医结合杂志,2012,22(9):747-749.
[10] 李 祥,罗闳丹,石 青,等.小鼠侵袭性肺曲霉病发病过程中TLRs/NF-κB信号通路的激活[J].中国免疫学杂志,2010(10):881-884.
[11] 黄瑛,尹 晶,于秋爽,等.脂多糖对大鼠膀胱上皮细胞中Toll样受体4与核因子-κB表达的影响[J].新乡医院学报,2016,33(3):169-173.
[12] Zheng F,Gong F L,Li Z Y.et al.Mutation analysis of region-cytotoxicity relationship in human transmembrane tumor nec- rosis factor-alpha[J].J Clin Oncol,2002,1(1):38-41.
[13] 武 剑.柴胡多糖对巨噬细胞免疫功能的调节及对TLR4信号通路的影响[D].上海:复旦大学,2012.
