HRM法在意大利蜜蜂抗白垩病相关SNP位点C2587245T检测中的应用
2018-05-21许叔鹏聂红毅罗婷张明莲苏松坤
许叔鹏 聂红毅 罗婷 张明莲 苏松坤
(福建农林大学蜂学学院,福州 350002)
蜜蜂白垩病是一种常见的蜜蜂幼虫病,该病属于真菌性病害,由蜜蜂球囊菌感染幼虫引起。蜜蜂白垩病主要感染西方蜜蜂,蜂群染病会导致幼虫死亡,造成群势下降,影响蜂群的采集能力,造成减产[1,2]。西方蜜蜂是我国饲养的主要蜂种,国内绝大多数蜂产品都产自西方蜜蜂,所以白垩病对我国养蜂业而言是主要病害之一,作为第一个被全基因组测序的真菌性昆虫病原微生物,也可见蜜蜂白垩病相当受到重视[3]。
蜜蜂的卫生行为被普遍认为与抗病相关,具有卫生行为的蜂群有更强的抗病性,能缩短蜜蜂球囊菌在蜂群中存在的时间,减少传播机会,从而控制白垩病。一般通过选育具有卫生行为蜂群的蜂王来预防白垩病,但是对已产生孢子的虫尸的清理反而会加快病原在蜂群的传播[4],所以选育幼虫本身具有抗白垩病能力的蜂种会更有效地降低白垩病的危害。分子生物学的高速发展促使从分子水平研究蜜蜂的病害,包括通过筛选分子遗传标记来选育抗白垩病蜂种而降低白垩病的危害。Holloway等采用QTL技术对比经过病原接种筛选的易感病和抗病幼虫个体基因组区域,鉴定出蜜蜂幼虫11号染色体一个区域与蜜蜂幼虫抗白垩病性状显著相关[5,6],这给分子辅助选育提供了基础。晏励民等基于这项研究利用重测序技术筛选出位于编码区的与蜜蜂抗白垩病相关的SNP位点680个,有118个位于第11条染色体,52个位于第2条染色体[7]。刘元珍等基于该研究发现位于MRJP5上的C2587245T位点与蜜蜂幼虫抗白垩病性状显著相关,该位点为C/T多态性位点,碱基C的基因频率越高蜂群抗白垩病能力越强,利用这一发现可以方便的鉴别蜂群的抗白垩病能力[8]。
高分辨率熔解曲线(High Resolution Melting,HRM)是近年来兴起的一种单核苷酸多态性检测方法,具有高灵敏度、高特异性、高通量、操作简便快捷、成本低等优点[9-11]。该方法通过在DNA双链中嵌入饱和荧光染料,在一定温度范围内对PCR产物进行程序升温使其加热变性,实时采集、分析荧光信号并绘制DNA熔解曲线,最终根据熔解曲线及熔解温度的不同来区分突变类型[12,13]。
1 材料与方法
1.1 材料
本研究以福建农林大学蜂学学院饲养的“蜂强1号”意蜂实验蜂群作为研究材料,从蜂群中收集50只蜜蜂进行实验。
1.2 DNA的提取
采用酚氯仿法提取蜜蜂样本的DNA,将50只蜜蜂的胸部剪下,分别放入1.5 ml离心管中,加入由1 mol/l Tris-HCl(pH=8.0)、0.5 mol/l EDTA、SDS配成的DNA抽提缓冲液进行研磨混匀形成匀浆,另外加入蛋白酶K后55℃水浴过夜。之后使用平衡酚、酚氯仿及氯仿各抽提一次去除杂质,并用无水乙醇沉淀DNA,然后用70%乙醇洗涤DNA沉淀,最后用无菌水溶解DNA沉淀。将溶解后的DNA用NanoDrop 2000型超微量分光光度计测得其质量与浓度,并用无菌水稀释至10 ng/μl。
1.3 引物合成
根据SNP位点的信息,在美国国立生物技术信息中心上查出目标位点前后各500 bp的DNA片段,然后根据基因片段用Primer 6.0设计引物,使通过引物扩增出来的产物包含目的SNP位点,且目的DNA片段的大小为100~200 bp,引物由铂尚生物技术(上海)有限公司进行合成。
1.4 PCR扩增及测序
利用EasyTaq PCR SuperMix(Transgen Biotech)进行PCR扩增,根据说明书配置PCR反应体系,反应总体积为20 μl。PCR扩增程序为94℃ 2 min;94℃ 30s,55℃ 30 s,72℃ 1 min,35个循环;72℃ 5 min。扩增产物长度为149 bp。为了筛选确定基因型的样本进行HRM检测,将PCR产物通过测序来验证基因型,测序由铂尚生物技术(上海)有限公司来完成。

表1 HRM法检测基因多态性位点C2587245T的引物序列
1.5 扩增与HRM分析
利用Precision Melt Supermix(BIO-RAD)进行PCR扩增,反应体系为20 μl,包括10 μl Precision melt supermix,200 nM引物以及40 ng DNA模板,DNA模板为经过测序筛选出来的C/T型模板3个,T/T型模板3个及C/T型模板3个,每个模板设置3个复孔。使用的仪器为Bio-Rad的CFX96荧光定量PCR系统。
PCR扩增程序:95℃ 2 min;95℃ 10 s,55℃ 30 s,72℃ 30 s,40个循环;72℃ 30 s。
HRM分析程序:95℃ 30 s,60℃ 1 min,以0.02℃/s的速度从65℃上升到95℃,分析熔解曲线。
2 结果
2.1 测序结果
经过PCR扩增及测序,50个样本在C2587245T位点有3种基因型,其结果如图1所示,自上而下依次是C/T型、T/T型及C/C型的测序峰图。
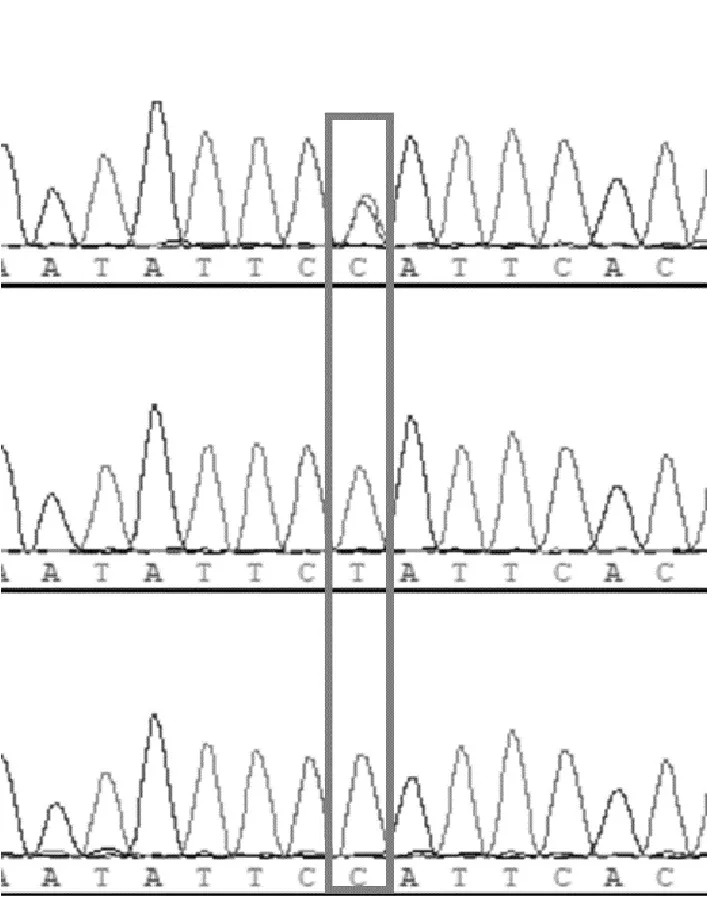
图1 C2587245T位点的3种测序峰图
2.2 HRM分析结果
选取不同基因型的样本各3个,验证是否能够通过HRM方法精确分辨这3种基因型,结果如图2所示,左边的熔解曲线图可以看出随着温度升高,DNA双链解链,荧光信号随之下降,不同基因型模板的产物熔解曲线存在一定差异,C/C型模板的PCR产物最易解链使荧光染料脱落,造成信号减弱最快,其次是C/T杂合型,再次是TT纯合型;右边的熔解温度图也能看到3型模板的PCR产物熔解温度也存在明显差异,C/C纯合型的熔解温度最低,C/T杂合型的熔解温度介于C/C纯合与T/T纯合之间,T/T纯合型则具有最高的熔解温度。所以通过HRM法能够辨别不同基因型样本之间因单个碱基不同产生的熔解曲线差异,进而区分不同基因型样本。
3 讨论
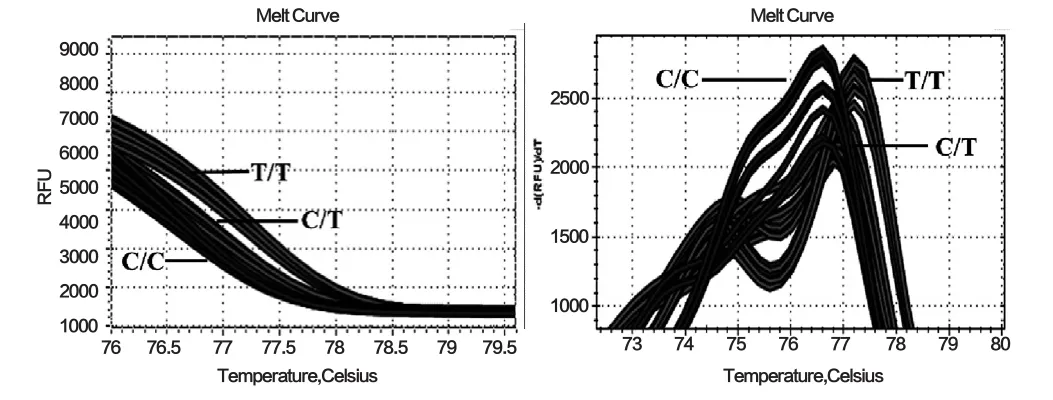
图2 3种基因型样本的熔解曲线及熔解温度
SNP分子标记因其具有结构简单、密度高、分布广、检测快速、易实现自动化检测等特点,被广泛应用于疾病研究及动植物抗病育种等领域。刘元珍等发现了C2587245T多态性位点与蜜蜂幼虫抗白垩病性状显著相关,通过检测蜂群在该位点的基因型,能够鉴别蜂群的抗白垩病能力[8]。传统的SNP基因分型方法主要有PCR产物测序法、限制性片段长度多态性(Restriction Fragment Length Polymorphism,RFLP)法、Taqman探针法等。PCR产物测序法包括PCR步骤及送公司测序,一方面需要的时间较长,另外花费也较高;RFLP法则是利用酶切的手段,将具有多态性的DNA片段用合适的限制性核酸内切酶酶切出具有长度差异的片段,这种差异是由限制性酶切位点上碱基的多态性引起的,根据酶切片段的差异能够对SNP进行基因分型,但是一方面该方法对于序列要求较高,需要在SNP处存在酶切位点,另一方面在PCR和酶切后还要通过电泳观察条带来鉴别基因型,整体实验操作复杂,耗时长,不适用于大规模的SNP基因分型[14];Taqman探针法则是需要针对不同SNP位点分别设计PCR引物和探针,花费较高且不适合大量的SNP位点分析。不同SNP标记基因分型方法的操作难度、花销及时耗都有差异,合适、易行、省时的分型方法在遗传育种的实际应用领域具有相当重要的意义。
HRM法的原理是在普通PCR的基础上,通过使用饱和荧光染料结合DNA双链,在PCR扩增完成后通过程序升温使产物逐渐解链,造成荧光物质脱落,荧光信号减弱,HRM程序能够根据实时的检测绘制出荧光信号随温度升高逐渐减弱的熔解曲线图。由于碱基的差异,双链解链的温度也存在细小的差异,精密的程序升温与荧光信号收集能捕捉到这细小的差异从而进行基因分型[13]。HRM法较传统的PCR产物测序法、RFLP法与Taqman探针法,具有成本低、操作简单、快捷的优点,用HRM来基因分型无需测序,无需酶切、电泳,也不需要进行探针的设计,只要在PCR扩增完成后追加一步程序升温及荧光检测即可,而现在大多数市售的荧光定量PCR仪都带有HRM程序,可以直接进行HRM分型实验。所以本研究通过HRM法尝试对意大利蜜蜂幼虫与抗白垩病相关单核苷酸多态性位点C2587245T进行基因分型,以期建立一种快捷的分型方法。
在本实验中共测序检测了50个样本,选取C/T型、T/T型、C/C型样本各3例来尝试进行HRM基因分型。验证结果和测序结果相符,存在3种基因型。将熔解曲线与测序结果匹配起来,得到了3种基因型所对应的熔解曲线及熔解温度,该数据可以为以后进行关于多态性位点C2587245T高通量的基因分型提供参考。通过该实验,HRM法进行基因分型的低成本、易操作的特性也得到了充分体现,希望该研究能够为HRM法直接检测SNP位点提供参考。
参考文献
[1]Bailey L.Infectious diseases of the honey-bee [J].London: Land Books Ltd., 1963: 176.
[2]Zaghloul O A, Mourad A K, El Kady M B, et al.Assessment of losses in honey yield due to the chalkbrood disease, with reference to the determination of its economic injury levels in Egypt [J].Communications in Agricultural and Applied Biological Sciences, 2005, 70(4): 703-714.
[3]Qin X, Evans J D, Aronstein K A, et al.Genome sequences of the honey bee pathogensPaenibacillus larvaeandAscosphaera apis[J].Insect Mol Biol, 2006, 15(5): 715-718.
[4]Invernizzi C, Rivas F, Bettucci L.Resistance to Chalkbrood disease inApis melliferaL.(Hymenoptera: Apidae) colonies with different hygienic behaviour [J].Neotrop Entomol, 2011, 40(1): 28-34.
[5]Holloway B, Tarver M R, Rinderer T E.Fine mapping identifies significantly associating markers for resistance to the honey bee brood fungal disease, Chalkbrood [J].Journal of Apicultural Research, 2013,52(3): 134-140.
[6]Holloway B, Sylvester H A, Bourgeois L, et al.Association of single nucleotide polymorphisms to resistance to chalkbrood inApis mellifera[J].Journal of Apicultural Research, 2012, 51(2): 154-163.
[7]晏励民.基于SNP重测序技术的蜜蜂抗白垩病性状相关的分子标记筛选[D].浙江大学,2014.
[8]Liu Y, Yan L, Li Z, et al.Larva-mediated chalkbrood resistanceassociated single nucleotide polymorphism markers in the honey beeApis mellifera[J].Insect Mol Biol, 2016, 25(3): 239-250.
[9]张远,何霞,钟磊,等.高分辨率熔解曲线法在GLP1R基因多态性位点rs3765467检测中的应用[J].中国药房,2017, 28(17): 2305-2308.
[10]应斌武.高分辨熔解曲线分析在遗传病分子诊断中的应用[J].中华检验医学杂志,2017, 40(2): 146-148.
[11]王倩,闫雯,沈明辉,等.荧光染料SYTO13用于高分辨熔解曲线技术SNP基因分型的评价[J].中华检验医学杂志,2017, 40(2): 88-94.
[12]Nguyen-Dumont T, Calvez-Kelm F L, Forey N, et al.Description and validation of high-throughput simultaneous genotyping and mutation scanning by high-resolution melting curve analysis [J].Human Mutation,2009, 6(9): 884-890.
[13]Chambliss A B, Resnick M, Petrides A K, et al.Rapid screening for targeted genetic variants via high-resolution melting curve analysis [J].Clinical Chemistry & Laboratory Medicine, 2016, 55(4): 507-516.
[14]党进军.限制性片段长度多态性[J].生命的化学,1985(6):9-10.
