常见蜂蜜和糖浆特征成分及功能性差异研究
2018-05-21吴伋徐锦忠陈磊
吴伋 徐锦忠 陈磊
(1 Saint Louis University High School,St.Louis 63110;2 江苏中谱检测有限公司,南京 210061;3 江苏出入境检验检疫局,南京 210001)
蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,经充分酿造而成的天然甜物质。作为传统的天然营养物质,在世界范围内都具有悠久的食用历史。传统中医药中蜂蜜也是重要的原材料,具有多种药理功能,对其药用价值的开发利用研究已经有较长的历史[1]。
优质蜂蜜在室温下放置数年不会腐败,表明其防腐作用极强。实验证实,蜂蜜对链球菌、葡萄球菌、白喉杆菌等革兰阳性菌有较强的抑制作用。“自由基”学说,是英国学者哈曼(Deham Harman)于1954年首先提出的一个重要衰老机制,认为人体衰老是体内过量的自由基引起的。蜂蜜中含有大量的抗氧化剂,它能清除人体内“垃圾”——氧自由基,从而达到延缓衰老的作用,蜂蜜的抗氧化性、抗菌性等已经被广为研究[3-5]。
近年来对于不同蜜种蜂蜜通过特征性组分进行鉴别研究,但方法比较复杂,很难确定各蜜种中独特的特征组分[6-13]。在糖浆掺假蜂蜜的检测研究中,通过液相色谱-质谱方法发现糖浆和蜂蜜中的差异进行掺假检测[14,15],因此研究不同蜜种中的特征性成分和蜂蜜、糖浆之间的差异性意义很大。
本文针对市场上存在的糖浆冒充蜂蜜的情况,通过液相色谱-质谱联用的方法研究蜂蜜和糖浆之间的差异,发现蜂蜜和糖浆的特征峰,为进一步研究蜜种鉴别和掺假检测奠定基础。通过实验验证了常见蜂蜜和糖浆在抗氧化性、抑菌性方面的区别。
1 材料与方法
1.1 样品采集
蜂蜜市场上蜜种繁多,但是很多蜜种由于产量和蜜源植物种植面积的问题,蜂蜜的纯度很难保证,为了保证研究结果的可靠性和中国市场的普遍性,经过市场调查后,选择了市场上最常见的6种蜂蜜,根据蜜种分为乔木类:洋槐,枣花;灌木类:荆条,麦卢卡;草本类:油菜,荞麦;以及最常见的2种蜂蜜掺杂的糖浆:大米糖浆,甜菜糖浆。
6种蜂蜜中洋槐、荆条、枣花、荞麦和油菜直接取自盛花期蜂农的蜂箱,保证蜜种的纯度。麦卢卡蜂蜜来自新西兰麦卢卡协会提供的样品。大米糖浆和甜菜糖浆来自相关研究机构,保证样品的可靠性。
1.2 化学试剂
除特殊说明外,所有试剂为分析纯试剂,水为符合国标要求的二级水,70%乙醇,碳酸钠,磷酸,铁氰化钾,福林试剂,没食子酸标准品(≥98%,10 mg)。
1.3 实验器材
液相色谱-质谱联用仪Thermo Fisher TSQ Quantum Ultra配ESI源;电子天平:0.01 g和0.01 mg;氮吹仪,恒温水浴锅,离心机,涡旋加速器,滴定管,移液枪。
1.4 液相色谱-质谱分析测定
1.4.1 实验材料制备
准确称取1.0(±0.05)g蜂蜜样品于50 ml玻璃离心管中,溶解于10.0 ml水中,超声至溶解,混匀,过水相滤膜后,准备进样。
1.4.2 色谱条件
色谱柱:Sepax GP-C8柱,2.1 mm(内径)×150 mm,5 μm;柱温:室温;流动相:甲醇(B)-水(A);梯度洗脱程序:0~0.5 min 5%B,0.5~3.0 min 5%B~20%B,3.0~6.0 min 20%B~90%B,6.0~8.0 min 90%B,8.1~10.0 min 5%B;流速:0.25 ml/min;进样量:25 μl。
1.4.3 质谱条件
离子源:ESI+。(a)离子喷雾电压:2500 V;(b)雾化气压力:50 arb;(c)辅助气压力:8 arb;(d)毛细管温度:350℃;(e)离子源温度:300℃;检测方式:全扫描(100~800 amu)。
1.5 总抗氧化性测定方法
1.5.1 抗氧化性标准曲线绘制(铁氰化钾还原法)
以400 μg/ml的没食子酸标准溶液为标准绘制抗氧化性标准曲线,方法如下:在2.5 ml,pH=6.6,即0.2 mol/l磷酸缓冲溶液中加入没食子酸标准溶液0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.9 ml,用双馏水补齐到1 ml,加入1 ml 1%铁氰化钾,混合物在50度恒温条件下加热20 min。急速冷却,加入2.5 ml 10%氯乙酸,3500转离心分离10 min。取上层清液2.5 ml,加2.5 ml双馏水,再加0.5 ml 0.1% FeCl3,混合均匀,静置10 min后在波长700 nm下测量吸光度A值。A越大,则样品的还原能力越强。
1.5.2 试样抗氧化性的测定
将提取液离心,取上层清液,按照标准曲线绘制的测定方法,依次加入试剂,以试剂空白作参比,用1 cm比色皿在700 nm处测定吸光,比较其抗氧化活性。
1.6 多酚含量测定
1.6.1 多酚标准曲线的制作
准确称取没食子酸标准品200 mg,加少量70%乙醇样品溶化,用70%乙醇定容至100 ml,摇匀,静置,再用移液枪吸取20 ml,用70%乙醇定容至100 ml,摇匀,配成浓度为400 μg/ml的没食子酸标准溶液,待用。
准确吸取浓度为400 μg/ml的没食子酸标准溶液0,0.05,0.1,0.15,0.2,0.25,0.35 ml于试管中。分别加入蒸馏水2.0,1.95,1.9,1.85,1.8,1.75,1.65 ml,再各自加入福林试剂1 ml,充分震荡后静置3~4 min,分别加入10%碳酸钠1 ml于25度,摇匀置于温水浴中反应2 h,同时做试剂空白,于765 nm下测定分光度,以含量对吸光度进行直线回归,计算回归方程。
1.6.2 试样多酚含量的测定
将提取液离心,取上清液,按标准曲线绘制的测定方法,依次加入试剂,以试剂空白作参比,用1 cm比色皿在765 nm处测定吸光度,计算多酚含量。
1.7 打孔法测定抑菌性
取培养好的金黄色葡萄球菌悬浊液于若干培养基中,每个培养基加入20 μl悬浊液,然后静置直到琼脂凝固为止。每个培养基均匀等距打上6个圆孔,依次加入蜂蜜样品20 μl,37℃培养1天。隔日比较抑菌圈的半径大小,并计算平均值,结果填入表内。
2 结果与讨论
2.1 液相色谱-质谱实验
为了研究蜂蜜和糖浆中差异性的原因,通过液相色谱-质谱联用的方法对样品进行分析。同时分析2种糖浆和6种蜂蜜样品,通过设定的色谱条件对样品从100~800(m/z)进行全扫描,全扫描图谱如图1所示,可以看出2种糖浆中除了2.1 min的糖峰外,在7.0~12.0 min之间几乎没有峰,尤其是甜菜糖浆看不到任何峰,而蜂蜜中在这个区域能看到很多峰。进一步通过提取离子对所得图谱对比分析,找出糖浆和各种蜂蜜之间的差异物质,结果如表1所示,选择离子色谱图见图2。
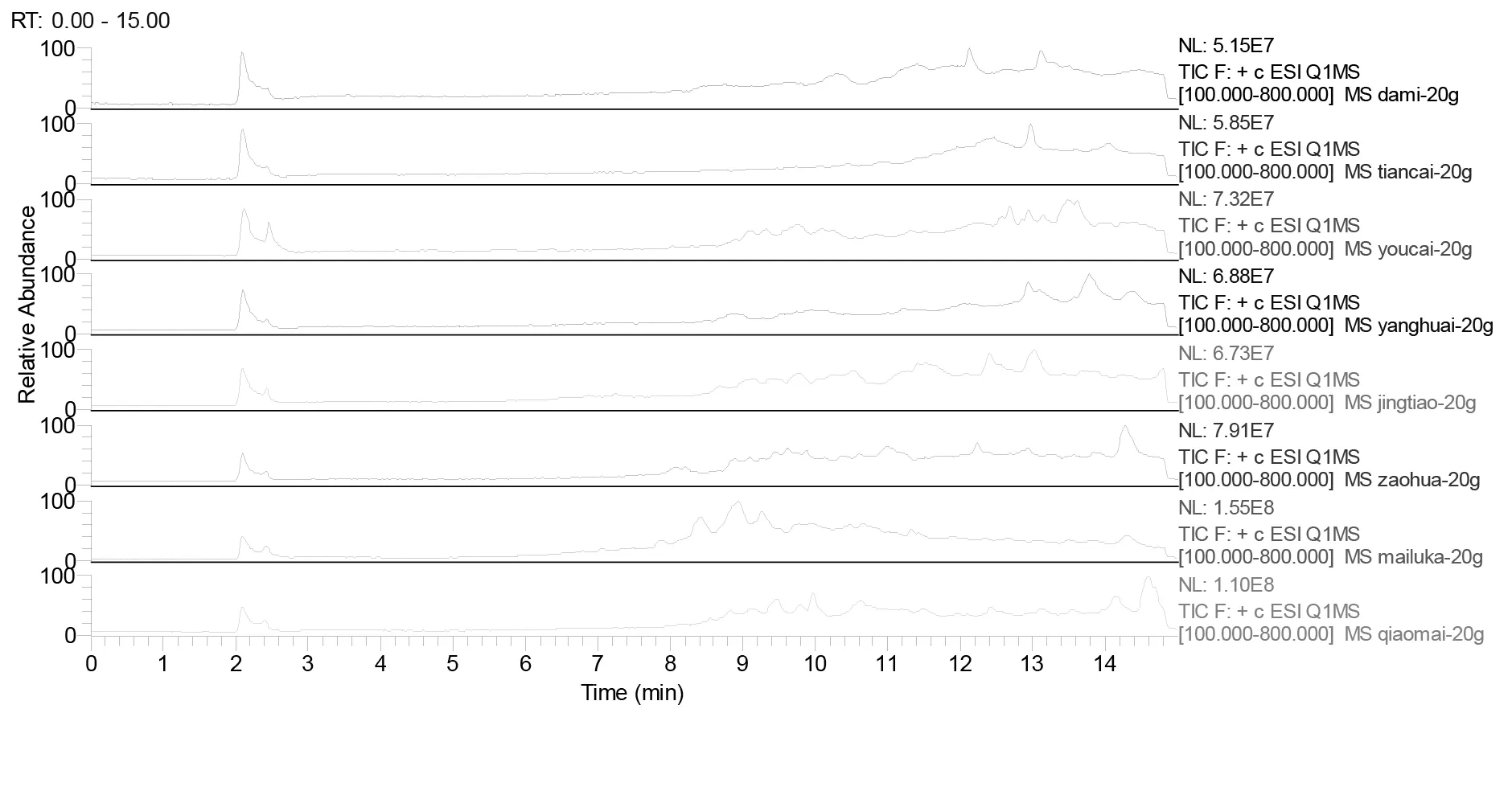
图1 糖浆和蜂蜜的LC-MS总离子流色谱图

图2 糖浆和蜂蜜的LC-MS选择离子流色谱图
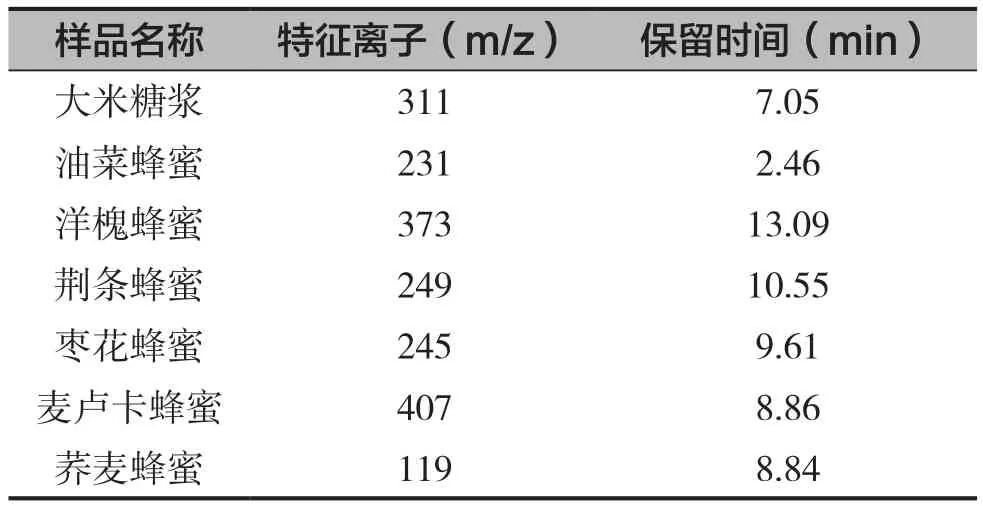
表1 糖浆和蜂蜜中特征离子和保留时间
从表1可以看出,除了甜菜糖浆外,大米糖浆可以确定其中的特征离子为311,与文献报道的一致[10,11],对比图谱见图2。如果在蜂蜜中检测出大米糖浆的特征离子就可以确定蜂蜜中添加了一定量的大米糖浆。甜菜糖浆由于其生产工艺简单,通过这个方法未能发现明显的特征离子,需要进一步研究。
从表1也能看出,每种蜂蜜中都能找到区别于其他蜜种的特征离子,同样用这种特征离子也可以确定是不是在价格高的蜂蜜如洋槐蜂蜜中添加了价格低的油菜蜂蜜,还有麦卢卡蜂蜜是不是真的麦卢卡蜂蜜,有没有添加其他蜂蜜。
2.2 抗氧化性实验和多酚测定实验
蜂蜜与糖浆相比具有丰富的黄酮和多酚类物质,而这些物质通常具有较好的抗氧化活性。实验进一步研究了蜂蜜和糖浆的抗氧化性和多酚含量,测定实验结果如表2所示。这两个实验都是用没食子酸作为参考标准物质,分光光度法测定不同波长下的吸光度,最后折算成没食子酸含量来定量比较。从表2可以看出,糖浆也具有一定的抗氧化性,但是比蜂蜜小。蜂蜜的抗氧化性和多酚含量的高低是密切相关的。天然蜂蜜随着颜色的加深,抗氧化活性和多酚含量增加,抗氧化活性和多酚含量基本呈正相关。洋槐和油菜是蜂蜜中相对最低的,颜色也最淡,说明其中含有的多酚类物质少。而深色的枣花、麦卢卡和荞麦抗氧化活性高,荞麦是洋槐和油菜的4倍左右。由此可见,从抗氧化活性考虑,应该买颜色深的蜂蜜。
2.3 抑菌性实验结果
传统观念认为蜂蜜具有一定的抑菌效果,特别是麦卢卡蜂蜜,作为全球唯一具有针对胃炎功能的蜂蜜,具有良好的抑菌性。实验研究了这几种蜂蜜和糖浆对金黄色葡萄球菌的抑菌效果(见图3),结果表明只有荞麦蜜和麦卢卡蜂蜜有明显的抑菌圈出现,糖浆和其他几种蜂蜜看不到抑菌效果。
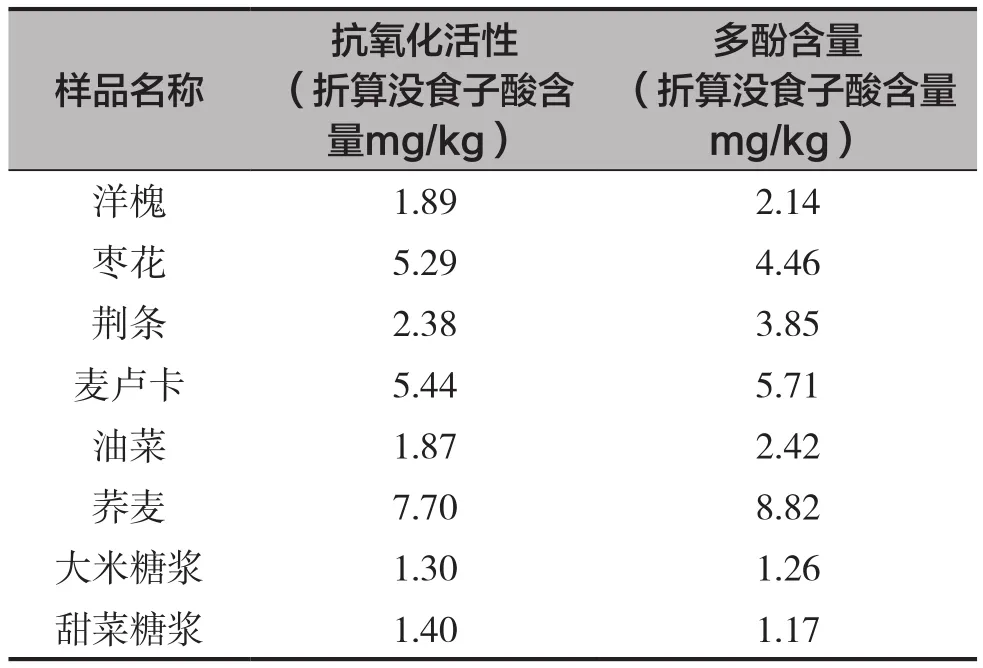
表2 蜂蜜和糖浆的抗氧化活性和多酚含量测定结果
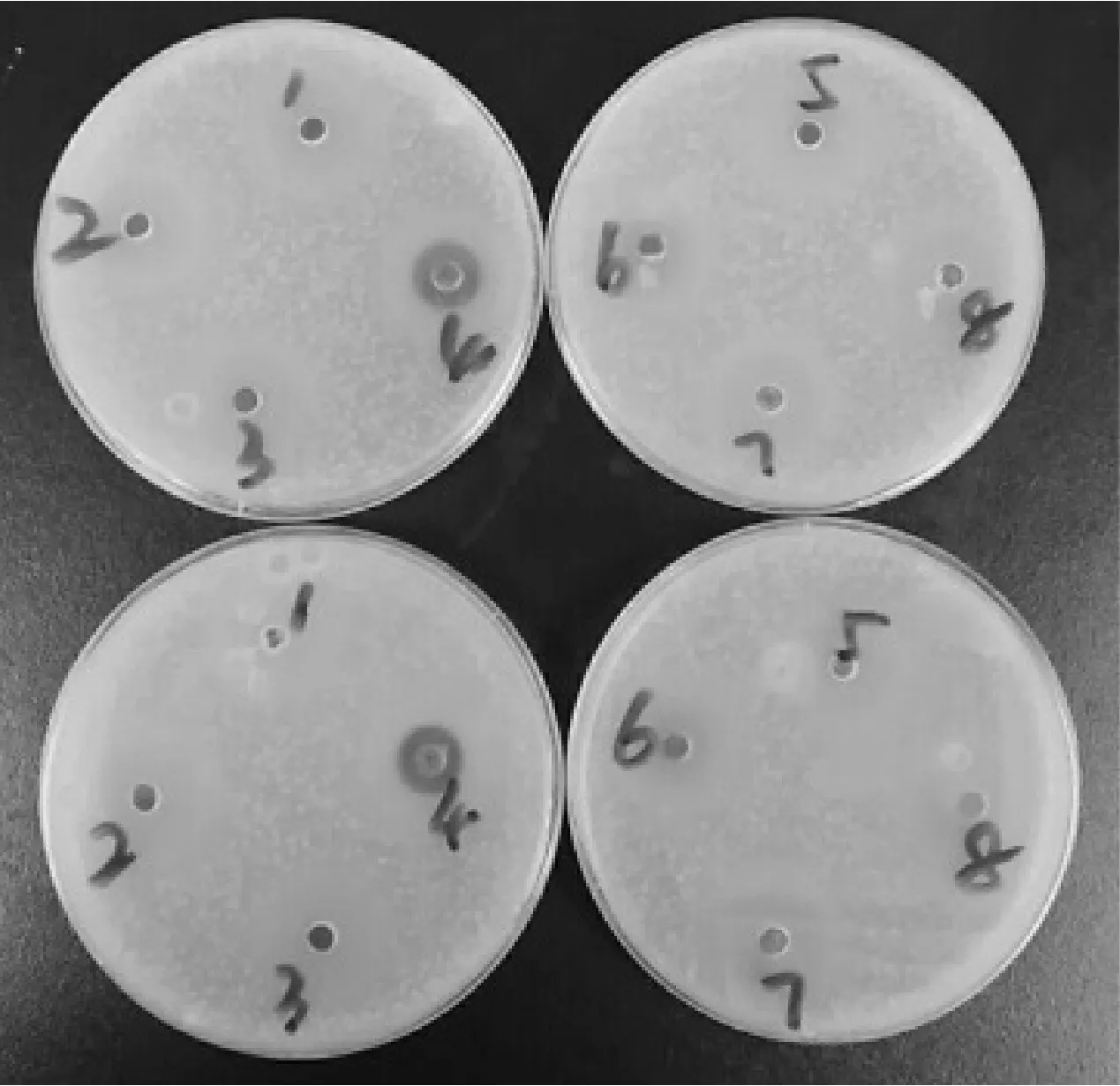
图3 抑菌实验的平板图
3 结论
上述研究确定了洋槐蜂蜜和大米糖浆中的特征离子,为进一步检测蜂蜜掺杂和造假奠定了基础。通过抗氧化活性和多酚含量测定,说明蜂蜜中含有来自于植物的多酚类物质,相比糖浆而言具有一定的抗氧化活性。抑菌实验确定麦卢卡蜂蜜和荞麦蜜具有一定的抑菌效果,特别是荞麦蜜可以进一步开发成功能性保健食品。实验通过探究不同蜜种的特征离子为蜜种鉴别和掺假检测奠定了基础,并验证了6种常见天然蜂蜜在抗氧化活性、抑菌性方面优于糖浆的潜在药用价值。
参考文献
[1]郭夏丽,罗丽萍,冷婷婷,等.7种不同蜜源蜂蜜的化学组成及抗氧化性[J].天然产物研究与开发,2010, 22: 665-670.
[2]李琦智,朱敏,任德曦,等.蜂蜜的功效与应用[J].四川中医,2004, 22(1): 30-31.
[3]温玉顺.蜂蜜蜂王浆有助抗癌[J].蜜蜂杂志,2005(3): 17.
[4]曹炜,陈卫军,宋纪蓉.不同种类蜂蜜总酚酸含量测定和抗氧化作用的研究[J].食品科学,2005, 26(1): 48-51.
[5]王笑笑,周勇,徐国群,等.黄酮类成分在蜂蜜抗菌性中的效能研究[J].中国现代应用药学,2017, 34(3): 363-369.
[6]李艳艳,初正云,翟延君,等.刺槐花总黄酮提取工艺研究[J].辽宁中医药大学学报,2011, 13(5): 87-91.
[7]陈兰珍,叶志华,赵静.蜂蜜品种鉴别技术研究进展[J].食品科学,2008, 29(3): 494-498.
[8]万伟杰,李瑞丽,昌晓宇,等.蜂蜜的掺假识别研究进展[J].食品安全导刊,2017(12): 135-137.
[9]汪思凡,曹振辉,潘洪彬,等.蜂蜜化学成分及其主要生物学功能研究进展[J].食品研究与开发,2018, 39(1): 176-181.
[10]梁馨文,李强强,王凯,等.蜂蜜溯源特征标记物研究进展[J].食品科学,2017.08.29,网络预发表.
[11]Zheng W, Wang SY .Antioxidant activity and phenolic compounds in selected herbs [J].J.Agric.Food Chem., 2001, 49(11): 5165-5170.
[12]Yao LH, Jiang YM, Singanusong R, et al.Phenolic acids in Australian Melaleuca, Guioa, Lophostemon, Banksia and Helianthus honeys and their potential for floral authentication [J].Food Research International, 2005, 38(6): 651-658.
[13]Martos I, Ferreres F, Tomás-Barberán F.Identification of flavonoid markers for the botanical origin of Eucalyptus honey [J].J.Agric.Food Chem., 2000, 48(5): 1498-1502.
[14]Xue XF, Wang Q, Li Y, et al.2-Acetylfuran-3-glucopyranoside as a novel marker for the detection of honey adulterated with rice syrup [J].J Agric Food Chem, 2013, 61(31):7488-7493.
[15]Du B, Wu LM, Xue XF, et al.Rapid screening of multiclass syrup adulterants in honey by Ultrahigh-Performance Liquid Chromatography/Quadrupole Time of Flight Mass Spectrometry [J].J Agric Food Chem, 2015, 63(29): 6614-6623.
