腺病毒介导转铁蛋白受体报告基因在结直肠癌细胞MRI中的初步观察
2018-05-21续梦玲王一帆郜发宝郭玉林
续梦玲,王一帆,何 花,郜发宝,郭玉林*
(1.宁夏医科大学基础医学院,宁夏 银川 750004;2.宁夏医科大学总医院放射科,宁夏 银川 750004;3.四川大学华西医院放射科分子影像研究室,四川 成都 610041)
近年来,欧美地区结直肠癌新发病人数和死亡人数居恶性肿瘤第3位[1-2],在我国其发病率也呈上升趋势。MR分子成像可实现细胞和分子层面的实时在体无创成像,对研究疾病发病机制、诊断形态学改变前的分子水平变化及评估相关基因介导治疗效果有重要价值,其关键在于报告基因[3-6]。本研究将腺病毒介导转铁蛋白受体(transferrin receptor, TFRC)报告基因转导入人结直肠癌(Lovo)细胞,观察TFRC报告基因在转染细胞的过表达情况及体外7.0T MR成像效果,观察在体成像示踪肿瘤的生长情况及其早期转移机制。
1 材料与方法
1.1 材料 MR仪器采用Bruker Biospec 70/30大孔径7.0T MR机,容积线圈,内径40 mm,外径75 mm。重组腺病毒载体(Ad-TFRC)和人Lovo细胞由四川大学华西医院信号转导及分子靶向治疗研究室提供;转铁蛋白(transferrin,Tf)-超微超顺磁性氧化铁(ultrasmall superparamagnetic iron oxide, USPIO)分子探针由中科院化学所合成;1640培养基购自Invitrogen公司;胰蛋白酶购自Sigma公司;胎牛血清FBS购自Gibco公司。
1.2 实验方法
1.2.1 Ad-TFRC感染Lovo细胞 将6孔板中(2×108/孔)对数生长期的人Lovo细胞置于7℃、5% CO2的培养箱内培养24 h,细胞贴壁融合后,以新鲜含10% FBS的1640培养液替换,用于Ad-TFRC感染,以无处理Lovo细胞作为对照。将腺病毒以0、5、10、50、100的感染复数(multiplicity of infection, MOI)感染Lovo细胞,4 h后更换新鲜培养液。感染36 h后以荧光显微镜观察荧光显示情况,明确最佳MOI值。
1.2.2 TFRC表达定量检测 用Ad-TFRC(Ad-TFRC组)、空病毒载体(空病毒载体组)转染Lovo细胞,以未感染Lovo细胞作为空白对照组;分别提取各组中总RNA,应用染料法行反转录,检测各组TFRC及内参GAPDH的表达。TFRC引物序列为:上游,5′-GGCTACTTGGGCTATTGTAAAGG-3′;下游,5′-CAGTTTCTC CGACAACTTTCTCT-3′。GAPDH引物序列为:上游,5′-GAGTCAACGGATTTGGTCGT-3′;下游,5′-GACAAGCTTCCCGT TCTCAG-3′。反应条件:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火20 s,50个循环进行扩增。用2-△△Ct解析法处理相对定量分析中所测得数据[7]。
1.2.3 探针最佳标记浓度检测 将Ad-TFRC组、空病毒载体组及空白对照组Lovo细胞(2×104/孔)置于12孔板中生长,24 h后待细胞贴壁,而后以浓度不一(0、0.5、0.8、1.2、1.5、2.5、3.5、5.0、8.0、10.0 μg/ml)的Tf-USPIO孵育各组Lovo细胞过夜。以磷酸盐缓冲液(phosphate buffer solution, PBS)清洗2次,每次2 min,4%多聚甲醛处理(室温)20 min,自来水/蒸馏水分别清洗1次,每次2 min,染色剂A1∶A2按1∶1配制,混匀30 min后蒸馏水清洗5 min,用伊红淡染细胞核2 s,自来水冲洗后封镜,显微镜下观察细胞内铁颗粒含量。重复上述实验3次。
1.2.4 细胞活力检测 采用台盼蓝排除实验检测以Tf-USPIO(1.5 μg/ml铁浓度)标记的Ad-TFRC组Lovo细胞24 h细胞活力变化,以无处理Lovo细胞作为空白对照组。每组重复6个样本,实验重复3次。
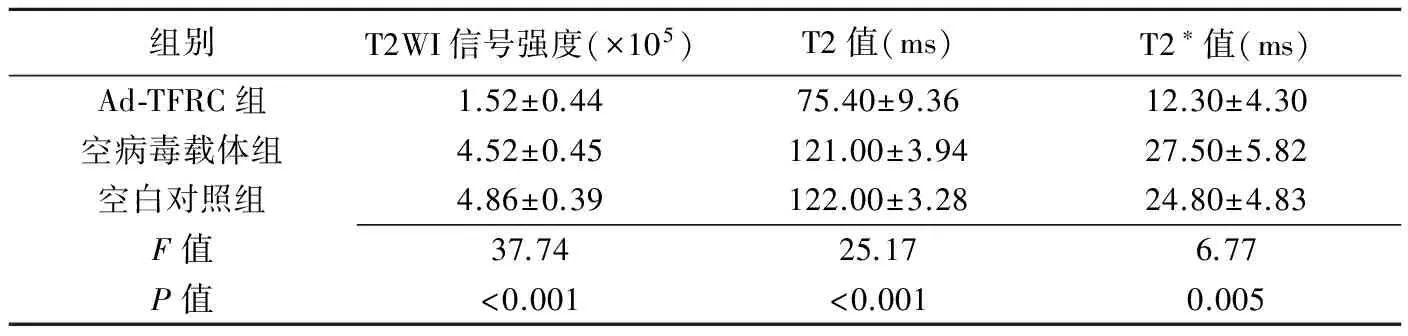
表1 各组体外细胞MRI信号强度及弛豫时间比较

图1 Lovo细胞荧光表达 A.无处理Lovo细胞(×100); B.感染Ad-TFRC后Lovo细胞(×100)
1.2.5 体外细胞MR成像 以Tf-USPIO(1.5 μg/ml铁浓度)探针分别标记Ad-TFRC组、空病毒载体组和空白对照组Lovo细胞;经胰酶消化后各取1×106个细胞重悬于500 μl EP管内的0.5%琼脂糖溶液中,配成400 μl的琼脂糖凝胶模型。行轴位TurboRARE T2W(TR 3 000 ms,TE 5 ms)、MSME T2 map(TR 5 000 ms,TE 11 ms)、MGE T2*map(TR 1500 ms,TE 4 ms, 翻转角 30°)序列MR扫描,层厚1 mm,矩阵256×256,视野4 cm×4 cm。应用Matlab软件合成T2 map伪彩图。通过Paravision 5.0后处理软件测量T2WI信号强度及T2、T2*值,实验重复3次,每个序列采纳3层图像,每层获3个ROI(0.12 cm2)。
1.3 统计学分析 采用SPSS 17.0统计分析软件。计量资料以±s表示,采用单因素方差分析比较3组间计量资料,以独立样本t检验比较2组间计量资料。以P<0.05为差异有统计学意义。
2 结果
2.1 Ad-TFRC感染Lovo细胞鉴定 MOI最佳值为50。感染24 h后荧光显微镜开始观察到绿色荧光蛋白,36 h后镜下可见细胞内大量绿色荧光蛋白(图1),阳性感染率>90%;无处理Lovo细胞内无绿色荧光蛋白表达。
2.2 细胞TFRC mRNA的表达 Ad-TFRC组、空病毒载体组、空白对照组TFRC基因相对表达量分别为3.16±0.39、1.16±0.16、1.00±0.06,3组总体差异有统计学意义(F=72.47,P<0.001),两两比较显示Ad-TFRC组与空病毒载体组、空白对照组差异有统计学意义(P均<0.01),空病毒载体组与空白对照组差异无统计学意义(P>0.05)。
2.3 探针最佳标记浓度 光学显微镜示铁浓度为1.5 μg/ml的Tf-USPIO标记的Ad-TFRC组细胞内可见存在大量蓝染铁颗粒,铁颗粒位于胞浆内(图2),标记率为100%,而空病毒载体组及空白对照组仅有少量蓝染铁颗粒。
2.4 细胞活力的评价 Ad-TFRC组Lovo细胞以Tf-USPIO(1.5 μg/ml铁浓度)探针标记24 h后,拒染率为(93.80±1.60)%,空白对照组拒染率为(95.10±2.30)%,二者差异无统计学意义(t=-1.489,P=0.186)。

图2 铁浓度为1.5 μg/ml的Tf-USPIO标记的Lovo细胞病理图(普鲁士蓝,×400) A、B.空病毒载体组及空白对照组细胞中几乎无蓝色颗粒; C.Ad-TFRC组细胞内可见大量蓝色颗粒,标记率为100%

图3 相同细胞浓度的体外MR成像 从左向右依次为Ad-TFRC组、空病毒载体组、空白对照组 A.T2WI; B.T2 map;C.T2*map; D.T2 map伪彩图
2.5 体外MR成像 MR T2W、T2 map及T2*map序列成像显示,Ad-TFRC组、空病毒载体组、空白对照组均可检测到低信号(图3)。3组信号强度、弛豫时间比较差异均有统计学意义(P均<0.05),两两比较除空病毒载体组与空白对照组,余组别差异均有统计学意义(P均<0.05),见表1。
3 讨论
目前MR分子成像研究备受关注,其可获得生理和超微解剖结构的三维信息,且空间分辨力高、无辐射,但敏感度较低[8]。本实验采用复制缺陷型腺病毒载体,发现其具有生物安全性好、转染率高等诸多优点,无需与宿主细胞基因组整合,避免了插入突变的危险;以之作为基因转运载体,转染后的细胞与正常状态下培养的细胞形态无差别,对转染目标细胞几乎无伤害,与金玲等[9]研究结果一致,提示可将其作为外源性目的基因导入细胞内的工具。本实验中根据已有研究[10]及前期实验基础设定病毒转染浓度梯度,并得出最佳MOI值为50;MOI为0~50时,荧光强度相对弱,且随MOI值增加而变强;MOI>50,荧光强度和MOI值的增加无正相关;当MOI达到100时,细胞生长状态受影响。实时定量PCR可从mRNA水平反映转染细胞中TFRC的正常表达。本研究结果表明,腺病毒可成功介导转铁蛋白受体报告基因在结直肠癌Lovo细胞中的高效表达。
USPIO是超顺磁性对比剂,在磁敏感效应的作用下形成微小磁场,致磁场均匀性下降,T2缩短,T2WI上信号减低,即T2负强化效应[11]。本实验中经Tf-USPIO探针(1.5 μg/ml铁浓度)标记Lovo细胞后普鲁士蓝染色示空白对照组Lovo细胞内也存在少量蓝染铁颗粒,可能是由于在人结直肠癌Lovo细胞及大部分肿瘤细胞内源性表达的转铁蛋白受体较正常增高;同时细胞外无残存铁,可清晰显示标识细胞的情况,但本研究未能定量检测USPIO标记细胞内的铁含量。
报告基因显像属于间接分子影像技术[12]。本研究应用USPIO纳米颗粒[13]与Tf共价结合的复合物作为探针。细胞膜上的转铁蛋白受体靶向摄取Tf-USPIO,在胞饮作用下将结合产物转运至细胞内,受体与探针复合物分离后回到细胞膜面,探针则留在胞内。这类是细胞表面膜受体过表达并与特异性的MR对比剂联合成像。TFRC报告基因成像的基本机制是:通过重组DNA技术使TFRC转导入靶细胞内,其表达引起相应TFRC增加,与耦联Tf的报告探针特异性结合,使MRI信号增强,进而可靶向示踪。Lee等[14]将TFRC过表达的胶质瘤细胞活体种植成瘤,利用单晶氧化铁纳米颗粒与Tf形成的复合物与TFRC特异性连合,对瘤体进行MR分子成像。报告基因显像技术及直接用对比剂标记靶细胞方法的基础均在于产生成像信号的细胞必须是具有活性的细胞,而报告基因显像技术的优势为可在体长期观察靶向成像,且不会因细胞分裂增殖而影响成像信号强度[15],其缺点为操作程序复杂。
此外,在T2W、T2 map、T2*map序列成像中,本研究Ad-TFRC组、空病毒载体组、空白对照组信号强度及弛豫时间差异均有统计学意义,3组间以T2*变化率最大,可能与T2*map 对磁化率的差异更敏感,铁引起的磁敏感效应更大有关,与李安宁等[16]研究结果一致。
综上所述,腺病毒载体可以成功介导转铁蛋白受体报告基因转染到体外Lovo细胞完成显像,为下一步进行活体内肿瘤靶向示踪MR成像提供了实验基础。
[参考文献]
[1] Siegel R, Ma JM, Zou ZH, et al. Cancer statistics, 2014. CA Cancer J Clin, 2014,64(1):9-29.
[2] Smith RA, Manassaram-Baptiste D, Brooks D, et al. Cancer screening in the United States, 2014: A review of current American Cancer Society guidelines and current issues in cancer screening. CA Cancer J Clin, 2014,64(1):30-51.
[3] Wang K, Wang K, Shen B, et al. MR reporter gene imaging of endostatin expression and therapy. Mol Imaging Biol, 2010,12(5):520-529.
[4] Gilad AA, Winnard PT, Van Zijl PC, et al. Developing MR reporter genes: Promises and pitfalls. NMR Biomed, 2007,20(3):275-290.
[5] Lau JF, Anderson SA, Adler E, et al. Imaging approaches for the study of cell-based cardiac therapies. Nat Rev Cardiol, 2010,7(2):97-105.
[6] Kang JH, Chung JK. Molecular-genetic imaging based on reporter gene expression. J Nucl Med, 2008,49(2):164S-179S.
[7] Thomson JM, Newman M, Parker JS, et al. Extensive post-transcriptional regulation of microRNAs and its implications for cancer. Genes Dev, 2006,20(16):2202-2207.
[8] Pysz MA, Gambhir SS, Willmann JK. Molecular imaging: Current status and emerging strategies. Clin Radiol, 2010,65(7):500-516.
[9] 金玲,刘小勇,徐玮,等.腺病毒载体携带标记基因EGFP转染人羊膜上皮细胞.中国组织工程研究,2017,21(21):3382-3387.
[10] Wang YF, Liu T, Guo YL, et al. Construction and identification of the adenoviral vector with dual reporter gene for multimodality molecular imaging. J Huazhong Univ Sci Technol Med Sci, 2013,33(4):600-605.
[11] 黄丹萍.磁性氧化铁纳米探针用于肿瘤靶向磁共振成像的研究现状.中国介入影像与治疗学,2012,9(10):766-769.
[12] 滕皋军,崔莹.磁共振分子影像学研究进展.磁共振成像,2014,5(z1):31-36.
[13] 张贺诚,李默,孔令钢,等.肝癌磁共振分子影像学的研究进展.北京医学,2017,39(01):83-86.
[14] Lee SW, Lee SH, Biswal S. Magnetic resonance reporter gene imaging. Theranostics, 2012,2(4):403-412.
[15] Wu JC, Abraham MR, Kraitchman DL. Current perspectives on imaging cardiac stem cell therapy. J Nucl Med, 2010,51(Suppl 1):128S-136S.
[16] 李安宁,姚振威,冯晓源,等.超顺磁性氧化铁标记小鼠淋巴细胞MR成像特性探讨.中华放射学杂志,2012,46(3):260-263.