肺窗观察头颈CTA图像显示肺部病变
2018-05-21张丽娟吕发金
姜 雪,张丽娟,黄 琳,吕发金
(重庆医科大学附属第一医院放射科,重庆 400016)
头颈CTA是目前检查头颈血管类疾病最常用的方法之一[1]。随着PACS及多窗宽窗位观察的应用[2-5],头颈CTA图像胶片主要打印头窗和纵隔窗图像,放射科医师如需其他窗宽窗位图像,可通过PACS系统观察。临床工作中,放射科医师在阅读患者头颈CTA图像时,往往重视颅内及血管病变而忽视肺部情况。既往有学者[6-7]提出采用肺底窗宽观察腹部CT图像具有一定意义。本研究探讨采用肺窗观察头颈CTA图像对于显示肺部病变的价值。
1 资料与方法
1.1 一般资料 回顾性分析我院2015年1月1日—2016年4月30日连续1 000例接受头颈CTA的患者资料,男553例,年龄5~89岁,平均(59.2±13.6)岁,女447例,年龄17~88岁,平均(58.0±14.4)岁;根据患者年龄分为老年组(≥60岁)494例、中青年组(<60岁)506例,根据是否吸烟分为吸烟组348例(吸烟至少1年者)、非吸烟组652例。
1.2 仪器与方法 采用GE Discovery HD750 CT机。嘱患者仰卧,先小剂量团注对比剂(优维显,370 mgI/ml)测试,再行头颈部VCT DSA扫描,速率均为4.0 ml/s。两次扫描对比剂用量分别为4.0 ml及45.0~55.0 ml,并以相同速率跟注生理盐水,剂量分别为15.0 ml及40.0 ml。扫描范围为头顶层面至主动脉弓层面。参数:管电压100 kV(平扫)、120 kV(增强),管电流250~450 mA,层厚及层间距均为5 mm,螺距0.969,FOV 20~24 cm;原始图像重建层厚0.625 mm[8]。最后将VCT DSA图像传入PACS系统以供图像分析。
1.3 图像评价 由2名高年资放射科医师采用双盲法对所有头颈CTA图像和所包括肺部组织进行重复阅片。第一次阅读纵隔窗图像,窗宽300 HU,窗位60 HU;第二次阅读肺窗图像,窗宽1 600 HU,窗位-600 HU。统计检出的所有肺部病变,意见不一致时经协商决定。
肺部病变包括肺部肿块、肺大疱、肺气肿、钙化灶、纤维灶、结节、炎症、支气管扩张、胸膜增厚及胸腔积液。参考第4版《医学影像诊断学》[9],将肺部肿块定义为最大径>3 cm实性、磨玻璃或混合肿块,边界清楚;肺大疱定义为≥1 cm含气空腔;肺气肿定义为不均匀密度减低区;钙化灶定义为高密度结节或不规则影;纤维灶定义为孤立性索条影;结节定义为≤3 cm实性、磨玻璃密度或混合结节影;炎症定义为实变、渗出病变,表现为致密影或磨玻璃密度、条片状密度影或网格影;支气管扩张定义为支气管管径大于同层面血管管径;胸膜增厚定义为沿着胸壁的带状软组织影,厚薄不均匀,表面不光滑;胸腔积液定义为后胸壁内缘与胸壁平行的弧形液体密度影。根据肺部病变显示情况分为仅肺窗可见、仅纵隔窗可见及两者均可见病变。对于多发病变患者,如其中1个病变为仅肺窗可见,则视为该患者的肺部病变为仅肺窗可见。
1.4 统计学分析 采用SPSS 19.0统计分析软件。正态分布的计量资料以±s表示,计数资料以百分数表示。采用χ2检验比较各组别纵隔窗和肺窗对病变的检出情况,P<0.05为差异有统计学意义。
2 结果
2.1 肺部病变情况 1 000例中,308例(308/1 000,30.80%)检出肺部病变,其中126例有2种及以上病变。308例肺部病变中,283例仅肺窗可见,8例仅纵隔可见,17例两者均可见。
肺窗检出8例患者有肺部肿块,5例为吸烟者,其中7例为实性肿块,纵隔窗、肺窗均可见,1例为磨玻璃密度肿块,仅肺窗可见;病理证实肺癌6例,转移性肺癌2例。7例纵隔窗可见实性肿块的平均最大径径约(39.48±19.34)mm(多发者以最大者直径计算)。
本组肺窗检出肺大疱、肺气肿、纤维灶、结节、炎症及支气管扩张6种病变优于纵隔窗,磨玻璃密度肿块则仅肺窗可见;纵隔窗检出胸膜增厚优于肺窗;而对检出肺部肿块、钙化灶和胸腔积液,肺窗与纵隔窗差异无统计学意义。见表1、图1~3。
2.2 不同组别患者肺部病变情况 仅肺窗可见病变中,老年组(191/494,38.67%)与中青年组(92/506,18.18%)差异有统计学意义(P<0.001);吸烟组(143/348,41.09%)和非吸烟组(140/652,21.47%)差异有统计学意义(P<0.001;表2)。
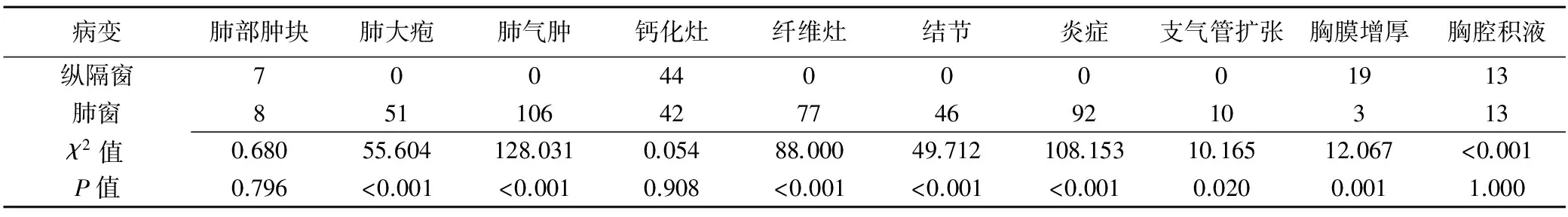
表1 肺窗与纵隔窗检出肺部病变情况(例,n=308)
3 讨论
本研究通过对头颈CTA所包括肺部组织进行大样本纵隔窗和肺窗观察,发现在28.30%(283/1 000)患者以肺窗观察图像可发现肺部病变,且大多数病变仅肺窗可见,尤其是磨玻璃密度肿块,提示放射科医师在临床工作中,阅读头颈CTA图像时,应将以肺窗观察图像作为常规程序。
高宗辉等[6]纳入100例肿瘤患者,并与腹部CT软组织窗对比,分析肺窗和骨窗观察后是否可增加病变检出,结果提示多窗宽窗位调节可增加对于病变特性的显示能力,从而提高诊断准确率,且认为对于癌症史患者或临床高度可疑癌症患者,进行多窗宽窗位调节有利于提高诊断效益。刘文洪等[10]探讨MSCT冠状动脉成像肺窗对肺部病变的检出情况,认为其对肺部病变的临床诊断具有重要价值,可避免漏诊延误病情。Rinaldi等[7]针对腹部CT检查所包括肺底组织的小结节进行研究,认为放射科医师常常忽略腹部CT扫描图像中的肺部情况,可能影响患者的后续治疗。本研究纳入患者多系因颅内病变或头颈血管疾病而接受头颈CTA,而非肿瘤患者,且头颈部肿瘤病变即使发生转移也多见于颈部淋巴结,而非肺尖组织,故本研究可在一定程度上视为大样本普查。此外,本研究针对的肺部病变更广(不局限于小结节),并且探讨了对于特定人群(老年人及吸烟患者)进行肺窗观察的价值。

表2 不同组别肺部病变的检出情况[例(%)]
本组7例患者的实性肿块体积较大,纵隔可见,未出现漏诊。Wang等[11]认为磨玻璃密度结节是肺恶性肿瘤的独立预测因子,但易出现漏诊或误诊。本研究仅发现1例肿块为磨玻璃密度,由于未进行肺窗观察而漏诊,延迟10个月后才获检出。Yao等[12]提出了检出肺磨玻璃密度病变的最佳窗宽窗位,并认为检出恶性病变的最佳窗宽窗位绝对值均低于良性病变,故调节窗宽窗位可以鉴别肺部良恶性病变。
本研究中在对38.67%老年组、41.09%吸烟组患者进行肺窗观察后发现了新的肺部病变。随着年龄增长,老年人的肺结构和功能明显下降,易患疾病,常见肺部疾病主要有肺炎、慢性阻塞性肺病、哮喘、肺癌和特发性肺纤维化等[13]。Morse等[14]研究表明,吸烟是慢性阻塞性肺病和间质性肺病的最大危险因素,常引起肺纤维化和肺气肿。吸烟也是肺癌的主要危险因素[15-16]。本组 8例肺癌,其中5例为吸烟者。CT上老年人或吸烟者慢性肺部疾病常表现为肺气肿、肺大疱、肺纤维灶或间质改变等,上述病变仅肺窗可见。因此,对于老年人和吸烟者,在分析头颈CTA图像时,观察肺窗尤其重要。
本研究属于回顾性研究,由于患者存在个体差异,且在头颈CTA中所包括肺部组织大小不同,可能造成一定的结果偏倚。
总之,观察头颈CTA肺窗图像可增加肺部病变的显示率,对于老年人(≥60岁)或长期吸烟者尤有意义。
[参考文献]
[1] Cai W, Hu CH, Wang XM, et al. Applied research of "quadri-low" combined with automatic tube current modulation and iterative model reconstruction technology in head and neck CT angiography. Zhonghua Yi Xue Za Zhi, 2018,98(1):30-35.
[2] 白国刚,陈思平.PACS系统中显示器质量控制方法的研究.中国医学影像技术,2003,19(3):367-369.
[3] 许建铭,邓力.PACS的临床应用.中国医学影像技术,2004,20(9):1440-1442.
[4] 乞文旭,潘诗农,郭启勇,等.256层螺旋CT诊断肋软骨骨折:窗宽、窗位优化分析.中国医学影像技术,2010,26(2):355-357.
[5] Esfahani MZ, Khajouei R, Baneshi MR. Augmentation of the think aloud method with users' perspectives for the selection of a picture archiving and communication system. J Biomed Inform, 2018. doi: 10.1016/j.jbi.2018.02.017.
[6] 高宗辉,王冬梅.上腹部CT扫描调节骨窗肺窗的意义.中国医学影像学杂志,2003,11(5):345-346,376.
[7] Rinaldi MF, Bartalena T, Giannelli G, et al. Incidental lung nodules on CT examinations of the abdomen: Prevalence and reporting rates in the PACS era. Eur J Radiol, 2010,74(3):e84-e88.
[8] 吕发金,谢鹏,罗天友,等.数字减影CT血管成像在蛛网膜下腔出血诊断中的价值.中国医学影像技术,2007,15(1):45-48.
[9] 白人驹,韩萍,于春水,等.医学影像诊断学.北京:人民卫生出版社,2001:190-194.
[10] 刘文洪,罗光华,赵衡,等.利用螺旋CT冠状动脉成像中源图像对冠状动脉以外其它病变的诊断分析.航空航天医学杂志,2017,28(4):414-417.
[11] Wang X, Xu YH, Du ZY, et al. Risk factor analysis of the patients with solitary pulmonary nodules and establishment of a prediction model for the probability of malignancy. Zhonghua Zhong Liu Za Zhi, 2018,40(2):115-120.
[12] Yao G. Value of window technique in diagnosis of the ground glass opacities in patients with non-small cell pulmonary cancer. Oncol Lett, 2016,12(5):3933-3935.
[13] Akgün KM, Crothers K, Pisani M. Epidemiology and management of common pulmonary diseases in older persons. J Gerontol A Biol Sci Med Sci, 2012,67(3):276-291.
[14] Morse D, Rosas IO. Tobacco smoke-induced lung fibrosis and emphysema. Annu Rev Physiol, 2014,76(76):493-513.
[15] Kameyama N, Chubachi S, Hegab AE, et al. Intermittent exposure to cigarette smoke increases lung tumors and the severity of emphysema more than continuous exposure. Am J Respir Cell Mol Biol, 2018. doi: 10.1165/rcmb.2017-0375OC.
[16] Zhang P, Nie X, Bie Z, et al. Impact of heavy smoking on the benefits from first-line EGFR-TKI therapy in patients with advanced lung adenocarcinoma. Medicine (Baltimore), 2018,97(9): e0006.