量化MRI活体示踪新型顺磁性铁纳米粒子标记SD大鼠脂肪源性干细胞
2018-05-21汤间仪马伟琼张宝林雷正贤陈惠娴吴敏仪张鼎旋
谢 琦,汤间仪,马伟琼,张宝林,雷正贤,陈惠娴,吴敏仪,张鼎旋
(1.广州医科大学附属广州市第一人民医院 广州市南沙中心医院医学影像科,广东 广州 510180;2.广州市中西医结合医院放射科,广东 广州 510800;3.惠州中心人民医院放射科,广东 惠州 516001;4.桂林理工大学材料科学与工程学院,广西 桂林 541000)
干细胞移植后, 可用MR活体示踪成像监测干细胞在宿主体内的存活、迁移以及与宿主组织的整合情况[1-2]。前期研究[3-5]发现经改良多醇法加入聚乙二醇/聚乙烯亚胺(polyethylene glycol/polyehthyleneimine, PEG/PEI)修饰,合成表面为正电荷的氧化铁纳米粒子(polyehthyleneimine modified superparamagnetic iron oxide, PEG/PEI-SPIO)具有更高的稳定性、溶解性和强磁性,且可在细胞水平不需转染剂而直接高效率标记脂肪源性干细胞(adipose derived stem cells, ADSCs)。本研究观察MRI活体示踪SD大鼠慢性脑缺血模型颅内移植经PEG/PEI-SPIO标记的ADSCs 的效果。
1 材料与方法
1.1 模型制作 30只SPF级雌性SD大鼠(购于广东省医学实验动物中心),7~8周龄,体质量180~200 g,按文献[6-7]方法永久性结扎双侧颈总动脉6个月,制成大鼠慢性脑缺血模型。术后将大鼠分笼饲养于SPF级动物实验室,确保适宜的温度、湿度,饲养6个月。本实验获广州医学院动物实验伦理委员会批准。
1.2 ADSCs移植
1.2.1 ADSCs的提取、纯化、鉴定与PEG/PEI-SPIO的标记 提取4周龄以内SD大鼠腹股沟处脂肪组织,经消化、离心、纯化至P3代细胞进行细胞表面抗原鉴定;将P3代ADSCs加入PEG/PEI-SPIO共孵育培养进行标记,采用细胞计数板计算并调整标记细胞密度至105/3 μl悬液,置于无菌EP管,37℃水浴保温,用于移植实验[3-4]。
1.2.2 标记后ADSCs的移植 将大鼠模型分为PEG/PEI-SPIO标记细胞移植组和未标记细胞移植组,每组15只。采用10%水合氯醛(350 mg/kg体质量)腹腔注射麻醉大鼠,将其保定于脑立体定位仪,选取右侧侧脑室为移植区,坐标为前囟后0.8 mm,前囟旁1.5 mm,深度5.5 mm[7],注入标记或未标记ADSCs悬液105/3 μl。术中大鼠体温维持在36.5℃。
1.3 MR成像 于移植术后第7天、14天、21天,每组各取5只模型鼠行颅脑MR成像。采用Siemens Vrio Tim 3.0T MR扫描仪,7 cm腕关节线圈,参照文献[7]定位、麻醉,行以下序列扫描:T1W,TR 600 ms,TE 12 ms,FOV 70 mm×60 mm,矩阵256×233,层厚3.0 mm;T2W,TR 3 700 ms,TE 109 ms,FOV 70 mm×60 mm,矩阵256×256,层厚3.0 mm;T2*W,TR 520 ms,TE 20 ms,FOV 70 mm×60 mm,矩阵256×206,层厚3 mm;T2-mapping,TR 1 100 ms,TE 16、32、48、64 ms,FOV 70 mm×70 mm,矩阵256×206,层厚3.0 mm;SWI:TR 120 ms,TE 45 ms,FOV 80 mm×40 mm,矩阵256×243,层厚0.7 mm。
1.4 病理学检查 MR扫描结束后,即对移植后的模型鼠进行心脏灌流固定,取鼠脑,于4%多聚甲醛中固定24 h,参照文献[7]切片,取材从视交叉纹状体层面到海马层面、小脑层面,脱水后经石蜡包埋,分两部分用于常规HE染色及普鲁士蓝染色。
1.5 数据采集
1.5.1 测量T2值 在T2-mapping图像上,于颞顶叶皮质、海马、小脑选取大小、位置尽量相近的ROI,测量各ROI的T2值,见图1、2。

图1 参考大鼠脑立体定位图谱,距离基线(听耳线)的位置为6 mm,选取ROI 1、2代表颞顶叶皮质,3、4代表海马 图2 参考大鼠脑立体定位图谱,位于基线(听耳线)的位置,选取ROI 1、2代表小脑
1.5.2 普鲁士蓝染色 参照T2-mapping图像测量T2值的ROI相应层面,取大鼠相应部位切片4张,于高倍镜下(×400)左、右两侧颞顶叶皮质、海马、小脑分别随机选取5个视野进行测量,使每个区域5个视野应尽可能大小、位置相同,观察蓝染颗粒数量。
1.6 统计学分析 采用SPSS 18.0统计分析软件。所有计量资料均以±s表示,符合正态分布且方差齐;采用独立样本t检验比较2组同一脑区、同一时间点的T2值、蓝染颗粒数量;采用配对样本t检验比较同一时间点左右两侧脑区的T2值、蓝染颗粒数量;以P<0.05为差异有统计学意义。
2 结果
2.1 MR表现 于T2WI、T2*WI、SWI可见2组颞顶叶皮质、海马散在类圆形低信号区,以T2*WI显示最佳;SWI对比度虽好,但难以排除血管影响(图3、4)。小脑均未发现明显异常低信号区。
2.2 T2值 移植后第7天,2组各脑区T2值差异无统计学意义(P均>0.05);第14天,标记细胞移植组右侧颞顶叶皮质、右侧海马T2值较未标记细胞移植组缩短(t=4.795、2.998,P=0.013、0.045),其余各脑区2组间T2值差异均无统计学意义(P均>0.05);第21天,标记细胞移植组右侧颞顶叶皮质T2值较未标记细胞移植组缩短(t=3.958,P=0.007),其余各脑区2组间T2值差异均无统计学意义(P均>0.05);见表1。
2.3 普鲁士蓝染色 2组大脑颞顶叶皮质、海马均可见散在蓝染颗粒,小脑组织内未见明确蓝色颗粒。标记细胞移植组和未标记细胞移植组移植后各时间点各脑区蓝染颗粒数量见表2,标记细胞移植组移植后各时间点各脑区蓝染颗粒数量均较未标记细胞移植组相应时间点脑区数量多;2组移植后第14天右侧颞顶叶皮质、右侧海马及第21天右侧颞顶叶皮质蓝染颗粒数量差异有统计学意义(t=2.283、1.841、2.062,P=0.029、0.043、0.032)。
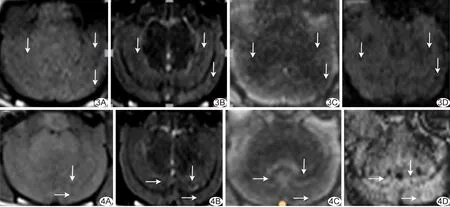
图3 未标记细胞移植组MRI T1WI(A)、T2WI(B)、T2*WI(C)、SWI(D)于颞顶叶皮质及海马区可见散在类圆形低信号区(箭) 图4 标记细胞移植组MRI T1WI(A)、T2WI(B)、T2*WI(C)、SWI(D)于颞顶叶皮质、海马区均见散在类圆形低信号区(箭)

组别移植后第7天右侧颞顶叶皮质右侧海马右侧小脑左侧颞顶叶皮质左侧海马左侧小脑标记细胞移植组64.25±1.0866.90±1.5470.52±5.5165.08±2.0967.95±0.7772.73±8.76未标记细胞移植组64.28±2.2365.10±2.3070.80±1.4262.73±2.6164.70±2.6768.70±0.24t值0.0100.6500.0480.7031.1700.459P值0.9920.5400.9630.5080.2860.677组别移植后第14天右侧颞顶叶皮质右侧海马右侧小脑左侧颞顶叶皮质左侧海马左侧小脑标记细胞移植组49.83±0.5055.60±0.3370.83±5.6959.05±1.5364.20±3.2872.53±4.94未标记细胞移植组59.73±2.0162.68±2.3462.78±3.2657.40±1.3364.90±0.4968.83±4.25t值4.7952.9981.2270.8150.2111.730P值0.0130.0450.2770.4470.8400.134组别移植后第21天右侧颞顶叶皮质右侧海马右侧小脑左侧颞顶叶皮质左侧海马左侧小脑标记细胞移植组55.58±1.6264.20±2.3670.88±3.1459.05±1.9265.68±2.2269.05±3.54未标记细胞移植组62.55±0.7065.48±6.0968.60±4.5760.65±0.8369.00±2.8756.50±3.53t值3.9581.7262.2140.7640.9162.109P值0.0070.1350.0690.4740.3950.056
表2 2组干细胞移植后不同时间不同脑区蓝染颗粒数量比较(个/mm2,±s,n=5)

表2 2组干细胞移植后不同时间不同脑区蓝染颗粒数量比较(个/mm2,±s,n=5)
组别移植后第7天右侧颞顶叶皮质左侧颞顶叶皮质右侧海马左侧海马标记细胞移植组6.40±1.705.80±1.165.20±1.045.60±0.88未标记细胞移植组6.40±0.885.20±1.204.00±0.844.80±1.31t值0.0000.7930.8960.561P值1.0000.3610.3820.618组别移植后第14天右侧颞顶叶皮质左侧颞顶叶皮质右侧海马左侧海马标记细胞组16.40±6.5813.00±5.0016.60±4.8313.0±4.99未标记细胞组6.70±1.348.40±1.246.20±1.106.00±1.21t值2.2831.1331.8411.460P值0.0290.1550.0430.059组别移植后第21天右侧颞顶叶皮质左侧颞顶叶皮质右侧海马左侧海马标记细胞组18.00±8.3410.10±3.517.60±1.267.10±1.27未标记细胞组8.20±2.157.50±0.975.80±1.416.00±1.92t值2.0620.4670.0980.026P值0.0320.6750.9430.989
3 讨论
既往研究[8-11]表明,脑缺血第1周时常规HE染色组织切片未见大鼠海马CA1区神经元受损,第2周时6%~29%大鼠海马CA1区可见有神经元损伤,第4周时增加至55%,到第8~13周时可增加至67%,提示脑缺血具有选择性易损脑区,大脑皮层、丘脑、海马、纹状体均为缺血损伤的敏感脑区,其中以海马最为敏感。本实验选择大鼠海马、颞顶叶皮质和小脑放置ROI,发现细胞移植后颞顶叶皮质、海马出现低信号,与既往研究[6-7]结果相符;小脑区未出现异常信号,考虑双侧颈总动脉永久性结扎术致大鼠慢性脑缺血时,虽然大鼠颅内血流量显著下降,但由于小脑由椎基底动脉供血,小脑血流量下降不明显,不易受损。
研究[12-13]表明,移植入脑内SPIO标记的干细胞可定向迁移至脑损伤部位,推测注射入脑室的干细胞多分布于脑脊液,损伤区域血脑屏障和脑脊液屏障受到破坏,脑脊液流速和循环较正常区域明显增加,故移植入脑室的干细胞可向损伤部位迁徙[14]。本实验标记细胞移植组在移植后第14天右侧颞顶叶皮质和海马及第21天右侧颞顶叶皮质的T2值较未标记细胞移植组缩短,相应大鼠脑标本普鲁士蓝染色显示蓝染颗粒计数亦增多,提示慢性脑缺血可致受损部位铁含量增加,T2WI、T2*WI表现为低信号,推测PEG/PEI-SPIO标记的ADSCs可向因慢性脑缺血致受损的颞顶叶皮质、海马迁移,表明对于慢性脑缺血大鼠模型,采用临床型3.0T MR T2值活体示踪移植PEG/PEI-SPIO标记ADSCs脑内迁移和分布是可行的。
本实验发现移植后第21天时,2组右侧海马区T2值差异无统计学意义,而右侧颞顶叶皮质区差异有统计学意义,普鲁士染色蓝染颗粒计数亦呈相同变化。考虑原因,可能在于随细胞增殖分裂,细胞内SPIO浓度逐渐稀释到低于MRI可探测的数值;而从右侧脑室注射入的移植干细胞多随脑脊液循环进入颞顶叶皮质区,海马区细胞则通过白质神经束循环进入,相对较少。此外,移植细胞还可穿透胼胝体进入对侧大脑半球,但数量更少,也难以进行MR示踪[12]。
本实验结果显示,带正电荷的PEG/PEI-SPIO标记ADSCs移植入慢性脑缺血大鼠模型后,采用临床型3.0T MR T2值可活体示踪移植细胞在大鼠脑内的迁移和分布,以同侧颞顶叶皮质区明显,可持续到移植后第21天,而海马区及对侧大脑半球难以示踪。本实验的主要不足:动物模型数量少,观察时长有限。活体情况下,PEG/PEI-SPIO颗粒在ADSCs内能持续标记的最长时间,以及ADSCs分化或凋亡后PEG/PEI-SPIO颗粒的代谢情况等有待进一步观察。
[参考文献]
[1] Liu XL, Zhang W, Tang SJ. Intracranial transplantation of human adipose-derived stem cells promotes the expression of neurotrophic factors and nerve repair in rats of cerebral ischemia-reperfusion injury. Int J Clin Exp Pathol, 2014,7(1):174-183.
[2] Im W, Ban J, Lim J, et al. Extracts of adipose derived stem cells slows progression in the R6/2 model of Huntington's disease. PLoS One, 2013,8(4):e59438.
[3] 马伟琼,谢琦,张鼎旋,等.多元醇法合成SPIO标记大鼠ADSCS的成神经诱导潜能及体外MR成像.中国介入影像与治疗学,2015,12(11):686-690.
[4] 马伟琼,谢琦,张鼎旋,等.新型超顺磁性氧化铁标记SD大鼠脂肪干细胞的有效性及安全性研究.放射学实践,2016,31(5):386-392.
[5] Yang G, Ma W, Zhang B, et al. The labeling of stem cells by superparamagnetic iron oxide nanoparticles modified with PEG/PVP or PEG/PEI. Mater Sci Eng C Mater Biol Appl, 2016,62:384-390.
[6] 马伟琼,谢琦,陈明旺,等.临床医用1.5T磁共振对AD模型大鼠的颅脑MR成像研究.中国CT和MRI杂志,2014,12(6):1-3.
[7] 徐海侠.两血管闭塞联合高Cu2+喂养法致大鼠痴呆模型的MR成像研究.广州:广州医学院,2010:1.
[8] Ma Y, Qu Y, Fei Z. Vascular endothelial growth factor in cerebral ischemia. J Neurosci Res, 2011,89(7):969-978.
[9] Farkas E, Institóris A, Domoki F, et al. The effect of pre-and posttreatment with diazoxide on the early phase of chronic cerebral hypoperfusion in the rat. Brain Res, 2006,1087(1):168-174.
[10] Liu J, Jin DZ, Xiao L, et al. Paeoniflorin attenuates chronic cerebral hypoperfusion-induced learning dysfunction and brain damage in rats. Brain Res, 2006,1089(1):162-170.
[11] Lee B, Sur BJ, Kwon S, et al. Acupuncture stimulation alleviates corticosterone-induced impairments of spatial memory and cholinergic neurons in rats. Evid Based Complement Alternat Med, 2012,2012:670536.
[12] Wennersten A, Meier X, Holmin S, et al. Proliferation, migration, and differentiation of human neural stem/progenitor cells after transplantation into a rat model of traumatic brain injury. J Neurosurg, 2004,100(1):88-96.
[13] Guzman R, Uchida N, Bliss TM, et al. Long-term monitoring of transplanted human neural stem cells in developmental and pathological contexts with MRI. Proc Natl Acad Sci U S A, 2007,104(24):10211-10216.
[14] Johanson CE, Duncan JA, Stopa EG, et al. Enhanced prospects for drug delivery and brain targeting by the choroid plexus-CSF route. Pharm Res, 2005,22(7):1011-1037.