制备叶酸受体靶向载阿霉素/黑色素多功能造影剂及体外超声/光声显像
2018-05-21姚元志王志刚
姚元志,王志刚,张 亮,王 冬,李 芳*
(1.重庆市肿瘤医院 重庆市肿瘤研究所 重庆大学附属肿瘤医院超声医学科,重庆 400030;2.重庆医科大学超声影像学研究所,重庆 400010;3.重庆医科大学附属第一医院超声科,重庆 400016)
为提高疾病治愈率,高敏感、高精准诊疗技术的应用必不可少[1]。分子影像学技术在疾病早期诊断和靶向治疗领域极具发展潜力和应用前景[2-3]。黑色素作为一种天然生物色素,具有特征性的光声效应和良好的生物相容性,是光声成像的理想靶标[4-5]。本研究以叶酸为靶针,磷脂高分子微粒为载体,制备包裹黑色素/阿霉素的多功能分子探针,观察其体外寻靶和体外超声、光声显像能力。
1 材料与方法
1.1 主要试剂与设备 磷脂PEG叶酸[DSPE-PEG(2000)Folate]、磷脂酰胆碱(DSPC)、磷脂酰乙醇胺(DPPE)、胆固醇(Avanti公司)、黑色素(Sigma公司);C3F8(天津核工业理化工程研究所);RE-52A旋转蒸发仪(上海亚荣生化仪器厂);XL2020声震仪(美国Heat System Inc);Malvern激光粒径检测仪(美国Zetesize公司);UV-2500紫外-可见分光光度计(日本Shimadzu公司);正置光学显微镜(日本Olympus公司);Mylab90彩色超声诊断仪(意大利Esaote公司);VevoRLAZR光声成像系统(加拿大VisualSonics 公司)。
1.2 制备叶酸受体靶向载阿霉素/黑色素多功能造影剂 称取一定质量比(10∶4∶3∶3)DSPC、DSPE-PEG(2000)Folate、DPPE、胆固醇溶于10 ml氯仿中,加热待其完全溶解,置于旋转蒸发仪,55℃减压蒸发2 h去除溶剂,形成均匀脂质膜后加入PBS水化;将2 mg黑色素加入2 ml氢氧化钠溶液(pH=12)至其完全溶解后装入透析袋(M=12 000 kD),以稀盐酸溶液调整其pH为7.4,后取2 mg阿霉素溶于黑色素溶液中,形成黑色素阿霉素溶液;冰浴条件下,采用声振仪(脉冲式,功率100 W,时间10 min,工作10 s,暂停10 s)乳化脂质溶液并逐滴加入黑色素阿霉素溶液,得到载阿霉素/黑色素叶酸靶向脂质纳米粒。在4℃条件下将载阿霉素/黑色素叶酸靶向脂质纳米粒多次离心洗涤(12 000转/分,10 min),以2 ml双蒸水稀释,冷冻干燥24 h后减压充入C3F8气体保存待用。另外上述制备过程中加入普通DPPE替代DSPE-PEG(2000)Folate,步骤同前,得到普通载黑色素/阿霉素脂质纳米粒。
1.3 基本性能检测 双蒸水稀释叶酸受体靶向载阿霉素/黑色素脂质纳米粒至适宜浓度,光镜下观察其分布和形态,以Malvern激光粒径仪测量其粒径、表面电位。采用阿霉素对照样品做标准曲线,以紫外-可见光分光光度法测量阿霉素载药量(最大吸收波长483 nm)。
1.4 体外细胞寻靶能力 体外培养人乳腺癌MDA-MB-231细胞,取对数期细胞,以1×104/孔接种于激光共聚焦培养皿中,普通1 640培养液培养24 h后,移除培养液,加入无叶酸1 640培养液继续培养2 h。将以上细胞分为3组:①靶向造影剂组,在培养皿中加入经DiI染色的叶酸受体靶向载阿霉素/黑色素造影剂100 μl;②普通造影剂组,在培养皿中加入经DiI染色普通造影剂100 μl;③游离叶酸干预组,在培养皿中首先加入1 ml游离叶酸溶液(1 mol/L)封闭叶酸受体,再加入经DiI染色的叶酸受体靶向造影剂100 μl。上述各组正常培养2 h后,采用4%多聚甲醛固定,加入DiO染料着色细胞膜5 min,用PBS液多次反复冲洗去除游离造影剂及染料,于激光共聚焦显微镜下观察造影剂与细胞结合情况。
1.5 体外细胞毒性作用 将人乳腺癌MDA-MB-231细胞接种于96孔板中(1×104/孔),培养液为含10%胎牛血清1 640培养基,于全湿度培养箱(37℃、5%CO2)培养24 h后移除旧培养液,并分为阿霉素组、叶酸受体靶向造影剂组(阿霉素终浓度为0.2 μg/ml)及黑色素组、未载药造影剂组(与叶酸受体靶向造影剂组相同比例稀释)4组,以新鲜培养液继续孵育12 h、24 h和48 h。各组设置3个复孔,均重复3次实验。
每孔加入20 μl MTT液继续孵育4 h,弃上清,再加入DMSO溶液150 μl,轻振10 min后,在酶标仪上于490 nm波长下检测各孔吸光度(A值)。经以下公式测得细胞活性:细胞存活率(%)=1-(阿霉素组/叶酸受体靶向造影剂组/黑色素组A值-空白A值)/(未载药造影剂组A值-空白A值)×100%。
1.6 体外超声、光声双模态显像 采用琼脂糖凝胶为模型,取少量造影剂用双蒸水稀释至1 mg/ml,以单纯双蒸水为对照组。采用医用超声诊断仪观察基波及谐波模式下超声显影情况(LA523探头,频率4~13 MHz,增益70%,MI 0.12),并采用超声Flash辐照,作用3次后,继续观察其超声显影情况,并用超声定量仪进行定量分析。
取上述相同浓度造影剂于模型中,模型孔心距探头<1 cm,以波长为700 nm脉冲激光辐照,以双蒸水为对照,观察其光声成像情况。
1.7 统计学分析 采用SPSS 20.0统计分析软件。计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
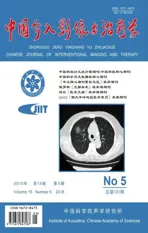
2.1 叶酸受体靶向载药造影剂的制备及其理化特性 本实验成功制备出叶酸受体靶向载阿霉素/黑色素脂质纳米粒,形态规则,大小均一,分散良好,外观呈棕色(图1、2),粒径为(659.60±27.56) nm,Zeta电位为(-38.90±4.00)mV。纳米粒在4 ℃下可稳定保存1周,冷冻干燥后充入C3F8气体可保存1个月以上。测得阿霉素载药量为85.72 μg/mg。
2.2 叶酸受体靶向造影剂体外靶向能力 在激光共聚焦显微镜下(图3),经DiI染色造影剂外壳呈红色,DiO染色细胞膜呈绿色。靶向造影剂组可见大量造影剂向MDA-MB-231细胞紧密聚集,在细胞表面较明显,部分被细胞吞噬于胞内;普通造影剂组和游离叶酸干预组未见或少见造影剂靶向聚集。
2.3 造影剂细胞毒性 阿霉素组和叶酸受体靶向造影剂组中,随着孵育时间延长,细胞存活率明显下降;2组间不同时间点细胞存活率差异有统计学意义(P均<0.05)。未载药造影剂组与黑色素组不同时间点细胞存活率差异无统计学意义(P均>0.05,图4)。
2.4 体外超声、光声双模态显像结果 叶酸受体靶向造影剂在超声基波及谐波模式下均出现明显超声回波信号[灰阶值强度分别为(63.25±4.52)dB和(41.64±3.14)dB],经超声Flash辐照后,超声基波模式下回波信号[灰阶值强度(38.51±2.62)dB]明显降低(P<0.05),而在谐波模式下超声回声信号基本消失[灰阶值强度(2.29±0.68)dB,P<0.05;图5];对照组在超声基波和谐波模式下均呈无回声。造影剂在波长700 nm脉冲激光辐照下具有良好光声成像效果,而对照组无光声信号(图6),造影剂与双蒸水的PA值分别为0.83 a.u和0.06 a.u(P<0.05)。
图1 靶向造影剂光镜图(×1000) 图2 靶向造影剂透射电镜图 图3 造影剂体外寻靶的共聚焦图(×600) A.靶向造影剂组; B.普通造影剂组; C.游离叶酸干预组 图4 不同时间点各组细胞的活性影响
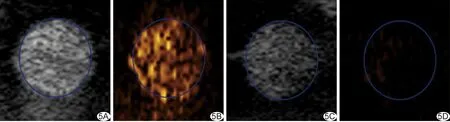
图5 叶酸受体靶向造影剂超声成像 A.超声Flash辐照前基波成像; B.超声Flash辐照前谐波成像; C.超声Flash辐照后基波成像; D.超声Flash辐照后谐波成像
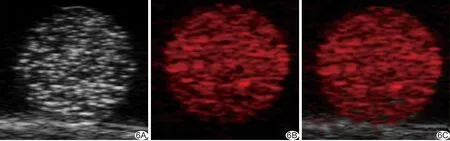
图6 叶酸受体靶向造影剂光声成像 A.超声成像图; B.光声成像图; C.超声和光声成像融合图
3 讨论
近年来,分子影像学的发展为肿瘤等重大疾病的早期诊疗提供了新手段[6-7]。超声分子探针的发展为应用超声早期诊断、精准治疗以及超声操控多功能诊疗提供了可能。以超声造影剂为载体,联合CT、MRI、核素、荧光成像剂,制备双模态或多模态造影剂,可实现优势互补,提高疾病早期诊断率。由于造影剂各种成分的理化特性、生物安全性等因素,制备多模态造影剂仍需进行安全风险评估,并面临制备工艺的挑战。
超声微泡粒径大和载药率低是其作为分子探针和药物载体发展的瓶颈。超声纳泡粒径小、稳定性较好、体内半衰期较长,能通过连接靶向介质实现精准定位、靶点显像的目的,携带基因、药物等后可同时实现精准治疗[8-9]。Fan等[10]研究表明,超声纳泡与临床应用的声诺维造影剂对增强超声显像具有较好的一致性。本课题组的前期研究[11]也证实脂质纳泡与声诺维微泡具有相同HIFU增效作用。本实验通过冷冻干燥-真空充气法制备叶酸受体靶向造影剂,在体外凝胶模型中证实了叶酸受体靶向载阿霉素/黑色素造影剂具有较好的超声成像能力。
光声成像是近年来超声多模态成像研究的热点之一,目前对金纳米粒子、碳纳米材料及人造染料等光声成像对比剂的研究最多[12]。黑色素广泛存在于人体皮肤及毛发中,在紫外波长范围内具有强烈的光吸收能力,是一种天然、安全、有效的光声成像对比剂[13]。本研究以黑色素为光声成像对比剂核心,以超声脂质微泡为载体,叶酸为靶向,制备包裹治疗药物-阿霉素的多功能造影剂,在体外模型中初步证实了叶酸受体靶向载阿霉素/黑色素多功能造影剂具有较好的主动靶向性能、细胞生物疗效和超声和光声成像能力。研究[14-15]显示,以超声造影剂为载体,携带各种治疗药物或基因,通过超声与造影剂作用的声孔效应,可以实现治疗药物的局部释放、减少全身不良反应及提高基因转染效率。
本研究的局限性:叶酸受体靶向载阿霉素/黑色素多功能造影剂在体超声显像效果还有待证实;黑色素具有良好的光声成像能力,尚需与目前研究热门的金纳米粒子、碳纳米材料以及人造染料等光声对比剂进行对比评估;造影剂有待进一步优化制备和深入研究。
综上所述,本实验制备的叶酸受体靶向载阿霉素/黑色素多功能造影剂是集靶向治疗、超声和光声多模态显像于一体的多功能造影剂,有望成为乳腺癌精准显像和治疗的理想分子探针。
[参考文献]
[1] 杭渤,束永前,刘平,等.肿瘤的精准医疗:概念,技术和展望.科技导报,2015,33(15):14-21.
[2] 李德智,陈宏达,毕锋,等.多模态分子影像技术在肿瘤诊断中的进展.分析化学,2016,44(10):1609-1618.
[3] Koczera P, Appold L, Shi Y, et al. PBCA-based polymeric microbubbles for molecular imaging and drug delivery. J Control Release, 2017,259(2017):128-135.
[4] Fan Q, Cheng K, Hu X, et al. Transferring biomarker into molecular probe: Melanin nanoparticle as a naturally active platform for multimodality imaging. J Am Chem Soc, 2014,136(43):15185-15194.
[5] Zhang R, Fan Q, Yang M, et al. Engineering melanin nanoparticles as an efficient drug-delivery system for imaging-guided chemotherapy. Adv Mater, 2015,27(34):5063-5069.
[6] 戴志飞.分子探针在重大疾病诊疗中的应用,机遇与挑战.科学通报,2017,62(1):25-35.
[7] 骆杰,王志刚.肝癌超声分子影像学的研究进展.中国介入影像与治疗学,2009,6(6):575-578.
[8] Yang H, Cai W, Xu L, et al. Nanobubble-Affibody: Novel ultrasound contrast agents for targeted molecular ultrasound imaging of tumor. Biomaterials, 2015,37:279-288.
[9] Yin T, Wang P, Zheng R, et al. Nanobubbles for enhanced ultrasound imaging of tumors. Int J Nanomedicine, 2012,7:895-904.
[10] Fan XZ, Wang LF, GuoYL, et al. Experimental investigation of the penetration of ultrasound nanobubbles in a gastric cancer xenagraft. Nanotechnology, 2013,24(32):325102.
[11] 姚元志,王志刚,杨珂,等.对比观察脂质纳泡与微泡在高强度聚焦超声消融兔肝中的增效作用.中国介入影像与治疗学,2015,12(8):493-498.
[12] 骆三,查正宝,李妍妍,等.光声成像造影剂的研究进展.现代生物医学进展,2014,14(25):4974-4977,4996.
[13] 邹宇,尹冬梅,胡文忠,等.天然黑色素理化性质与功能特性研究进展.食品工业科技,2012,33(24):445-447.
[14] Li P, Zheng YY, Ran HT, et al. Ultrasound triggered drug release from 10-hydroxycamptothecin-loaded phospholipid microbubbles for targeted tumor therapy in mice. J Control Release, 2012,162(2):349-354.
[15] Zhou Y, Gu HT, Xu Y, et al. Targeted antiangiogenesis gene therapy using targeted cationic microbubbles conjugated with CD 105 antibody compared with untargeted cationic and neutral microbubbles. Theranostics, 2015,5(4):399-417.