茶树菇β-葡萄糖苷酶的纯化及应用研究
2018-05-18杨成丽鲍炳鑫蒲姝瑾张煦彤李大力石若夫
陈 杏,杨成丽,鲍炳鑫,张 璇,蒲姝瑾,张煦彤,李大力,石若夫
(南京理工大学生物工程系,江苏南京210094)
β-葡萄糖苷酶属于水解酶类,它能催化β-D-糖苷类物质生成葡萄糖和糖苷配基。β-葡萄糖苷酶在生物体内广泛存在,包括细菌[1-2]、真菌[3-4]、植物[5-6]、动物[7-8]。β-葡萄糖苷酶在食品、医药工业等领域具有重要的应用价值。β-葡萄糖苷酶不仅能水解食品中β-糖苷类的风味前体物质[9],而且能制备多种药物活性分子,如京尼平[10]、大豆异黄酮苷元[11]、人参皂苷[12]。此外,β-葡萄糖苷酶在纤维素生物质的资源化领域有着不可替代的作用[13-14]。茶树菇是一类具有大型子实体的可食性真菌。在茶树菇的整个菌丝生长和出菇期间,分泌大量胞外β-葡萄糖苷酶,促进菌丝细胞对纤维素等大分子物质的降解和子实体的生长发育[15]。因此,茶树菇是一种能分泌高产量、安全性高的β-葡萄糖苷酶的酶源。目前,还未见研究茶树菇中β-葡萄糖苷酶的报道。我国是中药大国,提取有效成分后的中药残渣一般含有丰富的粗纤维,但这些残渣大多被当作废物垃圾处理。中草药提取生物活性成分的加工过程包括碾碎[16]、碱处理[17]、有机溶剂处理[18]等,因此,通过生物催化方法降解中药残渣,可简化预处理过程,而且得到的葡萄糖可作为一种重要的碳源,成为微生物发酵生产乙醇、甲醇的重要原料。本研究从茶树菇中分离纯化得到β-葡萄糖苷酶,并初步探索了茶树菇β-葡萄糖苷酶和纤维素酶对提取喜树碱后喜树果渣的协同糖化作用。
1 材料与方法
1.1 材料
茶树菇子实体购自江苏省南京市孝陵卫农贸市场,对硝基苯-β-D-葡萄糖苷(pNPG)购自Aladdin公司。其他试验所用的试剂均购自国药集团化学试剂有限公司。主要试验设备为高速冷冻离心机(himac CR21G)、紫外-可见分光光度计(HITACHI)、数显高速均质机(杭州齐威仪器有限公司)、切向流超滤装置(Millipore Pellicon-2)、制备电泳仪(BIO-RAD 491型)。
1.2 方法
1.2.1 茶树菇β-葡萄糖苷酶的分离纯化 称取茶树菇子实体,充分匀浆,纱布过滤得到滤过液,将滤过液于4℃、10 000 g下离心10 min,上清液即为粗酶液。依次使用截留分子量为500、10 ku的超滤膜进行浓缩分离,得到的酶液经40%~85%饱和度的硫酸铵分级沉淀后,透析。利用美国BIO-RAD 491型制备型电泳仪纯化酶蛋白。以5%浓缩胶和10%分离胶进行聚丙烯酰胺凝胶电泳,使用磷酸缓冲液(50 mmol/L,pH值 7.0)洗脱。电泳过程在低温下进行,工作电压为200 V。
将纯化后的酶蛋白分别进行Native-PAGE和SDSPAGE。Native-PAGE使用含0.05%的β-D-葡萄糖苷-4-甲基伞形酯的琼脂覆盖层染色[19]。
1.2.2 β-葡萄糖苷酶活性测定方法 在1 mL柠檬酸 -Na2HPO4缓冲液(50 mmol/L,pH值 6.0)中加入 100μL pNPG(8 mmol/L),再加入100μL酶液,50℃反应 10 min,然后加入 1.5 mL Na2CO3(0.1 mmol/L)终止反应,在 410 nm下测定吸光度的变化。空白对照用蒸馏水代替酶液。酶活单位定义:在最适反应条件下,1 min催化生成1μmol的对硝基苯酚所需要的酶量定为1个酶活单位(U)。
1.2.3 最适pH值和温度的测定 配制不同pH值的柠檬酸 -Na2HPO4缓冲液,pH值为3.0~8.0,浓度为50 mmol/L,测定酶在不同pH值缓冲液中的酶活性以考察酶反应的最适pH值。通过测定酶在不同温度中的酶活性以考察酶反应的最适温度,温度水平为20~80℃。
1.2.4 β-葡萄糖苷酶稳定性的测定 将β-葡萄糖苷酶分别放置在不同pH值的柠檬酸-Na2HPO4缓冲液(pH值5.0、6.0、8.0)中,于4、50℃保存不同时间(0~3 h),以 30 min为间隔取样,在最适反应条件下测定残留酶活性。
1.2.5 β-葡萄糖苷酶动力学参数的测定 反应体系中,加入 pNPG的终浓度为 6.67~666.7μmol/L,得到不同 pNPG浓度下的反应速率。米氏常数Km和最大反应速率Vmax根据试验数据通过双倒数作图法求得。
1.2.6 茶树菇β-葡萄糖苷酶与纤维素酶协同糖化提取喜树碱后喜树残渣的研究 从成年喜树上采集果实,晒干并粉碎成粉末,称取10 g喜树果实的粉末,加入100 mL 90%乙醇,在70℃下浸提1 h,将料液离心,回收残渣,经水洗、干燥后,作为糖化的原料。
以乙醇浸提的喜树果实残渣为原料,对β-葡萄糖苷酶与纤维素酶协同糖化作用进行研究。在1.6 mL柠檬酸-柠檬酸钠缓冲液(50 mmol/L,pH值 6.0)中,残渣的浓度为0625%,同时加入纤维素酶(30 U)和β-葡萄糖苷酶(1 U),50℃下水解48 h,比较单酶法(纤维素酶)和双酶法(β-葡萄糖苷酶与纤维素酶)处理残渣时还原糖和葡萄糖含量随时间的变化情况。
2 结果与分析
2.1 β-葡萄糖苷酶分离纯化结果
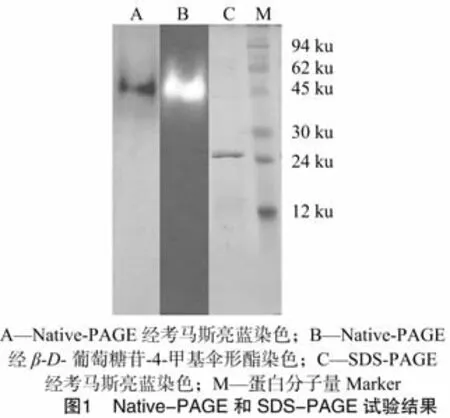
经分离纯化得到的酶液Native-PAGE和SDS-PAGE结果如图1所示。制备电泳纯化的酶液经 Native-PAGE,β-葡萄糖苷酶活性区域在紫外线观察下显示为荧光条带,将此凝胶进一步使用考马斯亮蓝染色,出现单一条带,说明得到了纯化的β-葡萄糖苷酶。将制备电泳纯化的酶液和蛋白分子量 Marker经 SDS-PAGE,并使用考马斯亮蓝染色,β-葡萄糖苷酶染色后出现单一条带,与蛋白分子量Marker比较,β-葡萄糖苷酶的相对分子质量为26 ku。
2.2 β-葡萄糖苷酶的最适pH值和温度
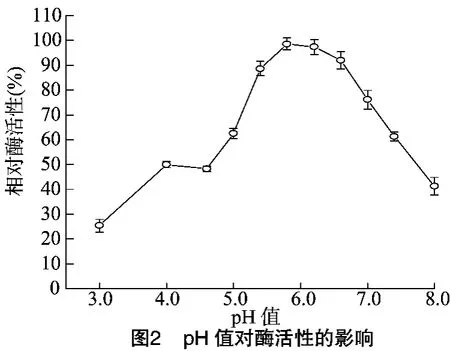
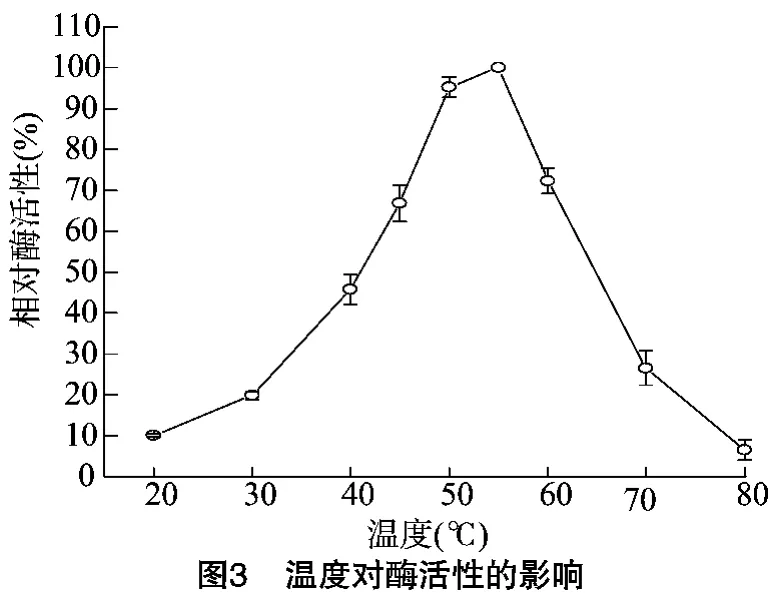
pH值对酶活性的影响如图2所示,β-葡萄糖苷酶在pH值6.0下酶活性最大,在pH值5.5~6.5范围内时,酶活性保持在85%以上,当pH值<5.5或者pH值>6.5时,酶活性下降明显。温度对酶活性的影响如图3所示,β-葡萄糖苷酶在50~55℃下表现出最大的催化反应活性,在较低的温度范围(20~50℃)内,β-葡萄糖苷酶的反应速率随温度升高而增大,但当温度高于55℃后,酶活性急剧下降。
2.3 β-葡萄糖苷酶的pH值耐受性和温度耐受性
如图4所示,在pH值 6.0、4℃下,β-葡萄糖苷酶的酶活性基本不变。在最适反应条件(pH值 6.0、50℃)下,1 h后,酶活性剩余80%以上;3 h后,酶活性剩余60%以上。在环境温度为50℃下,β-葡萄糖苷酶在pH值6.0的耐受性高于 pH值5.0和 pH值8.0。
2.4 β-葡萄糖苷酶的动力学参数
β-葡萄糖苷酶对底物pNPG的水解反应符合米氏方程,双倒数作图法计算得出米氏常数Km为0.114 mmol/L,最大反应速率 Vmax为 10.96μmol/(L·min)。
2.5 茶树菇β-葡萄糖苷酶与纤维素酶协同糖化喜树残渣
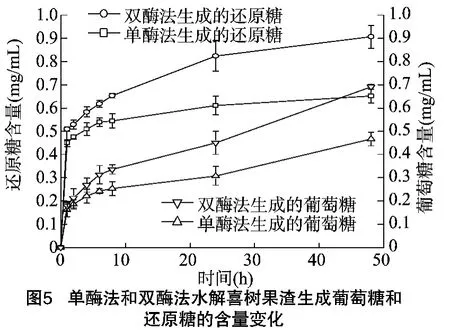
本试验使用的原料为乙醇浸提喜树碱后的喜树果渣,研究茶树菇β-葡萄糖苷酶与纤维素酶对其的协同糖化作用。图5为单酶法和双酶法水解喜树果渣生成葡萄糖和还原糖的含量随水解时间变化的情况。从图5可知,双酶水解48 h后,还原糖与葡萄糖的含量分别为 0.90、0.69 mg/mL,相比于单酶(纤维素酶)处理提高了39.17% 、48.15%。因此,以喜树残渣为原料酶法制备葡萄糖时,双酶法相较于单酶法葡萄糖的生成量明显增加。

3 讨论与结论
茶树菇β-葡萄糖苷酶的相对分子量为26 ku,最适温度及最适pH值分别为50℃和6.0,在最适反应条件下具有较好的温度和pH值耐受性。以乙醇浸提喜树碱后的喜树果渣为原料,经β-葡萄糖苷酶和纤维素酶的协同水解作用后,还原糖和葡萄糖的生成量有明显增加。本试验对中药残渣进行了再利用,有利于解决残渣堆积造成的环境污染问题,实现中药残渣的资源化和价值提升。
参考文献:
[1]Asha BM,Pathma J,Sakthivel N.Isolation and characterization of a novel thermostableβ-glucosidase from Bacillus subtilis SU40[J].Applied Biochemistry and Microbiology,2015,51(1):21-26.
[2]Dong M,Fan M T,Zhang Z,et al.Purification and characterization of β-glucosidase from Oenococcus oeni 31MBR[J].European Food Research and Technology,2014,239(6):995-1001.
[3]Park A R,Hong JH,Kim J J,et al.Biochemical characterization of an extracellularβ-glucosidase from the fungus,Penicillium italicum,isolated from rotten citrus peel[J].Mycobiology,2012,40(3):173-180.
[4]Rashid M H,Siddiqui K S.Purification and characterization ofbetaglucosidase from Aspergillus niger[J].Folia Microbiologica,2016,19(3):652-661.
[5]Sener A.Extraction,partial purification and determination of some biochemical properties ofβ-glucosidase from tea leaves(Camellia sinensis L.)[J].Journal of Food Science and Technology,2015,52(12):8322-8328.
[6]Espindola Mateos S,Matias Cervantes C A,Slomianny M C,et al.Purification and partial characterization ofβ-glucosidase in chayote(Sechium edule)[J].Molecules,2015,20(10):19372-19392.
[7]Akemi U C,Tokuda G,Watanabe H A,et al.A novel glucosetolerantβ-glucosidase from the salivary gland of the termite Nasutitermes takasagoensis[J].Journal of General and Applied Microbiology,2013,59(2):141-145.
[8]Pontoh J,Low N H.Purification and characterization ofβglucosidase from honey bees(Apismellifera)[J].Insect Biochemistry and Molecular Biology,2002,32(6):679-690.
[9]Agrawal R V A,Satlewal A.Application of nanoparticleimmobilized thermostableβ-glucosidase for improving the sugarcane juice properties[J]. Innovative Food Science & Emerging Technologies,2016,33:472-482.
[10]Gong G,Zheng Z,Liu H,et al.Purification and characterization of a β-glucosidase from Aspergillus niger and its application in the hydrolysis of geniposide to genipin[J].Journal of Microbiology and Biotechnology,2014,24(6):788-794.
[11]Maitan-Alfenas G P,de Alage L G,de Almeida M N,et al.Hydrolysis of soybean isoflavones by Debaryomyceshansenii UFV-1 immobilised cells and freeβ-glucosidase[J].Food Chemistry,2014,146(1):429-436.
[12]Xu C C,Yu B H,Wang H L,et al.Transformation of minor ginsenoside Rd and CK by recombinant thermostableβ-glucosidase[J].Chemical Journal of Chinese Universities,2016,37(2):281-289.
[13]Borges D G,Baraldo Junior A,Farinas C S,et al.Enhanced saccharification of sugarcane bagasse using soluble cellulase supplemented with immobilizedβ-glucosidase[J].Bioresource Technology,2014,167(3):206-213.
[14]Kurniasih SD,Alfi A,Natalia D,et al.Construction of individual,fused,and co-expressed proteins of endoglucanase andβglucosidase for hydrolyzing sugarcane bagasse[J].Microbiological Research,2014,169(9/10):725-732.
[15]路等学,王 龙,张 铎,等.茶薪菇胞外酶学性质研究[J].中国酿造,2010,29(2):37-39.
[16]Xing W,Chen L,Zhang F.Separation of camptothecin from Camptotheca acuminate samples using cloud point extraction[J].Analytical Methods,2014,6(11):3644-3650.
[17]Jing L J,LI S Y,Chang Z,et al.Optimization of ultrasoundassisted extraction of camptothecin from Camptotheca acuminata seeds[J].Journal of Forestry Research,2011,22(2):239-242.
[18]Fulzele D P,Satdive R K.Comparison of techniques for the extraction of the anti-cancer drug camptothecin from Nothapodytes foetida[J].Journal of Chromatography A,2005,1063(1/2):9-13.
[19]Akatin M Y.Characterization of aβ-glucosidase from an edible mushroom,Lycoperdon pyriforme[J].International Journal of Food Properties,2013,16(7):1565-1577.
