联合生物加工木质纤维素生产生物乙醇的研究进展
2018-05-18孙曼钰彭太兵何士成贾士儒
孙曼钰,彭太兵,何士成,贾士儒,钟 成
(天津科技大学生物工程学院/工业发酵微生物教育部重点实验室,天津300457)
纤维素是自然界中存在最广泛的一类碳水化合物,同时也是地球上数量最多的生物质资源,植物每年通过光合作用产生约1.55×1011t纤维素类物质,仅我国农作物秸秆量就达6亿多t。目前,自然界中只有小部分纤维素得到了利用,绝大多数纤维素被浪费并造成环境污染。产量巨大的木质纤维材料的主要组成成分为糖类和芳香族化合物,可以将它们降解转化为各种燃料、化学品和材料。利用化工和微生物技术等手段将其中一部分转化为燃料、饲料、化工原料等,这一系列的举措可以缓解资源不足等难题,并对环境的保护做出巨大贡献。因此,利用工业技术和生物质生产燃料、化学品和材料等大宗产品,具有重要的理论意义和较高的社会价值[1]。利用微生物生产的纤维素酶将其转化为糖,并进一步发酵生成乙醇等化工原料,对开发新能源、保护环境有非常重要的现实意义。
木质纤维素由纤维素、半纤维素和木质素3部分组成,其结构和性质较为复杂。半纤维素通过氢键与纤维素相连,其侧链通过阿魏酸或醛酸与木素相连,半纤维素与木素将纤维素包裹起来,形成难以被微生物降解的聚合体[2]。由于纤维素本身高度结晶,难以被纤维素酶水解,使得纤维素乙醇加工过程变得困难。一般情况下,可以通过部分水解木质素和半纤维素,破坏纤维素的结晶结构,在此基础上,通过糖化酶(纤维素酶与半纤维素酶)水解纤维素和半纤维素,再通过微生物对己糖、戊糖进行发酵,得到所需的最终产物乙醇。纤维素酶是能够降解纤维素生成葡萄糖的多酶组分的复合酶系,是一类酶的总称。不仅微生物可以产生纤维素酶,昆虫、软体动物、原生动物等也能产生纤维素酶。
纤维素生物质的乙醇生产涉及5个单元的操作:预处理、纤维素酶的生产、酶水解、微生物发酵、产品回收,具体见图1[3]。纤维素生产生物乙醇的过程一般有4种方式:单独水解和发酵(separate hydrolysis and fermentation,SHF)、同步糖化发酵(simultaneous saccharification and fermentation,SSF)、同步糖化共发酵(simultaneous saccharification and cofermentation,SSCF)、联 合 生 物 加 工 技 术 (consolidated bioprocessing,CBP)[4]。然而妨碍木质纤维素资源化的生物转化技术在实用化过程中的障碍之一是由于纤维素酶的生产效率低、成本较高。在工业应用中,木质纤维素降解为葡萄糖至少需要3种不同的纤维素酶[5]:外切纤维素酶、内切葡聚糖酶以及β-葡萄糖苷酶。目前使用的纤维素酶活力较低、单位原料用酶量大、酶解效率低,产酶和酶解技术都需要改进。在目前的产酶技术条件下,生产3.97 L乙醇需用纤维素酶的生产费用为30~50美分。由于酶的价格比较昂贵,纤维素酶的花费占纤维素产乙醇成本的主要部分。为了减少酶的花费,联合生物加工工艺(consolidated bioprocessing,CBP)应运而生。即将纤维素酶和半纤维素酶生产、水解和乙醇发酵组合或部分组合在一起完成[6],这就要求纤维素酶生成和乙醇发酵都由1种微生物或1个微生物群体来施行。将产酶、糖化、己糖戊糖共发酵产生生物乙醇集合在1个反应器内,其工艺简单,操作方便,能大幅度降低纤维素乙醇生产过程中的成本。
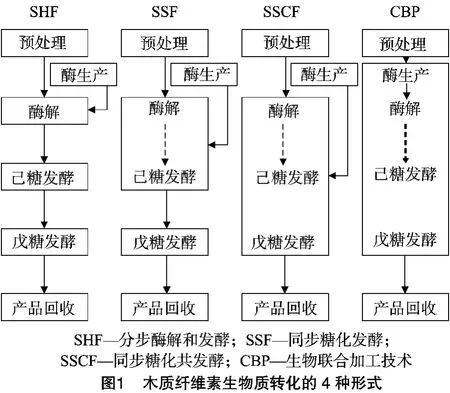
采用联合生物加工技术生产乙醇,目前可以朝2条途径进行:(1)在产乙醇的过程中,使用能产纤维素酶且能发酵产乙醇的双功能单一菌株(如热纤梭菌作为出发株)进行末端产物(乙醇)代谢途径的代谢工程;(2)通过基因工程使异源纤维素酶系统导入到一些生长较快、研究较为成熟的真菌表达系统或细菌表达系统中表达,使之能够在预处理的木质纤维素上生长和发酵。
1 天然策略
自然界中的某些微生物:梭状芽孢杆菌、尖孢镰刀菌、链孢霉菌等都具有直接把生物质转化为乙醇的能力。目前,联合生物技术利用的微生物中,尤其是真菌和一些嗜热微生物,因具备耐高温性质,同时有着比中温菌活性更强的产纤维素酶系的能力和更高效生产乙醇的途径,成为近年来生物乙醇转化研究的热点菌株。嗜热厌氧菌具有独特的高纤维素和植物细胞壁溶解率[7]。嗜热菌是一类生活在高温环境(约50~110℃)中的微生物,热稳定性强,可以在工业生产中的高温条件下生长。不但降低了反应系统的冷却能耗,而且不易被中温微生物污染,同时有利于乙醇的回收,所产生的酶制剂能够在室温长久保持活性,便于长期贮存。另外,大部分嗜热菌对化学变性剂和在极端pH值环境下的耐受性较高,底物范围较广,能够利用葡萄糖、戊糖、阿拉伯糖等生产乙醇(部分嗜热菌可直接利用结晶纤维素)。此外,有些嗜热菌在生长代谢过程中产生的耐高温酶可应用于以植物自身作为生物反应容器的酶解研究中。因此,嗜热菌在纤维素乙醇领域的应用已经成为国际上新的技术制高点,前景广阔。据报道,一些真菌像念珠菌、尖孢镰刀菌、酒曲菌属、木霉属等能将纤维素转化成乙醇。这些菌含有2个生物合成系统:一个是在有氧条件下产生纤维素酶降解纤维素生产可溶性糖;另一个是在厌氧条件下生产其他副产物,如乙酸等。表1总结了不同真菌利用纤维素产乙醇的情况[8]。目前研究最为广泛的有热纤梭菌,还有宛氏拟青霉、尖孢镰刀菌和里氏木霉。
1.1 热纤梭菌
据研究报道,热纤梭菌是目前研究最多的严格厌氧嗜热菌。嗜热厌氧的热纤梭菌可以迅速水解纤维素,达到2.5 g/(L·h)[13]。野生型菌株产生乙醇的产率理论最大值达到10%~30%[14]。热纤梭菌革兰氏染色呈阳性、周生鞭毛、能运动、芽孢卵圆形、端生,该菌培养温度为50~60℃。能发酵纤维素和纤维糊精产生乙醇、乙酸、乳酸、氢和二氧化碳,不能发酵戊糖和淀粉,有人把该菌不能在木糖上生长作为它的一个鉴别特性。热纤梭菌不论接种物的碳源是纤维二糖还是葡萄糖,相比纤维二糖,热纤梭菌在葡萄糖上生长的滞留期更长,生长在纤维二糖上的热纤梭菌生长量几乎为生长在葡萄糖上的2倍。
热纤梭菌通过它的一种胞外纤维素酶复合体降解纤维素,该复合体由几种具有不同底物专一性和不同水解机制的特异蛋白质组成,其中较重要的有活性较强的内葡聚糖酶(β-1,4糖苷键水解酶)。它可以断裂内切葡聚糖苷键,同时也可以水解短链低聚物(聚合度DP≥4)[15]。
该复合物也具有很弱的外葡聚糖酶活性,能够从纤维素的还原末端水解纤维二糖的单位。但与大多数分解纤维素的微生物不同,热纤梭菌不是通过纤维二糖酶的作用将纤维二糖分解成葡萄糖,而是通过纤维二糖磷酸化酶的作用将纤维二糖转化为葡萄糖-1-磷酸和葡萄糖。热纤梭菌通过纤维二糖磷酸化酶和纤维糊精磷酸化酶吸收纤维素的水解产物纤维糊精[15]。热纤梭菌原始纤维素酶复合体还具有明显的木聚糖酶活性。
热纤梭菌在发酵过程中纤维素被降解成还原糖、乙醇等产物。在发酵前3 d,纤维素降解,还原糖和乙醇生成都非常迅速,到4 d变化趋势较缓。纤维素由开始的10.00 g/L降到1.10 g/L,转化率达到 89%。发酵液中乙醇含量达到1.07 g/L。目前,从发酵工艺角度看,热纤梭菌利用纤维素产乙醇存在3个问题[16]:(1)乙醇产率较低。由于碳水化合物发酵不完全(还原性糖类积累)和乙酸、乳酸、氢的形成,使得乙醇的产量较低。(2)由于纤维素发酵速度慢,细胞生成量低由此而引起的纤维素酶效价低,造成容积生产力较低。(3)终产物乙醇及有机酸对细胞有相当大的毒性。为解决这些问题,大多数的研究是与另一种不分解纤维素的嗜热厌氧菌进行共培养,该菌能利用热纤梭菌分解纤维素时所产生的游离单糖产生乙醇。已测试过的能在共培养体系中增加乙醇产率的微生物有:嗜热硫化氢梭菌、嗜热解糖梭菌、乙醇嗜热厌氧杆菌等。这些菌不仅生长的条件与热纤梭菌相似,而且不分解纤维素,还可以发酵产生还原糖,使得乙醇产率提高。通过比较热纤梭菌单独培养和将其与嗜热硫化氢梭菌共培养发酵的几种纤维素基质的结果,可以发现共培养时乙醇含量比单独发酵时要高,还原糖积累量比单独培养发酵时要少。
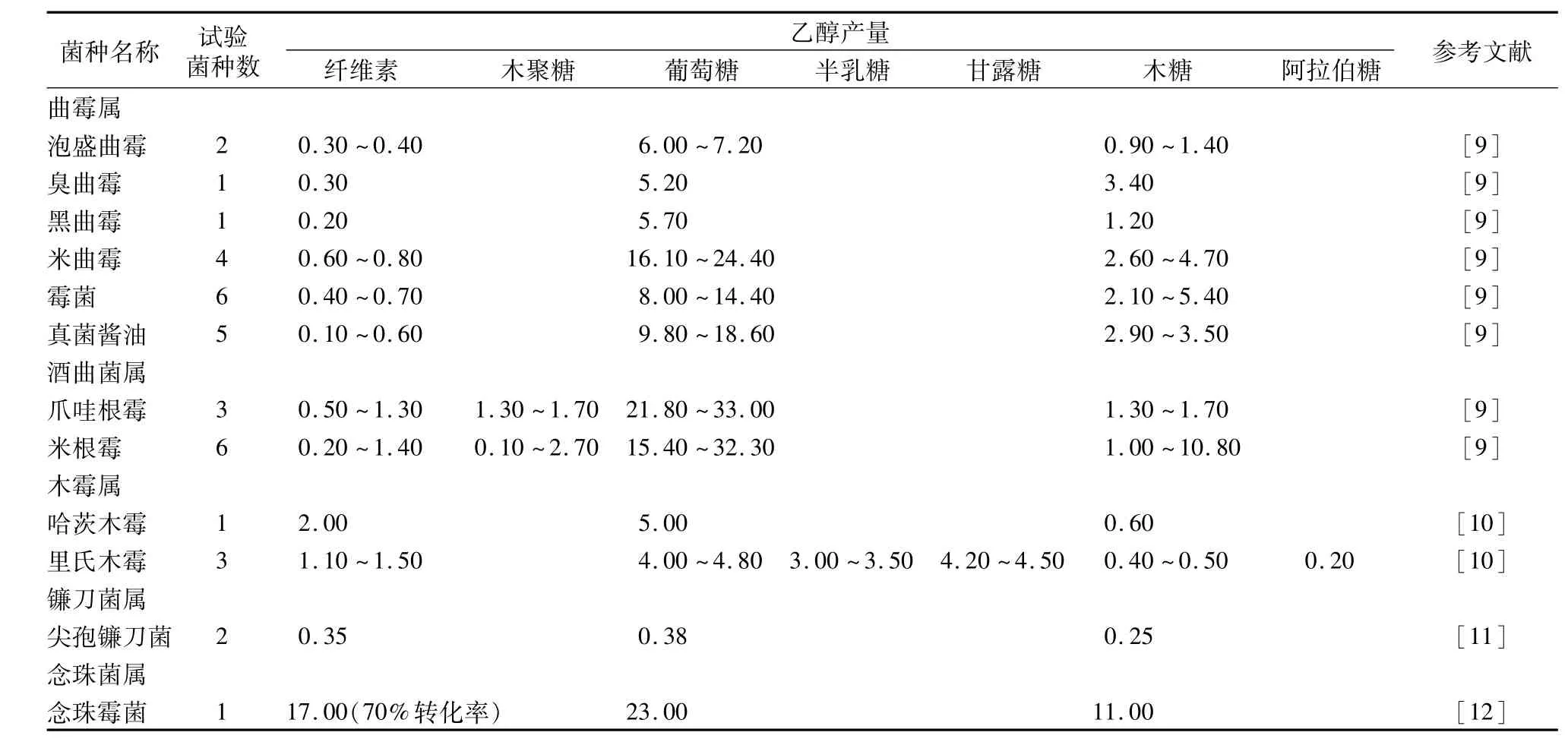
表1 直接利用纤维素产乙醇的几种真菌
1.2 宛氏拟青霉
宛氏拟青霉很早就引起了人们的广泛关注,不仅是因为它是一种次生代谢产物的来源,同时它可以产生各种各样的酶,能够有效地将纤维素分解生产高价值的生物制品[17],但在CBP过程中的潜力还很少被研究。宛氏拟青霉是丝状真菌,它的生物技术的应用及其产生酶和新化合物的能力较强。它的代谢潜力尤其是包括一个经典的单细胞蛋白生产以及通过连续发酵工艺制造,都已经用于动物饲料工业。它还被用于环萜类化合物和芳香醛的还原及废水的脱毒。宛氏拟青霉是全球分布最广的真菌类群,不受季节和地域的限制,是自然界生物量和生物多样性的重要组成部分,属于真菌门、半知菌亚门、丝孢纲、丝孢目、丝孢科中的1个属。菌落白色、淡粉红色、紫丁香色、黄褐色或脏灰褐色,偶尔带有浅绿色调,但不会是真正的绿色,呈质地紧密的毡状、棉絮状或索状,少数呈湿润或黏质状。
宛氏拟青霉可以产生纤维素酶,纤维素通过他们的木质素降解酶降解成还原糖,然后经过真菌发酵,将其转换成高附加值产品如生物乙醇[18]。Zerva等利用宛氏拟青霉菌ATHUM 8891通过CBP的方法利用纤维素生产生物乙醇[19]。宛氏拟青霉在马铃薯葡萄糖琼脂培养基上培养,培养基初始pH值为6,121℃灭菌20 min。同时补充培养基所需的碳源和氮源,接种的浓度为5×105个/mL。在29℃、180 r/min条件下培养5~7 d。取样、离心(13 000 r/min,10 min)、过滤,取上清液测定乙醇和糖的浓度。通过试验可以证实,该菌能有效地将葡萄糖和木糖发酵生成乙醇,且接近理论最大值。同时,氮的含量极大程度影响了乙醇的产量,该真菌能够有效发酵葡萄糖和木糖。此外,真菌具有木质纤维素降解酶的必要工厂。值得注意的是,宛氏拟青霉对木糖发酵的乙醇产量高于葡萄糖,而葡萄糖-木糖混合物中没有观察到共发酵。总的来说,笔者所在实验室的研究结果表明,宛氏拟青霉是一种新的可能和趋势。
1.3 尖孢镰刀菌
尖孢镰刀菌是一种丝状真菌。尖孢镰刀菌是少数微生物物种所具有的分解纤维素和半纤维素的酶系统,而且对它的纤维素分解系统的各个成分有较具体的研究[20],同时可以发酵己糖和戊糖产生乙醇。尖孢镰刀菌是一种世界性分布的土传病原真菌,寄主范围广泛。在PDA平板上培养,菌落突起絮状,菌丝白色质密。菌落粉白色、浅粉色至肉色,略带有紫色,由于大量孢子生成而呈粉质。菌落高3~5 mm,小型分生孢子着生于单生瓶梗上,常在瓶梗顶端聚成球团,单胞,卵形;大型分生孢子镰刀形,少许弯曲,多数为3隔。厚垣孢子尖生或顶生,球形。尖孢镰刀菌致病菌能侵入植物根部引起根腐或侵入植物维管束系统导致植物萎蔫枯死。尖孢镰刀菌的强致病性与其所产纤维素酶有密切关系。由于植物病原菌通过渗入外细胞层和侵入不同的植物组织而感染宿主,感染期间病原菌会完全破坏细胞壁结构中的纤维素等多聚物,对纤维素降解能力很强,因此对该菌纤维素降解系统的研究最初是基于防治的目的。随着研究的深入,尖孢镰刀菌高产纤维素酶的性能逐渐被认识。其所产纤维素酶为胞外酶,且酶系完全。但目前对尖孢镰刀菌纤维素酶的研究集中在防治植物枯萎病方面,对其所产纤维素酶的应用方面的研究十分少见[21]。
有研究表明,尖孢镰刀菌在咪唑类离子液体处理中所产生的纤维素酶量更多,且可以直接通过联合生物技术将咪唑类离子液体处理过的水稻秸秆转化成生物乙醇,在最佳的发酵条件下,可以产 0.125 g/g生物乙醇,理论产量达到64.2%[22]。范金霞等研究了尖孢镰刀菌利用不同碳源生产乙醇的情况(表2)[23]。在葡萄糖单糖发酵中,葡萄糖消耗速率为 0.248 g/(L·h),最大乙醇产量为 8.50 g/L,最大菌体干质量为 4.67 g/L,发酵周期为 3 d。

表2 尖孢镰刀菌利用不同碳源生产乙醇
在木糖单糖发酵中,木糖消耗速率为0.159 g/(L·h),最大乙醇产量为5.77 g/L,最大菌体干质量为6.18 g/L,发酵周期为7 d;在葡萄糖、木糖混合糖发酵中,葡萄糖优先被利用且葡萄糖利用速率比木糖的高。通过对尖孢镰刀菌产纤维素酶进行研究,筛选出酶活较高的菌株,分析其所产纤维素酶的酶学性质,并进行一定的产酶工艺条件优化,以及对其潜在的工业利用价值进行初步的探索。
1.4 里氏木霉
里氏木霉是一种好氧的丝状真菌,为多细胞真核微生物,菌丝层较厚,致密丛束状,初期为白色平坦,后期因产生分生孢子而呈深绿色,产孢区常排列成同心轮纹状。菌落背面无色,有时呈浅黄色。菌丝透明、有隔,细胞壁光滑,分生孢子梗由菌丝直立生出,无色,分枝多,对生或互生二至三级分枝,整体像树枝;分枝与分生孢子梗近似直角,末端为小梗。小梗瓶形,分生孢子球形或长椭圆形,表面粗糙,布满小刺;单胞,靠黏液在小梗上聚集成球状绿色的分生孢子头。以里氏木霉为出发菌种,经初筛、复筛、诱变后,固态法发酵或液体深层培养发酵生产纤维素酶,其分泌的纤维素酶是胞外酶,经初提和分离纯化就可得到纤维素酶制剂。里氏木霉具有一套完整的降解纤维素的酶系,研究表明里氏木霉所分泌的纤维素酶具有产酶量高、稳定性好、适应性强等优点,是目前应用最为广泛的纤维素酶。众多研究表明,其分泌的纤维素酶是由三大酶体系所组成的酶复合体:内切葡聚糖酶、外切葡聚糖酶(CBHⅠ)和β-葡萄糖苷酶。外切葡聚糖酶是里氏木霉表达最多的纤维素酶,也是最主要的纤维素酶[24]。里氏木霉主要表达2种外切葡聚糖酶:CBHⅠ和CBHⅡ。此外,里氏木霉所分泌的β-葡萄糖苷酶很少,但β-葡萄糖苷酶是主要限制分解纤维素降解的因素。
白合超等通过分批补料,采用间接出酶的方法,对里氏木霉产纤维素酶进行研究[25]。分批补料过程中最佳的补料速度为5.5 g/(L·d),此条件下产酶第 8天滤纸酶活力和β-葡萄糖苷酶活力分别达到14.40、1.59 U/mL。在分批补料的基础上进行间歇出酶,与对照相比,第4、6、8天出酶模式时,总滤纸酶活力提高18.14%;第4、7天出酶模式时,总滤纸酶活力提高17.75%;第5、8天出酶模式时,总滤纸酶活力提高27.35%。研究表明,通过间歇出酶可以有效提高纤维素酶总滤纸酶的活力[25]。纤维素酶可以应用于果蔬业、酿酒业和纺织加工等行业。筛选高效纤维素分解菌,确定纤维素酶的发酵条件,是利用稻草、秸秆、稻壳中纤维素的关键。
2 合成CBP微生物
20世纪80年代以来,随着分子生物技术的发展,基因工程技术已用来克隆、表达具有较高酶活的纤维素酶。与诱变育种相比,利用DNA重组技术进行菌种选育具有良好的定向性。大多数真菌的纤维素酶产量高但生长慢,可以将真菌的纤维素酶基因导入到一些生长较快研究较为成熟的真菌表达系统或细菌表达系统中表达,以得到高的纤维素酶产量。其实质主要是构建异源酶系统,使得预处理的纤维素能够同时分解和发酵。而目前在这种水平的已表达的蛋白主要有酿酒酵母和大肠杆菌。表3总结了酵母菌和大肠杆菌利用几种不同底物为原料生产乙醇的情况。

表3 2种菌利用几种不同底物为原料生产乙醇情况
2.1 大肠杆菌
大肠杆菌可以说是重组蛋白生产中最常见的宿主菌。大肠含有利用五碳糖的所有必需酶,但厌氧条件下发酵形成的产物很复杂,乙醇只是其中很少的一部分。最后生成乙醇的阶段是由丙酮酸脱羧酶(PDC)和乙醇脱氢酶Ⅱ(ADH)催化完成的。大肠杆菌缺乏PDC,而且APH的表达水平也很低,最终代谢产物中乙醇含量极低。所以于梁将PDC和ADH基因的重组载体PET-AP成功转化到大肠杆菌BL21中,构建导入PDC和ADH基因的工程菌,将丙酮酸到乙醇的代谢途径导入到大肠杆菌中,利用构建的基因工程菌大肠杆菌(E.coli SWZX426)将五碳糖发酵生成乙醇[31]。E.coli SWZX426成功地在大肠杆菌细胞内构建了丙酮酸脱羧代谢途径;同时增强了大肠杆菌细胞内乙醇脱氢酶的活力,使得乙醇成为构建工程菌的主要代谢产物。通过对初始pH值、温度、通气量和转速的进一步优化,E.coli SWZX426在发酵20 g/L葡萄糖时,发酵72 h后乙醇含量为6.4 g/L;发酵 20 g/L木糖时,发酵72 h后乙醇含量为4.8 g/L;木糖发酵的乙醇含量低于葡萄糖发酵的乙醇含量。该菌在发酵混合糖(含葡萄糖15 g/L和木糖 5 g/L)时,发酵 72 h后乙醇含量为 5.7 g/L。
Luo等通过结合从双向运动发酵单胞菌中得到的丙酮酸脱羧酶基因PDC和乙醇脱氢酶基因(ADHB),与大肠杆菌JM109结合构建了具有产乙醇能力的大肠杆菌ZY81[32]。然后,β-葡萄糖苷酶表达基因bglB在ZY81上分泌表达,重组菌株大肠杆菌ZY81/bglB的胞外酶活力显著增强。同时乙二胺四乙酸(EDTA)可以有效促进细胞周质蛋白的释放,该重组菌株利用纤维素二糖作为唯一的碳源可以使生产乙醇的理论产量达到33.99%。
为了提高木质纤维素材料的利用率,基因工程改造的大肠杆菌菌株也可以用于甜菜渣等木质纤维素含量高的原材料。Edwards等成功地构建了具有纤维二糖发酵和果胶降解能力的大肠杆菌KO11,该重组菌株能够稳定表达染色体整合的PDC和乙醇脱氢酶(ADHB)[33],果胶甲酯酶对部分果胶的有效降解,使得最终乙醇的产量提高。
2.2 酿酒酵母
酿酒酵母是传统的乙醇生产菌株,具有许多优良的生产性能,如在厌氧条件下有较好的生长能力,能发酵葡萄糖产生较高的乙醇得率和生产速率,具有较高的耐受乙醇和其他抑制物的性能。酿酒酵母遗传背景清晰,基因水平的改造可操作性强,并且具有生长速率快、对抑制剂耐受性强等优势,被公认为最具潜力的CBP乙醇生产菌株[34]。将酿酒酵母作为统合生物加工载体的主要要求是在酿酒酵母中高效分泌表达木质纤维素水解酶。外源基因在酿酒酵母中的表达是酿酒酵母统合加工纤维素乙醇的关键,其影响因素有外源基因的序列特性、拷贝数、对酵母细胞生命活动的影响、受体菌分泌途径及分泌过程中蛋白质的正确加工等。
Yamada等通过控制3种纤维素酶的表达水平来构建重组酿酒酵母菌株,采用混合整体化的方法优化纤维素酶的活性[35]。通过构建重组菌株,其中包含6份外切葡聚糖酶、16份内切葡聚糖酶和1份β-葡聚糖苷酶。20 g/L原料可以产生3.1 g/L乙醇。到目前为止,来自真菌和细菌的纤维素酶已成功异源表达为多酶复合体。酵母菌株中的纤维素酶基因大都来自真菌,特别是里氏木霉。许多真菌的纤维素酶产量高但生长慢,可以将真菌的纤维素酶基因导入到一些生长较快研究较为成熟的真菌表达系统或细菌表达系统中进行表达,以得到高的纤维素酶产量。汤新等将从里氏木霉中分离到的eg4基因(内切葡萄糖苷酶基因)与毕赤酵母表达载体pPlCZ连接,得到重组质粒pPICZαA-eg4[36]。将该重组质粒线性化后转化毕赤酵母GS115,eg4基因经过同源重组被整合到毕赤酵母的染色体上,并处于酵母α因子的下游,得到重组菌株 P.pastoris EGlV l,培养液的酶活力达到 2.11 U/mL。
Treebupachatsakul等通过将里氏木霉中的CeI3B基因和棘孢曲霉中的AaBGL1基因构成重组表达体,然后在酿酒酵母中表达[37]。重组蛋白可以提高β-葡萄糖苷酶的活力,对于糖的转化具有重要作用。AaBGL1在酿酒酵母中的表达有效地提高了乙醇的含量。
虽然酿酒酵母具有能将各种类型的纤维素发酵成乙醇的潜力,但它不能利用包含在半纤维素中的木糖。因此,通常将木糖还原酶(XR)和木糖醇脱氢酶(XDH)2种基因引入酿酒酵母菌株中,此外,酿酒酵母的内源性XK基因的表达也可以增加木糖的利用效率[38]。笔者所在实验室认为木质纤维素乙醇的统合生物加工过程实质上是通过一种微生物将纤维素酶生产、纤维素水解和乙醇发酵过程组合或部分组合,在酿酒酵母中共表达CBP酵母所需要的所有外源基因是不太容易实现的,不仅会增加细胞的负担,而且酿酒酵母代谢己糖和戊糖的能力也有可能受到影响。如果根据特定微生物产生纤维素酶系的某些不足,将不足组分酶的基因在酿酒酵母中高效表达,配合使用相应酶系的酶制剂,也是酿酒酵母统合加工纤维素乙醇的一个策略,能在一定程度上减少成本[39]。
3 总结
在生产生物乙醇的过程中,使用能产纤维素酶且能发酵产乙醇的双功能单一菌株,或者通过基因工程将异源纤维素酶系统导入到一些生长较快研究较为成熟的真菌表达系统或细菌表达系统中表达,是目前国内外联合生物加工木质素生产生物乙醇的主要研究方向。联合生物加工由于其工艺上的高度整合,有效节省了原料和时间,迎合了未来生物质能源生产发展的趋势。近年来,通过试验研究,证明了2个策略的可行性,积极开发出了利用纤维素的微生物和其他发酵物,使得预处理的生物质得到高速率和高转化率,并产生所需的高产量和效价。通过将相对于低成本的可再生生物质转化为燃料以及各种工业化学品,从而实现社会效益低成本转换的质的飞跃。因此,联合生物加工木质纤维素生产生物乙醇的前景一片光明。
参考文献:
[1]曲音波.纤维素乙醇产业化[J].化学进展,2007,19(7/8):1098-1108.
[2]岳 军,胡世洋,鳪继星,等.木质纤维素材料预处理研究进展[J].现代化工,2014,34(10):31-35,37.
[3]Fan Z.Consolidated bioprocessing for ethanol production[M].Biorefineries,2014:141-160.
[4]Parisutham V,Kim T H,Lee S K.Feasibilities of consolidated bioprocessingmicrobes:from pretreatment to biofuel production[J].Bioresource Technology,2014,161(3):431-440.
[5]Yanase S,Yamada R,Kaneko S,et al.Ethanol production from cellulosic materials using cellulase- expressing yeast[J].Biotechnology Journal,2010,5(5):449-455.
[6]Lynd LR,ZylW H V,Mcbride JE,etal.Consolidated bioprocessing of cellulosic biomass:an update[J]. Current Opinion in Biotechnology,2005,16(5):577-583.
[7]Paye JM D,Guseva A,Hammer S K,et al.Biological lignocellulose solubilization:comparative evaluation of biocatalysts and enhancement via cotreatment.[J].Biotechnology for Biofuels,2015,9(1):8.
[8]Xu Q,Singh A,Himmel M E.Perspectives and new directions for the production of bioethanol using consolidated bioprocessing of lignocellulose[J].Cheminform,2009,40(49):364-371.
[9]Christopher S,Shelby F,Rodney B,et al.Screening for ethanolproducing filamentous fungi[J].Biotechnol Letters,1997,19(3):203-206.
[10]Stevenson D M,Weimer P J.Isolation and characterization of a Trichoderma strain capable of fermenting cellulose to ethanol[J].Applied Microbiology and Biotechnology,2002,59(6):721-726.
[11]Ruiz E,Romero I,De Moya M A,et al.Sugar fermentation by Fusarium oxysporum to produce ethanol[J]. World Journal Microbiology&Biotechnology,2007,23(2):259-267.
[12]Gong C,Maun CM,Tsao G T,et al.Direct fermentation of cellulose to ethanol by a cellulolytic filamentous fungus,Monilia sp.[J].Biotechnology Letters,1981,3(2):77-82.
[13]Argyros A,Tripathi S A,Barrett T,et al.High ethanol titers from cellulose by using metabolically engineered thermophilic,anaerobic microbes[J].Applied and Environmental Microbiology,2011,77(23):8288-8294.
[14]Olson D G,Sparling R,Lynd L R.Ethanol production by engineered thermophiles[J].Current Opinion in Biotechnology,2015,33C(1):130.
[15]Scully S M,Orlygsson J.Recent advances in second generation ethanol production by thermophilic bacteria[J].Energies,2014,8(1):1-30.
[16]Wiegel J.Ethanol from cellulose[J].Cellular and Molecular Life Sciences,1982,38(2):79-84.
[17]Maitan-Alfenas G P,Visser E M,Guimares V M.Enzymatic hydrolysis of lignocellulosic biomass:converting food waste in valuable products[J].Current Opinion in Food Science,2015,1(1):44-49.
[18]Marante F,Mioso R,Barrera J B.Structural characterization and metabolite profiling of the facultative marine fungus Paecilomyces variotii[J].Annals of Microbiology,2012,62(4):1601-1607.
[19]Zerva A,Savvides A L,Katsifas E A,et al. Evaluation of Paecilomyces variotii potential in bioethanol production from lignocellulose through consolidated bioprocessing[J].Bioresour Technol,2014,162(162C):294-299.
[20]Amore A,Faraco V.Potential of fungi as category I consolidated bioprocessing organisms for cellulosic ethanol production[J].Renewable&Sustainable Energy Reviews,2012,16(5):3286-3301.
[21]王 玮.尖孢镰刀菌高产纤维素酶菌株的筛选鉴定及发酵条件优化[D].呼和浩特:内蒙古大学,2011.
[22]Xu J X,Wang X F,Hu L,et al.A novel ionic liquid-tolerant Fusarium oxysporum BN secreting ionic liquid-stable cellulase:consolidated bioprocessing of pretreated lignocellulose containing residual ionic liquid[J].Bioresource Technology,2015,181:18-25.
[23]范金霞,杨 谦,陈忠祥,等.尖孢镰刀菌发酵混合糖产乙醇[J].东北林业大学学报,2010,38(9):113-115.
[24]张家松,董宏标,段亚飞,等.里氏木霉产纤维素酶的研究及其应用[J].南方水产科学,2014,10(5):99-104.
[25]白合超,蒋 露,王步成,等.间歇出酶对里氏木霉产纤维素酶的影响[J].南京林业大学学报(自然科学版),2016,40(1):87-91.
[26]Den H R,Rose SH,lynd L R,et al.Hydrolysis and fermentation of amorphous cellulose by recombinant Saccharomyces cerevisiae[J].Metabolic Engineering,2007,9(1):87-94.
[27]Tsai S L,Goyal G,Chen W.Surface display of a functional minicellulosome by intracellular complementation using a synthetic yeast consortium and its application to cellulose hydrolysis and ethanol production[J].Applied and Environmental Microbiology,2010,76(22):7514-7520.
[28]Matano Y,Hasunuma T,Kondo A.Cell recycle batch fermentation of high-solid lignocellulose using a recombinant cellulase-displaying yeast strain for high yield ethanol production in consolidated bioprocessing[J].Bioresource Technology,2013,135:403-409.
[29]Shin H D,McClendon S,Vo T,et al.Escherichia coli binary culture engineered for direct fermentation of hemicellulose to a biofuel[J].Applied and Environmental Microbiology,2010,76(24):8150-8159.
[30]Edwards M C,Henriksen ED,Yomano LP,etal.Addition of genes for cellobiase and pectinolytic activity in Escherichia coli for fuel ethanol production from pectin-rich lignocellulosic biomass[J].Applied and Environmental Microbiology,2011,77(15):5184-5191.
[31]于 梁.同时利用戊糖己糖产乙醇E.coli工程菌的构建[D].长春:吉林大学,2014
[32]Luo Z C,Zhang Y,Bao J,et al.Extracellular secretion ofβglucosidase in ethanologenic E.coli enhances ethanol fermentation of cellobiose[J].Applied Biochemistry and Biotechnology,2014,174(2):772-783.
[33]Edwards M C,Henriksen ED,Yomano L P,et al.Addition of genes for cellobiase and pectinolytic activity in Escherichia coli for fuel ethanol production from pectin-rich lignocellulosic biomass[J].Applied and Environmental Microbiology,2011,77(15):5184-5191.
[34]Hasunuma T,Kondo A.Development of yeast cell factories for consolidated bioprocessing of lignocellulose to bioethanol through cell surface engineering[J].Biotechnology Advances,2012,30(6):1207-1218.
[35]Yamada R,Taniguchi N,Tanaka T,et al.Direct ethanol production from cellulosic materials using a diploid strain of Saccharomyces cerevisiae with optimized cellulase expression[J].Biotechnology for Biofuels,2011,4(1):8.
[36]汤 新,刘 刚,田生礼,等.里氏木霉内切葡萄糖苷酶Ⅳ在毕赤酵母中的表达[J].微生物学通报,2005,32(6):47-51.
[37]Treebupachatsakul T,Nakazawa H,Shinbo H,et al.Heterologously expressed Aspergillus aculeatus,β-glucosidase in Saccharomyces cerevisiae,is a cost- effective alternative to commercial supplementation ofβ-glucosidase in industrial ethanol production using Trichoderma reesei,cellulases[J].Journal of Bioscience&Bioengineering,2015,121(1):27-35.
[38]Hasunuma T,Kondo A.Development of yeast cell factories for consolidated bioprocessing of lignocellulose to bioethanol through cell surface engineering[J].Biotechnology Advances,2012,30(6):1207-1218.
[39]徐丽丽,沈 煜,鲍晓明.酿酒酵母纤维素乙醇统合加工(CBP)的策略及研究进展[J].生物工程学报,2010,26(7):870-879.
