慢病毒介导的miR194-5p过表达精原细胞株的建立*
2018-05-17夏蒙蒙牛长敏申雪沂王建军
夏 静 夏蒙蒙 牛长敏 申雪沂 王建军 郑 英
扬州大学医学院组织学与胚胎学教研室(江苏扬州 225001)
miRNA是一类长约18-22nt的小分子非编码RNA,它们能结合在多个下游靶基因的3′UTR(3’端非编码区),通常导致靶基因的表达沉默,进而在一系列生物学过程中发挥重要功能[1]。研究表明miRNA也参与精子发生过程的调控,且有表达细胞特异性及阶段性[2]。一些特异性的miRNA能作为诊断男性不育的潜在标记[3,4]。Stra8(stimulated by retinoic acid 8)对精子发生具有重要意义,其对减数分裂的启动是必须的,同时它对精原细胞的分化也发挥着重要的作用,但是其调控精子发生的机制尚不清楚。miRNA是否能通过Stra8调控精子发生过程尚不清楚。利用生物信息学分析方法,我们发现Stra8是miR-194-5p下游靶基因之一,因此我们试图探讨miR-194-5p与Stra8之间是否具有调控关系。本研究旨在构建携带miR-194-5p的慢病毒表达载体,并包装成慢病毒,以期达到高效稳定感染目的细胞Stra8-GC1-spg,建立稳定表达miR-194-5p的精原细胞株,为深入研究miR-194-5p与Stra8之间的调控关系及阐明Stra8在精子发生中的作用机制提供参考价值。
材料和方法
一、材料
慢病毒表达质粒pMSCV-PIG及Gag pol、VSV.G辅助质粒由江苏省非编码RNA基础与临床转化重点实验室郁多男教授惠赠。LA tag酶、EcoRⅠ BglⅡ、miRNA逆转录试剂盒及荧光定量试剂盒购自TaKaRa公司。pGEM-T-easy 载体、T4 DNA连接酶、切胶回收试剂盒购自Promega公司。293T细胞、Stra8-GC1-spg、大肠杆菌JM109由本实验室前期保存。DMEM、FBS购自Hyclone公司;X-gal和IPTG、嘌呤霉素、PEI购自北京索莱宝生物有限公司;核酸提取试剂TRIzol购自Invitrogen公司;引物合成及DNA测序由深圳华大基因生物工程公司完成。
二、方法
(一)目的片段的扩增
利用小鼠基因组DNA为模板,进行PCR扩增反应,PCR扩增引物:F:5′-GGAGATCTCCACCA CACACCAGGAAGAG-3′,R: 5′-GGGAATTCT AACCAAGAGCCCACCCAG-3′;PCR反应体系:ddH2O 31.5µL,LA buffer 5µL,2.5mMdNTPs 8µL,F(10µM)2µL,R(10µM)2µL,LA tag酶0.5µL,DNA 1µL;PCR反应条件:95℃ 5min,95℃ 30s,58℃ 30 s,72℃ 60 s,共35个循环,72℃ 5min。PCR产物经琼脂糖凝胶电泳鉴定。
(二)pGEM-T-easy-miR194-5p重组质粒的构建
PCR产物经AxyPrep DNA凝胶回收试剂盒进行纯化,后与pGEM-T-easy 载体连接,连接产物转化到JM109感受态中,涂于LB琼脂糖平板(含50μg /μL X-gal和0.1moL IPTG、50μg /mL氨苄青霉素)上。37℃孵育过夜,经蓝白斑筛选,取白色克隆,摇菌过夜,碱裂解法提取质粒,EcoRⅠ酶切鉴定,最后进行DNA序列测定验证。
(三)pMSCV-PIG-miR194-5p重组载体构建
将pGEM-T-easy-miR194-5p及慢病毒载体pMSCV-PIG分别进行EcoRⅠ、BglⅡ双酶切,回收并纯化所需片段,以载体插入片段=1:3~1:5摩尔比进行连接,转化JM109感受态菌后涂于LB琼脂糖平板(含50μg /mL氨苄青霉素)上,37℃过夜。次日,挑单菌落接种于LB培养液(50μg /mL氨苄青霉素)中,37℃振摇培养过夜,用碱裂解法提取质粒,利用EcoRⅠ、BglⅡ双酶切鉴定。
(四)慢病毒包装
将293T细胞铺于6cm细胞培养皿内,使次日细胞融合率为60%左右。每孔加3mL DMEM完全培养基。慢病毒包装转染体系:0.9%NaCl 500μL、Gag pol 3µg 、VSV.G 3μg、pMSCV-PIG-miR194-5p 8μg(实验组)或pMSCV-PIG 8μg(对照组)、PEI 100μL(μg/μL),混匀后室温孵育10min,加至培养的293T细胞中,37℃、5%CO2过夜,12h后更换为DMEM完全培养基。分别收集转染后36h、48h、60h、72h的病毒上清,经0.45μm滤器过滤,-80℃保存。
(五)慢病毒感染效果的验证
将293T细胞铺于6cm细胞培养皿内,使次日细胞融合率为60%左右。按照以下体系感染293T细胞:慢病毒上清 2mL、enhance 液1mL、polybrene 1.5μL,37℃、5%CO2培养箱培养。6h后进行重复感染一次。6h后再进行第三次感染。6h后更换为新鲜的DMEM完全培养基。72h后用倒置荧光显微镜观察感染的293T细胞有无绿色荧光。分别提取pMSCV-PIG-miR194-5p感染组及 pMSCV-PIG对照组293T细胞总RNA,利用逆转录试剂盒反转录为cDNA,qRTPCR验证感染慢病毒的293T细胞内的miR194-5p转录水平。
(六)稳定过表达miR194-5p Stra8-GC1-spg细胞株的建立
将Stra8-GC1-spg细胞铺于六孔板内,使次日细胞融合率为50%左右。在六孔板每孔内加入enhance液0.5mL、慢病毒上清1.5mL 、polybrene1μL。37℃、5%CO2培养箱培养。6h后进行重复感染一次。6h后再进行第三次感染。6h后更换为新鲜的DMEM完全培养基。72h后用倒置荧光显微镜观察细胞是否带有绿色荧光。用5μg/mL嘌呤霉素筛选一周,以获得稳定过表达miR194-5p Stra8-GC1-spg细胞株。
(七)miR194-5p表达水平的验证
分别取感染慢病毒pMSCV-PIG-miR194-5p及对照组pMSCV-PIG的Stra8GC1细胞,用TRIzol提取总RNA,按照逆转录试剂盒说明书步骤进行反转录,以此cDNA为模板,应用实时定量PCR法检测miR194-5p的表达水平,并用2-ΔΔct计算其相对表达量,两组间数据比较采用t检验,P<0.05有统计学意义。
结 果
一、目的基因片段pri-miR194-5p的扩增
以小鼠基因组DNA为模板,进行PCR反应扩增,获得目的基因片段pri-miR194-5p,其大小为293bp,与预计片段大小相一致(图1)。
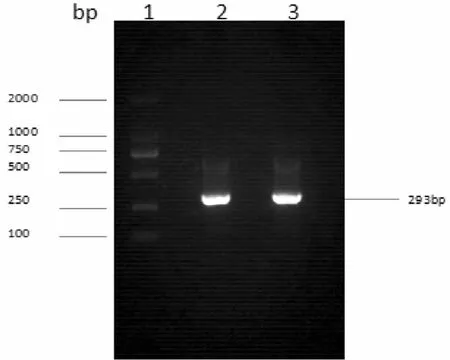
图1 pri-miR194-5p PCR产物琼脂糖凝胶电泳图
二、pri-miR194-5p与pGEM-T-easy 载体的连接
将pri-miR194-5p PCR产物与pGEM-T-easy载体相连接,经酶切鉴定证实PCR片段已成功插入到pGEMT-easy载体(图2)。DNA序列测定证实此序列与pri-miR194-5p序列完全一致。表明pGEM-T-easy-primiR194-5p重组载体构建成功。
三、pMSCV-PIG-miR194-5p重组载体的构建
将重组质粒pGEM-T-easy-pri-miR194-5p及空载慢病毒载体pMSCV-PIG分别进行双酶切,然后进行连接,获得的重组质粒pMSCV-PIG-miR194-5p经限制性内切酶酶切鉴定,发现重组质粒pMSCV-PIG-miR194-5p构建成功(图3)。
四、慢病毒的包装及表达的验证
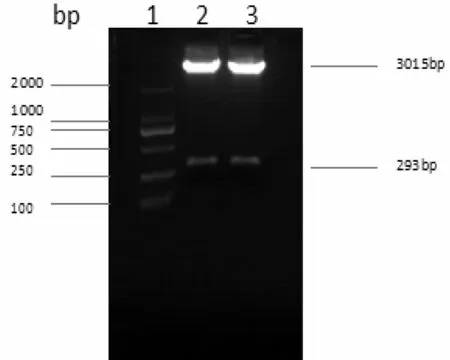
图2 pGEM-T-easy-pri-miR194-5p酶切鉴定产物琼脂糖凝胶电泳图
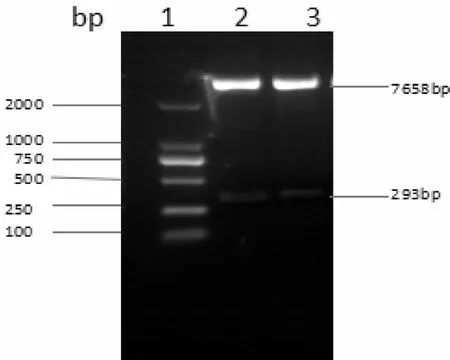
图3 pMSCV-PIG-miR194-5p酶切鉴定

图4 pMSCV-PIG及pMSCV-PIG-miR194-5p重组质粒转染293T细胞72h后荧光图

图5 慢病毒pMSCV-PIG及pMSCV-PIG-miR194-5p感染293T细胞72h后荧光图
应用PEI法转染293T包装细胞,72h后荧光显微镜观察发现大多数293T细胞均显示绿色荧光(图4)。用慢病毒上清感染293T细胞,72h后荧光显微镜观察,发现大部分293T细胞显示绿色荧光(图5)。表明包装的慢病毒颗粒能成功感染细胞。应用实时定量PCR对感染后的293T细胞进行miR194-5p表达水平检测,结果发现,与对照组相比较,实验组细胞表达高水平miR194-5p(图6)。提示慢病毒能有效感染293T细胞并高表达miR194-5p。
五、过表达miR194-5p Stra8-GC1-spg细胞株的建立
应用慢病毒上清感染Stra8-GC1-spg。72h后荧光显微镜观察,发现细胞有绿色荧光产生(图7)。经嘌呤霉素筛选1周后,对miR194-5p表达水平进行定量分析。结果发现与对照组相比较,实验组Stra8-GC1-spg细胞中miR194-5p的表达量明显增高(图8),表明成功稳定过表达miR194-5p Stra8-GC1-spg细胞株。
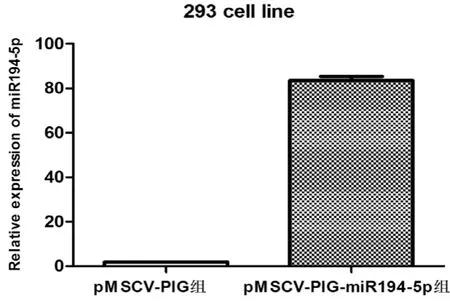
图6 慢病毒pMSCV-PIG及pMSCV-PIG-miR194-5p感染的293T细胞中miR194-5p相对表达水平分析
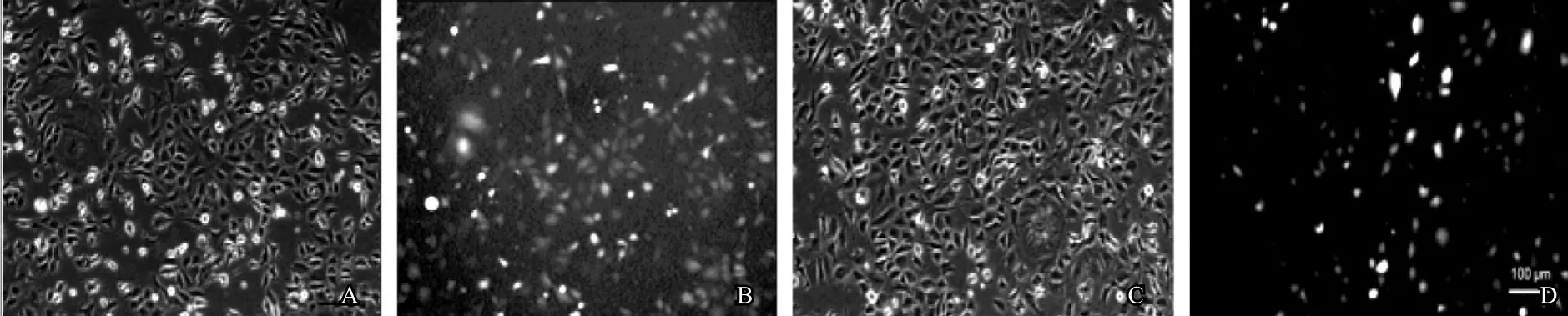
图7 慢病毒pMSCV-PIG及pMSCV-PIG-miR194-5p感染Stra8-GC1-spg细胞72h后荧光图
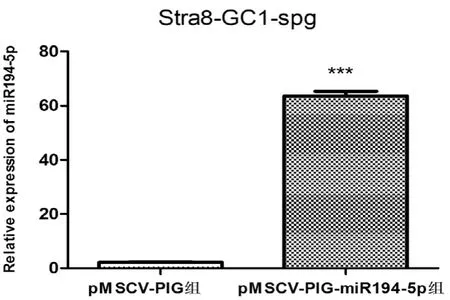
图8 慢病毒pMSCV-PIG及pMSCV-PIG-miR194-5p感染的Stra8-GC1-spg细胞中miR194-5p的相对表达水平分析
讨 论
精子发生是高度精密的过程,此期间需要大量的基因在转录、转录后及表观遗传学水平对其进行调控。大量研究发现在精子发生的不同阶段,miRNAs作为转录后调控元件,可能通过激活特异性基因的表达参与精子发生[5]。在人类精子发生中,miRNAs也发挥着重要的功能[6,7]。 研究发现在小鼠精子发生中一些miRNAs(miR-221, miR-203, miR-34b-5p)特异性表达于精原干细胞、减数分裂前细胞及减数分裂细胞中[8]。 miR-34c特异性表达在睾丸内,且主要表达在减数分裂晚期的粗线期精母细胞及精子细胞中[9]。 miR-449a 及miR-34b/c在鼠科精子发生中有协同作用[10]。miR-146能作用在靶基因Med1上进而阻碍视磺酸诱导精原细胞分化[11]。 另外,miR-221/222家族通过作用在Kit mRNA 上,进而维持未分化精原细胞数量[12]。
目前已知Stra8作为精子发生中一个基因,对精原细胞的分裂分化及减数分裂的启动都发挥着重要的作用。研究发现Stra8基因敲除的雄性小鼠不育[13]。但是关于Stra8在精子发生中的作用机制目前仍未能完全阐明。Yu等发现miR-34c可能通过作用在Nanos2的3’UTR上抑制其表达,而这将导致Stra8 、Scp3及 Dazl的表达上调,而促进减数分裂进程[14]。Wang等发现在鸡的睾丸内miR-31 可以通过作用在靶基因Stra8的3’UTR(非编码区)上直接抑制Stra8的表达进而阻滞减数分裂的进程[15]。而有关miRNAs与Stra8之间的关系目前仍未完全阐明。信息学分析发现mmu-miR-194-5p是Stra8上游的靶向miRNA。而目前有关miR-194-5p的研究仅仅是着重在它在各种肿瘤及免疫性疾病上的作用[16-19]。而有关miR-194-5p与Stra8之间的调控关系及它们在精子发生中的作用目前仍未有任何报道。是否有可能miR-194-5p可以在精子发生的特定阶段被激活,从而发挥对Stra8的调控作用呢?因此研究miR-194-5p与Stra8之间的关系对揭示Stra8在精子发生中的作用机制具有十分重要的意义。
本实验室前期工作中已构建了Stra8过表达精原细胞株,将其命名为Stra8-GC1-spg。为了进一步研究miR194-5p与Stra8之间的调控关系,本研究采用了慢病毒重组质粒pMSCV-PIG-miR194-5p来包装293T细胞,产生慢病毒颗粒。为了检测该慢病毒是否包装成功,我们将获得的病毒上清首先感染了293T细胞,通过荧光实时定量发现与对照组相比,pMSCV-PIG-miR194-5p慢病毒感染组,miR194-5p表达水平明显增高。说明该慢病毒已经包装成功。本实验中所用的pMSCV-PIG空载质粒带有GFP标签,能使细胞产生绿色荧光。转染293T时使用的PEI(Polyethylenimine)是一种聚合物转染试剂,它是运用最广泛及最有效的非病毒载体之一[20]。PEI每相隔二个碳原子就有1个氨基,构成了多聚网状结构,它具有大量的正电荷,能使 DNA 缩合成颗粒状。PEI/DNA 复合物通过静电作用吸附到细胞表面,经过细胞内吞作用进入细胞内[21]。PEI 几乎可在任何 pH 条件下都能够吸收质子,这使其具有质子海绵的作用[22]。这一特性使 PEI能在内涵体的酸性环境中吸收 H+,进而增高内涵体内的渗透压,导致膜不稳定甚至破裂,从而使PEI/DNA复合物从内涵体内逃逸出来,避免 DNA 降解。一般认为,PEI 的基因转染效率随其相对分子质量的增大而提高。这是由于 PEI 相对分子质量越大,其质子海绵作用越强,PEI/DNA 复合物就更快的被释放入胞质,从而减少了内涵体对 DNA 的降解,进而提高了转染效率[23]。重要的是PEI以盐酸盐形式提供,大大提高了水溶性。与Lipofectamine 2000相比,PEI转染效率更高,且细胞凋亡率更低[24]。我们用该慢病毒感染Stra8-GC1-spg细胞72h后,嘌呤霉素筛选获得稳定表达miR194-5p的Stra8-GC1-spg细胞株。通过荧光实时定量分析发现miR194-5p 在Stra8-GC1-spg细胞中miR194-5p的表达水平与对照组相比显著性增高。当我们应用瞬时转染法转染精原细胞株时转染效率很低,但用此方法包装出的慢病毒感染Stra8-GC1-spg细胞使感染效率大大提高,因而更加有利于后续实验的开展。本研究采用的慢病毒系统优于一般的商品化的慢病毒感染系统,既具有GFP荧光示踪系统,又能够通过嘌呤霉素进行阳性细胞的筛选。
总之,本实验成功构建了过表达miR194-5p 的Stra8-GC1-spg细胞株。这种细胞系可以作为一种细胞模型用于后续研究miR194-5p与Stra8之间的调控关系,为进一步揭示Stra8在精子发生中的作用机制奠定基础。
参考文献
1 Pritchard CC, Cheng HH, Tewari M.MicroRNA profiling:approaches and considerations.Nat Rev Genet2012;13(5): 358-369
2 Yang Q, Hua J, Wang L,et al.MicroRNA and piRNA profiles in normal human testis detected by next generation sequencing.PLoS One2013; 8(6): e66809
3 Rahbar S, Novin MG, Alizadeh E,et al.New insights into the expression profile of MicroRNA-34c and P53 in infertile men spermatozoa and testicular tissue.Cell Mol Biol (Noisy-le-grand)2017; 63(8): 77-83
4 Boissière A, Gala A, Ferrières-Hoa A,et al.Cell-free and intracellular nucleic acids: new non-invasive biomarkers to explore male infertility.Basic Clin Androl2017; 27: 7
5 Kotaja N.Micro RNAs and spermatogenesis.Fertil Steril2014; 101(6): 1552-1562
6 Lian J, Zhang X, Tian H,et al.Altered micro RNA expression in patients with non-obstructive azoospermia.Reprod Biol Endocrinol2009; 7: 13
7 Abu-Halima M, Backes C, Leidinger P,et al.MicroRNA expression profiles in human testicular tissues of infertile men with different histopathologic patterns.Fertil Steril2014; 101(1): 78-86.e2
8 Smorag L, Zheng Y, Nolte J,et al.MicroRNA signature in various cell types of mouse spermatogenesis: evidence for stage-specifically expressed miRNA-221, -203and -34b-5p mediated spermatogenesis regulation.Biol Cell2012;104(11): 677-692
9 Bouhallier F, Allioli N, Lavial F,et al.Role of miR-34c microRNA in the late steps of spermatogenesis.RNA2010; 16(4): 720-731
10 Bao J, Li D, Wang L,et al.MicroRNA-449 and microRNA-34b/c function redundantly in murine testes by targeting E2F transcription factor-retinoblastoma protein (E2F-pRb) pathway.J Biol Chem2012; 287(26):21686-21698
11 Huszar JM, Payne CJ.MicroRNA 146 (Mir146)modulates spermatogonial differentiation by retinoic acid in mice.Biol Reprod2013; 88(1): 15
12 Yang QE, Racicot KE, Kaucher AV,et al.MicroRNAs221 and 222 regulate the undifferentiated state in mammalian male germ cells.Development2013; 140(2): 280-290
13 Mark M, Jacobs H, Oulad-Abdelghani M,et al.STRA8-deficient spermatocytes initiate, but fail to complete, meiosis and undergo premature chromosome condensation.J Cell Sci2008; 121(Pt 19): 3233-3242
14 Yu M, Mu H, Niu Z, et al.miR-34c enhances mouse spermatogonial stem cells differentiation by targeting Nanos2.J Cell Biochem 2014; 115(2): 232-242
15 Wang Y, Zuo Q, Bi Y,et al.miR-31 Regulates Spermatogonial Stem Cells Meiosis via Targeting Stra8.J Cell Biochem2017; 118(12): 4844-4853
16 Wang SH, Wu XC, Zhang MD,et al.Long noncoding RNA H19 contributes to gallbladder cancer cell proliferation by modulated miR-194-5p targeting AKT2.Tumour Biol2016; 37(7): 9721-9730
17 Huo D, Clayton WM, Yoshimatsu TF,et al.Identification of a circulating microRNA signature to distinguish recurrence in breast cancer patients.Oncotarget2016;7(34): 55231-55248
18 Lewinska A, Adamczyk-Grochala J, Kwasniewicz E,et al.Reduced levels of methyltransferase DNMT2 sensitize human fibroblasts to oxidative stress and DNA damage that is accompanied by changes in proliferation-related miRNA expression.Redox Biol2018; 14: 20-34
19 van der Ree MH, Jansen L, Kruize Z,et al.Plasma MicroRNA Levels Are Associated With Hepatitis B e Antigen Status and Treatment Response in Chronic Hepatitis B Patients.J Infect Dis2017; 215(9): 1421-1429 20 Deng R, Yue Y, Jin F,et al.Revisit the complexation of PEI and DNA -How to make low cytotoxic and highly efficient PEI gene transfection non - viral vectors with a controllable chain length and structure?J Control Release2009; 140(1): 40-46
21 Cryan SA,O' Driscoll CM.Mechanistic studies on nonviral gene delivery to the intestine using in vitro differentiated cell culture models and an in vivo rat intestinal loop.Pharm Res2003; 20(4): 569-575
22 Kichler A, Leborgne C, Coeytaux E,et al.Polyethylenimine-mediated gene delivery: a mechanistic study.J Gene Med2001; 3(2): 135-144
23 Brunner S, Sauser T, Carotta S,et al.Cell cycle dependence of gene transfer by lipoplex, polyplex and recombinant adenovirus.Gene Ther2000; 7(5): 401-407
24 Lin CW, Jan MS, Kuo JS.The vector-related influences of autophagic microRNA delivery by Lipofectamine 2000 and polyethylenimine 25K on mouse embryonicfibroblast cells.Eur J Pharm Sci2017; 101: 11-21
