厚壳贻贝抗菌肽mytichitin-CB的固相化学合成、复性及功能
2018-05-16宫延斌秦传利
宫延斌,秦传利,石 戈,廖 智
(浙江海洋大学海洋科学与技术学院,海洋生物蛋白质工程实验室,浙江舟山 316022)
抗菌肽因其广谱的抗菌活性和微生物对其难以产生抗性等优势而成为当前生物活性物质研究的重要内容。同时抗菌肽也是当前新型生物抗生素研究的先导分子,在医学和药学等方面具有重要的研究意义。海洋生物历来是抗菌肽研究的重要领域,其中贻贝(Mytilus)抗菌肽因其抗菌活性强,分子种类丰富而成为海洋生物抗菌肽研究的重要物种。目前已从贻贝中鉴定抗菌肽共计9个家族,包括mytilin[1]、myticin[2]、mytimycin[3]、defensin[4-5]、mytimacin[6]、big defencin[6]以及 mytichitin-CB[7]、myticusin[8]以及最近被报道的 Myticalins[9]。这使得贻贝成为海洋生物中,发现抗菌肽家族最多的物种之一。对已被抗菌肽的相关结构与功能研究表明,贻贝抗菌肽具有较强的功能多样性和结构多样性,具有重要的研究价值[10]。
厚壳贻贝Mytilus coruscus具有重要经济价值,也是我国东部海域常见的养殖贝类[11]。厚壳贻贝体内富含多种抗菌肽分子,在此前的研究中已发现和报道了厚壳贻贝抗菌肽mytilin,myticin,myticusin等。Mytichitin-CB是近年来于厚壳贻贝血清中鉴定到的一种分子量为6.3 kD的抗菌肽,其序列由55个氨基酸残基组成,含三对二硫键。与其他贻贝抗菌肽不同的是,该抗菌肽含几丁质结合结构域(chitin-biding domain,CB)。此前的研究表明,mytichitin-CB是厚壳贻贝几丁质酶的C端部分,在体内经裂解后释放入血淋巴作为抗菌肽参与厚壳贻贝的免疫防御[7]。这也是首次发现贻贝几丁质酶存在与鱼类组蛋白样抗菌肽的体内裂解现象[12]。可见mytichitin-CB具有较为特殊的生理活性以及产生机制。但是由于天然mytichitin-CB在贻贝体内含量极低,因而对其后续研究较为困难。为深入研究厚壳贻贝mytichitin-CB的结构与功能,根据mytichitin-CB的氨基酸序列,采用固相多肽化学合成 (Solid-phase peptide synthesis,SPPS)手段合成了mytichitin-CB,同时开展了合成mytichitin-CB的氧化复性和功能研究。上述研究为进一步揭示mytichitin-CB的结构与功能关系奠定了基础。
1 材料与方法
1.1 试剂
9-芴甲氧羰基(Fmoc)氨基酸、二氯甲烷、二异丙基乙胺、HOBt(1-羟基-苯并-三氮唑)、TBTU(1-氧-3-双二甲胺羰基苯骈三氮唑四氟化硼盐)、DMF(N,N-二甲基甲酰胺)等固相化学合成试剂购自上海吉尔公司。NMM(N-甲基吗啉)、piperidine(哌啶)、Fmoc-Rink-AM-Resin 合成树脂、TFA(三氟乙酸)为 Sigma 公司产品。乙腈为美国TEDIA公司产品。
1.2 mytichitin-CB的固相化学合成与鉴定
厚壳贻贝mytichitin-CB的氨基酸序列如下:TVKCGMNGKMP-CKHGAFYTDTCDKNVFYRCVWGRPVKKHCGRGLVWNPRGFCDYA;该目标序列共55个氨基酸残基,含6个半胱氨酸,在不形成二硫键的情况下,其理论分子量6 304.4 Da;采用固相多肽化学合成策略,在Tetras多肽合成仪(美国ThuraMed公司)上进行多肽化学合成,基本路线为:将事先以二氯甲烷溶胀好的FMOC-Rink-AM-Resin树脂置入反应器;之后选取C端第一个残基(FMOC-丙氨酸,FMOC-Ala)于二氯甲烷中溶解,再加入二异丙基乙胺混合后加入反应器中,吹N2反应2 h,将反应液过滤除去,加入甲醇封闭反应1 h后,以DMF清洗反应器,然后用配制好的去保护剂去除树脂上的FMOC保护基团,时间20 min,之后用DMF洗涤数次。称取C端第二个氨基酸FMOC-Tyr(tBu)-OH,加入TBTU和二异丙基乙胺为缩合剂,并加入DMF为溶剂,放入反应柱中,吹N2反应2 h。以去保护液去除FMOC-Tyr(tBu)-OH的FMOC保护基团,DMF洗涤。重复上述步骤,直到最后一个氨基酸残基(苏氨酸,Thr)偶联反应完全。加入K试剂(含82.5%的TFA,5%的苯酚,5%的苯甲硫醚,以及2.5%的巯基乙醇水溶液),完成对合成后的多肽进行侧链去保护以及从树脂上裂解。
合成后的线性多肽粗品采取高效液相色谱进行分离纯化,色谱柱为C8反相柱(4.6×250 mm,Diamonsil 5 μm),洗脱液分别为A液:含0.1%TFA的纯水;B液:含0.1%TFA的乙腈;洗脱梯度为25 min内B液比例由10%上升到25%;流速为1.0 mL/min;采用紫外检测器进行检测,检测波长为220 nm。收集洗脱目标峰开展质谱分析。
采用质谱(WatersZQ2000,美国Waters公司)分析洗脱目标峰的精确分子量,质谱检测条件为:气动辅助电喷雾离子化(ESI);毛细管电压为4.50 kV;检测器电压为1.5 kV;干燥气流速为1.5 L/min;离子源温度为250℃;辅助气温度为200°C;离子检测方式为选择性离子检测;离子极性为正离子。
1.3 mytichitin-CB的氧化复性
采用谷胱甘肽氧化型(GSSG)和还原型(GSH)按1:10配置混合溶液(其中,GSH浓度为1.5 mmol/L,GSSG浓度为0.15 mmol/L,含0.05 mol/L的Tris-HCl缓冲液及 0.05 mol/L的NaCl溶液,pH值为8.6)对固相合成后的mytichitin-CB进行复性;复性温度为4°C,复性时间为24 h,每12 h采用HPLC对复性产物进行检测。
复性后的mytichitin-CB蛋白采用C8反相柱进行分离纯化;氧化复性后的mytichitin-CB经离心和过滤后上样反相高效液相色谱;采用安捷伦C8反相柱(5 μm,300 A);流速为1 mL;检测波长为280和254 nm;采取线性梯度洗脱,30 min内乙腈浓度由15%上升到35%;收集主要洗脱峰,经冻干后置于冰箱保存;
1.4 抑菌活性检测
采用生长曲线抑制法测定合成mytichitin-CB的抑菌活性[7]。测试用细菌共14种(表1),事先用LB液体培养基培养至OD630达到0.01;在预先经灭菌处理的96孔板中,每孔加入90 μL菌液。合成且复性后的mytichitin-CB以灭菌纯水溶解,(500 μmol/L),然后倍比稀释,最低浓度为1.25 μmol/L,以纯水作为阴性对照;将各浓度样品溶液按10 μL/孔加入96孔板中,将96孔板置于振荡器上轻柔振荡促使样品和菌液混合均匀,之后将96孔板置于恒温箱,37℃培养10 h。之后采用酶标仪测定每孔OD630值,通过与培养前的吸光值进行比较以衡量多肽对于细菌生长的抑制作用。对细菌的最低抑制浓度 (Minimal inhibitory concentrations,MIC)的范围值[a]~[b]代表Mytichin-CB的抑菌活性用,其中[a]代表细菌继续生长时,其加入的多肽样品的最大浓度,而[b]代表细菌完全被抑制时,其加入的多肽样品的的最低浓度。
1.5 几丁质结合活性检测
几丁质结合活性采用几丁质孵育结合SDS-PAGE法测定。将合成mytichitin-CB配置成1 mg/mL浓度(样品1);加入适量几丁质粉末,充分震荡混匀后室温下孵育1 h,再经离心处理(4°C,12 000 g,15 min),收集上清液(样品2);沉淀部分加入5%醋酸,震荡混匀1 h后,离心收集上清(样品3)。利用SDS-PAGE分别对样品1、2、3进行电泳分析;分离胶浓度为15%。样品按1:1加入电泳上样缓冲液(上海生工公司);电泳上样量为20 μL;采用120 v恒压模式电泳。电泳结束后以考马斯亮蓝R250进行胶染色并观察。
2 结果
2.1 mytichitin-CB 的固相化学合成、鉴定和复性
Mytichitin-CB经故相多肽化学合成,分别以HPLC和质谱检测,结果如图1。合成后的mytichitin-CB在HPLC分离时呈单一洗脱峰(图1A箭头所示),表明纯度较好;质谱分析结果表明,合成的mytichitin-CB的精确分子量为6 303 Da(以图1B中多电荷峰的分子量乘以相应的电荷数再减去相应电荷数),与理论分子量6 304基本吻合,表明合成成功。其缺失的1 Da分子量是由于固相多肽化学合成导致多肽的C端出现酰胺化(-CONH2),所以相比羧基化C端(-COOH)的多肽,分子量降低1 Da。
合成mytichitin-CB经氧化复性,通过HPLC检测复性过程中分子变化并进行纯化,结果如图2A,随着复性时间的延长,复性后的mytichitin-CB相较于未复性的多肽,其空间结构的正确折叠会导致疏水性氨基酸残基的包埋,因而其疏水性下降,导致在反相色谱中的洗脱时间有缩短趋势,从0 h的16.87 min提前到复性24 h后的14.96 min。分别收集复性前以及复性24 h后的目标峰,开展质谱分析。结果见图2B[l3]。由图2B可见,复性后,合成mytichitin-CB的分子量由6 303减少至6 297 Da,减少的6 Da来自于序列中6个半胱氨酸形成3对二硫键,因此减少了6个H所致。上述结果表明mytichitin-CB复性成功,可开展后续实验。
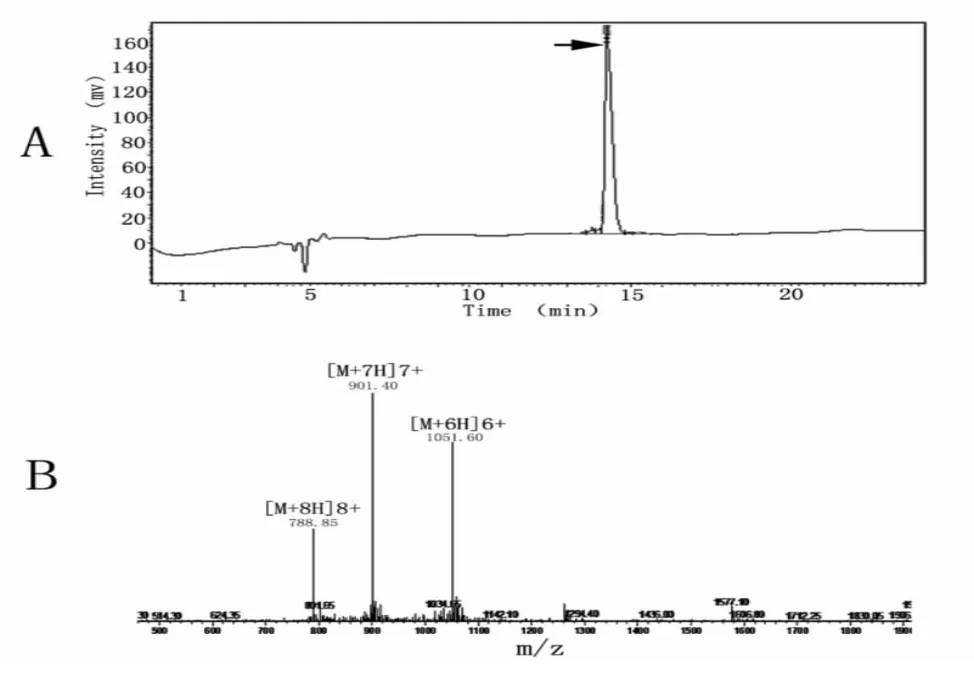
图1 合成mytichitin-CB的HPLC分离(A)和质谱鉴定图(B)。箭头所示为目标洗脱峰。Fig.1 Purification of synthesized mytichitin-CB by HPLC(A)and the mass spectrum of the fraction collected from HPLC elution(denoted by an arrow in Fig.1A)
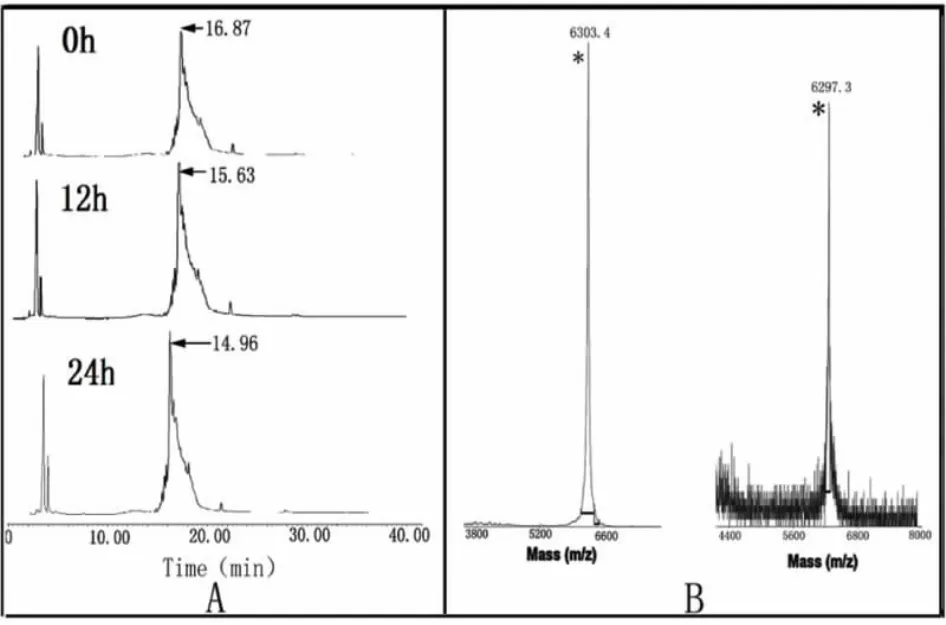
图2 氧化复性过程中HPLC监测图(A)及氧化复性前后质谱检测图(B)Fig.2 Chromatograms in oxidative refolding process of the synthesized mytichitin-CB(A)and mass spectrums of synthesized mytichitin-CB before and after oxidation(B)
2.2 合成mytichitin-CB 的抑菌活性
采用生长曲线抑制法测试合成mytichitin-CB的抑菌活性。分别测试了14种菌,合成的mytichitin-CB对上述菌种的抑制活性见表1,mytichitin-CB对所测试的各菌种均有明显的抑制活性,其中,对革兰氏阳性菌的抑制活性相对较强,平均抑制浓度约为20 μmol/L;其次对真菌也表现出较强的抑制活性,其平均抑制浓度约为11 μmol/L;而合成的mytichitin-CB对革兰氏阴性菌的抑制活性则相对较弱,其平均抑制浓度约为 60 μmol/L。

表1 合成mytichitin-CB的抑菌活性Tab.1 The antimicrobial activities of synthesized mytichitin-CB
对合成mytichitin-CB开展热稳定性检测。将合成mytichitin-CB溶于纯水(浓度为50 μmol/L)后,经不同温度孵育30 min,采用滕黄叠球菌为指示菌,检测不同温度处理后的合成mytichitin-CB对滕黄叠球菌培养皿的抑菌圈,以纯水作为对照,结果如图3,合成mytichitin-CB具有较好的热稳定性,60°C孵育30 min后,其对滕黄叠球菌的抑菌活性未见明显下降。
2.3 合成mytichitin-CB的几丁质结合活性
采用几丁质孵育结合SDS-PAGE法检测合成mytichitin-CB的几丁质结合活性,结果如图4,mytichitin-CB与几丁质具有明显的结合活性,在与几丁质孵育1小时并离心后,上清液经SDSPAGE检测,无目标条带(图4泳道2)。该结合活性可被5%醋酸解除(图4泳道3),表明mytichitin-CB与几丁质的结合属于可逆性结合。
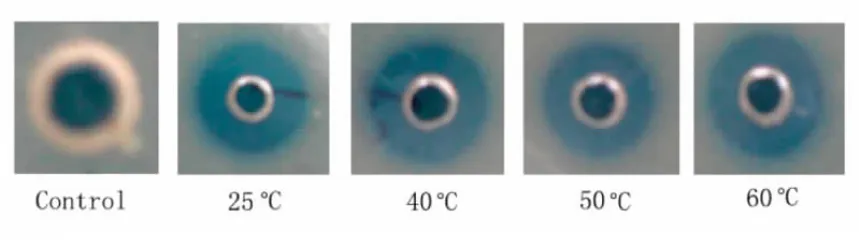
图3 合成mytichitin-CB的经不同温度处理后的抑菌活性检测图Fig.3 The antimicrobial activity of synthesized mytichitin-CB after various heat processes
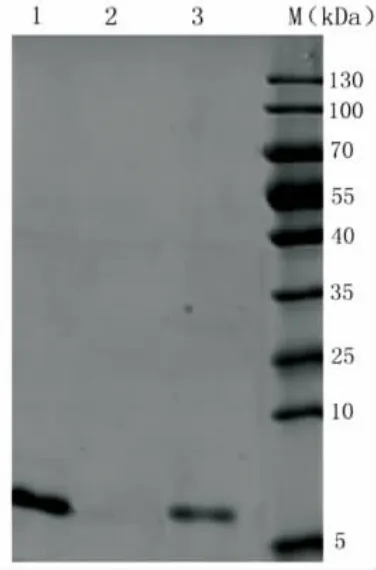
图4 SDS-PAGE检测合成mytichitin-CB的几丁质结合活性。Fig.4 The chitin-binding function of mytichitin-CB tested by SDS-PAGE
3 讨论
含几丁质结合结构域的抗菌肽此前在无脊椎动物[13]和植物中均有报道[14]。最早发现具有几丁质结合结构域的抗菌肽为来自马蹄蟹Tachypleus tridentatus血细胞的Tachycitin[15]。Tachycitin由73个氨基酸残基组成,其分子量在8 kDa,其序列中含10个半胱氨酸并形成5对二硫键;Tachycitin的序列中含有典型的几丁质结合结构域且表现出明显的几丁质结合活性[15];此外,从南美白对虾Penaeus vannamei中分离到的抗菌肽penaeidins家族(47~63个氨
基酸组成,含3对二硫键)也是一种代表性的具有几丁质结合结构域的抗菌肽分子,既具有抗菌活性也具有几丁质结合活性[15]。上述抗菌肽分子同时具有较强的抗真菌活性,其分子机制推测与真菌细胞壁中富含的几丁质有关[17];同时,上述甲壳类抗菌肽的几丁质结合活性还与甲壳类动物体表的损伤修复有关[15]。这表明含几丁质结合结构域的抗菌肽是一种多功能分子,对于抗菌肽的分子进化以及开发新型生物抗生素具有重要研究价值。
Mytichitin-CB是第一种发现自贻贝的含几丁质结合结构域的抗菌肽分子。在序列上,mytichitin-CB与Tachycitin、penaeidins等分子差异较大;但在空间结构上,mytichitin-CB与Tachycitin等均采取了以beta-折叠为主的二级结构[7,18]。由于mytichitin-CB分子在贻贝血清中的含量极低,为此采取了固相多肽化学合成手段,人工合成了mytichitin-CB分子。目前针对多肽的固相化学合成主要有BOC法和FMOC法,其中BOC法对于短肽合成效果较好,但对于序列较长的多肽则效率较低;而FMOC法则反应条件温和,适合较长序列的多肽合成。由于mytichitin-CB分子序列较长,因此本研究采取了FMOC策略,所合成的mytichitin-CB经HPLC法检测,其纯度超过90%。此外,mytichitin-CB含有3对二硫键,因此在合成后需要经过氧化复性,才能得到真正有活性的多肽分子。氧化复性历来是抗菌肽合成的难点领域。从目前的结果来看,富含二硫键的抗菌肽分子在合成后,其复性率通常都在15%左右,且尚无统一的,高效的氧化复性策略[18]。多肽二硫键的正确配对涉及一个非常复杂的氧化复性过程,GSSG/GSH所形成的巯基氧化还原对是目前用于多肽氧化复性的常用手段;同时,二硫键的形成涉及巯基/二硫键的交换反应,而半胱氨酸巯基的解离值(pKa)为8.6左右,因此在本研究中,我们采取了GSSG/GSH为1:10的比例,pH值设定为8.6,同时将复性时间设置为24 h,在此情况成功完成对合成的mytichitin-CB的氧化复性,通过HPLC结合质谱法检测复性效率;同时,根据HPLC洗脱峰峰面积经归一化计算复性产率,最终计算出合成mytichitin-CB的复性率约为20%。
在前期研究中,天然mytichitin-CB分子对革兰氏阳性菌、阴性菌和真菌均表现出明显的抑制作用[7]。对合成及复性成功后mytichitin-CB分子的研究表明,该多肽同样具有明显的抑菌活性,且与天然mytichitin分子相比[7],其对革兰氏阳性菌、阴性菌和真菌的抑制作用未发生明显变化,仍表现出对革兰氏阳性菌和真菌较强的抑制作用,而对革兰氏阴性菌的抑制作用则相对较弱;上述结果表明,合成且复性成功的mytichitin-CB与天然的mytichitin-CB分子具有相同的结构与功能。此外,本研究发现合成mytichitin-CB具有较好的热稳定性,在60°C孵育30 min后,其抑菌活性未见明显下降,推测由于mytichitin-CB存在3对二硫键而使得其分子结构致密,因而具有较好的热稳定性,这表明mytichitin-CB具有较好的开发和应用研究价值。此外,mytichitin-CB分子序列中含有典型的几丁质结合结构域[7],在本研究中,通过SDS-PAGE方法验证了mytichitin-CB与几丁质之间存在可逆的结合作用。这种结合作用也被认为是含几丁质结合结构域的多肽对真菌产生抑制作用的原因[19-20]。但是几丁质结合结构域对于抗菌肽抑制细菌的作用机制目前尚不清楚。mytichitin-CB的成功合成及复性,为后续开展mytichitin-CB的抗菌分子机理以及mytichitin-CB的蛋白质工程研究奠定了基础。
参考文献:
[1]CHARLET M,CHERNYSH S,PHILIPPE H,et al.Innate immunity.Isolation of several cysteine-rich antimicrobial peptides from the blood of a mollusk,Mytilus edulis[J].Jounal of Biological Chemistry,1996,271(36):21 808-21 813.
[2]MITTA G,HUBERT F,NOËL T,et al.Myticin,a novel cysteine-rich antimicrobial peptide isolated from hemo-cytes and plasma of the mussel Mytilus galloprovincialis[J].European Journal of Biochemistry,1999,265(1):71-78.
[3]CANTET F,TOUBIANA M,PARISI M G,et al.Individual variability of mytimycin gene expression in mussel[J].Fish and Shellfish Immunol,2012,33(3):641-644.
[4]HUBERT F,NOEL T,ROCH P.A member of the arthropod defensin family from edible Mediterranean mussels(Mytilus galloprovincialis)[J].European Journal of Biochemistry,1996,240(1):302-306.
[5]MITTA G,VANDENBULCKE F,HUBERT F,et al.Mussel defensins are synthesized and processed in granulocytes then released into the plasma after bacterial challenge[J].Journal of Cell Science,1999,112(23):4 233-4 242.
[6]MARCO G,GIANLUCA D M,CHIARA M,et al.Big defensins and mytimacins,new AMP families of the Mediterranean mussel Mytilus galloprovincialis[J].Developmental and Comparative Immunology,2012,36(2):390-399.
[7]QIN Chuan-li,HUANG Wei,ZHOU Shi-quan,et al.Characterization of a novel antimicrobial peptide with chiting-biding domain from Mytilus coruscus[J].Fish and Shellfish Immunol.2014,41(2):362-370.
[8]LIAO Zhi,WANG Xin-chao,LIU Hui-hui et al.Molecular characterization of a novel antimicrobial peptide from Mytilus coruscus[J].Fish and Shellfish Immunology,2013,34(2):610-616.
[9]LEONI G,POLI A D,MARDIROSSIAN M,et al.Myticalins:A Novel Multigenic Family of Linear,Cationic Antimicrobial Peptides from Marine Mussels(Mytilus spp.)[J].Marine Drugs,2017,15(8):E261.
[10]ZANNELLA C,MOSCA F,MARIANI F,et al.Microbial Diseases of Bivalve Mollusks:Infections,Immunology and Antimicrobial Defense[J].Marine Drugs,2017,15(6):E182.
[11]梁 君,王伟定,虞宝存,等.东极海洋牧场厚壳贻贝筏式养殖区可移出碳汇能力评估[J].浙江海洋学院学报:自然科学版,2015,34(1):9-14.
[12]KIM H S,YOON H,MINN I,et al.Pepsin-mediated processingof the cytoplasmic histone H2A to strong antimicrobial peptide buforin I[J].Journal of Immunology,2000,165:3 268-3 274.
[13]FUSETANI N.Antifungal peptides in marine invertebrates[J].Invertebrate Survival Journal,2010,7:53-66.
[14]DE BOLLE M F,DAVID K M,REES S B,et al.Cloning and characterization of a cDNA encoding an antimicrobial chitinbinding protein from amaranth,Amaranthus caudatus[J].Plant Molecular Biology,1993,22(6):1 187-1 190.
[15]KAWABATAS,NAGAYAMA R,HIRATA M,et al.Tachycitin,a small granular component in horshoe carb hemocytes,is an antimicrobial protein with chitin-binding activity[J].Journal of Biochemistry,1996,120(6):1 253-1 260.
[16]LOONGYAI W,AVARRW J C,CERUTTI M,et al.Isolation and functional characterization of a new shrimp ovarian peritrophin with antimicrobial activity from Fenneropenaeus merguiensis[J].Marine Biotechnology(NY),2007,9(5):624-637.
[17]MALAGUARNERA L.Chitotriosidase:the yin and yang[J].Cell Molecular Life Science,2006,63:3 018-3 029.
[18]SUETAKE T,TSUDA S,KAWABATA S,et al.Chitin-binding proteins in invertebrates and plants conprise a common chitinbinding structural motif[J].Journal of Biological Chemistry,2000,275(24):17 929-17 932.
[19]YOKOYAMA S,IIDA Y,KAWASAKI Y,et al.The chitin-binding capability of Cy-AMP1 from cycad is essential to antifungal activity[J].Journal of Peptide Science,2009,15(7):492-497.
[20]XU Na,ZHANG Shi-cui.Identification,expression and bioactivity of a chitotriosidase-like homolog in amphioxus:dependence of enzymatic and antifungal activities on the chitin-binding domain[J].Molecular Immunology,2012,51(1):57-65.
