虾肝肠胞虫(EHP)在凡纳滨对虾养殖水环境中的分布情况及传播途径初步研究
2018-05-16丁慧昕谢建军王庚申许文军
丁慧昕,施 慧,谢建军,王庚申,汪 玮,何 杰,许文军
(1.浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江省海水增养殖重点实验室,浙江舟山 316021;2.浙江海洋大学水产学院,浙江舟山 316022)
虾肝肠胞虫Enterocytozoon hepatopenaei(EHP)归属于孢子虫纲Sporozoa,隐孢子虫目Cryptosporidium,肠上皮微孢子虫科,是目前凡纳滨对虾养殖过程中出现的一种重要寄生虫病原,主要寄生于对虾肝胰腺小管的上皮细胞内,已被证实与对虾生长缓慢症关系密切。其最早发现于泰国养殖的生长缓慢的斑节对虾,感染该寄生虫的对虾往往吃料正常,不会发生爆发性死亡,但生长缓慢或停滞,并出现大小不一的情况[1]。自2013年以来,我国所有的凡纳滨对虾养殖主产区均已发现了虾肝肠胞虫病[2],并造成重大危害,严重影响对虾养殖业的健康与持续发展。
EHP的个体微小,大小为(1.1±0.2)~(0.7±0.1)μm,临床上普通的光学显微镜很难观察或诊断,主要依靠实验室检测才可确诊。关于EHP的检测方法的研究报道较多,SANTHOSHKUMAR,et al[3]运用组织病理学方法观察到了在人工感染试验对虾体内处于不同发育阶段的EHP;TANGPRASITTIPAP,et al[4]建立了套式PCR检测法和地高辛标记核酸探针原位杂交法;刘珍等[2]将实时荧光定量PCR法运用于EHP的实验室检测;SUEBSING,et al[5]建立EHP的LAMP技术方法,使临床检测EHP更简单、快速;但目前尚无有关EHP在养殖水环境中分布情况的报道。为了了解EHP在水环境中分布情况以及传播途径,本研究采用巢式PCR检测方法,对舟山地区凡纳滨对虾养殖水环境中采集的其它水生生物以及水样等样本进行EHP检测,初步分析了EHP在对虾养殖水体环境中的分布情况;同时以不同方式保存的病虾对健康对虾进行了人工感染试验,分析了EHP在养殖水环境中的传播方式。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
水样分别为出现生长缓慢的对虾养殖场进水、养殖塘水、养殖塘排水渠中尾水,生物样本主要为养殖场排水渠中鱼、虾类和蟹类。EHP感染虾采集自浙江省海洋水产研究所试验场;人工感染试验所用的健康凡纳滨对虾取自舟山市旭旺养殖场,体长为7.5±0.5 cm。
1.1.2 试剂
组织DNA提取试剂盒QlAampDNA Mini Kit购自Qiagen公司;高保真Ex Taq DNA聚合酶、dNTPs、DL 2000 Marker、UNIQ-10柱式胶回收试剂盒购买自TAKARA公司;其它均为国产分析纯级试剂。
1.2 仪器和设备
实验使用的主要仪器:AL204型电子天平,瑞士梅特勒-托利多仪器有限公司;Centrifuge 5424R台式冷冻离心机,德国Eppendorf公司;Nikon Eclipse 50i生物显微镜,美国尼康公司;Bio-Rad DNA Engine多槽PCR仪和Bio-Rad GDXI型凝胶成像系统,美国伯乐公司;漩涡振荡器,德国IKA公司。
1.3 试验方法
1.3.1 养殖水环境样本的采集
于2017年4月至2017年10月,分3批次采集,共4个种类的108个样;其中,鱼类共采集了鲻鱼7尾,弹涂鱼10尾;蟹类共采集寄居蟹11只,招潮蟹12只;虾类采集绿籽虾26尾,口虾蛄1尾。将样本冰鲜保存带回实验室,每种采样信息和分析样本数量见表1。
表1 养殖环境中生物采样信息Tab.1 Biological sampling information in aquaculture environment
1.3.2 人工感染试验方法
采用巢式PCR检测健康虾体内EHP携带情况,经PCR确认EHP核酸阴性后,暂养1周备用;感染用病虾运用巢式PCR检测EHP,确认EHP核酸阳性后,一部分病虾-20℃冻存,一部分暂养备用。
从采集的健康凡纳滨对虾中挑选大小均一、体格健壮的对虾用于感染实验,试验期间连续充气,水温为24~26℃。感染实验共设A、B、C、D四组,每组均设立平行对照,A组投喂冰冻病虾的肝胰腺组织,B组投喂鲜活病虾的肝胰腺组织,C组为健康虾与病虾混合饲养,D组为对照组,每组24尾虾。试验期间前2周,A组和B组只投喂病虾的肝胰腺组织,C组和D组投喂正常人工配合饲料,每日早晚投喂1次。实验期间每天清理试验对虾的残饵和排泄物,隔天换水1次。连续投喂两周以后,全部投喂正常人工配合饲料,1周之后随机取样,每组3尾,每周取样1次,共采集4周。
1.3.3 PCR模板制备
水样本使用0.22 μm滤膜进行抽滤,滤膜用适量生理盐水冲洗,洗液离心后弃上清,取沉淀提取DNA样本;采集的鱼样本取肠道组织提取DNA样本;采集的虾蟹样本和人工感染试验组对虾,取肝胰腺组织提取DNA样本;上述样本分别称取20~25 mg,使用QlAamp DNA Mini Kit,按照说明书提取总基因组DNA。
1.3.4 巢式PCR扩增
样品检测主要采用亚太水产养殖中心网络(NACA)推荐的巢式PCR检测方法,引物包括一对外引物ExF/ExR 和一对内引物 InF/InR:ExF:5′–TTG ACG TGA AGC AAT TGG AG–3′;ExR:5′–AAG CAG CAC AAT CCA CTC CT–3′;InF:5′–GGT GGG CAA AGA ATG AAA TC–3′;InR:5′–CGA GCG TAC TAT CCC CAG AG–3′,由上海生工生物工程技术服务有限公司合成。PCR 反应体系(25 μL)为:2.5 μL 10×buffer、2 μL dNTP(2.5 mM)、Primer 1 和 2(10 μM)各 0.25 μL、0.25 μL Taq DNA 聚合酶、5 μL DNA模板,用灭菌去离子水补充反应总体积至25 μL,将混合物置PCR仪中反应。PCR循环参数:94℃预变性5 min后开始循环,94℃ 45 s,55℃ 45 s,72℃ 1 min,共35个循环,最后72℃延伸7 min。取5 μL PCR产物经琼脂糖凝胶电泳后,在紫外凝胶成像仪中照相记录。二次PCR模板为一次PCR扩增产物,PCR反应体系及循环参数同一次PCR,获得的PCR产物用1.5%的琼脂糖凝胶电泳检测,送上海生工生物工程技术服务有限公司进行序列测定。
2 结果
2.1 养殖场采集样品检测结果
从携带EHP对虾养殖塘中采集的水样,经PCR检测,EHP均呈核酸阳性,但养殖塘进水口和排水渠中采集的水样未有EHP检出,采集的水生生物样本中虾和蟹类的部分样本PCR检测EHP呈核酸阳性,采集的鱼类样本未有EHP检测,具体结果见表2。

表2 养殖环境采集样品的PCR结果以及阳性检出率Tab.2 Detection of EHP in samples of aquaculture environment by PCR and positive rates
2.2 样品检测基因扩增测序结果
采集样本的二次PCR扩增产物经1.0%琼脂糖凝胶电泳后,在250~500 bp处可见特异性单一条带。将获得的PCR扩增产物进行序列测定,应用DNAMAN软件进行比对分析,获得一个223 bp大小的基因片段。该序列经BLAST同源检索分析,与TANGPRASITTIPAP,et al[4]之前报道的感染斑节对虾Penaeus monodon的EHP的基因序列(KF362130)结果一致。
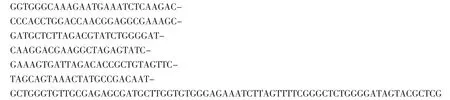
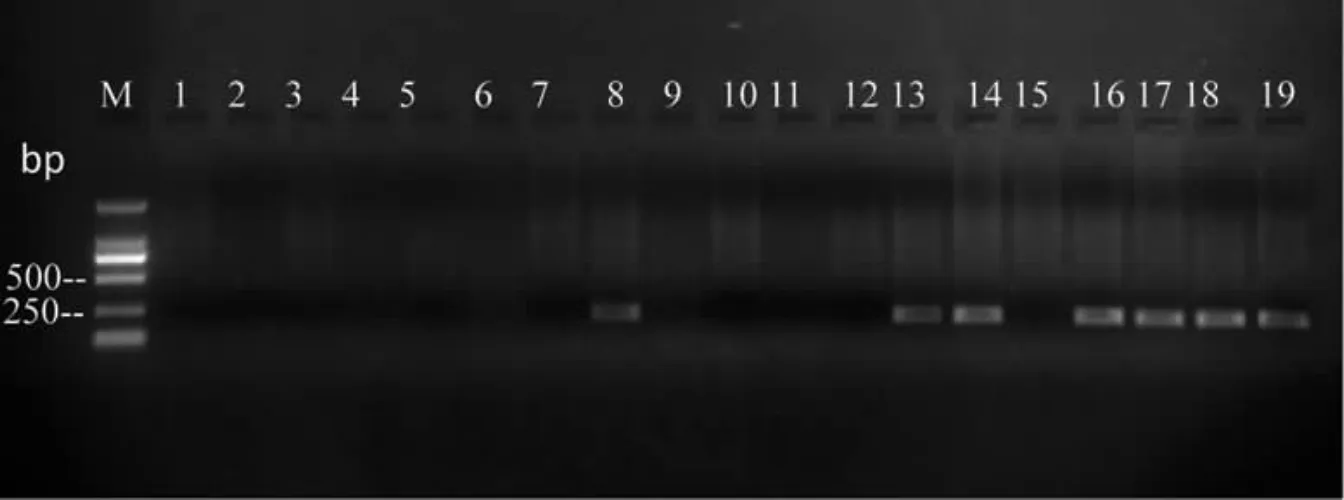
图1 养殖场采集虾、蟹类样本EHP PCR检测结果Fig.1 Detected results of the E.hepatopenaei infection of P.vannamei samples by PCR
2.3 人工感染实验样品检测结果
病虾肝胰腺组织投喂组投喂2周后停止投喂,改为投喂正常饲料,1周后开始取样,每隔7 d取样1次进行PCR检测,前3次每次3尾,最后一次6尾,共计24个样本,阳性检出率为12.5%;混合饲养组混养1周后开始取样,7 d取样1次,每次3尾,共取样5次,共计24个样本,阳性检出率为54.2%;对照组取样次数和尾数同混合饲养组,未有EHP检出,结果见表3。
3 讨论
微孢子虫是一类古老的细胞内寄生微生物,所有微孢子虫的生活史均起始于成熟孢子在适当环境下挤出极丝,释放出具有侵染性的孢原质,孢子在被寄主吞入消化道后迅速活化并在寄主体内迅速增殖并继续侵染[6-7]。TOURTIP,et al[8]研究发现EHP在斑节对虾的肝胰腺管上皮细胞中发育成成熟的带有极丝的孢子。本研究分别从携带EHP对虾的养殖水体、虾塘进水口及排水渠中均采集了水和生物样本,PCR检测结果显示,发病虾塘中水体中EHP阳性检出率100%,虽然虾塘的进水口和排水渠水样本中未有检出EHP,但排水渠采集的虾蟹等甲壳类样本中检出了EHP。在人工感染试验中,与健康虾和病虾混合饲养组阳性检出率54.2%相比,冰冻或活虾肝胰腺组织投喂组EHP阳性率检出率相对比较低,分别只有12.5%和45.8%。这可能与孢子虫的生活史特征也有关联,由于病虾体内EHP不可能都处于成熟阶段,在养殖试验过程中,这些未成熟的EHP会继续发育成熟,从而形成出更多成熟孢子并释放到养殖环境中,增加了混养的健康虾接触这些具有侵染性的孢子的机会,而投喂冰冻或活虾肝胰腺组织组,投喂的组织中成熟孢子有限,健康虾摄食到侵染性孢子的机会少,降低了感染机率。试验结果说明EHP感染对虾后在虾肝胰腺管细胞内形成孢原质,成熟后又通过粪便排出体外,在水环境中形成孢子体,散在分布于水体或附着于藻类、碎屑、饲料表面以及池壁和底泥环境中,孢子可在养殖环境中累积,从而导致疫情的传播。
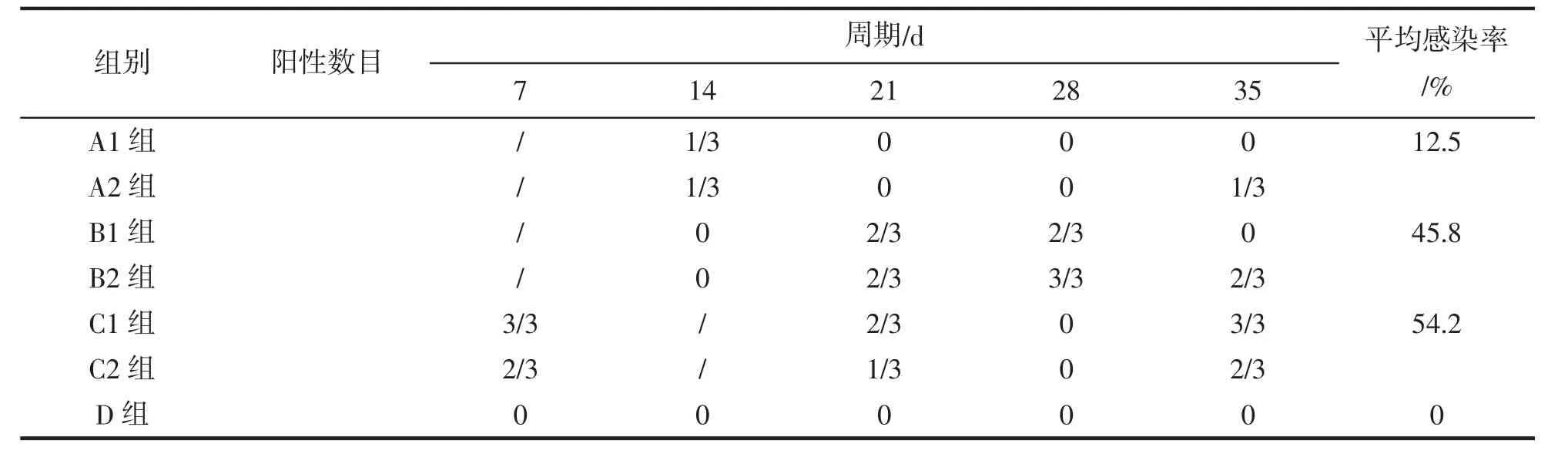
表3 人工感染样品的PCR结果以及阳性检出率Tab.3 Detection of EHP in samples of artificial infection by PCR and positive rates

图2 凡纳滨对虾样本EHP PCR检测结果Fig.2 Detected results of the E.hepatopenaei infection of P.vannamei samples by PCR
本试验采集了感染EHP养殖塘排水渠中的虾、蟹及鱼类等水生动物样本进行EHP携带情况检测,结果在虾和蟹类样本中检出了EHP,但采集的所有鱼类样本中并未有EHP检出。本试验结果表明对虾可以通过摄食携带EHP的对虾直接感染EHP,结果与刘珍等[2]试验结果相同。王维娜等[6]认为感染对虾的微孢子虫其中间宿主主要是各种鱼类,但本试验结果表明EHP的增殖并不需要中间宿主,但不排除鱼类是EHP传播过程中宿主的可能性。本研究中对虾塘进水口和排水渠水样中没有检测出EHP,是因为进水口和排水渠均为相对开放的的一个水环境,且流速一般比较大,附着孢子的浮游生物极易随流水进入外海,所以进水口和排水渠水样相对养殖塘比较难检测到EHP。
微孢子虫表面包裹着一层致密特殊结构,使得微孢子虫能抵御外界环境、维持自身形态和渗透压等方面发挥着重要作用。游信毅等[9]利用10%的甘油、乙二醇、水等作为冷冻保护剂,将东方蜜蜂微孢子虫的孢子在-80℃保存5个月后对意蜂工蜂进行感染,结果几种冷冻保存剂保存的孢子都能够侵染意蜂。本试验中摄食冷冻保存的病虾肝胰腺组织健康虾在一段时间后,部分对虾肝胰腺EHP检测呈核酸阳性,但冰冻组总阳性检出率低于鲜活病虾肝胰腺组织投喂组,说明低温环境使部分EHP丧失了侵染性,但仍然有部分EHP可以存活并仍具有感染力,结果与刘珍等[10]的实验结果吻合。JAROENLAK,et al[10]研究发现轮虫和卤虫可以携带EHP,而两者又是对虾苗种生产中主要饵料,这将增加对虾感染EHP的可能性,因此建议在养殖生产中应对投喂的鲜活饵料进行巴氏消毒处理,以预防对虾感染EHP。刘珍等[11]和陈禄芝等[12]研究认为对虾EHP的载量与养殖环境有紧密联系,环境不同其EHP的载量指数不同。目前EHP对养殖对虾的危害程度还不十分清楚,而感染EHP的对虾缺乏可供判断的特征性临床病征,只有通过PCR等实验室检测手段才可以确诊,同时由于EHP无有效治疗措施,因此在对虾养殖过程中,对养殖水体、饲养饵料以及养殖尾水等环境因素进行严格把关,对控制对虾感染EHP病原极为重要。
参考文献:
[1]刘雅梅.虾肝肠胞虫Taqman荧光定量PCR检测技术的建立及其与对虾生长相关性的研究[D].上海:上海海洋大学,2016.
[2]刘 珍.虾肝肠胞虫实时荧光定量PCR检测技术的建立及其与对虾生长相关性的研究[D].上海:上海海洋大学,2015.
[3]SANTHOSHKUMAR S,SIVAKUMAR S,VIMAL S,et al.Biochemical changes and tissue distribution of Enterocytozoon hepatopenaei(EHP)in naturally and experimentally EHP-infected whiteleg shrimp,Litopenaeus vannamei(Boone,1931),in India[J].Journal of Fish Diseases,2016,40(4):529-539.
[4]TANGPRASITTIPAP A,SRISALA J,CHOUWDEE S,et al.The microsporidian Enterocytozoon hepatopenaei is not the cause of white feces syndrome in white leg shrimp Penaeus(Litopenaeus)vannamei[J].BMC Veterinary Research,2013,139(9):1-10.
[5]SUEBSING R,PROMBUN P,SRISALA J,et al.Loop-mediated isothermal amplification combined with colorimetric nanogold for detection of the microsporidian Enterocytozoon hepatopenaei in Penaeid shrimp[J].Journal of Applied Microbiology,2013,114(5):1 254-1 263.
[6]王维娜,王安利,陈 丽,等.斑节对虾体内微孢子虫的超微结构[J].动物学报,2001,47(专刊):78-81.
[7]WATERS L.Electron microscopic study on microsporidia disease of Penaeus chinensis[J].Marine Sciences,1995,7(2):284-303.
[8]TOURTIP S,WONGTRIPOP S,STENTIFORD G D,et al.Enterocytozoon hepatopenaei,sp.nov.(Microsporida:Enterocytozoonidae),a parasite of the black tiger shrimp Penaeus monodon,(Decapoda:Penaeidae):Fine structure and phylogenetic relationships[J].Journal of Invertebrate Pathology,2009,102(1):21-29.
[9]游信毅,叶坤婷,应碧华,等.东方蜜蜂微孢子虫孢子冷冻保存后对意蜂工蜂的侵染性[J].中国蜂业,2014,65(Z2):33-35.
[10]JAROENLAK P,SANGUANRUT P,WILLIAMS B A,et al.A Nested PCR Assay to Avoid False Positive Detection of the Microsporidian Enterocytozoon hepatopenaei(EHP)in Environmental Samples in Shrimp Farms[J].Plos One,2016,11(11):e0166320.
[11]刘 珍,张庆利,万晓媛,等.虾肝肠胞虫(Enterocytozoon hepatopenaei)实时荧光定量PCR检测方法的建立及对虾样品的检测[J].渔业科学进展,2016,37(2):119-126.
[12]陈禄芝,余霞艳,胡一丞,等.粤西地区凡纳滨对虾虾肝肠胞虫、传染性皮下和造血组织坏死病毒感染情况的初步调查[J].渔业研究,2016,38(4):273-280.
